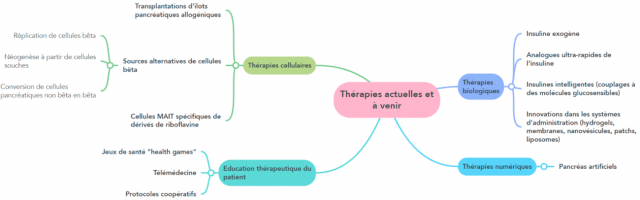
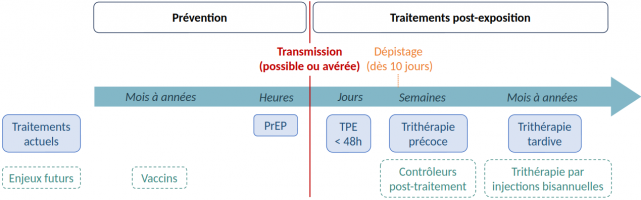
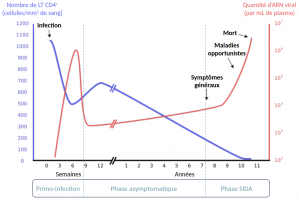
Médiathèque

Médiathèque
2462 médias

Les sujets présentant des allèles INS-VNTR de classe I non protecteurs ont des niveaux élevés de lymphocytes T CD4+ spécifiques de la proinsuline comparativement aux sujets porteurs des allèles protecteurs de classe III de ce même locus. Il n’y a pas de différence entre ces sujets, concernant le pou...
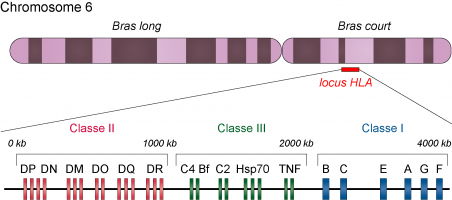
Les gènes du complexe majeur d’histocompatibilité (également appelé HLA chez l’être humain) sont situés sur le bras court du chromosome 6. Le CMH de classe I et celui de classe II sont impliqués dans la présentation des antigènes aux lymphocytes T. Les gènes de classe III codent diverses protéines q...
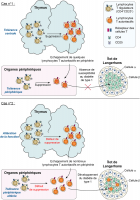
Dans le cas n°1 (individu sain), les lymphocytes T régulateurs orchestrent les mécanismes de suppression des lymphocytes T autoréactifs au niveau du thymus et en périphérie. Dans le cas n°2 (individu diabétique), une altération de la fonction des lymphocytes T régulateurs induit l’échappement d’un g...
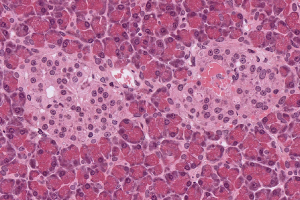
Le pancréas est constitué de cellules acineuses pancréatiques, qui apparaissent foncées. Elles sont impliquées dans la fonction exocrine du pancréas : la sécrétion d'enzymes digestives. Au centre de l'image, deux îlots de Langerhans apparaissent plus clairs. Ces îlots remplissent la fonction endocri...

Les résultats présentés ici ont été obtenus chez des chiens témoins et chez des chiens atteints de diabète. Chez les chiens, le diabète est associé à une diminution du nombre de cellules β des îlots de Langerhans du pancréas, comme pour le diabète de type 1 de l’être humain. A. Nombre de cellules β ...

Les glycémies et insulinémies de huit personnes (quatre femmes, quatre hommes) en bonne santé (en particulier, non atteints de diabète) ont été mesurées régulièrement pendant 24 heures. Durant la journée de mesures, les personnes reçoivent 50 % de leurs apports énergétiques soit sous forme de saccha...

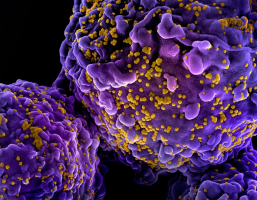
Des lymphocytes T CD4+ sont infectés avec le VIH-1 pendant 48 heures puis cultivés pendant 24 h avec des anticorps neutralisant à large spectre (broadly neutralizing antibodies – bNAbs). A. Observation en microscopie électronique à transmission. Rétention virale au site de bourgeonnement, comprenan...