Le microbiote humain est composé d’un assemblage de communautés microbiennes dynamiques qui occupent différentes zones du corps. La coévolution du microbiote et de son hôte explique le rôle primordial que jouent ces communautés dans la santé humaine. En conséquence, des perturbations dans le microbiote, nommées dysbioses, peuvent causer ou amplifier de nombreuses maladies, qu’elles soient métaboliques, auto-immunes ou psychiques. Les preuves d’un lien étroit entre dysbioses microbiennes et développement de maladies s’accumulant, la communauté scientifique s’intéresse dorénavant à l’ingénierie du microbiote comme nouvel outil thérapeutique, de façon à en remodeler et reprogrammer la composition et le fonctionnement.
Qu’est-ce que le microbiote humain ?
À partir de la fin du XIXe siècle, différentes études vont prouver que des organismes infiniment petits vivent à proximité ou dans les tissus humains. Pour les désigner, le mot « microflore » est tout d’abord choisi, avant de céder sa place à celui de « microbiote ». Les progrès des techniques d’identification microbienne, et notamment l’utilisation du gène codant l’ARN ribosomique 16S par le microbiologiste Carl Woese dans les années 1970, sont à l’origine de classifications de plus en plus précises des micro-organismes 12. Peu à peu, les cultures in vitro de micro-organismes sont donc complétées par le séquençage du gène codant l’ARN 16S, permettant de donner une idée plus exhaustive et précise de la composition microbienne d’un milieu. Dans les années 2000, les premiers séquençages du microbiote intestinal humain sont réalisés 3, permettant aujourd’hui d’avancer qu’environ 4.1013 micro-organismes symbiotiques vivent sur et à l’intérieur du corps humain, soit autant que de cellules humaines 45.
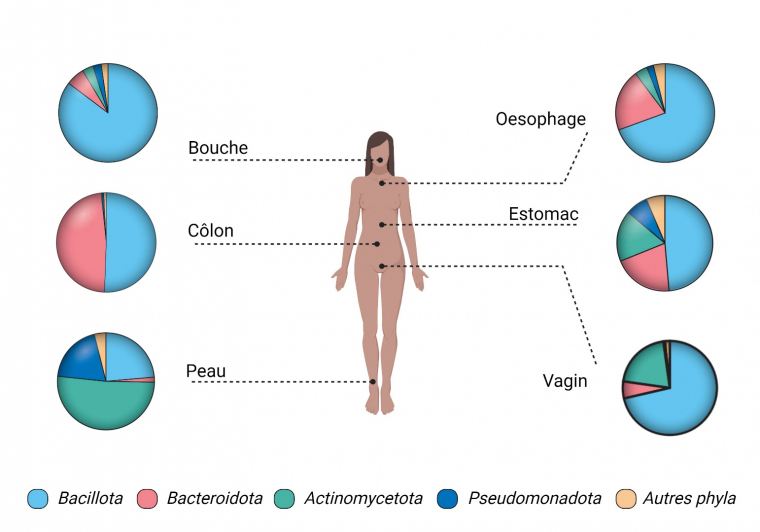
Les tissus colonisés sont essentiellement les muqueuses (intestinale, buccale, vaginale) et la surface de la peau, mais on trouve également des micro-organismes autour des yeux, sous les ongles, dans le nez ou encore les poumons. Les différents micro-organismes sont répartis dans ces diverses niches écologiques selon leurs préférences de température, de pH, de concentration en O2, d’osmolarité et de ressources nutritives.
Cette communauté microbienne est très diverse, à la fois taxonomiquement (par exemple, on estime qu’entre 500 et 1000 espèces différentes de bactéries sont associées à un corps humain à un instant t 6), mais aussi fonctionnellement, d’autant que chaque humain possède une combinaison unique de micro-organismes en densités très variables, y compris parmi les taxons les plus conservés 7. Parmi eux, les bactéries et les bactériophages sont majoritaires (99 %), tandis que le pourcent restant est composé d’autres virus, de levures, de champignons et d’archées. Les taxons bactériens les plus représentés sont les Bacillota (anciennement Firmicutes8), les Bacteroidota (ex-Bacteroidetes) et les Actinomycetota (ex-Actinobacteria), en proportions variables selon les organes considérés (Figure 1).
Schéma réalisé à l'aide de BioRender.
La prise de conscience de l’abondance et de la diversité des micro-organismes associés à l’être humain a contribué à l’émergence du concept d’holobionte au début des années 1990 12. Lynn Margulis, puis Zilber-Rosenberg et Rosenberg ont défini ce terme comme l’ensemble formé par un organisme et les micro-organismes avec lesquels l’hôte interagit et établit un dialogue moléculaire 3. À l’heure actuelle, il est admis que les organismes pluricellulaires sont associés à de multiples micro-organismes avec lesquels ils interagissent plus ou moins étroitement et, pour le moment, aucune exception n’est connue au sein du vivant 4. Le concept d’holobionte place donc les micro-organismes, jusque-là fort peu considérés du fait de leur inaccessibilité ou de leur pathogénicité, au centre des écosystèmes.
L’hôte interagit avec les micro-organismes qu’il héberge de façon directe (signalisation inter-espèces, échanges métaboliques) ou indirecte (modulation de la réponse immunitaire de l’hôte), modifiant les propriétés physico-chimiques des organes concernés et facilitant parfois la colonisation par d’autres micro-organismes. Qu’elles soient temporaires ou durables, ces interactions modifient les propriétés de l’hôte et de son microbiote, et sont donc essentielles pour la santé de l’hôte. Ainsi, la notion d’hologénome a été proposée en 2008 en complément au concept d’holobionte. L’hologénome correspond à la somme des gènes d’un hôte et de ceux apportés par son microbiote (qui forment le microbiome) 56. Devant l’importance des fonctions « gagnées » avec l’aide du microbiote, certains auteurs vont jusqu’à qualifier le microbiote intestinal humain d’organe à part entière, entretenant une relation symbiotique avec l’hôte, d’autant qu’il contient à lui seul environ 25 fois plus de gènes que le nombre de gènes humains 7.
La nature des interactions entre hôte et microbiote est variée. Les premiers travaux en microbiologie datant de la fin du XIXe siècle visaient d’ailleurs à relier des maladies (végétales ou humaines) à la présence de micro-organismes pathogènes (souvent des bactéries ou des champignons), et l’infiniment petit est ainsi essentiellement perçu à cette époque comme vecteur de maladies. Cette perception parcellaire de la réalité permet toutefois de grandes avancées scientifiques, notamment médicales, comme l’élaboration du premier vaccin contre la rage en 1885. Plus tard, au début du XXe siècle, Elie Metchnikov – un des élèves de Pasteur – se focalise sur les propriétés des bactéries présentes dans les intestins humains, et met en avant leur rôle potentiellement bénéfique dans la digestion, à considérer tout autant que leurs éventuelles propriétés pathogènes. Entretenir l’équilibre microbien, en termes de diversité taxonomique tout autant de que de diversité fonctionnelle, est donc primordial pour la santé humaine.
L’étude du microbiote humain, de plus en plus accessible
Si aujourd’hui, l’étude du microbiote humain est facilitée par l’émergence de techniques de plus en plus précises et de moins en moins coûteuses, il n’en fut pas toujours ainsi. Le microbiote fut d’abord étudié chez certains bovins dès les années 1940. Un chercheur américain, Robert Hungate, développe alors la méthode des tubes roulants (roll tubes), étanches aux gaz, permettant la culture de bactéries anaérobies du rumen de la vache, difficiles à cultiver jusqu’alors 89. Petit à petit, de nouvelles connaissances sur les micro-organismes des systèmes digestifs animaux sont ainsi acquises, mais le microbiote humain demeure encore largement inconnu.
Avant 1990, le microbiote intestinal humain est encore qualifié de « flore intestinale », terme rendu impropre suite à la nouvelle classification du vivant proposée par Carl Woese, dans laquelle il distingue les bactéries des archées et des eucaryotes (dont les végétaux auxquels les bactéries étaient assimilées jusqu’alors) 10. À partir des techniques développées sur d’autres animaux, le microbiote humain est rendu plus accessible et son exploration débute alors au début des années 1990. Le séquençage de l’ADN permet de mieux comprendre le rôle de certaines bactéries : en 1997 est ainsi publié dans Nature la séquence complète du génome de Bacillus subtilis 11. De façon générale, le séquençage permet de caractériser des bactéries difficilement cultivables qui représentent pourtant jusqu’à 70 % du microbiote intestinal. La conjugaison de différentes techniques d’étude permet donc actuellement une approche plus complète des communautés microbiennes : morphologique, taxonomique et génomique.
En mars 2010, la revue Nature titre « Our other genome » (Notre autre génome) et publie une étude présentant une première liste de plus de 3 millions de gènes microbiens obtenue par métaséquençage à partir d’échantillons fécaux, depuis complétée pour atteindre 10 millions de gènes, pour environ 3500 genres différents de bactéries ou d’archées 12. Ces travaux ont montré qu’il existerait au moins trois grands types de microbiotes intestinaux chez l’humain, appelés entérotypes. Chaque entérotype serait constitué d’un assemblage de communautés dominé par un genre bactérien (Bacteroides, Ruminococcus et Prevotella), déterminé notamment par le régime alimentaire 131415. Cette dominance n’exclut toutefois pas une diversité plus ou moins grande de micro-organismes selon les individus, qui peut évoluer au cours de la vie, et l’existence même de ces entérotypes reste encore discutée 16. Il semble toutefois clair que certaines bactéries se retrouvent chez tous les individus notamment celles des genres Faecalibacterium, Ruminococcus, Eubacterium, Dorea, Bacteroides, Alistipes et Bifidobacterium 17.
La diversité du microbiote, entre dynamisme et stabilité
La composition taxonomique du microbiote, intestinal notamment, et les fonctions associées diffèrent en fonction de nombreux paramètres variant dès la naissance, en fonction du mode d’accouchement et des habitudes de vie des parents, puis tout au long de l’existence de l’hôte : âge, régime alimentaire de l’enfant puis de l’adulte, consommation de tabac, antibiotiques, médicaments ou drogues, activité physique, interactions sociales… 181920212223
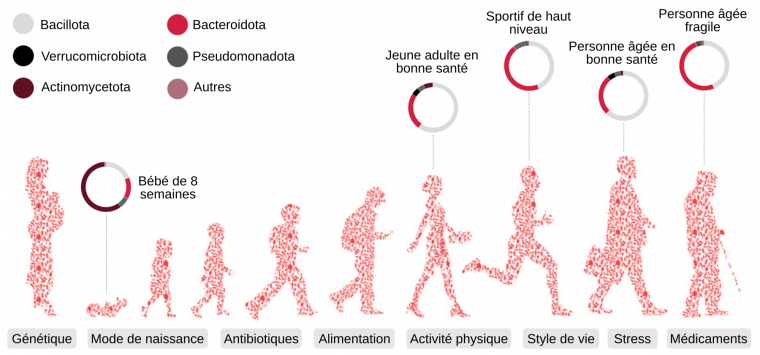
Dès les années 80, les travaux de transplantation de flores réalisés sur des souris ont permis de concevoir le dynamisme du microbiote intestinal animal, acquis à la naissance avant d’être soumis à différentes modifications en fonction de l’environnement (Figure 2) 24. En effet, le microbiote d’un individu s’acquiert dans un premier temps pendant l’accouchement, à partir du microbiote maternel. La communauté microbienne, bactérienne notamment, est à ce stade très simple 25. Au fur et à mesure de la croissance de l’individu, durant les deux à trois premières années de vie, elle évolue vers une communauté de plus en plus diverse, et de plus en plus stable, qui caractérisera le stade adulte 2627. Les personnes âgées présentent un microbiote intestinal à nouveau plus sensible aux perturbations extérieures, caractéristiques d’une sénescence plus ou moins rapide de la fonction protectrice de la barrière intestinale notamment (par exemple, leur microbiote est souvent caractérisé par une diminution de l’abondance de Bifidobacterium spp., responsable de la stimulation du système immunitaire et de certains processus métaboliques 28).
La diversité bactérienne du microbiote intestinal augmente durant les premiers mois de vie et devient stable à partir de l'âge de trois ans environ. Durant la vie adulte, la composition du microbiote intestinal est à peu près constante, mais peut varier suite à une maladie ou à la prise de médicaments (antibiotiques notamment) par exemple. La diversité bactérienne diminue chez les personnes âgées.
Les noms des phylums bactériens sont donnés selon la nouvelle nomenclature mise en place en 2021 par le Comité international de systématique des procaryotes. La correspondance est la suivante : Bacillota (ex-Firmicutes), Verrucomicrobiota (ex-Verrucomicrobia), Actinomycetota (ex-Actinobacteria), Bacteroidota (ex-Bacteroidetes), Pseudomonadota (ex-Proteobacteria).
Les facteurs environnementaux semblent être les déterminants principaux de la composition du microbiote intestinal (Figure 3), bien plus importants que l’effet du génome individuel humain, comme le montrent notamment les études comparant le microbiote de vrais et de faux jumeaux dans des environnements différents 1. Les microbiotes de la peau, de la muqueuse vaginale ou de la muqueuse buccale sont eux aussi différents à la fois d’un individu à l’autre – chaque individu développant une signature microbienne unique – mais également au cours du temps au sein d’un unique individu 23.
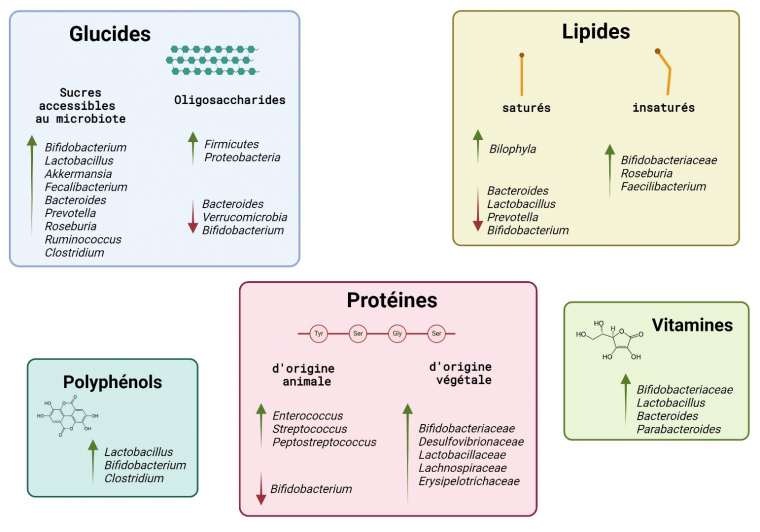
Les flèches indiquent une augmentation ou une diminution de l’abondance bactérienne des taxons cités. Ainsi, il a été prouvé qu’un régime de type « occidental » favorise la présence des micro-organismes tolérants à la bile, ainsi que l’augmentation des taux d’acides biliaires secondaires et d’oxyde de triméthylamine (un composé lié à l’excrétion azotée), le tout dans un contexte de santé dégradée. À l’inverse, un régime de type « méditerranéen » (riches en fruits et légumes notamment) favorise la présence de bactéries capables de dégrader les fibres, la synthèse d’acides gras à courte chaîne et de dérivés d’acide phénolique, dans un contexte de bonne santé générale.
Schéma réalisé à l'aide de BioRender.
Parmi l’ensemble des micro-organismes présents, on peut toutefois distinguer un « microbiote central » (core microbiota), relativement constant, d'un microbiote intermittent ou temporaire, affecté par des conditions environnementales spécifiques 1. Le microbiote central est la communauté microbienne constamment associée à un certain génotype hôte ou un environnement spécifique 2.
Le microbiote humain présente donc à la fois une certaine stabilité, mais également un certain dynamisme, comme toute biocénose peuplant un écosystème. Les variations dans la densité des populations d’espèces et la diversité des assemblages, selon des ampleurs et des échelles temporelles variables s’expliquent en particulier par les phénomènes de compétition entre les taxons microbiens, et des relations métaboliques changeantes, influencées par l’état du système immunitaire, le régime alimentaire ou les facteurs environnementaux 3.
Importance de l’équilibre fonctionnel de l’holobionte
Les gènes du microbiote, formant le microbiome, contribuent à la régulation de la physiologie de l’hôte grâce à différents types de protéines enzymatiques, influencent les métabolites produits et affectent donc le métabolisme humain. Selon les modifications dans la composition en espèces du microbiote, ces fonctions associées peuvent changer, rendant l’organisme plus ou moins sensible aux perturbations extérieures.
Afin de caractériser l’état fonctionnel d’un microbiote, il est possible de croiser des techniques de métagénomique quantitative et fonctionnelle. La métagénomique quantitative vise à comparer les microbiotes de sujets malades et de sujets sains, de façon à caractériser un « microbiote malade » et à faciliter l’anticipation de l’apparition de pathologies, ou à établir un diagnostic. La métagénomique fonctionnelle permet, à partir des gènes dominants d’un échantillon dont les micro-organismes en présence ne seraient pas forcément déterminés, d’identifier les fonctions découlant des interactions entre les micro-organismes et les cellules humaines, ainsi que les mécanismes de ces interactions, de façon à anticiper les conséquences d’un éventuel dysfonctionnement.
Les dernières avancées sur le sujet ont montré l’implication du microbiote intestinal dans la modulation du phénotype métabolique (les micro-organismes étant notamment impliqués dans le métabolisme protéique et glucidique), la régulation du développement épithélial et la régulation de l’immunité innée 45678. Les métabolites émis par les micro-organismes (notamment les acides gras à courte chaîne, les acides biliaires ou les dérivés du tryptophane) sont étudiés grâce à la métabolomique, technique récente permettant d’analyser la signature chimique d’un organisme ou d’un environnement. Certains micro-organismes produisent des métabolites qui, selon les cas, peuvent avoir des effets pro-inflammatoires ou anti-inflammatoires. En effet, les cellules épithéliales de l’intestin, les monocytes et les lymphocytes produisent des cytokines en réponse à ces métabolites, ce qui aboutit à une modulation de la réponse inflammatoire.
Grâce aux micro-organismes qui possèdent un bagage génétique codant des enzymes spécifiques impliquées dans des voies métaboliques originales, le corps humain est capable d’extraire plus d’énergie de la nourriture ingérée, de synthétiser des vitamines ou de métaboliser des glucides non digestibles par les enzymes humaines 910. Par exemple, le microbiote intestinal est impliqué dans l’assimilation de certains aliments non digérés dans l’estomac et l’intestin grêle, comme des fibres retrouvées dans les légumes et digérées par une espèce spécifique du genre Bacteroides 11. Certains oligosaccharides peuvent être utilisés par des Lactobacillus ou des Bifidobacterium 12. Par ailleurs, le microbiote intestinal produit 50 à 100 mmol/L/jour d’acides gras à courte chaîne (acides acétique, propionique, butyrique) qui servent de source d’énergie pour l’épithélium intestinal. De plus, il permet d’accentuer la disponibilité de certaines vitamines pour l’hôte, comme la vitamine K, la biotine, la vitamine B2 ou B12 13.
Les macronutriments et micronutriments ne sont pas les seules molécules dont l’absorption est modulée par le microbiote. Une équipe de chercheurs belges a montré l’importance du microbiote intestinal dans l’augmentation de l’absorption d’un médicament utilisé comme anti-rejet après une greffe d’organe. Certaines souches bactériennes permettraient en effet de limiter l’action d’une pompe protéique présente à la surface des entérocytes et limitant naturellement l’absorption de nombreux médicaments (des immunosuppresseurs par exemple) vers la circulation systémique 14. Enfin, le microbiote humain protège également contre l’installation de pathogènes, en occupant l’espace disponible, en entrant en compétition pour les ressources et en produisant des substances anti-microbiennes 151617.
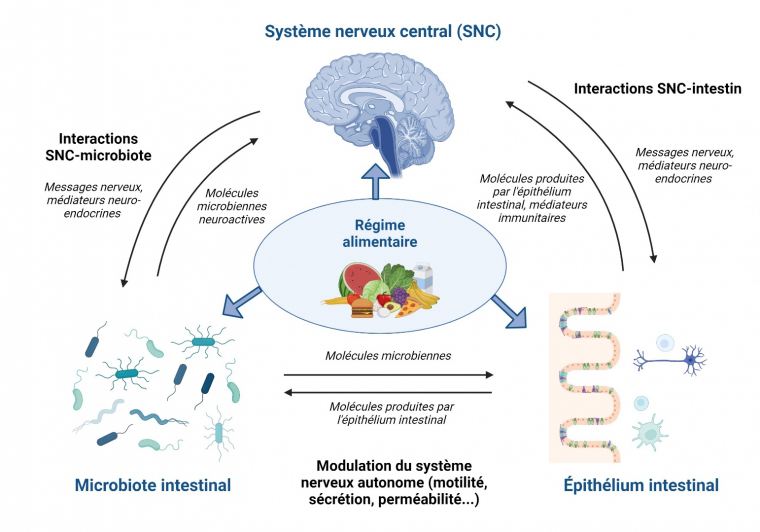
La grande diversité des fonctions enrichies par la présence d’un microbiote symbiotique est modulée par le dialogue microbiote-intestin-système nerveux central. En effet, à tous les stades de l’existence, le microbiote (intestinal surtout) est en étroite interaction avec les systèmes immunitaire, endocrine et nerveux, par l’intermédiaire de molécules microbiennes activatrices ou inhibitrices, de médiateurs immunitaires ou de messages nerveux. Il existe de multiples études mettant en évidence l’importance primordiale du maintien de l’équilibre de ces interactions de façon à garantir l’homéostasie de l’holobionte (Figure 4).
Le système cerveau-intestin-microbiote est constitué de canaux de communication neuro-endocrines, nerveux et immunitaires, à l’origine d’un réseau d’interactions bidirectionnelles entre les éléments du triptyque, renforcé par des boucles de rétroaction. Le régime alimentaire joue un rôle sur la composition du microbiote intestinal, mais peut également moduler la structure et la fonction du cerveau grâce à ces canaux de communication. Les nutriments ingérés peuvent influer directement sur l’intestin et agir sur le cerveau après absorption dans l’intestin grêle. La modulation de la diversité et de l’abondance microbienne par le régime alimentaire provoque des modifications du métabolisme microbien, qui peut lui-même affecter l’épithélium intestinal. Certaines molécules microbiennes sont absorbées et atteignent le cerveau via la circulation systémique et/ou le nerf vague. De son côté, le cerveau peut moduler le microbiote de façon directe grâce à des substances neuro-actives libérées dans la lumière intestinale, qui affectent l’expression des gènes microbiens, ou de façon indirecte via des altérations de l’environnement microbien.
Facteurs de déséquilibre et conséquences
On ne saurait aborder le lien entre microbiote humain et santé sans évoquer le rôle des micro-organismes dans le développement de maladies. Lorsque la symbiose entre hôte et microbiote est altérée, on parle de dysbiose microbienne, notamment caractérisée par une perte importante de diversité 12. De nombreuses pathologies semblent être associées à des dysbioses plus ou moins importantes, mais ces corrélations sont souvent fondées sur des études observationnelles, et établir un lien irréfutable de causalité entre dysbiose et apparition de symptômes reste encore rare.
Afin de comprendre le lien entre perturbation du microbiote et santé, plusieurs méthodes sont utilisées. Les plus connues concernent l’utilisation d’animaux dits axéniques, élevés en milieu stérile et de ce fait dépourvus de microbiote. Le microbiote d’un individu malade peut ensuite être implanté dans ces animaux pour voir s’il est possible de reproduire les symptômes de la maladie et, le cas échéant, d’étudier ensuite celle-ci.
La dysbiose du microbiote semble favorisée par le stress oxydatif, l’augmentation de la perméabilité de l’épithélium intestinal ou un état inflammatoire, et tous les compartiments colonisés par les micro-organismes peuvent être touchés. Toutefois, la majorité des résultats concernent les dysbioses du microbiote intestinal. Ainsi, il semblerait notamment qu’un microbiote pauvre en termes de diversité, ou d’entérotype Bacteroidota, puisse être associé au développement plus fréquent de maladies cardiométaboliques 345. Petit à petit, la liste des maladies corrélées à un dysfonctionnement du microbiote intestinal s’allonge : maladies inflammatoires chroniques de l’intestin (2006), diabète de type II (2012), obésité (2013), cirrhose (2014)… mais également cancers, maladies neurodégénératives (sclérose en plaque, maladies d’Alzheimer et de Parkinson) ou neuropsychiatriques (autisme, dépression, bipolarité…), maladies infectieuses.
Les maladies infectieuses sont des maladies provoquées par l’entrée dans l’organisme d’un agent infectieux (virus, bactérie, champignon…), et illustrent donc un lien direct d’interaction entre corps humain et micro-organismes. D’après de nombreuses études, il y aurait de plus une relation étroite entre la probabilité d’une telle infection et la dysbiose préexistante du microbiote intestinal, comme dans le cas d’infections bactériennes (par exemple à Clostridioides difficile, une bactérie qui fabrique une toxine altérant l’épithélium intestinal, ce qui provoque de fortes diarrhées) ou virales (VIH, hépatite B…) 67891011. En effet, même si les micro-organismes pathogènes ne représentent qu’une infime fraction des micro-organismes associés à l’humain, l’apparition ou la disparition de certaines espèces microbiennes au sein d’une population peut conduire, en raison des phénomènes de compétition existant entre ces espèces, à un bouleversement de l’équilibre taxonomique en place dans un microbiote considéré comme « sain ». L’activation ou la réactivation d’espèces pathogènes à l’état latent, tout comme la néocolonisation par des pathogènes opportunistes, est alors possible 12. L’impact d’une infection peut également être modulé par la présence du microbiote : par exemple, des pathogènes peuvent coloniser la muqueuse intestinale, ce qui implique une réponse inflammatoire importante et une augmentation de la perméabilité de l’épithélium intestinal. La translocation microbienne de molécules produites par les bactéries symbiotiques vers la circulation systémique est donc accentuée, engendrant une réaction immunitaire d’autant plus importante 1314. L’émergence d’une maladie infectieuse pose donc une question de temporalité des événements : l’arrivée d’un pathogène est-elle à l’origine de la dysbiose du microbiote en place, ce qui provoque un déséquilibre fonctionnel et favorise le développement de symptômes (comme cela a été montré chez la souris 15), ou bien la dysbiose du microbiote provoquée par des facteurs externes facilite-t-elle l’infection par un pathogène opportuniste ou la réactivation d’un pathogène latent ?
Dans le cas des maladies neurodégénératives, les mécanismes qui sont à l’origine du lien maladie-microbiote, et notamment la temporalité des événements sont encore assez mal connus. Il semblerait cependant qu’une dysbiose microbienne au niveau intestinal puisse provoquer une inflammation favorisant la perméabilité de la barrière hémato-encéphalique. Le rôle de cette barrière est de protéger le cerveau et la moelle épinière du passage de certaines substances toxiques, son altération favoriserait donc l’apparition de maladies neurodégénératives ou psychiatriques. Le lien entre dysbiose du microbiote et état inflammatoire est confirmé par les nombreuses maladies inflammatoires à médiation immunitaire qui semblent favorisées dans un contexte de déséquilibre microbien : maladie de Crohn, polyarthrite rhumatoïde, sclérose en plaques… Une fois l’équilibre microbien altéré, un cercle vicieux se met alors en place, entretenant ce contexte favorable au développement de certaines maladies chroniques.
Établir une liste exhaustive des maladies liées plus ou moins directement à une dysbiose du microbiote serait donc peine perdue, mais on peut toutefois citer encore quelques exemples bien connus liés à un probable déséquilibre du microbiote oral. Ce microbiote se caractérise par une organisation en biofilms, qui recouvrent les dents, l’intérieur des joues et les gencives. La plaque dentaire se développe et les caries apparaissent lorsque la composition de ces biofilms est perturbée ou déséquilibrée 16. Si ces affections sont connues et caractérisées depuis longtemps, les dysbioses du microbiote oral pourraient également être liées à des maladies articulaires ou osseuses comme l’arthrite rhumatoïde 17, les maladies inflammatoires chroniques de l’intestin 18 ou le lupus érythémateux par exemple 19. De nombreuses espèces microbiennes vivent également à la surface de la peau ou dans la sphère ORL. Un déséquilibre des communautés formées peut provoquer transpiration excessive, mauvaise haleine ou acné.
Prendre soin de son microbiote, quelles perspectives ?
La définition exacte d’un microbiote dit « sain » reste encore à préciser, mais l’ensemble de la communauté microbienne associée à un individu peut toutefois être divisé en micro-organismes bénéfiques de type symbiotique (les micro-organismes remplissent des fonctions contribuant à la santé de l’organisme), en micro-organismes pathogènes (dont l’impact sur l’humain est négatif), et en micro-organismes neutres ou à l’état latent vis-à-vis de la santé humaine.
Lancé en 2022, le projet French Gut vise à caractériser le microbiote des Français à partir de la collecte des selles de 100 000 volontaires d’ici 2027, en même temps que les données nutritionnelles et cliniques de chacun 20. L’enjeu est de définir ce qu’est un microbiote sain, ainsi que les altérations possibles en cas de maladies chroniques, neurodéveloppementales ou neurodégénératives. Ce projet s’inscrit dans un vaste programme mondial (Million Microbiome of Humans Project) qui permettra l’analyse d’un million d’échantillons microbiens provenant des intestins, mais également de la bouche, la peau ou l’appareil reproducteur humains.
S’il est actuellement encore trop tôt pour des applications cliniques, les scientifiques espèrent que ce procédé deviendra dans le futur aussi courant qu’une analyse de sang, et qu’il permettra la détection et la prise en charge de nombreuses pathologies.
Agir de façon préventive
Les facteurs principaux d’influence sur la diversité du microbiote restent le mode de vie et l’alimentation de l’hôte. En effet, étant donné qu’hôte et microbiote vivent en symbiose, il est nécessaire de prendre en compte l’ensemble de l’holobionte et non pas uniquement d’agir directement sur le microbiote seul.
Plus l’alimentation est variée et saine (se rapprochant d’un régime type méditerranéen), plus la diversité microbienne est favorisée, et ainsi son potentiel protecteur vis-à-vis des pathogènes augmenté 2122. En effet, de nombreux aliments contiennent des prébiotiques, c’est-à-dire des molécules non digestibles par l’hôte humain, mais qui constituent une source d’alimentation des micro-organismes du microbiote 23. Ils sont naturellement présents dans une grande variété d’aliments : la consommation régulière de fruits et légumes riches en fibres est ainsi préconisée afin d’augmenter la richesse et la diversité microbienne. Ces longues chaînes polysaccharidiques sont dégradées et fermentées par diverses espèces microbiennes, chacune ayant sa place dans le processus en fonction des enzymes produites. Une réduction de l’apport en fibres diminue la diversité bactérienne responsable de cette chaîne de dégradation. De plus, la transformation des fibres permet la production d’acides gras à courte chaîne, bons pour notre santé, car ils régulent les processus inflammatoires et inhibent la prolifération de cellules cancéreuses dans le côlon, entre autres 242526. Les polyphénols également contenus dans les végétaux ont des propriétés anti-oxydantes et anti-inflammatoires bénéfiques au microbiote intestinal. Les aliments riches en protéines apportent de la glutamine, un acide aminé qui contribue à la croissance de la paroi intestinale (en stimulant la prolifération des entérocytes) et à la restauration des jonctions intercellulaires assurant son rôle de barrière protectrice 2728.
Il est également possible de consommer des probiotiques, c’est-à-dire des micro-organismes vivants qui viennent enrichir le microbiote intestinal. Les souches les plus communes parmi les probiotiques utilisés sont Lactobacillus et Bifidobacterium. Ces probiotiques sont présents dans de nombreux aliments fermentés comme les yaourts, le fromage ou le kéfir par exemple. Il a été montré que les probiotiques, outre leurs effets bénéfiques sur l’équilibre général du microbiote, peuvent aider à soulager le syndrome de l’intestin irritable, à augmenter la production de vitamines, l’absorption des nutriments et à diminuer les symptômes des affections courantes comme la grippe ou d’autres affections respiratoires 293031. Dans le cadre de certaines maladies comme la dépression, il a d’ores et déjà été montré, chez la souris, que la combinaison de l’utilisation d’un probiotique, de la glutamine (un acide aminé protégeant la barrière intestinale) et de la curcumine (un polyphénol anti-oxydant et anti-inflammatoire) permet d’agir sur les quatre facteurs principaux de dysbiose et de donner des résultats analogues à ceux d’un anti-dépresseur, la clomipramine 32.
Afin de prendre soin de l’hôte – soit l’environnement du microbiote – il est préconisé de limiter le recours aux antibiotiques, qui éliminent à la fois « bonnes » et « mauvaises » bactéries, leur utilisation prolongée ou trop régulière pouvant engendrer un appauvrissement du microbiote et une antibiorésistance 3334353637. En effet, la prise de traitements antibiotiques peut être associée à une perte de diversité bactérienne ainsi qu’à une augmentation du nombre de bactéries résistantes suite à des transferts horizontaux de gènes ou à des mutations. Par ailleurs, un régime alimentaire pauvre en contaminants (résidus de pesticides, émulsifiants, édulcorants) permet de réduire le risque d’apparition des maladies chroniques en optimisant le fonctionnement du système immunitaire 3839. Enfin, limiter les facteurs de stress qui augmenteraient la perméabilité des intestins et donc les risques d’altération du microbiote semble important 404142.
Rétablir un microbiote sain
Actuellement, l’ingénierie du microbiote humain concerne essentiellement des ajouts d’un ou plusieurs micro-organismes spécifiques au microbiote intestinal (par exemple par transplantation de microbiote fécal), la prise de prébiotiques ou encore de métabolites particuliers, de façon à provoquer un changement dans la composition et les fonctions du microbiote 1.
La technique de transfert de microbiote intestinal consiste à administrer des selles de donneurs sains au système digestif d’un receveur afin de restaurer la diversité de son microbiote. Les selles sont préalablement filtrées pour retirer les plus grosses particules, puis elles sont administrées par voie haute (sonde naso-gastrique ou naso-intestinale, pilules) ou par voie basse (coloscopie, lavement) 2. La transplantation de microbiote fécal est actuellement utilisée en routine dans le traitement des infections récidivantes à la bactérie Clostridioides difficile, avec succès dans 80 à 90 % des cas. Les premiers résultats obtenus dans le cadre du traitement du cancer sont également prometteurs. En 2016, les essais ont permis de rétablir la symbiose microbienne de 90 % de patients atteints de leucémie myéloïde aiguë post-chimiothérapie (en diminuant en outre le nombre de bactéries pro-inflammatoires), ce qui est primordial pour ces patients dont le microbiote est considérablement altéré par la chimiothérapie et les antibiotiques utilisés pour soigner la maladie. En 2021, la technique de transfert de microbiote encapsulé a permis d’améliorer la survie de patients ayant subi une greffe de moelle osseuse dans le traitement de la leucémie, sujets à une maladie du greffon contre l’hôte 3. À l’heure actuelle, de nombreux projets de recherche visant à élaborer des traitements contre les maladies neurodégénératives ou inflammatoires font la part belle à la transplantation de microbiote fécal et à l’utilisation de probiotiques de nouvelle génération, qui correspondent à des bactéries identifiées comme absentes du microbiote des personnes malades et qui leur sont donc administrées 45.
Conclusion
L’étude et la compréhension du fonctionnement du microbiote humain constituent donc un champ de recherche très dynamique et prometteur. Les enjeux actuels visent à transposer à l’être humain certains résultats obtenus sur modèles murins, à vérifier à grande échelle les nombreuses relations supposées entre dysbioses microbiennes et émergence de pathologies, et à fiabiliser les techniques d’ingénierie du microbiote actuellement développées, de manière à pouvoir généraliser les situations thérapeutiques dans lesquelles elles sont d’ores et déjà utilisées.