La majorité des êtres vivants pluricellulaires sont colonisés par une multitude de micro-organismes. C’est le cas notamment des plantes, dont les racines abritent une vaste biodiversité microbienne. Ce microbiote est composé de diverses espèces de bactéries, champignons et protistes, qui étendent le répertoire génétique de la plante, interagissent et contribuent à sa survie. Des recherches récentes illustrent l’importance du microbiote pour la santé des plantes et une agriculture durable.
La plante et son microbiote forment un holobionte
Les plantes évoluent dans un environnement riche en micro-organismes qui proviennent de multiples sources (par exemple le sol, l’air, l’eau, les insectes) et qui peuvent entrer en contact avec les tissus végétaux. Chaque plante interagit donc avec un milieu composé d’une grande diversité microbienne (plusieurs milliers d’espèces) appartenant aux bactéries [1], archées [2], champignons [3] et protistes [4]. Par ailleurs, les virus (dont les bactériophages), après infection de cellules vivantes, peuvent également faire partie de ces communautés microbiennes [5]. Parmi cette diversité de micro-organismes environnant les plantes, certains peuvent interagir directement avec elles, et même les coloniser en surface ou à l’intérieur de leurs tissus, pour former ce qu’on appelle le microbiote des plantes. Cet article traite de généralités sur le microbiote de plante, incluant toutes les formes d’interaction entre les micro-organismes et la plante (symbiose mutualiste lorsque les deux partenaires en tirent un bénéfice mutuel, parasitisme lorsque qu’il y a un effet négatif pour la plante et positif pour le micro-organisme, commensalisme lorsqu’il y a un effet positif pour le micro-organisme sans contre-partie pour la plante). Nous donnons principalement des exemples d’interactions bénéfiques pour la plante, sans oublier que la frontière entre un micro-organisme bénéfique ou pathogène est fine et que le résultat de l’interaction dépend du contexte environnemental, dont font partie la diversité au sein du microbiote et les facteurs anthropiques qui affectent cette diversité.
Une composition variable du microbiote
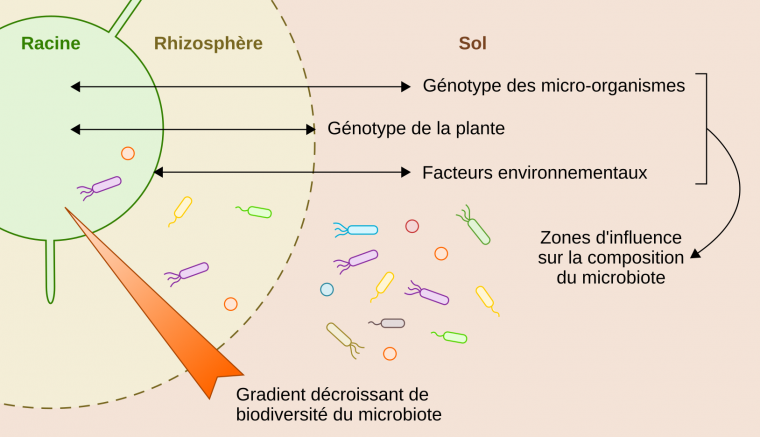
La composition du microbiote des plantes varie fortement selon le génotype de la plante (dépendant de l’espèce végétale et de la variété cultivée), les propriétés de son lieu de croissance (type de sol, climat et autres facteurs environnementaux), et la capacité génétique des micro-organismes environnants à interagir avec la plante (Figure 1).
Schéma d’une coupe transversale de racine de plante présentant les compartiments colonisés par des microbiotes spécifiques (racine, rhizosphère et sol), le gradient de biodiversité du microbiote et les facteurs influençant la composition du microbiote dans chaque compartiment : génotype des micro-organismes, génotype de la plante, environnement de la plante.
Télécharger une version éditable au format SVG.
Selon le génotype des plantes
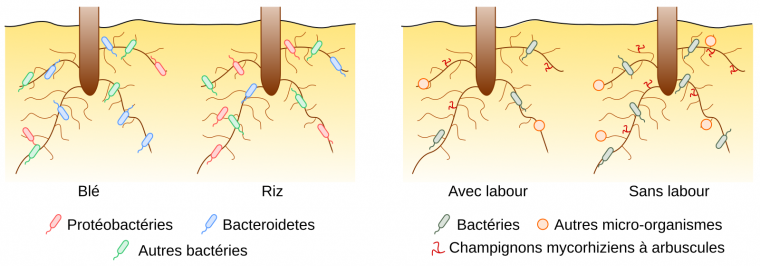
Le microbiote associé à un plant de riz cultivé en Asie est différent du microbiote associé à un plant de blé cultivé en Afrique ; l’abondance (c’est-à-dire le nombre de micro-organismes) et la diversité (par exemple le nombre d’espèces différentes ou leur répartition sur un arbre phylogénétique selon l’indice de diversité considéré) varient. En particulier, chez le blé, les bactéries du phylum Bacteroidetes sont dominantes par rapport aux Proteobacteria [6], alors que l’inverse est observé pour le riz [7] (Figure 2). Le génotype de la plante conditionne donc les espèces de micro-organismes avec lesquelles la plante est associée. Bien que le riz et le blé soient deux céréales (taxon des Poacées, ou Graminées), leur anatomie, leur physiologie, leur métabolisme, et la composition des exsudats racinaires diffèrent et entraînent la colonisation de microbiotes différents. Cependant, les recherches indiquent que les facteurs environnementaux ont généralement plus d’impacts que le génotype de la plante sur son microbiote.
À gauche. Effet du génotype de la plante (riz ou blé) sur le microbiote bactérien racinaire.
À droite. Effet d’un facteur environnemental (la pratique du labour) sur le microbiote bactérien et fongique racinaire.
Télécharger une version éditable au format SVG.
Selon les propriétés du lieu de croissance
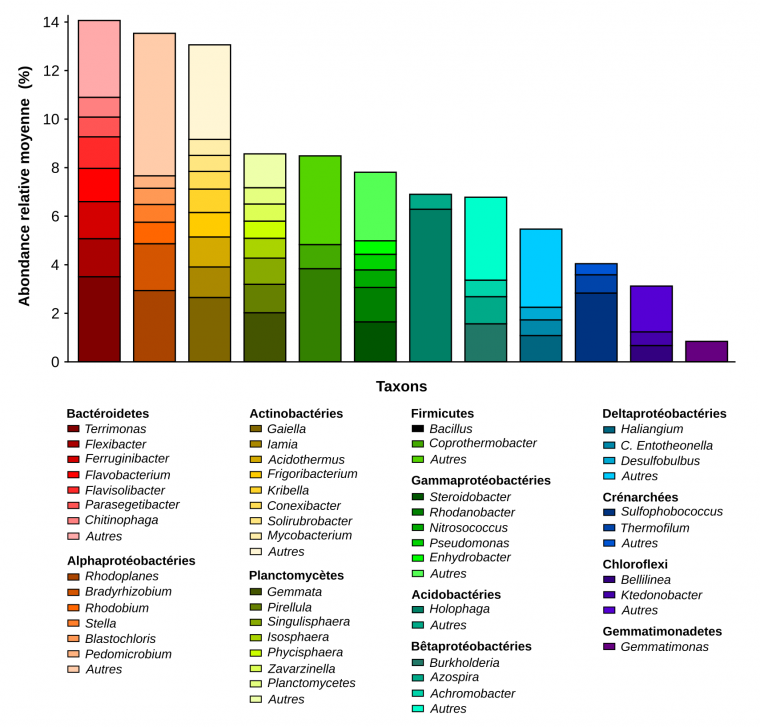
Les deux espèces que sont le riz et le blé sont cultivées dans des sols différents et sont soumises à des pratiques agricoles contrastées (le riz est irrigué alors que le blé est arrosé par la pluie). Cela entraîne une composition particulière du microbiote du sol qui est l’inoculum principal du microbiote des racines. Selon la situation géographique et les pratiques agricoles, la diversité des micro-organismes du sol sera donc différente et cela constituera par conséquent un réservoir unique pour l’assemblage du microbiote de la plante. La figure 3 montre par exemple la composition des bactéries et des archées présentes dans les sols en France, et susceptibles de coloniser les plantes.
Abondances relatives moyennes (en ordonnée) des 12 phyla et 47 genres principaux de Bactéries et Archées (en abscisse) retrouvés dans 2173 échantillons de sols répartis sur l'ensemble de la France métropolitaine. Les catégorie « Autres » correspond à la somme de tous les genres de chaque phylum représentant moins de 0,5% des séquences d’ADN servant à l’identification des micro-organismes.
Télécharger une version éditable au format SVG.
Selon les capacités des micro-organismes à interagir avec la plante
Les caractéristiques des micro-organismes contraignent leur capacité de colonisation. Selon les gènes qu’ils possèdent, différents mécanismes d’interaction se mettent en place avec la plante. De plus, le résultat de cette interaction dépend du contexte environnemental. Par exemple, la colonisation fongique (c’est-à-dire par les champignons) des plantes apparaît plus sensible aux pratiques agricoles que celle des bactéries, probablement car ces micro-organismes ont des besoins et des cycles de développement distincts ; le temps de génération des champignons est plus lent que celui des bactéries, ce qui les rendrait moins résilients aux perturbations du sol comme le labour (Figure 2, à droite). Par conséquent, le microbiote fongique des plantes varie de manière plus importante selon les pratiques agricoles mises en œuvre pour la culture des plantes que le microbiote bactérien (comme démontré en comparant l’agriculture conventionnelle avec l’agriculture biologique [6] ou avec l’agriculture de conservation [7]).
Une compartimentation spécifique du microbiote selon les tissus
Le microbiote des plantes colonise tous les tissus végétaux accessibles et se retrouve donc dans tous les organes des plantes : la rhizosphère (c’est-à-dire la fraction du sol directement sous l’influence des racines), les racines (en surface et à l’intérieur), les tiges, les feuilles, les fleurs et les graines. Cependant, de la même manière que la composition du microbiote dépend de chaque plante cultivée, la composition du microbiote varie selon les organes de la plante car les propriétés de ces habitats (pH, disponibilité en dioxygène, en nutriments et en eau) diffèrent. Cela aboutit à une compartimentation du microbiote, formant ainsi des microbiotes spécifiques à chaque tissu.
Au niveau des racines, il existe un gradient de biodiversité décroissant de l’extérieur vers l’intérieur de ces organes [8]. Autrement dit, la diversité des espèces est plus importante dans la rhizosphère qu’à l’intérieur des racines (Figure 1). Chez le riz par exemple, on observe environ cinq fois plus de bactéries spécifiques à la rhizosphère qu’à l’intérieur des racines [9]. Ce gradient de diversité est en partie dû aux défenses immunitaires de la plante qui contrôlent l’entrée et la croissance des micro-organismes dans les tissus végétaux grâce à des mécanismes moléculaires spécifiques traduisant la coévolution entre les plantes et leurs microbiotes [10]. Plus on s’éloigne de la racine, plus l’effet des défenses de la plante sur le microbiote diminue et ce dernier devient alors principalement influencé par la composition des exsudats racinaires et les propriétés du sol (Figure 1). Si les conditions sont favorables à la croissance du microbiote et qu’il possède la constitution génétique pour interagir durablement avec la plante, alors l’association entre la plante et le microbiote peut persister au fil des générations.
Une association durable
Chez certaines plantes, la coévolution de la plante et de son microbiote acquis dans l’environnement (transmission horizontale, comme vu dans la partie 1.2.) a mené à la mise en place de symbioses aux bénéfices réciproques qui sont cruciales au développement de la plante. À titre d’exemple, on peut citer les symbioses entre les bactéries du genre Rhizobium, fixatrices d’azote atmosphérique, et les Fabacées (ou Légumineuses) dans des sols pauvres en azote [11], ou entre les champignons du genre Epichloë et les Poacées, pour lesquels l’association permet aux deux partenaires une croissance et une reproduction améliorées. Par ailleurs, les Epichloë peuvent coloniser les graines et se transmettent ainsi de génération en génération de plantes, suggérant l’importance d’une telle symbiose [12]. Les graines de quinoa, quant à elles, sont colonisées par des bactéries du genre Bacillus qui leur permettent de germer en quelques minutes dans des conditions extrêmement hostiles de sécheresse ou de salinité [13]. Il existe même des orchidées qui ne peuvent germer qu’en présence de champignons du genre Sebacina [14].
Les plantes évoluent donc avec leur microbiote en conservant une partie des micro-organismes transmis verticalement de génération en génération et en acquérant une autre partie depuis l’environnement. Collectivement, les organismes du microbiote apportent des fonctions essentielles à la survie des plantes. Face à cette observation, les plantes ne peuvent plus être considérées comme des êtres individuels et autonomes mais comme un assemblage d’espèces et de leurs répertoires de gènes que l’on appelle un holobionte (une plante hôte + son microbiote associé).
À l’interface entre le sol et les racines, le microbiote de la rhizosphère a des implications importantes dans le fonctionnement des plantes que nous allons détailler dans la suite de cet exposé.
Le microbiote de la rhizosphère est un phénotype étendu de la plante
En tant qu’organismes sessiles (c’est-à-dire immobiles), les plantes font face à un environnement changeant et imprévisible. Ainsi soumises à de multiples stress biotiques (par exemple des attaques par des agents pathogènes ou par des herbivores) ou abiotiques (par exemple des sécheresses ou des carences en nutriments), elles disposent d’une plasticité phénotypique leur permettant de moduler l’architecture et la physiologie de leur système racinaire pour explorer les différents horizons du sol, détecter et exploiter les couches riches en eau, en nutriments et en micro-organismes [15].
Des fonctions essentielles à la survie
Les plantes sont en interaction avec des agents pathogènes responsables de nombreuses maladies comme la pyriculoriose du riz et l’oïdium de la vigne pour ne citer que celles-ci (stress biotiques). De plus, les plantes doivent extraire du sol des ressources telles que l’eau et les nutriments (azote, phosphore et potassium, principalement), dont la distribution est inégale et change de façon dynamique (stress abiotiques). Pour survivre, l’une des stratégies apparues au cours de l’évolution consiste à recruter un microbiote, en particulier dans la rhizosphère, qui représente un catalogue de gènes et donc de fonctions pouvant contribuer à la tolérance aux stress et même à leur survie.
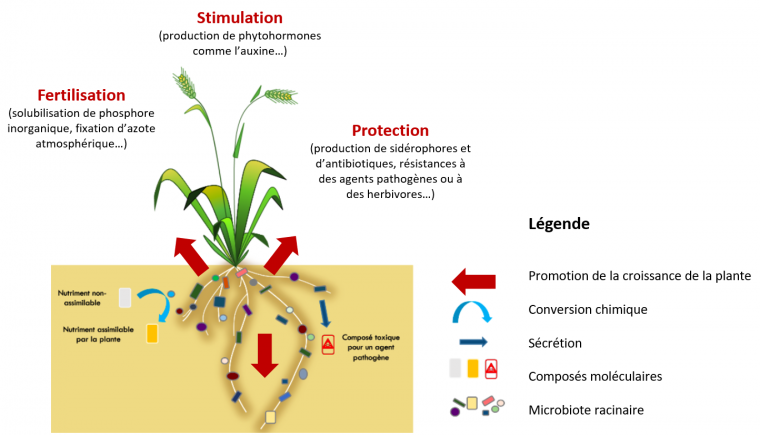
Le microbiote peut avoir de nombreux effets directs et indirects de soutien de la croissance des plantes (Figure 4). Ces effets comprennent la fertilisation (c’est le cas de bactéries qui fixent l’azote atmosphérique ou de champignons qui solubilisent le phosphore pour le rendre plus assimilable par la plante), la stimulation de la croissance (c’est le cas de bactéries qui produisent de l’auxine, une phytohormone stimulant la croissance racinaire) et la protection (c’est le cas de bactéries qui produisent des molécules antagonistes d’agents pathogènes). Par exemple, dans des conditions de faible teneur en phosphore, les plantes satisfont leurs besoins en ce nutriment essentiel en s’associant à des partenaires microbiens, en particulier à des champignons mycorhiziens à arbuscules qui colonisent plus de 80 % des plantes terrestres [16]. D’autre part, les micro-organismes stimulent la production d’hormones végétales par la plante qui déclenchent des résistances systémiques ou acquises lors d’une attaque par un agent pathogène ou un herbivore via l’activation de gènes de défense [17]. En conférant aux plantes une tolérance aux stress biotiques et abiotiques et en assurant la croissance et la santé des plantes, leur microbiote apporte des caractères supplémentaires aux plantes et contribue au phénotype étendu des plantes.
La croissance de la plante est soutenue par trois fonctions portées par son microbiote racinaire que sont la fertilisation, la stimulation de la croissance et la protection.
Des mécanismes d’interaction mis en jeu
Les plantes utilisent différents mécanismes pour modifier les propriétés physico-chimiques du sol et ainsi moduler la composition du microbiote de la rhizosphère. Réciproquement, les micro-organismes du sol déclenchent d’importants ajustements fonctionnels chez les plantes, tels que la stimulation de la croissance des racines ou l’amélioration de la disponibilité en nutriments pour la plante, comme mentionné ci-dessus.
Au niveau des racines, les plantes exsudent dans la rhizosphère une vaste gamme de composés. L’exsudation racinaire comprend la sécrétion de composés de faible poids moléculaire (par exemple des molécules telles que du dioxygène libre, de l’eau, des acides aminés, des sucres simples) qui représentent une grande partie de la diversité des exsudats racinaires, et des exsudats de poids moléculaire élevé (par exemple des mucilages tels que les polysaccharides) qui sont moins diversifiés mais composent souvent une plus grande proportion de la masse des exsudats racinaires [18]. Bien que les fonctions de la plupart de ces exsudats racinaires n’aient pas été déterminées, plusieurs composés jouent des rôles importants dans les processus biologiques. Par exemple, les plantes pourraient stimuler ou inhiber la croissance de micro-organismes spécifiques par le dépôt d’exsudats dans la rhizosphère (rhizodéposition) pour leur propre bénéfice et maintenir ainsi les fonctions de survie [19]. Des preuves récentes suggèrent même que les plantes « appellent à l’aide » lors de l’exposition à un stress en changeant la chimie de l’exsudation de leurs racines, ce qui entraîne le recrutement de micro-organismes spécifiques permettant de minimiser les dommages causés par le stress [20]. L’exsudation racinaire, et la rhizodéposition qui en résulte, seraient donc les principaux moteurs des interactions entre les plantes et leur microbiote, et pourraient même assurer la protection de la génération suivante dans le même sol [21]. En raison de ces modifications dans la composition du microbiote de la rhizosphère, les plantes transforment non seulement leur propre physiologie, mais aussi les propriétés physico-chimiques et donc la niche écologique qui les abrite. Ainsi, la résistance des plantes aux stress biotiques et abiotiques n’est pas seulement déterminée par la constitution génétique de la plante mais aussi par son microbiote, et par des effets de rétroaction qui peuvent émerger entre ces organismes qui partagent le même écosystème.
L’ingénierie du microbiote des plantes : vers des solutions de remplacement aux engrais et pesticides de synthèse
Par l’étude approfondie du microbiote des plantes
Deux méthodes complémentaires sont couramment utilisées par la recherche en écologie microbienne pour étudier les microbiotes.
Les méthodes de culture
Cette première méthode implique d’abord d’isoler les micro-organismes à partir d’échantillons frais (par exemple des racines ou du sol) au laboratoire sur boite de Petri ou en milieu liquide permettant la croissance des micro-organismes. Ils sont cultivés, isolés, purifiés et conservés sur des milieux de culture afin de maintenir le matériel microbien vivant et de pouvoir l’utiliser dans des expériences in vitro ou in vivo au laboratoire. Les tests in vitro comprennent la caractérisation des traits favorisant la croissance des plantes (par exemple la fixation d’azote, la production d’ammonium, la solubilisation de phosphore, la solubilisation de zinc ou la production d’auxine) et des traits de défense (par exemple l’activité chitinase pour le caractère antifongique, la production de sidérophores qui séquestrent le fer et empêchent les agents pathogènes de se développer, la production d’acide salicylique qui est une phytohormone de défense). L’activité antagoniste contre d’autres organismes (par exemple les nématodes phytoparasitaires ou des bactéries du même microbiote) peut également être mesurée. Les tests in vivo comprennent la validation de ces traits sur la plante, en mesurant de potentiels bénéfices sur la croissance et la reproduction des plantes, ainsi que sur la réduction des symptômes après l’infection par un agent pathogène.
Les méthodes de culture ne nécessitent qu’une expertise et un matériel simples en microbiologie. Cependant, leur principale limite réside dans le très faible pourcentage de micro-organismes cultivables. Par exemple, chez les plantes, moins de 10 % seulement des bactéries sont récupérées par les méthodes de culture classiques, car la plupart des bactéries associées aux plantes nécessitent des conditions de croissance spécifiques. Néanmoins, ce pourcentage peut être amélioré en utilisant par exemple des milieux de culture à base de plantes et une méthode de culture à haut débit appelé « culturomique », mais qui nécessite davantage de temps et de ressources matérielles.
Les méthodes génomiques
Pour surmonter certaines des limites des méthodes basées sur la culture, une autre méthode, moléculaire et à haut-débit, implique des techniques de séquençage de nouvelle génération et des analyses in silico. Avec cette méthode, un gène de référence est amplifié simultanément dans toutes les séquences d’ADN microbien dans les différents échantillons collectés. Les étapes sont les suivantes :
- extraction de l’ADN microbien des échantillons environnementaux,
- amplification d’un fragment de gène, appelé « code barre » génétique, car ce gène est présent dans tous les microbes, mais avec quelques différences qui permettent de discriminer leur groupe taxonomique
- analyse in silico de l’abondance des différents microbes et de leur diversité dans chaque échantillon. Les fonctions écologiques et les réseaux d’interaction au sein du microbiote peuvent même être prédits.
Cette méthode est suffisamment puissante pour générer rapidement une grande quantité de données et nous permettre de décrire en profondeur les microbiotes. Elle a révélé une formidable diversité microbienne (voir par exemple Figure 3), y compris des phyla nouvellement découverts dont l’existence n’était pas soupçonnée avec les méthodes de cultures. Elle nous permet non seulement de savoir quels organismes sont présents dans les échantillons, leur nombre et leur diversité, mais aussi de faire des prédictions sur leurs fonctions et comment ils interagissent. Cependant, elle nécessite de grandes ressources bio-informatiques et une validation expérimentale de l’interprétation des données, en particulier via l’inoculation sur plante de micro-organismes préalablement isolés au laboratoire avec des techniques de culture.
Par l’inoculation d’un microbiote fonctionnel
En modulant la composition du microbiote des plantes et du sol, il est possible d’améliorer les fonctions essentielles à la survie des plantes, de soigner voire de prévenir les maladies et ainsi d’améliorer aussi bien la santé des plantes que la qualité du sol. Depuis longtemps, les agriculteurs appliquent des pratiques qui permettent aux plantes de rester en bonne santé et d’être productives, en maintenant des facteurs qui sont favorables à la fois à la plante et à son microbiote. De manière plus consciente et précise aujourd’hui, il devient possible de choisir des pratiques pour cibler le développement d’un type de microbiote favorisant certaines fonctions chez la plante. Ce travail d’ingénierie repose sur deux méthodes principales :
- l’inoculation d’un seul taxon ou d’un petit nombre de micro-organisme(s) spécifique(s) pour lutter contre des agents pathogènes dans le sol ou pour stimuler la croissance des plantes. Par exemple, les agriculteurs américains inoculent souvent des Bradyrhizobium capables d’établir une symbiose avec le soja pour augmenter la fertilisation de la plante par fixation de l’azote atmosphérique, car ces bactéries symbiotiques ne sont naturellement pas présentes dans les sols en Amérique [22]. Dans les forêts, des champignons mycorhiziens à arbuscules peuvent être inoculés pour améliorer la nutrition des jeunes arbres [23], et des micro-organismes tels que ceux appartenant à des espèces de Trichoderma (des Ascomycètes) peuvent être inoculés pour lutter contre des parasites dans les champs [24].
- le transfert d’un sol ou amendement organique aux propriétés microbiennes intéressantes vers un sol dégradé ou pollué. Cette seconde méthode consiste à inoculer un substrat directement avec un assemblage complexe de micro-organismes. Par exemple, dans les sols dégradés ou dont on veut stimuler les fonctions biologiques (par exemple la régulation des maladies), le fait d’apporter de la matière organique, sous forme de fumier ou de compost par exemple, permet d’introduire à la fois des micro-organismes et des ressources alimentaires pour l’ensemble du réseau trophique du sol [7]. L’introduction d’une diversité de micro-organismes via ces amendements permet de stimuler la fertilité du sol et d’élargir le réservoir de micro-organismes avec lequel la plante peut interagir selon ses besoins. La restauration ou bioremédiation de sols pollués peut également être effectuée via le transfert de sol depuis un autre site. Il existe en effet des micro-organismes dans certains sols qui ont la capacité de transformer ou dégrader des composés toxiques, comme des métaux ou des hydrocarbures, et que l’on peut utiliser pour détoxifier des sols [25].
Par homologie, la médecine humaine peut préconiser l’utilisation de probiotiques (micro-organismes) ou prébiotiques (aliments) pour restaurer un microbiote intestinal normal ou la pratique de transplantations de microbiotes fécaux pour soigner des maladies dues à des agents pathogènes logés dans le microbiote intestinal comme Clostridioides difficile [26]. Ainsi, on peut imaginer un concept de santé globale pour soigner et prévenir les maladies des animaux et des végétaux, basé sur des méthodes similaires.
Par l’adaptation des pratiques agricoles
Depuis la « révolution verte » qui a eu lieu entre les années 1960 et 1990, un ensemble de mesures politiques a encouragé les agriculteurs à utiliser des technologies avancées que ce soit dans la production de semences hybrides, dans la fabrication d’engrais ou encore dans la synthèse de pesticides. Ces évolutions ont permis d’augmenter la production agricole, notamment du blé et du riz dans les pays en développement [27]. Face aux limites de ces pratiques (pollution de l’environnement, perte de biodiversité, érosion des sols…) et à la lumière des découvertes, entre autres, sur le rôle du microbiote dans la survie des plantes, on observe ces dernières années un regain de l’utilisation de pratiques agricoles qui prennent en compte le fonctionnement de la plante holobionte voire de l’écosystème, et pas seulement de la plante cultivée. Il s’agit de pratiques agroécologiques (de la contraction des mots agronomique et écologique, c’est-à-dire qui reposent sur la science de l’agriculture et la science des interactions entre les êtres vivants) qui visent notamment à tirer bénéfice des interactions entre les organismes d’un champ, en particulier en maintenant un microbiote fonctionnel pour les cultures. Pour ce faire, l’agroécologie repose sur des ensembles de pratiques applicables selon les contraintes propres à chaque culture. La sélection de graines selon les capacités génétiques de leur microbiote associé peut permettre une meilleure survie des plantes cultivées. L’arrêt du labour diminue les perturbations du sol et permet de maintenir une niche écologique pour que le microbiote de la rhizosphère puisse se développer et aider les plantes à assurer leurs fonctions essentielles de survie et de reproduction. Le maintien d’une biodiversité fonctionnelle permet de limiter l’émergence de maladies de plantes. Aussi, l’agroécologie vise à optimiser les flux d’énergie du système, en utilisant moins de combustibles fossiles, ainsi que le recyclage des nutriments, en utilisant de la matière organique comme engrais. À cela, s’ajoute une dimension socio-économique qui permet aux systèmes agricoles d’être soutenables pour les fermiers. Un agroécosystème durable mêle des composantes environnementales, sociales et économiques qui reposent aussi bien sur les connaissances modernes que sur les savoirs traditionnels des paysans, spécifiques à leur culture et à leur champ [28]. Finalement, comprendre et exploiter le microbiote des plantes permet de s’affranchir ou, du moins, de réduire l’utilisation des engrais et pesticides de synthèse pour cultiver plus durablement.
Notions à retenir
- Les plantes sont associées à des communautés de micro-organismes diversifiés (bactéries, champignons, protistes, virus, etc.) que l’on appelle le microbiote.
- Le microbiote de la rhizosphère, à l’interface entre le sol et la racine, joue un rôle dans la plasticité phénotypique des plantes hôtes et contribue à leur nutrition et leur adaptation à des environnements changeants ou perturbés.
- Prendre en compte la plante et son microbiote lors de sa culture, permet de conserver des fonctions essentielles à la survie des plantes.
- La génétique du microbiote associé aux plantes représente une ressource génétique énorme et exploitable pour la transition vers des systèmes de production agricoles plus durables.
Références
[1] Delgado-Baquerizo, M., Oliverio, A. M., Brewer, T. E., Benavent-González, A., Eldridge, D. J., Bardgett, R. D., Maestre, F. T., Singh, B. K., & Fierer, N. (2018). A global atlas of the dominant bacteria found in soil. Science, 359(6373). https://doi.org/10.1126/science.aap9516
[2] Karimi, B., Terrat, S., Dequiedt, S., Saby, N. P. A., Horrigue, W., Lelièvre, M., Nowak, V., Jolivet, C., Arrouays, D., Wincker, P., Cruaud, C., Bispo, A., Maron, P. A., Prévost-Bouré, N. C., & Ranjard, L. (2018). Biogeography of soil bacteria and archaea across France. Science Advances, 4(7). https://doi.org/10.1126/SCIADV. AAT1808/SUPPL_FILE/AAT1808_SM. PDF
[3] Větrovský, T., Morais, D., Kohout, P., Lepinay, C., Algora, C., Awokunle Hollá, S., Bahnmann, B. D., Bílohnědá, K., Brabcová, V., D’Alò, F., Human, Z. R., Jomura, M., Kolařík, M., Kvasničková, J., Lladó, S., López-Mondéjar, R., Martinović, T., Mašínová, T., Meszárošová, L., et al. (2020). GlobalFungi : a global database of fungal occurrences from high-throughput-sequencing metabarcoding studies. Scientific Data, 7(1). https://doi.org/10.1038/s41597-020-0567-7
[4] Geisen, S., Lara, E., Mitchell, E. A. D., Völcker, E., & Krashevska, V. (2020). Soil protist life matters ! Soil Organisms, 92(3). https://doi.org/10.25674/so92iss3pp189
[5] Scholthof, K.-B. G., Adkins, S., Czosnek, H., Palukaitis, P., Jacquot, E., Hohn, T., Hohn, B., Sauders, K., Candresse, T., Ahlquist, P., Hemenway, C., & Foster, G. D. (2011). Top 10 plant viruses in molecular plant pathology. Molecular Plant Pathology, 12(9). https://doi.org/10.1111/j.1364-3703.2011.00752.x
[6] Simonin, M., Dasilva, C., Terzi, V., Ngonkeu, E. L. M., DIouf, Di., Kane, A., Béna, G., & Moulin, L. (2020). Influence of plant genotype and soil on the wheat rhizosphere microbiome : evidences for a core microbiome across eight African and European soils. FEMS Microbiology Ecology, 96(6). https://doi.org/10.1093/FEMSEC/FIAA067
[7] Masson, A.-S., Vermeire, M.-L., Leng, V., Simonin, M., Tivet, F., Nguyen Thi, H., Brunel, C., Suong, M., Kuok, F., Moulin, L., & Bellafiore, S. (2022). Enrichment in biodiversity and maturation of the soil food web under conservation agriculture is associated with suppression of rice-parasitic nematodes. Agriculture, Ecosystems & Environment, 331, 107913. https://doi.org/10.1016/J. AGEE.2022.107913
[8] Hacquard, S., Garrido-Oter, R., González, A., Spaepen, S., Ackermann, G., Lebeis, S., McHardy, A. C., Dangl, J. L., Knight, R., Ley, R., & Schulze-Lefert, P. (2015). Microbiota and host nutrition across plant and animal kingdoms. Cell Host & Microbe, 17(5). [https://doi.org/10.1016/J.](https://doi.org/10.1016/J. CHOM.2015.04.009)
[9] Masson, A.-S. (2021). The root-associated microbiota of rice in different contexts of infection by phytoparasitic nematodes : an ecological approach to a plant pathosystem. https://hal.inria.fr/tel-03572406v1
[11] Hirsch, A. M., Lum, M. R., & Downie, J. A. (2001). What makes the Rhizobia-legume symbiosis so special ? Plant Physiology, 127(4), 1484–1492. https://doi.org/10.1104/PP.010866
[12] Saikkonen, K., Young, C. A., Helander, M., & Schardl, C. L. (2015). Endophytic Epichloë species and their grass hosts : from evolution to applications. Plant Molecular Biology 2015 90:6, 90(6), 665–675. https://doi.org/10.1007/S11103-015-0399-6
[13] Pitzschke, A. (2016). Developmental peculiarities and seed-borne endophytes in Quinoa : omnipresent, robust bacilli contribute to plant fitness. Frontiers in Microbiology, 7(JAN), 2. https://doi.org/10.3389/FMICB.2016.00002/BIBTEX
[14] McKendrick, S. L., Leake, J. R., Taylor, D. L., & Read, D. J. (2002). Symbiotic germination and development of the myco-heterotrophic orchid Neottia nidus-avis in nature and its requirement for locally distributed Sebacina spp. New Phytologist, 154 (1), 233–247. https://doi.org/10.1046/J.1469-8137.2002.00372.X
[15] de la Fuente Cantó, C., Simonin, M., King, E., Moulin, L., Bennett, M. J., Castrillo, G., & Laplaze, L. (2020). An extended root phenotype : the rhizosphere, its formation and impacts on plant fitness. The Plant Journal, tpj.14781. https://doi.org/10.1111/tpj.14781
[16] Trivedi, P., Leach, J. E., Tringe, S. G., Sa, T., & Singh, B. K. (2020). Plant-microbiome interactions : from community assembly to plant health. Nature Reviews Microbiology. https://doi.org/10.1038/s41579-020-0412-1CHOM.2015.04.009
[17] Maithani, D., Singh, H., & Sharma, A. (2021). Stress alleviation in plants using SAR and ISR : current views on stress signaling network. Microbes and Signaling Biomolecules Against Plant Stress (pp. 7–36). Springer, Singapore. https://doi.org/10.1007/978-981-15-7094-0_2
[18] Bais, H. P., Weir, T. L., Perry, L. G., Gilroy, S., & Vivanco, J. M. (2006). The role of root exudates in rhizosphere interactions with plants and other organisms. Annual Review of Plant Biology, 57. https://doi.org/10.1146/annurev.arplant.57.032905.105159
[19] Worsley, S. F., Macey, M. C., Newitt, J. T., Patrick, E., Yu, D. W., Wilkinson, B., Murrell, C., & Hutchings, M. I. (2019). Investigating the role of exudates in recruiting Streptomyces bacteria to the Arabidopsis thaliana root microbiome. BioRxiv. https://doi.org/10.1101/532309
[20] Rizaludin, M. S., Stopnisek, N., Raaijmakers, J. M., & Garbeva, P. (2021). The chemistry of stress : understanding the “cry for help” of plant roots. Metabolites, 11(6). https://doi.org/10.3390/metabo11060357
[21] Bakker, P. A. H. M., Pieterse, C. M. J., de Jonge, R., & Berendsen, R. L. (2018). The soil-borne legacy. Cell, 172(6). https://doi.org/10.1016/j.cell.2018.02.024
[22] Alves, B. J. R., Boddey, R. M., & Urquiaga, S. (2003). The success of BNF in soybean in Brazil. Plant and Soil 2003 252:1, 252(1), 1–9. https://doi.org/10.1023/A:1024191913296
[23] Habte, M., Miyasaka, S. C., & Matsuyama, D. T. (2001). Arbuscular mycorrhizal fungi improve early forest-tree establishment. Plant Nutrition, 644–645. https://doi.org/10.1007/0-306-47624-X_312
[24] Radwan, M. A., Farrag, S. A. A., Abu-Elamayem, M. M., & Ahmed, N. S. (2012). Biological control of the root-knot nematode, Meloidogyne incognita on tomato using bioproducts of microbial origin. Applied Soil Ecology, 56, 58–62. https://doi.org/10.1016/J. APSOIL.2012.02.008
[25] Abatenh, E., Gizaw, B., Tsegaye, Z., & Wassie, M. (2017). The role of microorganisms in bioremediation – A review. Open Journal of Environmental Biology, 2(1), 038–046. https://doi.org/10.17352/OJEB.000007
[26] Vindigni, S. M., Broussard, E. K., & Surawicz, C. M. (2014). Alteration of the intestinal microbiome : fecal microbiota transplant and probiotics for Clostridium difficile and beyond. Expert Review of Gastorenterology & Hepatology, 7(7), 615–628. https://doi.org/10.1586/17474124.2013.832501
[27] Pingali, P. L. (2012). Green revolution : impacts, limits, and the path ahead. Proceedings of the National Academy of Sciences of the United States of America, 109(31), 12302–12308. https://doi.org/10.1073/pnas.0912953109
[28] Olivier, A. (2021) La révolution agroécologique, édition Écosociété