Fusobacterium nucleatum est une bactérie du microbiote oral, retrouvée au niveau de la plaque dentaire. Cette espèce s'observe également dans certains cancers colorectaux. En stimulant la prolifération des cellules cancéreuses et en diminuant l'activité des lymphocytes T cytotoxiques, F. nucleatum y favorise la progression tumorale.
Aujourd’hui, le déséquilibre du microbiote intestinal est défini comme une des quatorze « caractéristiques fondamentales du cancer » 1. Il s’agit d’étapes identifiées par la communauté scientifique pour décrire la transformation progressive de cellules non cancéreuses en cellules cancéreuses. Néanmoins, seuls quelques micro-organismes participant à ce processus ont été identifiés et étudiés au cours des dernières années. Parmi eux, Fusobacterium nucleatum, une bactérie commensale principalement présente dans la flore orale humaine, est impliquée dans la progression du cancer colorectal. Dans cet article, nous nous intéressons à son rôle sur la prolifération des cellules tumorales et son impact sur la dérégulation du système immunitaire, spécifiquement dans le contexte du cancer colorectal.
Une bactérie commensale de la flore orale
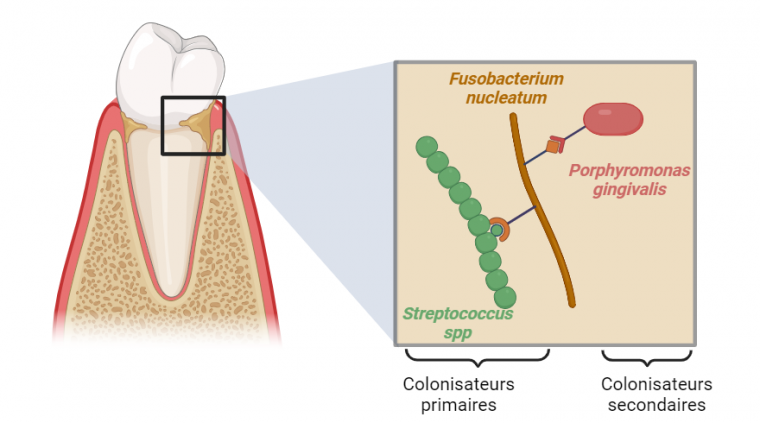
Fusobacterium nucleatum est une bactérie anaérobie à Gram négatif, présente dans la cavité buccale humaine 2 ainsi que dans le tractus intestinal à un faible niveau. Elle appartient au microbiote oral qui correspond à l’ensemble des micro-organismes résidant dans la bouche. Le microbiote oral existe généralement sous forme de biofilms, des micro-communautés denses intégrées dans une matrice extracellulaire composée de polymères produits à la fois par les bactéries et par l’hôte. F. nucleatum joue un rôle clé dans l’établissement du biofilm se situant à la surface des dents, plus connue sous le nom de plaque dentaire. Grâce à ses nombreuses adhésines, des protéines de surface lui permettant de se lier à d’autres bactéries ou à des surfaces de l’hôte, elle relie différentes espèces qui, autrement, n’adhéreraient pas entre elles. Elle permet ainsi l’agrégation d’espèces colonisatrices primaires de la plaque dentaire, telles que des Streptococcus spp., à des espèces colonisatrices secondaires, telle Porphyromonas gingivalis (Figure 1) 3.
Fusobacterium nucleatum adhère d'abord aux colonisateurs primaires de la surface dentaire tels que Streptococcus spp. Une fois fixée au biofilm en développement, F. nucleatum s'agrège aux colonisateurs secondaires tels que P. gingivalis. Schéma réalisé avec Biorender.
Un pathogène opportuniste
Bien que F. nucleatum soit présente en abondance dans la flore buccale chez les individus en bonne santé, cette espèce peut avoir un rôle de pathogène opportuniste et pourrait contribuer à la pathogenèse de nombreuses maladies. F. nucleatum est notamment impliquée dans la parodontite 1, une maladie pouvant être causée par une dysbiose, c’est-à-dire par une perturbation du microbiote oral. L’inflammation qui en résulte peut conduire à la destruction des tissus parodontaux (gencives) 23. Fusobacterium nucleatum est également associée à des maladies extra-orales telles que l’appendicite 4, les abcès cérébraux 5 et des complications de grossesse, y compris les naissances prématurées 6. Dans ces deux derniers cas, il a été démontré que cette bactérie se propage jusqu’aux organes concernés par la circulation sanguine.
Fusobacterium nucleatum, une oncobactérie
Au cours de la dernière décennie, une attention particulière a été portée à F. nucleatum en raison de son association croissante à certains cancers. En 2012, des études génomiques ont révélé pour la première fois la surabondance de cette bactérie dans des biopsies de cancers colorectaux 7. Depuis, si plusieurs travaux ont confirmé ce résultat, d’autres études n’ont pas permis de mettre en évidence un enrichissement en F. nucleatum dans les carcinomes colorectaux humains 8. Cette bactérie est également associée à d’autres types de cancers tels que ceux touchant le pancréas, le sein et l’œsophage.
Cependant, contrairement à d’autres espèces telle qu’Helicobacter pylori, à l’origine de plus de deux tiers des cancers de l’estomac dans le monde 9, F. nucleatum n’est pas une bactérie carcinogène, c’est-à-dire induisant à elle seule l’apparition d’un cancer. Il s’agit d’une espèce qui participe à la progression d'un cancer colorectal déjà établi 10. Nous allons nous focaliser sur deux mécanismes par lesquels F. nucleatum contribue à ce processus.
F. nucleatum augmente la prolifération des cellules cancéreuses
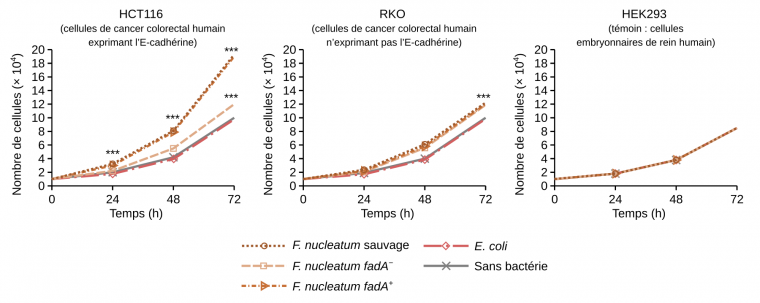
F. nucleatum participe à la progression du cancer colorectal en augmentant la prolifération des cellules cancéreuses. Une étude réalisée en 2013 a démontré que l’un des mécanismes impliqués est la liaison de l’adhésine bactérienne FadA à une protéine transmembranaire exprimée à la surface des cellules cancéreuses : l’E-cadhérine (Figure 2) 11.
La souche sauvage de Fusobacterium nucleatum et la souche mutante pour fadA mais complémentée en fadA (notée fadA+), ont stimulé la prolifération des cellules HCT116, une lignée cellulaire de cancer colorectal humain exprimant l’E-cadhérine.
La souche mutante dépourvue de fadA (fadA−), n'a que faiblement stimulé la croissance des cellules cancéreuses HCT116 en comparaison à la souche sauvage et à la souche mutante complémentée en fadA.
La croissance des cellules cancéreuses n'exprimant pas l'E-cadhérine (lignée RKO) n'est que faiblement stimulée par les différentes souches de Fusobacterium nucleatum.
La croissance des cellules embryonnaires de rein humain (lignée HEK293) n'est pas stimulée par les bactéries.
Les *** indiquent des différences statistiquement significatives par rapport au témoin.
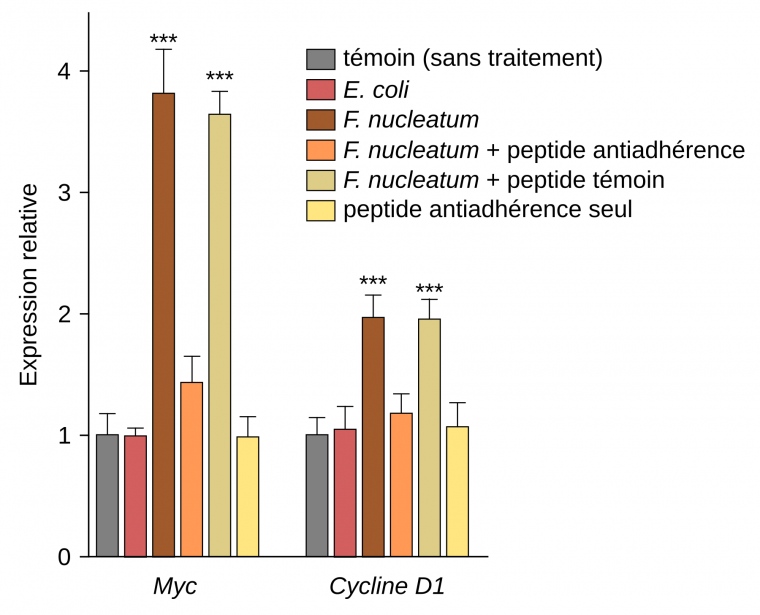
Au niveau moléculaire, cette prolifération est expliquée par l’augmentation de l’expression de proto-oncogènes tels que Myc et cycline D1 au sein des cellules cancéreuses lorsqu’elles interagissent avec F. nucleatum (Figure 3).
Des cellules de cancer colorectal humain ont été injectées en sous-cutanée chez des souris femelles. Elles ont ensuite reçu des traitements différents : Fusobacterium nucleatum seule, F. nucleatum en présence d’un peptide synthétique capable d'inhiber l'attachement et l'invasion des cellules cancéreuses par la bactérie, F. nucleatum en présence d’un peptide témoin, peptide anti-adhérence seul. Le niveau d'expression des transcrits des gènes Myc et cycline D1 ont ensuite été quantifiés par qRT-PCR. Les résultats sont présentés sous forme de moyenne ± écart-type. *** p < 0,001.
La modification de l'expression de certains gènes, dont ceux codant Myc et la cycline D1, est liée à l'adhérence entre FadA et l’E-cadhérine. En effet, cette interaction conduit à l’activation de la voie de signalisation Wnt/β-caténine, une cascade moléculaire jouant un rôle important dans la régulation de la prolifération cellulaire. En l’absence de stimulation, la β-caténine, un facteur de transcription, est dégradée dans le cytoplasme. Lors de l’activation de la voie Wnt, la β-caténine est stabilisée et passe dans le noyau où elle active la transcription de divers gènes dont Myc et cycline D1.
F. nucleatum altère l’immunité antitumorale
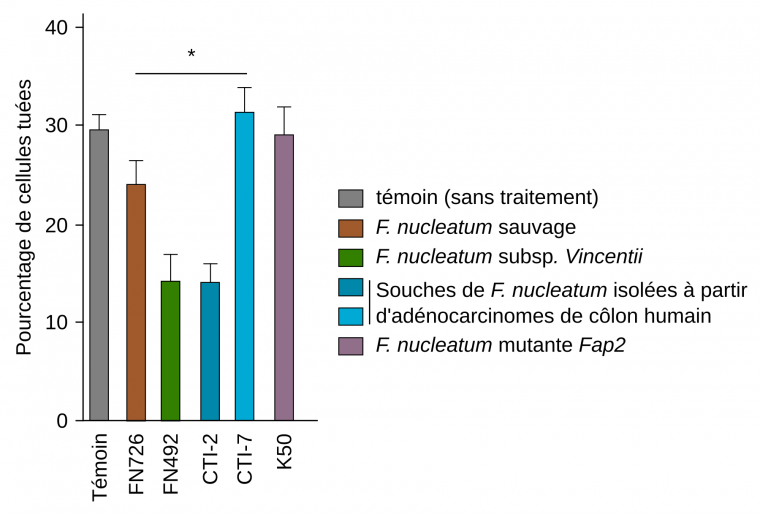
F. nucleatum participe également à la progression du cancer colorectal en contribuant à l’évasion immunitaire des tumeurs. Parmi les acteurs participant aux réponses immunitaires antitumorales, se trouvent les lymphocytes T cytotoxiques qui infiltrent les tumeurs et y tuent les cellules cancéreuses. Ces lymphocytes possèdent des récepteurs de surface appelés TIGIT (pour T cell immunoreceptor with Ig and ITIM domains), qui exercent une fonction régulatrice, principalement pour prévenir les réactions auto-immunes. En effet, la reconnaissance de molécules du soi par les TIGIT active des voies de signalisation abolissant l’activité cytotoxique des lymphocytes T. Une étude réalisée en 2015 démontre que F. nucleatum se lie aux TIGIT grâce à son adhésine Fap2, ce qui inhibe l’activité des lymphocytes T et contribue ainsi à l’évasion immunitaire des tumeurs (Figure 4) 1.
Des cellules cancéreuses issues d’un mélanome humain ont été incubées en absence de bactéries (témoin), en présence de la souche sauvage de Fusobacterium nucleatum Fn (FN726), de la sous-espèce Fusobacterium nucleatum subsp. Vincentii (FN492), de souches de F. nucleatum isolées à partir d'adénocarcinomes du côlon humain (CTI-2 et CTI-7) ou encore d’une souche dépourvue de protéine Fap2 fonctionnelle (K50). Le pourcentage de cellules cancéreuses tuées est ensuite mesuré. Le rapport cellules effectrices (LT) : cellules cibles (cellules cancéreuses) était de 5:1. Le rapport bactéries : cellules cancéreuses était de 600:1. *p < 0,05.
Les résultats présentés ci-dessus ont été obtenus à l'aide d’un test de cytotoxicité, une technique expérimentale permettant de déterminer la capacité de cellules immunitaires à éliminer des cellules cibles. Dans un premier temps, les cellules cibles (ici les cellules cancéreuses) sont cultivées en présence d’un isotope radioactif (ici la méthionine marquée au 35S), dans un milieu sans méthionine afin de marquer leurs protéines néoformées. Ces cellules sont ensuite incubées en présence des cellules effectrices : les lymphocytes T. Pour mesurer la capacité des cellules effectrices à tuer les cellules cibles, on s’intéresse à la présence de l’isotope radioactif dans le milieu. En effet, lors de la mort des cellules, l’isotope radioactif est libéré dans le milieu de culture, où il peut être quantifié par rapport à la libération spontanée de cet isotope chez des cellules témoins (non incubées avec les cellules effectrices).
Vers des nouvelles approches thérapeutiques ?
En raison des nombreux rôles du microbiote intestinal sur la santé de l’hôte, les possibilités d’élimination des bactéries impliquées dans les cancers colorectaux par des antibiotiques sont limitées 1. Cette approche non spécifique, ciblant à la fois des oncobactéries et des bactéries bénéfiques pour l’hôte, risquerait de contribuer au déséquilibre de la flore intestinale 2. Ainsi, de nombreuses études se tournent vers l’utilisation de bactériophages en tant qu’agents thérapeutiques, en raison de leur spécificité d’infection pour cibler des espèces bactériennes précises.
Une étude publiée en 2019 a mis en lumière l’utilisation d’un bactériophage pour éliminer F. nucleatum de tumeurs colorectales de souris tout en améliorant le traitement chimiothérapeutique ciblant les cellules cancéreuses 3. Dans ces travaux, des virus lysant spécifiquement F. nucleatum ont été chargés d’irinotécan, un agent chimiothérapeutique visant les cellules cancéreuses. Cette molécule, un inhibiteur de la topoisomérase I, entraîne l’accumulation de cassures d’ADN à l’intérieur des cellules cancéreuses, les empêchant de se diviser et de croître. Cette approche a ainsi permis à la fois de diminuer la présence de F. nucleatum à l’intérieur des tumeurs ainsi que d’augmenter la réponse des souris au traitement de chimiothérapie.