Les microorganismes composent la majorité de la biodiversité de la planète. Pourtant, de par leur invisibilité, il demeure difficile de quantifier et de caractériser la dynamique de cette biodiversité microbienne. Dans ce contexte, les microbiotes intestinaux humains et les microbiotes des sols agricoles ont été particulièrement étudiés. Dans les deux cas, il a été constaté que les pertes de biodiversité microbienne liées aux perturbations anthropiques sont majeures et non sans conséquences.
En raison de ses activités, l’humanité a déclenché une crise majeure d’effondrement de la biodiversité 1. Depuis la préhistoire, on estime par exemple que la surface des écosystèmes naturels a reculé de 47 %, que les abondances des espèces ont diminué de 23 % en moyenne, et que 25 % des espèces animales et végétales sont aujourd’hui menacées d’extinction. De nombreuses études scientifiques documentent cette crise et les facteurs à son origine : la pollution, la surexploitation et la destruction des habitats, les espèces envahissantes et le changement climatique. À la différence des communautés animales et végétales, il est beaucoup plus complexe de documenter les dynamiques de diversité des formes de vie qui nous sont invisibles. Pourtant, bactéries, archées, champignons et autres microorganismes sont omniprésents, des racines des plantes jusqu’au fond des océans, en passant par l’intérieur de notre intestin. Selon les estimations, jusqu’à 90 % des espèces sur Terre seraient des microorganismes 2. Les macroorganismes ne représenteraient donc qu’une petite fraction de la diversité du vivant et la majorité de la diversité des formes de vie, microbiennes, serait encore grandement inconnue.
Cette méconnaissance de la biodiversité microbienne provient justement de cette invisibilité : caractériser les espèces microbiennes n’est pas une mince affaire. Les observer au microscope n’est généralement pas suffisant pour distinguer les différentes espèces, qui le plus souvent se ressemblent toutes. De plus, les communautés microbiennes associées aux animaux et végétaux, appelées microbiotes, sont généralement composées de nombreuses espèces dont la majorité ne peuvent être cultivées en laboratoire, ce qui complique encore davantage leur isolement et leur identification. C’est seulement avec l’avènement des techniques de métagénomique que les microorganismes ont pu être plus facilement décrits. Parmi ces techniques, le métabarcoding est en règle générale utilisé afin d’identifier les espèces microbiennes présentes dans l’échantillon d’un certain milieu, comme dans des fèces humaines ou dans un fragment de racine.
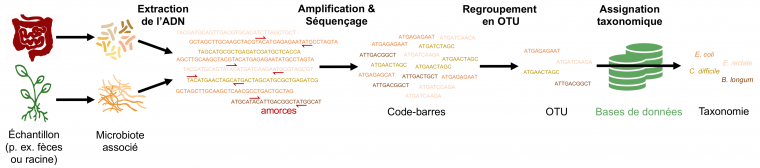
Le principe du métabarcoding repose sur la caractérisation d’une région particulière de l’ADN, appelée code-barres, présente chez toutes les espèces microbiennes mais dont la séquence nucléotidique varie d’une espèce à l’autre (Figure 1). À partir d’une infime quantité d’ADN provenant du milieu échantillonné, ces régions sont amplifiées par PCR (réaction en chaîne par polymérase) grâce à des amorces spécifiques. Les code-barres amplifiés sont ensuite séquencés afin de disposer de toutes les séquences d’ADN codes-barres présentes dans l’échantillon. À l’aide d’un ordinateur, les millions de séquences obtenues lors du séquençage sont regroupées par similarité au sein d’unités taxonomiques opérationnelles (OTU) selon certains critères. Par exemple, on regroupe fréquemment sous forme d’OTU toutes les séquences d’ADN similaires à plus de 97 % : on parle alors d’OTU à 97 %. La taxonomie de chaque OTU est déterminée en comparant la séquence d’ADN de l’OTU à des bases de données mondiales qui regroupent les séquences de référence de toutes les espèces microbiennes précédemment décrites. Compter le nombre d’OTU dans un échantillon renseigne ainsi sur la biodiversité microbienne présente (Figure 1). Il est important de noter que le seuil de 97 % est ici arbitraire. Chez les microorganismes, on ne dispose pas d’un critère consensus afin de délimiter des espèces et des seuils de 97 %, 99 % voire 100 % peuvent être utilisés selon les études. Les analyses d’une étude sont souvent répliquées en utilisant plusieurs valeurs de seuils afin de s’assurer que les résultats sont robustes à ce choix arbitraire lors de la construction des OTU. De plus, il n’existe pas de code-barres universel, c’est-à-dire de région génique qui permettrait de caractériser simultanément toutes les espèces microbiennes. Par exemple, pour les bactéries et les archées, une région variable du gène de l’ARN ribosomique 16S est souvent utilisée, tandis que l’on amplifie généralement des régions de l’ARN ribosomique 18S ou bien l’espaceur interne transcrit (ITS) pour les champignons. Ainsi, seules les compositions en OTU d’échantillons traités avec exactement le même protocole peuvent être comparées.
À partir d’un échantillon contenant des microorganismes, les molécules d’ADN de ces derniers sont extraites puis, grâce à des amorces spécifiques d’une région d’ADN (par exemple l’ARNr 16S pour les bactéries ou la région ITS pour les champignons), des codes-barres moléculaires sont amplifiés et séquencés. Sur ordinateur, les séquences d’ADN codes-barres obtenues sont ensuite regroupées par similarité sous forme d’unités taxonomiques opérationnelles (OTU) puis comparées à des bases de données afin de déterminer leur taxonomie. Dans cet exemple, quatre OTU sont détectées, chacune assignée à une espèce bactérienne. Cependant, les bases de données sont largement incomplètes car de nombreuses espèces bactériennes n’ont pas encore été décrites. Il arrive donc fréquemment qu’une OTU ne puisse être assignée à l’échelle de l’espèce, mais seulement à l’échelle du genre ou de la famille.
À l’heure actuelle, il n’existe pas encore de données fiables sur la dynamique de la biodiversité microbienne au niveau des différents écosystèmes de la Terre, ni sur le nombre total d’extinctions d’espèces microbiennes liées aux activités humaines. Cependant, deux types de communautés microbiennes ont particulièrement été étudiés en lien avec les perturbations d’origine anthropique : la perte de diversité des microbiotes intestinaux humains liée aux modes de vie occidentaux et l’érosion de la biodiversité des sols agricoles liée à l’agriculture intensive.
La perte de diversité des microbiotes intestinaux humains
L’intestin humain héberge un microbiote bactérien abondant et diversifié, notamment dans le côlon. Ce dernier contiendrait même jusqu’à 1014 bactéries qui pèseraient au total près de 500 grammes 1. Loin d’être de simples commensales, ces bactéries sont bénéfiques à l’être humain de multiples façons. Tout d’abord, elles ont un rôle dans la nutrition en participant à la digestion des fibres végétales et en produisant des acides aminés et des vitamines essentiels, comme la vitamine K. Elles contribuent également à la protection de l’organisme en évitant que des bactéries pathogènes ne trouvent refuge dans l’intestin. Enfin, elles établissent dès la naissance un dialogue permanent avec le système immunitaire de l’intestin. Le microbiote intestinal bactérien participe ainsi au développement et à la régulation du système immunitaire humain.
Les microbiotes intestinaux sont formés de communautés écologiquement complexes et dynamiques. Les bactéries de l’intestin interagissent en permanence entre elles, avec les autres microorganismes présents (champignons, virus…) ainsi qu’avec leur hôte qui exerce un contrôle sur ces bactéries, par exemple via la production d’immunoglobulines A (IgA). Parmi les interactions bactéries-bactéries, on retrouve des interactions de compétition, de prédation, ou encore de mutualisme (syntrophie). La composition du microbiote intestinal humain est variable d’un individu à l’autre, influencée par l’environnement et la génétique propres à chaque individu, mais aussi chez un même individu à différents moments de sa vie. Mode de vie, âge, état de santé et alimentation sont autant de facteurs qui peuvent modifier drastiquement la richesse et l’identité des espèces microbiennes au sein de l’intestin. En moyenne, entre 150 et 250 OTU à 97 % composent le microbiote intestinal d’un individu adulte en bonne santé (Figure 2), et on estime que moins de 15 OTU constituent un socle commun présent chez tous les individus. Les OTU bactériennes du microbiote intestinal humain appartiennent principalement aux phyla des Firmicutes (ordres Oscillospirales, Lachnospirales et Christensenellales) et des Bacteroidota (ordre Bacteroidales), mais aussi dans une moindre mesure aux Actinomycetota et Pseudomonadota (auxquels appartient Escherichia coli). Les abondances relatives de ces différents ordres bactériens varient notamment en fonction de l’alimentation. On distingue chez l’être humain trois principaux types de compositions des microbiotes intestinaux, appelés entérotypes, respectivement dominés par les Prevotella, les Ruminococcus ou les Bacteroides. Par exemple, un microbiote intestinal dominé par les Prevotella (Firmicutes) est fréquent chez les individus ayant une alimentation riche en fibres.
Le microbiote intestinal humain est le fruit de millions d’années d’évolution. Si la grande majorité des bactéries intestinales des primates est acquise depuis l’environnement à chaque génération, via l’alimentation par exemple, on estime que 5 à 10 % de toutes ces bactéries ont tendance à être transmises directement entre individus 2. Les bactéries ainsi transférées, par exemple lors des soins parentaux ou bien au cours de contacts entre congénères, sont spécifiques à chaque espèce de primates et partagent donc leur histoire évolutive. Beaucoup de ces bactéries ont même perdu la capacité à vivre en présence de dioxygène et restent confinées aux conditions anaérobies de l’intestin dont elles sont devenues des spécialistes. Certaines, comme les Bifidobacterium, ont acquis des capacités spécifiques de dégradation des oligosaccharides complexes du lait maternel qu’elles seules peuvent digérer, garantissant ainsi la croissance de « bonnes bactéries » au sein de l’intestin du nourrisson dès la naissance. Il s’agit là d’un exemple marquant de coévolution entre l’être humain et ces bactéries, qui illustre la longue histoire évolutive du microbiote intestinal.
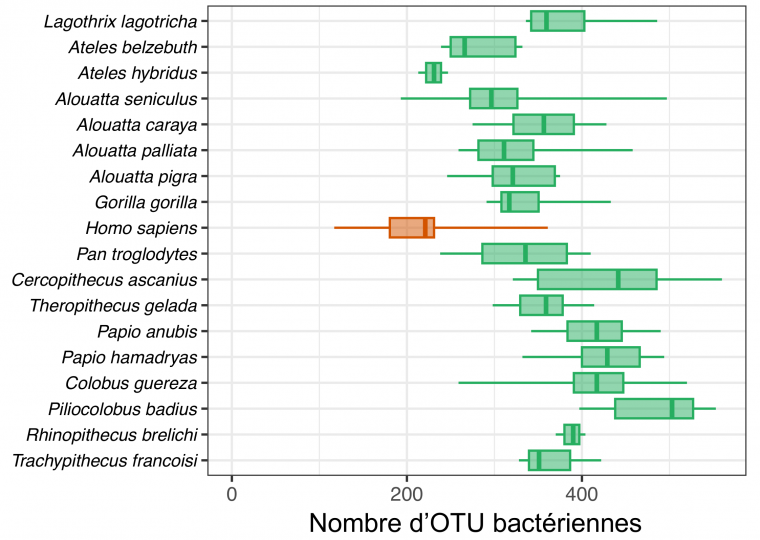
La comparaison du nombre d’OTU bactériennes des microbiotes intestinaux de différentes espèces de primates révèle que le microbiote des populations humaines industrialisées présente une faible diversité par rapport à celle des primates sauvages. En moyenne, notre microbiote contient 33 % d’OTU en moins par rapport à celui du chimpanzé ou du gorille. Cette érosion drastique de la diversité du microbiote intestinal humain est cependant moins avancée chez les populations de chasseurs-cueilleurs, dont le nombre d’OTU est en général 15 à 20 % plus élevé que chez les populations industrialisées 3. Ce déclin peut être expliqué par de multiples facteurs. Tout d’abord, la prise d’antibiotiques – bien que variable selon chaque individu, le type de médicament et sa posologie – peut conduire à la disparition de plus de 30 % des espèces bactériennes 4. À la suite d’un traitement antibiotique, il faut généralement attendre en moyenne plusieurs mois à plusieurs années pour retrouver un microbiote normal 5. Le microbiote subit également des perturbations directement liées à la pollution chimique de notre environnement, ainsi qu’à notre mode de vie aseptisé. En effet, si les nouvelles normes hygiéniques ont permis de lutter efficacement, voire d’éradiquer certaines pathologies infectieuses, elles entraînent simultanément et inexorablement une diminution de notre exposition à de « bonnes bactéries » présentes dans l’environnement, capables de coloniser le microbiote et de contribuer à notre bonne santé. De telles bactéries, appartenant notamment aux genres Bifidobacterium, Lactobacillus, ou Faecalibacterium, sont pourtant indispensables dès les premières semaines de vie, car elles contribuent à la maturation du système immunitaire humain avec lequel elles établissent un dialogue constant permettant de maintenir ensuite un bas niveau d’inflammation des tissus intestinaux 6. Enfin, les changements dans notre alimentation, devenue plus transformée, sucrée et grasse, affecte également la composition de notre microbiote. Une telle alimentation conduit souvent à la formation d’un entérotype présentant une proportion anormalement élevée du genre Bacteroides.
La perte de diversité du microbiote intestinal pourrait être partiellement réversible en favorisant un mode de vie permettant la recolonisation de l’intestin par des bactéries de l’environnement. Cependant, plus de 40 % des bactéries transmises de générations en générations chez les primates sont définitivement éteintes chez les populations humaines selon certaines estimations 7, signant le caractère irréversible d’une partie de la perte de diversité du microbiote intestinal humain.
Nombre d’OTU bactériennes à 97 % dans le microbiote intestinal de différentes espèces de primates dont l’être humain (en orange). Chaque boîte à moustache représente la distribution du nombre d’OTU pour différents individus de la même espèce : la ligne principale indique la médiane, entourée par les premier et troisième quartiles tandis que les moustaches se prolongent jusqu’aux valeurs les plus extrêmes.
Les données de métabarcoding ayant servi à générer cette figure proviennent de Song et coll., 2020 et de Goodrich et coll., 2014 (microbiotes intestinaux bactériens provenant de populations humaines industrialisées)
Une diminution significative de la diversité du microbiote fait partie des déséquilibres, appelés dysbioses, qui sont aujourd’hui observés dans le microbiote intestinal d’un nombre croissant d’individus souffrant de pathologies non infectieuses 1. Un tel constat est notamment fréquent chez les personnes atteintes de maladies inflammatoires chroniques, telles que la maladie de Crohn, qui pourraient être causées ou aggravées par des déséquilibres du microbiote. L’appauvrissement du microbiote peut tout d’abord faciliter l’installation de pathogènes dans l’intestin comme la levure Candida albicans. Il peut également favoriser la transition de certaines bactéries du mutualisme vers la pathogénicité : si Clostridioides difficile est une bactérie mutualiste que l’on retrouve dans l’intestin de la plupart des individus sains, un déséquilibre lié par exemple à la prise d’antibiotiques peut conduire à une croissance disproportionnée de C. difficile entrainant une inflammation sévère et parfois durable de l’intestin. Enfin, au-delà de la perte globale de diversité du microbiote intestinal, la disparition d’une espèce clé du microbiote peut engendrer, à elle seule, de sérieuses complications. Entre autres, la diminution d’Akkermansia muciniphila au sein de l’intestin est souvent associée à d’importants troubles inflammatoires. Ces exemples illustrent bien les conséquences néfastes que peuvent avoir sur la santé humaine un appauvrissement et un déséquilibre du microbiote intestinal humain.
Attention pour autant aux conclusions hâtives et à ne pas confondre corrélation et causalité. De nombreuses maladies, comme l’obésité, le diabète, ou encore des troubles tels l’autisme, sont corrélés avec des dysbioses. Cependant, ces troubles sont souvent d’origine multifactorielle et savoir si des perturbations du microbiote en sont la cause ou bien la conséquence n’est pas une mince affaire. De plus, face à la grande variabilité de la composition du microbiote intestinal, il est compliqué, à la fois conceptuellement et en pratique, de définir une frontière claire entre déséquilibre (« dysbiose ») et équilibre (« eubiose ») du microbiote. Il n’est pas non plus démontré qu’un microbiote intestinal plus divers est toujours synonyme de meilleure santé, ni que restaurer à l’identique les microbiotes ancestraux humains permettrait systématiquement de lutter efficacement contre les maladies auto-immunes émergentes 2. Les microbiotes intestinaux sont des communautés écologiques complexes dont les liens avec la santé humaine restent encore difficiles à appréhender. Mieux comprendre les relations entre dysbioses et maladies permettra de développer des solutions thérapeutiques adaptées.
Vers un amoindrissement du microbiote racinaire des plantes cultivées
Un autre exemple de microbiote perturbé par les activités humaines est le microbiote mycorhizien des plantes cultivées. La mycorhize est un organe mixte plante-champignon présent dans les racines de nombreuses plantes. Il s’y déroule une symbiose mutualiste où les photosynthétats (sucres et lipides) des plantes sont échangés contre de la matière minérale (eau et sels minéraux) prélevés dans le sol par les champignons mycorhiziens grâce à leurs longs filaments mycéliens qui y explorent de grands volumes. Ces derniers contribuent également à la protection des plantes, leur permettant par exemple une meilleure résistance au stress hydrique ou aux attaques d’herbivore. Il existe différents types de symbioses mycorhiziennes en fonction des plantes et champignons impliqués. La plus commune est l’endomycorhize à arbuscules qui concerne la majorité des espèces de plantes terrestres et les champignons mycorhiziens à arbuscules (division : Glomeromycotina).
Parce qu’elle implique des échanges nutritifs, cette symbiose est coûteuse. Une plante peut allouer plus de 15 % de sa matière organique à ses champignons mycorhiziens. De nombreuses espèces de plantes évitent ces coûts inutiles en formant des mycorhizes uniquement lorsqu’elles en ont besoin. Par exemple, au-delà d’une certaine concentration en phosphore dans le sol, certaines espèces de plantes arrêtent d’interagir avec des champignons mycorhiziens, étant capables d’assurer leur nutrition minérale en toute autonomie.
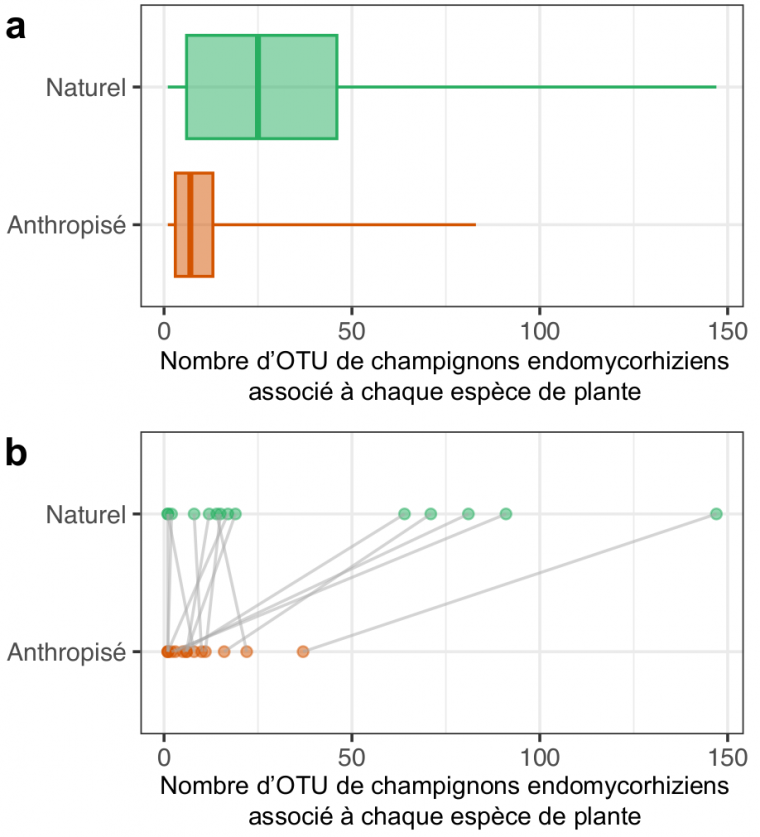
Présentes chez plus de 70 % des espèces de plantes terrestres en conditions naturelles, la symbiose endomycorhizienne est sous-représentée chez les plantes cultivées. Ces dernières interagissent avec trois fois moins d’espèces de champignons endomycorhiziens en moyenne (Figure 3a). De plus, une même espèce de plante en milieu anthropisé a tendance à interagir avec deux fois moins de champignons endomycorhiziens que lorsqu’elle pousse en milieu naturel, bien que cela puisse varier grandement en fonction des espèces (Figure 3b). Une partie de l’explication de cette diminution drastique de la diversité du microbiote mycorhizien réside dans nos pratiques agricoles. En effet, les changements majeurs de ces dernières au cours du siècle dernier ont bouleversé les communautés mycorhiziennes et les microbiotes racinaires des plantes 3. Premièrement, l’utilisation d’engrais chimiques qui enrichissent les sols en minéraux, comme le phosphore ou l’azote, permet aux plantes de se passer de leurs partenaires fongiques. Deuxièmement, les pesticides et autres polluants répandus sur les cultures perturbent la biologie des champignons mycorhiziens et conduisent à leur disparition, tandis que le labour brise mécaniquement les filaments mycéliens fragiles qui explorent le sol. Enfin, la monoculture diminue le nombre d’espèces de champignons capables de coexister à un endroit donné. Tout cela conduit inexorablement à l’érosion de la biodiversité microbienne des sols agricoles, ce qui accroit ainsi la dépendance des cultures aux intrants chimiques.
Face aux problématiques actuellement posées par les pratiques agricoles intensives, une piste de solution pour l’agriculture de demain consiste à pleinement stimuler ou renforcer les symbioses mycorhiziennes et les communautés microbiennes du sol. En plus de prévenir la diminution de la biodiversité microbienne, favoriser la mycorhization des plantes cultivées permet d’augmenter la productivité des cultures tout en améliorant leur résistance face à la sécheresse ou aux ravageurs, limitant ainsi l’utilisation d’engrais et de pesticides chimiques et garantissant une agriculture durable. De plus, en réduisant le recours au labour, la mycorhization limite l’érosion des sols.
Préserver les communautés microbiennes du sol participe également à la séquestration du carbone. En effet, une partie importante du carbone fixé par les plantes est directement exportée dans le sol via les mycorhizes. Ensuite, la décomposition partielle de la matière organique par les microorganismes du sol en condition anaérobie libère les éléments minéraux nécessaires aux plantes tout en contribuant au processus d’humification. La matière organique ainsi liée aux minéraux du sol, appelée humus, est stabilisée et donc moins rapidement minéralisée. Grâce à leurs communautés microbiennes, les sols forment un réservoir conséquent de carbone qui n’est, ainsi, pas dans l’atmosphère. Enfin, l’humus des sols permet également une meilleure rétention de l’eau.
a. Distribution du nombre d’OTU endomycorhiziennes (Gloméromycètes) associé à différentes espèces de plantes présentes en milieux naturel (vert) ou anthropisé (orange). Chaque boîte à moustache représente la médiane (ligne principale), entourée par les premier et troisième quartiles tandis que les moustaches se prolongent jusqu’aux valeurs les plus extrêmes.
b. Comparaison du nombre d’OTU endomycorhiziennes associé à 14 différentes espèces de plantes (lignes grises) étudiées à la fois en milieux naturel (vert) et anthropisé (orange) : parmi les 14 espèces, 10 interagissent avec moins d’OTU endomycorhiziennes en milieu anthropisé qu’en milieu naturel.
Données issues de la base de données MaarjAM, présentée dans Öpik et coll., 2014.
Ainsi, il est aujourd’hui incontestable que les activités humaines conduisent à un déclin massif de la diversité des microbiotes intestinaux humains et de racines des plantes cultivées. L’érosion de la biodiversité commence au plus proche des populations humaines, dans nos intestins comme dans nos champs. Mieux comprendre aujourd’hui le fonctionnement de ces microbiotes et les facteurs qui les perturbent ouvrira la voie à un meilleur contrôle de ces symbioses afin de prévenir leur déclin, d’atténuer les conséquences de leur absence, et d’au contraire profiter de leurs bienfaits.