Les êtres humains présentent des phénotypes variés qui se répartissent de manière hétérogène selon les zones géographiques. Ceci est le résultat d’une longue histoire évolutive qui a démarré dès l’émergence d’Homo sapiens il y a 300 000 ans, et qui s’est poursuivie avec le peuplement progressif des continents. L’accès de plus en plus précis au génome des populations humaines actuelles et anciennes permet aujourd’hui de reconstituer cette histoire.
Après avoir expliqué comment se met en place une adaptation, nous verrons comment l’étude du génome permet de retracer l’histoire évolutive des populations humaines puis nous détaillerons quelques exemples.
L’adaptation des populations, résultat de la sélection naturelle
Une adaptation peut être considérée soit comme un processus qui permet aux êtres vivants d’une population d’acquérir au cours du temps des caractères qui leur sont favorables dans un environnement donné, ou simplement comme le résultat de ce processus. L’adaptation des populations est le résultat de la sélection naturelle, un mécanisme évolutif qui nécessite trois conditions :
- La variabilité, à l’origine de l’apparition de nouveaux variants dans une population.
- L’héritabilité, qui permet de transmettre une variation aux générations suivantes.
- Les contraintes naturellement imposées par le milieu qui peuvent être de nature physique, chimique ou biologique.
À un moment et à un endroit donné, une variation avantageuse est une variation permettant aux individus qui la portent de produire plus de descendants que les individus qui ne la portent pas. La fréquence d’une variation avantageuse augmente donc peu à peu dans la population. À l’inverse, une variation néfaste voire délétère pour les individus aura tendance à disparaître au cours du temps. La valeur sélective d’un individu, aussi appelée fitness, représente la capacité de cet individu à se reproduire et à transmettre ses caractères. Par extension, la valeur sélective d’un trait représente la capacité des individus portant ce trait à se reproduire et à transmettre ce caractère, et témoigne donc de l’espérance de maintien de ce trait dans une population au cours du temps. Elle est liée à deux facteurs : la viabilité, c’est-à-dire la probabilité pour un zygote d’arriver à l’âge reproducteur, et la fécondité, correspondant au nombre moyen de zygotes produits à la génération suivante. Plus la valeur sélective d’un trait est élevée, plus celui-ci se propagera dans une population. Des traits qui n’ont aucun effet sur le succès reproducteur ne sont pas soumis à la sélection naturelle, ils sont dits neutres sur le plan évolutif.
La sélection naturelle correspond donc à la sélection par l’environnement des individus les plus aptes à survivre et/ou à se reproduire. Les effets de cette force évolutive peuvent varier dans l’espace et le temps en fonction des caractéristiques du milieu. Ainsi, certaines adaptations pourront se retrouver dans certaines populations d’une espèce donnée, mais pas dans d’autres1.
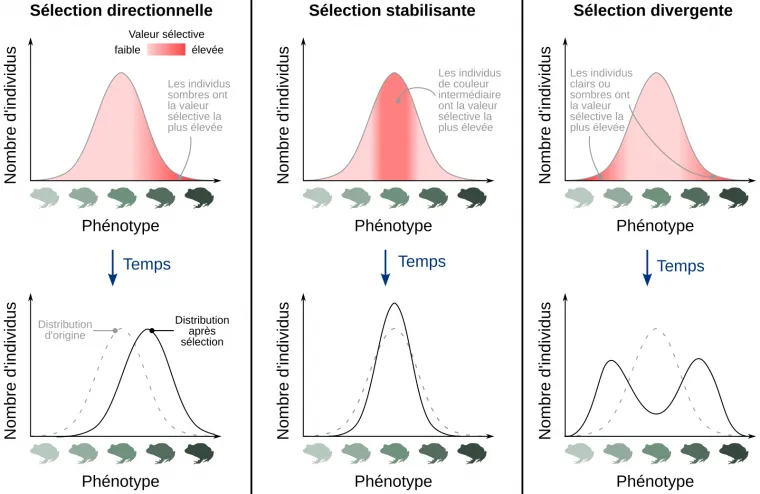
À l’échelle du phénotype, et pour un caractère présentant une variation continue entre deux extrêmes (taille, poids, coloration…) la sélection naturelle peut prendre différentes formes (Figure 1) :
- La sélection directionnelle, qui favorise la fréquence d’un trait extrême en particulier.
- La sélection stabilisante (ou stabilisatrice), qui favorise la sélection des phénotypes intermédiaires par rapport aux phénotypes extrêmes.
- La sélection disruptive ou divergente, qui tend à diminuer la fréquence des phénotypes intermédiaires et à augmenter celle des phénotypes extrêmes.
On considère un exemple fictif d’une population d’amphibiens présentant une variation continue de la coloration de leur peau, selon une distribution normale. En fonction du ou des phénotypes favorisés (par exemple du fait d’une prédation plus ou moins importante selon la coloration), différents types de sélection naturelle peuvent être distingués. La ligne du haut représente la distribution de départ du phénotype dans la population, identique dans les trois cas. La ligne du bas représente la distribution du phénotype dans la population après sélection (ligne noire continue) ; pour faciliter la comparaison, la distribution d’origine est représentée avec une ligne grise en pointillés.
Sélection directionnelle : un phénotype extrême est favorisé, conduisant à l’augmentation de sa fréquence dans la population. Dans l’exemple représenté, les individus à la peau sombre sont favorisés par rapport à ceux présentant une peau claire.
Sélection stabilisante ou stabilisatrice : les phénotypes intermédiaires sont favorisés par rapport aux phénotypes extrêmes.
Sélection divergente ou disruptive : les phénotypes extrêmes sont favorisés tandis que la fréquence des phénotypes intermédiaires tend à diminuer. Dans l’exemple présenté, les individus à la peau claire ou à la peau sombre sont favorisés par rapport aux individus de coloration intermédiaire.
Source de la silhouette d'amphibien, Craugastor augusti : Jose Carlos Arenas-Monroy, CC0, Phylopic.
Dans le cas où les variations phénotypiques sont d’origine génétique, la sélection naturelle fera varier les fréquences alléliques à l’origine de ces caractères entre 0 (cas où l’allèle disparaît) et 1 (cas où l’allèle se fixe dans une population). Par ailleurs, chaque régime de sélection (directionnelle, divergente, stabilisante) engendre une signature moléculaire particulière qu’il est aujourd’hui possible de détecter par l’intermédiaire de méthodes statistiques de plus en plus sophistiquées. C’est cette empreinte que les scientifiques recherchent dans le génome pour reconstituer l’histoire évolutive des populations.
Détecter les effets de la sélection naturelle à travers l’étude du génome
Les techniques de séquençage de l’ADN apparaissent en 1977 et l’étude du génome humain démarre en 1988 lors du lancement du projet Génome humain, impliquant de nombreux laboratoires. Au cours du temps, les progrès techniques et la diminution du coût du séquençage ont permis d’obtenir une séquence quasiment complète du génome humain et ont offert de nouvelles perspectives aux chercheurs. C’est ainsi que des projets internationaux comme le projet HapMap (Haplotype Mapping) ont vu le jour dans le but de cartographier les haplotypes du génome humain 1. Un haplotype correspond à un regroupement d’allèles localisés sur une même région d’un chromosome et suffisamment proches les uns des autres pour être le plus souvent transmis ensemble des parents aux descendants, c’est-à-dire suffisamment proches pour que cette combinaison d’allèles soit le plus souvent conservée malgré le brassage intrachromosomique se produisant lors de la méiose.
Le long de cette courte séquence, l’ADN des individus 1 et 2 est identique à une paire de nucléotides près : l’individu 1 possède le couple C-G tandis que l’individu 2 présente le couple A-T. Cette variation d’une paire de nucléotides, si elle est présente chez au moins 1 % de la population, est appelée polymorphisme mononucléotidique (SNP en anglais, à prononcer « snip »). En fonction de l’endroit où se situe la variation elle peut avoir un effet sur le phénotype ou non.
Les variations alléliques les plus étudiées dans la détermination des haplotypes sont celles liées aux substitutions, à l’origine d’un polymorphisme appelé polymorphisme mononucléotidique ou SNP (single nucleotide polymorphism) (Figure 2). La cartographie des SNP par le projet HapMap a permis de mener des études d’association pangénomique ou GWAS (genome-wide association study) dans lesquelles les variations génétiques entre individus sont comparées aux traits portés par ces individus, dans le but d’établir une corrélation entre génotype et phénotype 1. La découverte de variants fréquemment retrouvés dans certaines populations humaines a permis de révéler, entre autres, des allèles soumis à la sélection naturelle. En effet, lorsqu’une mutation apparaît, la valeur sélective des individus peut être modifiée en fonction des contraintes imposées immédiatement ou ultérieurement par le milieu de vie.
À l’échelle génétique, plusieurs types de sélection peuvent être distingués :
- La sélection positive : lorsqu’un allèle est avantageux, sa fréquence augmentera au cours du temps. La sélection positive peut agir sur un nouvel allèle ou sur un allèle préexistant devenant avantageux suite à une modification environnementale (sélection sur variant préexistant) ou encore sur plusieurs allèles lorsque chacun apporte un avantage aux individus (sélection polygénique).
- La sélection négative : elle agit sur les allèles défavorables et finit par les éliminer.
- La sélection balancée : elle sélectionne plusieurs allèles situés à un même site et favorise leur coexistence 1.
Selon les formes de sélection, l’impact sur la diversité génétique des populations et sur la diversité des haplotypes sera différent (Figure 3) 2. C’est cette empreinte que les études d’association tentent de mettre en évidence afin d’associer un ou plusieurs gènes à un phénotype et de mieux comprendre l’origine de l’adaptabilité des populations.
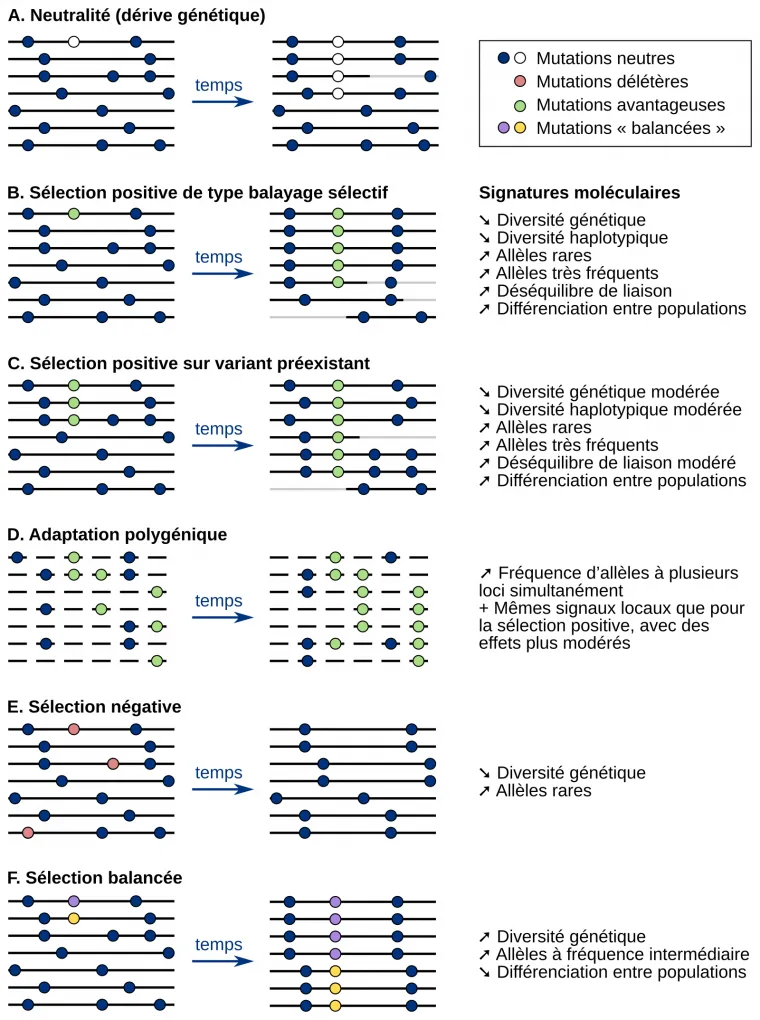
Les différentes formes de sélection naturelle laissent des signatures moléculaires différentes dans le génome des populations. En détectant ces signatures, il est donc possible de déduire la forme de sélection s’étant exercée sur un locus particulier. Cette figure illustre l’évolution de différents types de mutations (neutres, délétères, avantageuses, « balancées ») en fonction du type de sélection.
Pour chaque type de sélection, la partie de gauche représente les haplotypes de différents individus (chaque haplotype est représenté par une ligne) avant la sélection. La partie de droite représente les haplotypes des descendants des individus de gauche, après plusieurs générations. Sur les haplotypes, les points représentent des mutations neutres (points bleus ou blancs) ou des mutations évoluant sous sélection (points verts, rouges, violets et jaunes).
Le changement de couleur d’un haplotype (de noir vers gris) montre les évènements de recombinaison. Rappelons que les haplotypes sont des groupes d’allèles localisés sur une même région d’un chromosome et suffisamment proches les uns des autres pour être le plus souvent transmis ensemble des parents aux descendants, c’est-à-dire suffisamment proches pour que cette combinaison d’allèles soit le plus souvent conservée malgré le brassage intrachromosomique se produisant lors de la méiose. Le changement de couleur sur la figure montre donc des cas d’apparition de nouveaux haplotypes par recombinaison lors de la méiose.
A. Évolution sous neutralité. Il n’y a pas de sélection et seule la dérive génétique est responsable de l’évolution des fréquences alléliques.
B, C et D : Évolution sous sélection positive. La sélection de l’allèle avantageux entraîne la surreprésentation de l’haplotype le contenant. Ceci entraîne l’élimination des mutations neutres qui ne sont pas portées par l’haplotype contenant la mutation sélectionnée.
B. Dans le cas du balayage sélectif, la mutation avantageuse est rapidement sélectionnée dès son apparition.
C. Une mutation peut également d’abord évoluer sous neutralité avant de devenir avantageuse du fait d’un changement des pressions de sélection s’exerçant sur la population. Dans ce cas, la sélection s’effectue donc sur un variant préexistant.
D. La sélection positive d’un trait peut également impliquer non pas un, mais plusieurs locus. Elle est alors dite polygénique.
E. Évolution sous sélection négative. L’allèle délétère finit par disparaître du génome des individus.
F. Évolution sous sélection balancée. Différents allèles d’un même locus sont sélectionnés.
Adapté de la thèse de Maud Fagny : L'Homme face à son environnement : une histoire génétique et épigénétique du génome humain, 2015.
La sélection positive mène à l’augmentation de la fréquence d’un caractère avantageux dans la population, permettant ainsi l’adaptation des populations à leur environnement. D’un point de vue génétique, la sélection positive d’une mutation entraîne l’augmentation rapide de sa fréquence dans la population et, avec elle, l’augmentation de la fréquence des autres mutations portées par l’haplotype auquel elle appartient. Ces autres mutations sont comme prises en « auto-stop » par la mutation conférant le caractère avantageux. A contrario, les mutations qui ne sont pas portées par l’haplotype sélectionné sont progressivement éliminées. Au niveau de l’haplotype, la sélection positive se manifeste donc par un phénomène de balayage sélectif : la sélection entraîne une diminution de la variabilité génétique autour de la mutation sélectionnée, ou, autrement dit, une surreprésentation de l’haplotype contenant l’allèle avantageux dans la population 1.
L’étude du génome des populations actuelles, couplée aux études paléogénomiques, a permis de mieux comprendre l’origine génétique de l’adaptation des populations à leur environnement. L’utilisation de l’intelligence artificielle permet aujourd’hui d’améliorer la qualité des résultats et de détecter plus efficacement les variants génétiques soumis à la sélection naturelle en s’affranchissant des effets liés à la démographie. C’est ainsi que de nombreux gènes soumis à des pressions de sélection ont pu être identifiés. Ils sont en particulier impliqués dans la résistance aux maladies et à certains composés toxiques, la résistance à l’hypoxie, l’alimentation, la pigmentation de la peau et la taille (Tableau 1) 2.
| Catégorie | Adaptation | Gène(s) impliqué(s) | Populations concernées |
|---|---|---|---|
| Régime alimentaire | Persistance de la lactase | LCT | Eurasiens et Africains |
| Repas riches en graisse | FADS | Inuits du Groenland | |
| Repas riches en amidon | AMY1 | Nombreuses populations | |
| Taux élevé d’arsenic | AS3MT | Argentins | |
| Faible taux de sélénium | DI2, SelS, GPX1, GPX3, CELF1, SPS2, SEPSECS | Chinois | |
| Faible taux de fer | HFE | Européens | |
| Faible taux d’iode | TRIP4 | Pygmées d’Afrique centrale | |
| Faible taux de calcium | TRPV6 | Non Africains | |
| Taux de zinc | SLC30A9, SLC39A8 | Asiatiques de l’Est de l’Asie et Africains | |
| Déficit en ergothionéine | IBD5 (SLC22A4, SLC22A5) | Européens | |
| Famines fréquentes | CREBRF | Samoans | |
| Consommation d’alcool | ADH1B | Asiatiques | |
| Pathogènes | Résistance au paludisme | HBB, HBA, HPA, GYPA, GYPB, GYPC, G6PD, FY | Africains d’Afrique subsaharienne |
| Maladie du sommeil | APOL1 | Africains de l’Ouest de l’Afrique | |
| Hépatite C | IFNL4, IL28B | Eurasiens | |
| VIH | CUL5, TRIM5, APOBEC3G | Baka de la République centrafricaine | |
| Fonctionnement du système immunitaire | ADAM17, ITGAL, LAG3, IL6, LRRC19, PON2, groupe HLA (N), STAT2 (D), STAT2 (N), TLR1-TLR6-TLR10 (N) | Nombreuses populations | |
| Faible quantité de dioxygène | Haute altitude | EGLN1, EPAS1 (D), PPARA | Tibétains (EPAS1 chez les Chinois Han) |
| EGLN1, EDNRA, PRKAA1, NOS2A, BRINP3 | Andins | ||
| VAV3, CABARA1, ARNT2, THRB, BHLHE41 | Éthiopiens | ||
| Plongée en apnée | PDE10A, BDKRB2 | Bajau (Indonésie) | |
| Résistance au froid | Perception du froid | TRPM8 | Eurasiatiques |
| Régulation du métabolisme | CPT1A, LRP5, THADA | Russes de Sibérie | |
| Fonctionnement cardiovasculaire | PRKG1 | Russes de Sibérie | |
| Différenciation des adipocytes bruns et brites (brown-in-white) | TBX15 | Inuits du Groenland | |
| Exposition aux UV | Changement de pigmentation | SLC24A5, SLC45A2, OCA1-4, TYRP1, DCT, TYR, MC1R (N), HYAL2 (N) | Nombreuses populations |
| Faible taux de vitamine D | DHCR7, NADSYN1 | Européens du Nord | |
| Taille | Fonctions indéterminées | DOCK3, CISH, HESX1, POU1F1 | Chasseurs-cueilleurs d’Afrique centrale |
| Fonctions indéterminées | Nombreux gènes | Européens | |
| Épaisseur des cheveux | Fonction indéterminée | EDAR | Asiatiques de l’Est de l’Asie |
Parmi ces exemples, Planet-Vie propose un article sur les adaptations génétiques des populations humaines à leur alimentation ainsi qu’un autre sur la sélection génétique par les pandémies de peste. Dans la partie suivante, deux autres exemples d’adaptations seront développés : la pigmentation de la peau et l’adaptation aux conditions de vie à de très hautes altitudes.
Deux exemples d’adaptations
La pigmentation de la peau
Il existe aujourd’hui une corrélation entre la répartition mondiale de la couleur de la peau humaine et celle du rayonnement UV : la peau des êtres humains est souvent plus foncée au niveau de l’équateur, là où le rayonnement ultraviolet est plus intense 1. Elle s’éclaircit ensuite en direction des pôles en même temps que l’intensité du rayonnement ultraviolet diminue.
La couleur de la peau humaine est principalement liée à la présence de deux pigments : l’eumélanine et la phéomélanine, généralement rassemblés sous le nom de mélanine. Leur synthèse a lieu dans les mélanocytes localisés dans la couche profonde de l’épiderme. Elle s’effectue à partir d’un acide aminé, la tyrosine et dépend d’une enzyme, la tyrosinase. Une fois produite, la mélanine s’accumule dans des granules, les mélanosomes, qui sont ensuite transférés vers l’extrémité des prolongements des mélanocytes puis absorbés par les kératinocytes voisins.
Tous les êtres humains ont à peu près le même nombre de mélanocytes, les différences de pigmentation entre individus proviennent donc du type et de la quantité de mélanine produite : les individus ayant une peau foncée élaborent des mélanosomes plus foncés et plus nombreux que les individus ayant une peau pâle. Ces différences sont ensuite atténuées par le bronzage en cas d’exposition au soleil.
Dans les kératinocytes, les granules de mélanine s’accumulent sur la surface externe du noyau et forment un écran protecteur contre les diverses agressions engendrées par les rayons UV du soleil. La mélanine protège le matériel génétique des effets néfastes des UVA et de la photodégradation des folates, molécules apportées par la nourriture, indispensables à la fermeture du tube neural au cours de l’embryogenèse et aussi nécessaire au bon déroulement de la spermatogenèse. En revanche, en limitant le passage des UVB, la mélanine réduit la synthèse de la vitamine D, indispensable à la minéralisation des os tout au long de la vie.
De nombreux gènes sont impliqués dans la production de mélanine et l’expression de chacun d’entre eux affecte la couleur de la peau (Figure 4). Certains gènes comme SLC45A2 (solute carrier family 45 member 2), SLC24A5 (solute carrier family 24 member 5), MFSD12 (major facilitator superfamily domain containing 12) ou encore BNC2 (basonucléine 2) jouent un rôle majeur dans la synthèse et le transport de la mélanine 12.
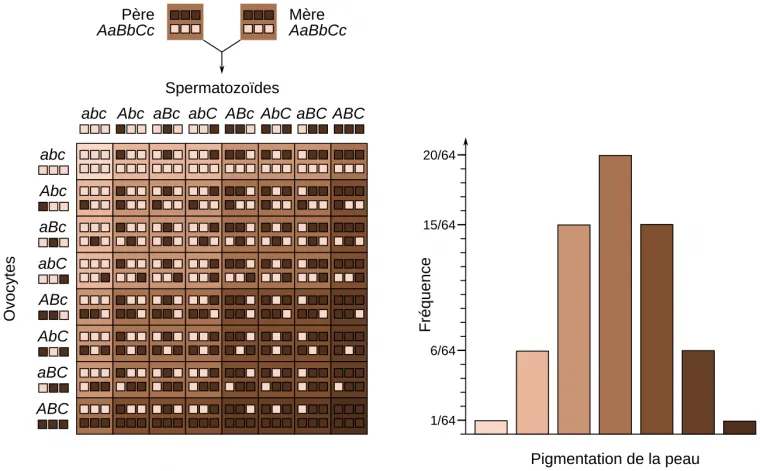
On se place dans un cas fictif où la pigmentation de la peau serait sous l’influence de trois gènes présentant chacun deux allèles : les allèles notés en majuscule (A, B, C), représentés par des carrés sombres, conduisent à une production importante de mélanine tandis que les allèles notés en minuscule (a, b, c), représentés par des carrés clairs, conduisent à une faible production de mélanine.
Dans le cas considéré, les deux parents sont hétérozygotes pour les trois gènes et présentent donc une pigmentation intermédiaire. La réalisation d’un échiquier de croisement permet de montrer les différents génotypes possibles (représentés par les six petits carrés) et les phénotypes correspondants (représentés par le grand carré). Le graphique de droite représente la distribution des phénotypes attendus parmi les descendants, en considérant que les trois gènes sont indépendants, c’est-à-dire portés par des chromosomes différents.
En réalité, dans l’espèce humaine, la pigmentation de la peau est contrôlée par plus de trois gènes, ce qui mène à plus de phénotypes possibles pour les descendants. De plus, les différences entre phénotypes sont ensuite atténuées selon l’exposition au soleil et le bronzage.
Les analyses pangénomiques de plusieurs populations à travers le monde ont permis d’établir des liens entre certains variants génétiques, la couleur de la peau et les conditions environnementales. Elles ont montré que le rayonnement ultraviolet est le principal facteur de sélection expliquant la répartition de la couleur de la peau. Aux basses latitudes, le rayonnement UV est plus important et avoir une peau foncée constitue donc un avantage pour les individus. Aux hautes latitudes, le rayonnement UV étant moins important, les variations génétiques responsables de la peau claire sont plus avantageuses et davantage transmises.
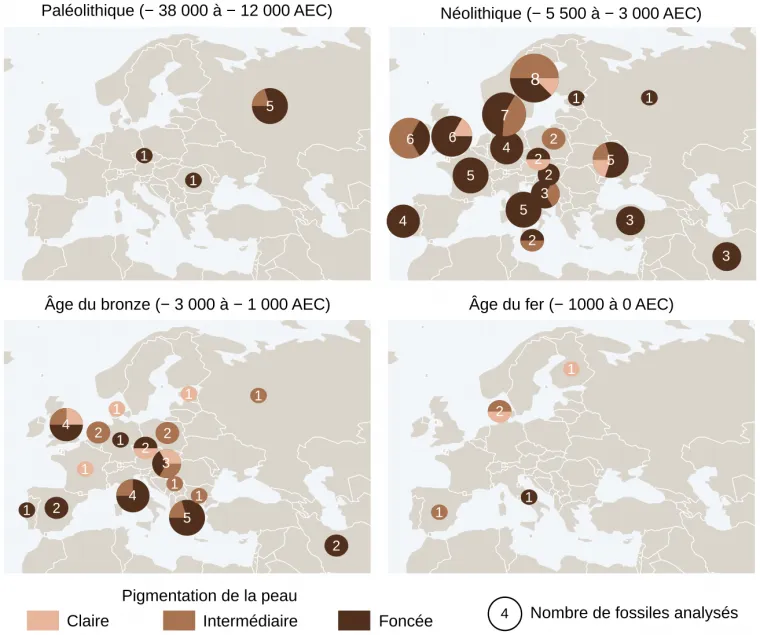
L’alimentation joue également un rôle dans la couleur de peau, comme le montre par exemple une étude récente fondée sur l’analyse de l’ADN de 348 squelettes datant du Paléolithique à l’âge du fer (Figure 5) 1. Les résultats montrent qu’une peau foncée aurait perduré dans les populations européennes jusqu’à un moment tardif de la préhistoire lorsque l’agriculture se serait développée. En effet, les premiers Européens, des chasseurs-cueilleurs, avaient une peau foncée et leur régime alimentaire, principalement composé de poisson et de gibier, permettait de compenser le manque de vitamine D. Au cours du Néolithique, les premiers agriculteurs arrivant en Europe auraient transmis un allèle du gène SLC24A5 conduisant à l’éclaircissement de la peau. Dans un environnement faiblement ensoleillé, la modification du mode de vie des individus évoluant vers une alimentation de plus en plus riche en céréales et appauvrie en vitamine D aurait créé une pression de sélection sur les individus, favorisant la dépigmentation progressive de la peau des Européens.
Des fossiles humains, datés de différentes périodes, ont été génotypés afin de déduire la pigmentation de leur peau. Trois catégories ont été définies : claire, intermédiaire et foncée. Les intervalles de dates (en AEC, années avant notre ère, c’est-à-dire avant Jésus-Christ) indiqués pour chaque période sont ceux retenus par les auteurs de l’étude pour catégoriser les fossiles. Les dates de début et fin de ces différentes périodes varient en réalité selon les zones géographiques considérées et selon les auteurs. Pour plus d’informations, l’Institut national de recherches archéologiques préventives propose une frise chronologique.
La dimension des cercles représente le nombre de fossiles analysés pour chaque pays de provenance des fossiles.
Il y a 10 000 ans, les premiers agriculteurs arrivant en Europe auraient introduit dans la population la mutation G → A du gène SLC24A5, donnant une peau plus claire. Les migrations successives et le développement d’une alimentation appauvrie en vitamine D auraient ensuite favorisé les individus à peau claire dans un environnement faiblement exposé au rayonnement ultraviolet. Cette modification du phénotype prédominant pour la couleur de la peau est cependant très lente puisque, à l’Âge du fer, seuls deux individus sur les cinq analysés ont la peau claire.
Le régime alimentaire est donc un autre facteur de sélection capable d’influencer la couleur de la peau. Aujourd’hui, cet effet peut être observé chez les Inuits qui présentent une peau foncée alors qu’ils vivent dans des régions faiblement ensoleillées 1. Cela est lié au fait que leur alimentation fut, pendant longtemps, riche en vitamine D.
La comparaison des génomes actuels et fossiles a aussi permis de montrer que certaines variations génétiques impliquées dans la pigmentation de la peau proviennent de métissage entre Homo sapiens et d'autres espèces humaines. Le gène BNC2 en est un exemple. Des analyses génomiques ont montré qu’un haplotype d’origine néandertalienne se retrouve aujourd’hui dans 70 % de la population européenne 2. Son expression conduit à un éclaircissement de la peau et aurait constitué un avantage sélectif améliorant l’adaptation d’Homo sapiens à son environnement en particulier au faible ensoleillement des hautes latitudes. Il s’agit d’un exemple d’introgression adaptative.
L’introgression adaptative
L’introgression correspond à l’incorporation, dans le génome d’une espèce A, de séquences d’une espèce B, suite à un ou plusieurs événements d’hybridation entre A et B, suivis de croisements répétés, au cours des générations, avec des membres de l’espèce A. Le génome de l’espèce B, initialement présent à 50 % dans les hybrides F1, se retrouve donc peu à peu dilué dans le génome de l’espèce A.
Lorsque les allèles incorporés confèrent un avantage adaptatif au receveur, on parle d’introgression adaptative. C’est ainsi que des portions du génome de Néanderthaliens ou de Dénisoviens se sont retrouvées dans le génome de certains Homo sapiens et persistent encore aujourd’hui.
Pour plus d’informations, voir l’article Homo sapiens et ses contemporains : les populations humaines du Pléistocène moyen et supérieur.
L’adaptation à la très haute altitude
25 millions de personnes vivent actuellement à plus de 3000 m d’altitude, où la quantité de dioxygène est réduite de 40 % par rapport au niveau de la mer. Ces habitants se répartissent principalement sur trois grandes zones géographiques : les Tibétains sur le plateau de l’Himalaya, les Quechuas et Aymaras sur les plateaux des Andes et les Amharas sur les plateaux d’Éthiopie.
L’organisme d’un individu vivant à basse altitude répond à des conditions d’hypoxie en mettant en place des mécanismes compensateurs (notamment augmentation des fréquences respiratoires et cardiaques) pour augmenter le prélèvement et le transport de dioxygène dans l’organisme : il s’agit d’un phénomène d’acclimatation. Le manque de dioxygène stimule également la sécrétion d’érythropoïétine (EPO) par les reins ce qui provoque une augmentation de la quantité de globules rouges dans le sang (polyglobulie). Si ces mécanismes s’avèrent insuffisants, l’hypoxie qui en résulte se traduit par l’apparition de symptômes : maux de tête, nausées, vertiges et fatigue ; il s’agit du « mal des montagnes » ou maladie de Monge 1. Ces symptômes disparaissent rapidement lorsque la concentration en dioxygène redevient normale (normoxie) et n’ont pas de conséquence sur l’organisme. En revanche, lorsque l’hypoxie perdure, l’impact sur la santé des individus est plus important. Les capacités cognitives et la fécondité diminuent et, très souvent, le développement des enfants est ralenti.
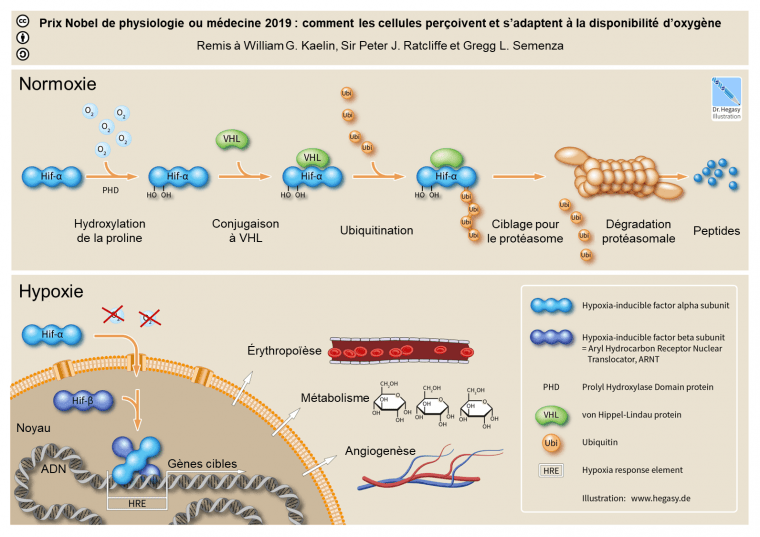
L’un des gènes impliqués dans la réponse à l’hypoxie est EPAS1 (endothelial Per-ARNT-Sim domain protein 1). Celui-ci code la protéine HIF-2α qui, avec HIF-1α, forme la sous-unité HIF-α d’un facteur de transcription induit par l’hypoxie : le facteur HIF (hypoxia inducible factors). Ce facteur de transcription est également composé d’une sous-unité HIF-β.
Lorsque la concentration en dioxygène est normale dans le sang, la sous-unité HIF-α est hydroxylée sur deux résidus proline, puis reconnue par la protéine VHL (von Hippel-Lindau) et ubiquitinylée (Figure 6). Cela provoque ensuite sa dégradation par le protéasome de la cellule.
En cas d’hypoxie, la sous-unité HIF-α n’est pas hydroxylée et n’est donc pas dégradée. HIF-α se déplace alors vers le noyau cellulaire et s’associe à la sous-unité HIF-β ainsi qu’à d’autres cofacteurs. Le facteur de transcription HIF, au complet, se lie à des séquences régulatrices appelées HRE (Hypoxia Response Element) ce qui permet l’activation des gènes cibles. Cela déclenche diverses réponses dans l’organisme telles que l’érythropoïèse (production de globules rouges), la glycolyse (permettant la production d’ATP malgré l’absence de dioxygène) ou l’angiogenèse (formation de nouveaux vaisseaux sanguins) pour pallier au manque de dioxygène 2.
Si l’érythropoïèse déclenchée par l’activation de HIF en hypoxie permet de capter davantage de dioxygène, la production accrue de globules rouges épaissit le sang et augmente le risque d’accidents cardiovasculaires. Cependant, les populations vivant en permanence en altitude et depuis plusieurs générations ne présentent pas polyglobulie et donc pas ce risque de troubles cardiovasculaires. Dans ces populations, d’autres traits physiologiques ont été sélectionnés et permettent de capter et de transporter davantage de dioxygène. Ces traits ne sont pas forcément les mêmes selon les populations considérées. Par exemple chez les Tibétains, la fréquence ventilatoire est plus importante que chez les individus des plaines mais la concentration en hémoglobine dans le sang est similaire, alors que chez les Andins, la fréquence ventilatoire est la même que celle d’individus des plaines tandis que la concentration en hémoglobine est plus importante 12.
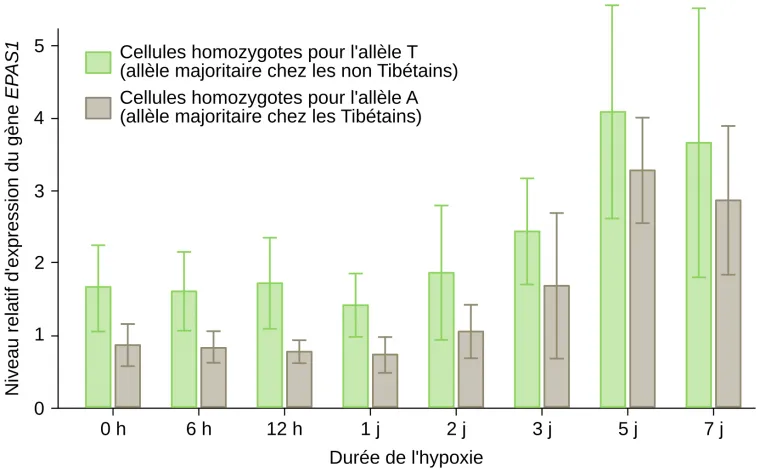
Pour comprendre une des origines génétiques de l’adaptation à la vie à haute altitude, nous prendrons ici l’exemple de la population tibétaine. La comparaison du génome d’une cohorte de Tibétains résidant dans le Yunnan à 3 500 m d’altitude avec celui d’individus d’origine chinoise appartenant à l’ethnie Han et vivant en plaine a permis d’identifier des variants typiques des populations tibétaines 3. Plusieurs de ces variations concernent le gène EPAS1 et l’une d’entre elles se situe dans une région non codante où une thymine (T), est remplacée par l’adénine (A). La fréquence de cette mutation atteint 57,2 % chez les Tibétains et seulement 0,5 % chez les Chinois Han et 3,2 % chez les Africains. Cette mutation est absente chez les Japonais et les Européens. Chez les individus homozygotes pour l’allèle A, EPAS1 est moins exprimé que chez les individus homozygotes pour l’allèle T en condition d’hypoxie (Figure 7) 4. L’expression moins forte du gène EPAS1 chez les Tibétains serait à l’origine d’une diminution de la réponse à l’hypoxie chez ces individus et constituerait donc une adaptation à la vie en haute altitude, en particulier en les protégeant contre une trop forte production de globules rouges.
Le niveau d’expression du gène EPAS1 de cellules endothéliales issues de cordons ombilicaux a été mesuré in vitro. Ces cellules proviennent d’individus Tibétains soit homozygotes T//T (phénotype « sauvage », c’est-à-dire le plus répandu dans la population mondiale) ou homozygotes A//A (phénotype adapté à la haute altitude). Le niveau d’expression du gène EPAS1 a été mesuré après différentes durées de culture en conditions d’hypoxie (1 % de dioxygène). Le niveau d’expression du gène EPAS1 augmente à partir de deux jours en condition d’hypoxie. Cependant, cette augmentation est moins importante chez les individus A//A (phénotype adapté à la haute altitude) que chez les individus homozygotes T//T (phénotype sauvage).
La signification des barres associées aux moyennes (écart type, erreur type de la moyenne...) n'est pas indiquée dans la publication d'origine.
La comparaison des génomes actuels des Tibétains et des Chinois Han avec l’ADN fossile a montré que cet allèle A du gène EPAS1 était déjà présent chez les Dénisoviens. Le métissage entre ces populations et les humains modernes se serait produit il y a entre 48 000 et 46 000 ans, à basse altitude 1. Cet allèle aurait ensuite été sélectionné plus tard, dans les populations ayant migré sur les hauts plateaux, il y a environ 25 000 ans. Il s’agit à nouveau d’un exemple d’introgression adaptative.
Conclusion
Les études des génomes des populations actuelles et fossiles permettent aujourd’hui de mettre en lien le génotype et le phénotype et de montrer que les adaptations locales des populations humaines sont le résultat de la sélection naturelle. Elles mettent aussi en évidence que les métissages ont joué un rôle majeur dans l’évolution des êtres humains et soulignent l’importance de la variation génétique au sein des populations. Cette variation est en effet une condition indispensable à l’adaptation à l’environnement.