Après un rapide historique des idées sur l'évolution des espèces, cet article se penche sur la source de la variation des êtres vivants, les mutations, et les conséquences que celles-ci ont sur le phénotype des individus et sur l'évolution des populations.
La transmission des traits
Le concept d’héritabilité des traits est très ancien
Le cheval domestique résulte d'une longue sélection à partir d'une race ancienne dont l'identité fait encore débat, mais qui semble être le tarpan (disparu en 1887) ou/et peut-être le cheval de Przewalski.
L’idée d’une transmission physique des caractéristiques des parents lors de la reproduction remonte de manière documentée à plusieurs milliers d’années. L’idée que les descendants ressembleront à leurs parents, en particulier, se retrouve dans divers écrits de l’Antiquité. Cependant, le médium de cette transmission, ainsi que la part respective des deux parents, ont été discutés jusque tard dans le XIXe siècle. Les connaissances et les idées sur le sujet ont été appliquées depuis plusieurs millénaires dans l’agriculture et l’élevage pour isoler les traits désirables (du point de vue de l’éleveur) des organismes élevés, et s’assurer qu’ils seront présents préférentiellement à la génération suivante. Le but est généralement d’obtenir un groupe portant les traits avantageux de manière homogène, qui produiront uniquement des descendants présentant ces propriétés. Ce résultat est obtenu par une sélection artificielle (Figure 1).
La sélection artificielle désigne le processus de modification d'une population d'un organisme par les êtres humains selon des critères qui peuvent être esthétiques ou fonctionnels. Cette modification se fait par un choix soigneux, à chaque génération, des individus qui seront autorisés à se reproduire.
Hérédité et génétique
Les progrès de la compréhension des mécanismes de l’hérédité, en particulier au niveau du génotype, sont nettement plus récents.
Les travaux de Gregor Mendel (1822-1884) sur l’hérédité des caractères chez les pois (publication en 1865), et surtout leur redécouverte au tout début du XXe siècle (Carl E. Correns et Hugo de Vries) ont posé les bases de ce qui a été appelé par la suite les lois de l’hérédité mendélienne. Les premiers travaux se basaient uniquement sur l’observation de caractères phénotypiques sur des croisements, mais l’étude du génotype se développa dés le premier quart du XXe siècle, bien que le support physique de l’hérédité ne soit pas connu jusqu’à la publication des travaux d’Oswald T. Avery, Colin MacLeod et Maclyn McCarthy en 1944, et la description de la structure de l’ADN en 1953 (travaux de James D. Watson, Francis Crick, Maurice Wilkins et Rosalind Franklin). La découverte de l’implication des chromosomes dans l'hérédité (1903), du fait qu'ils portent les gènes (T. H. Morgan, 1910), ainsi que les premières cartes génétiques datent de cette période très active. En particulier, de nombreuses expériences de croisements sur l'espèce modèle Drosophila melanogaster, ont permis un défrichement des notions de gène, et de liaison physique entre des gènes, même si, de nouveau, les notions de crossing-over (1931), et le fait que les gènes codent des protéines (E. M. Tatum, G. W. Beadle 1941) n'étaient pas encore accessibles.
La réplication semi-conservative est décrite en 1958 (M. Meselson & F. Stahl), le fait que l’information est répartie en codons, puis le code génétique (M. W. Nirenberg, H.J. Matthaei) entre 1961 et 1966.
Les premières séquences longues d’ADN furent obtenues en 1977 avec l’introduction des méthodes de séquençage de Sanger et de Maxam et Gilbert, et prit un essor important suite à la publication de la méthode de PCR (polymerase chain reaction ou amplification en chaîne par polymérase, Kary Mullis, 1986).
La nouveauté de l’idée de Darwin
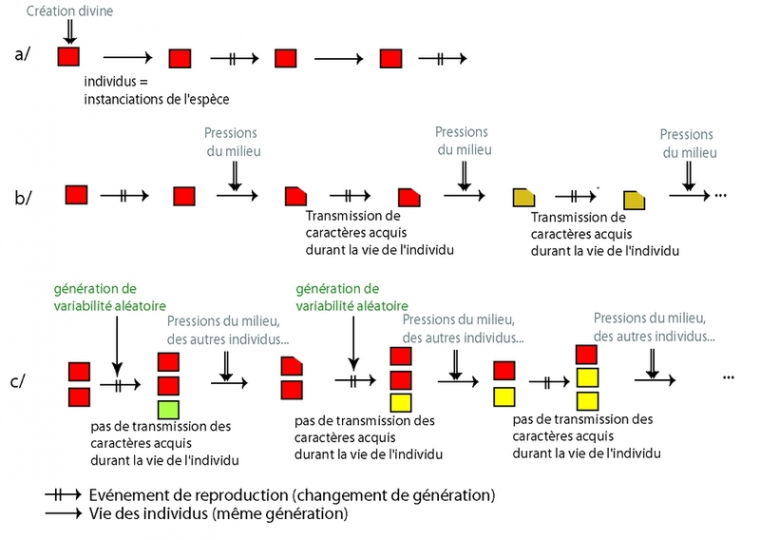
Le concept de transmutation des êtres vivants, de leur transformation au cours du temps, est ancien et remonte à bien avant le XIXe siècle. Pour comprendre la différence fondamentale existant entre les théories proposées par Darwin et Wallace, et celles largement diffusées à l’époque, il faut rappeler brièvement les caractéristiques et origines de celles-ci. D’une part, la conception des espèces telle que répandue à l’époque était nettement essentialiste, du fait entre autres du succès des idées et du système décrits par Linné, où les espèces sont considérées comme étant fixées une fois pour toutes par le créateur (provenant d’actes de création divine indépendants ; Figure 2a). Les variations interindividuelles étaient considérées comme des déviations de la norme, de ce qui était vu comme l’essence de l’espèce : des erreurs, et donc sans intérêt. En parallèle, cependant, de nombreux naturalistes acceptaient une forme ou une autre de transformisme. On peut citer par exemple parmi les premiers auteurs sur le sujet Diderot (Le rêve de d’Alembert, 1769, disponible sur le site de l'université du Québec de Chicoutimi), Maupertuis (Vénus physique, 1746, disponible en français sur le site Gallica; Système de la Nature, 1751), et Benoît de Maillet (Telliamed, 1748, disponible en français sur le site Gallica), mais également Erasmus Darwin (grand-père de Charles Darwin), avec son Zoonomia (1794, disponible en anglais, site du projet Gutenberg), ou Jean-Baptiste de Monet, chevalier de Lamarck (Philosophie zoologique, 1809 ; et Histoire naturelle des animaux sans vertèbres, 1815, disponibles en français sur le site Gallica). Dans ce cas, les êtres vivants n'étaient plus considérés comme fixés, les individus et les populations se transformant sous l’influence du milieu, et transmettant ces modifications à leur descendance (Figure 2b).
Deux articles soumis simultanément par Charles Darwin et Alfred Russell Wallace à une réunion de la Linnaean Society en 1859 présentèrent une approche résolument nouvelle. Mais c’est en novembre de la même année, avec la parution de la première édition de L’origine des espèces au moyen de la sélection naturelle (disponible en français sur le site de l'université du Québec de Chicoutimi), que cette idée a rapidement acquis une plus large diffusion (le nombre de commandes avant parution excédant même le nombre d’exemplaires imprimés). La controverse sociale qui s’ensuivit dura des années. Il y a deux nouveautés radicales par rapport aux hypothèses précédentes : la place centrale accordée à la variabilité entre les individus, qui n'est plus considérée comme un détail sans importance mais comme le matériau permettant la transformation des espèces, mais également l'idée que la source de la variation est liée au hasard. La variabilité, apparue de manière aléatoire, préexiste donc aux tris du milieu, et les différents mécanismes de « tri » de cette diversité (sélection naturelle, sélection sexuelle et, plus récemment, dérive) interviennent ensuite ou même simultanément (Figure 2c) conduisant à retenir ou éliminer certaines des variantes. La variabilité interindividuelle permet l'adaptation en fournissant un large choix d'individus différents dont certains seront peut-être mieux adaptés à certaines conditions du milieu, tandis que d'autres seront moins aptes à se reproduire ou à survivre (ce qui ne signifie pas qu'ils ne le feront pas du tout, comme nous le verrons par la suite).
La théorie ne se basait pas à l’époque sur une connaissance des lois de l’hérédité mendélienne, de la séparation des cellules somatiques et germinales, des mécanismes de création de variabilité génétique, ou de ceux d’évolution des populations. Ces notions ont été intégrées par la suite, mais il s'est avéré qu'ensemble, elles possédaient un pouvoir explicatif encore plus important.
Nous avons maintenant une bonne idée des mécanismes au niveau moléculaire (génotype) qui sous-tendent l’apparition de la variabilité, même si ces domaines sont encore un champ de recherche très actif et très fructueux.
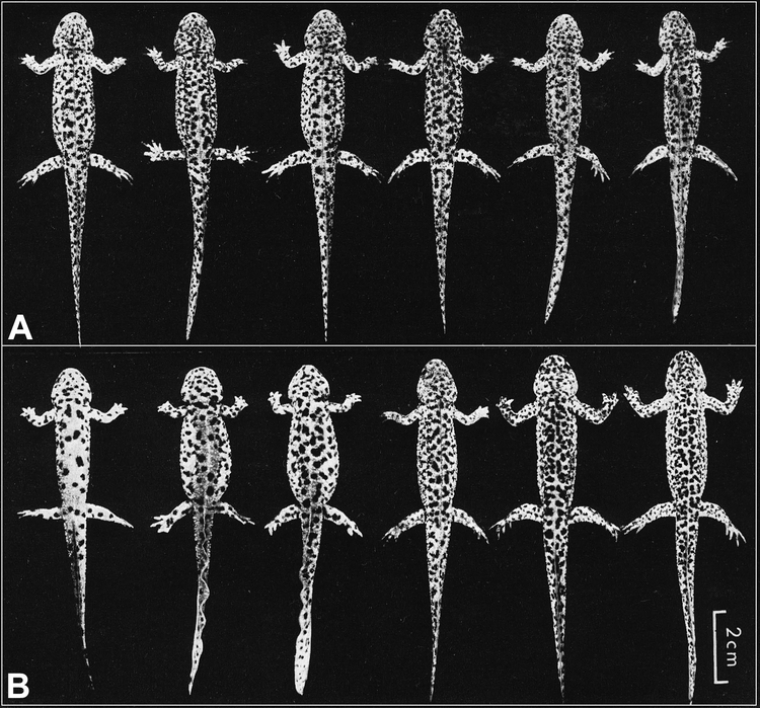
Il existe également une part de la variabilité qui n'est pas héritable, et qui est due à des événements spécifiques à chaque individu au cours de son développement, de sa vie. Même des individus avec un matériel génétique parfaitement identique au départ peuvent ainsi présenter des différences (Figure 3A).
Une population clonale d'amphibien urodèle (Pleurodeles waltlii) a été obtenue par transplantation nucléaire (3A). Les noyaux ont été prélevés à partir des cellules d'une unique blastula et transplantés dans des oeufs provenant de la ponte de la même femelle. On constate que bien qu'ayant le même patrimoine génétique, ces six individus présentent une distribution différente des plages pigmentées sur le tégument (les critères analysés quantitativement sont le nombre de taches et la distance entre les taches de chaque individu). Cette variabilité est cependant inférieure à celle observée sur des individus témoins (3B) correspondants aux animaux issus d'oeufs non transplantés provenant de la même ponte ayant fourni la blastula donneuse utilisée pour le transfert nucléaire. Ce résultat démontre que la distribution des plages pigmentées du tégument n'est pas entièrement codée génétiquement chez le pleurodèle. Des résultats similaires ont été obtenus chez d'autres animaux comme les vaches par exemple.
Il existe d’autre part des traits transmis d’une génération à l’autre qui ne passent pas par un déterminisme génétique, comme des comportements dont la transmission par imitation ou apprentissage est permis par le contact social.
Modification : création de variabilité génétique
La partie qui suit va s'intéresser à la fois aux mécanismes qui aident à maintenir l'intégrité de l'information génétique, et aux mécanismes d'apparition de la variabilité génétique.
Changements ponctuels et mécanismes de correction
La réplication de l’ADN est un processus semi-conservatif qui permet une copie avec une très bonne fidélité des brins d'ADN parentaux, mais la copie n'est cependant pas parfaite. De plus, l'ADN peut être endommagé ou remanié de manière plus ou moins importante suite à des processus endogènes ou exogènes. Les changements touchant un ou plusieurs nucléotides, qu'ils soient dus à des erreurs lors de la réplication ou à des agents externes (« agents mutagènes ») sont appelés des mutations.
Erreurs de copie
Les différentes polymérases (19 connues pour les Eucaryotes) sont plus ou moins spécialisées, et ont des taux d'erreurs plus ou moins importants. Certaines possèdent également des fonctions permettant la correction. Les erreurs de copies vont du mésappariement (qui est reconnu par un mécanisme de correction spécifique) à la délétion et l’insertion de bases, en particulier dans les régions comprenant des motifs répétés.
Mutagènes
Certains types de rayonnements (ultraviolets, rayons gamma…), ainsi que certains composés chimiques (en particulier les espèces réactives de l’oxygène), peuvent provoquer diverses modifications dans les brins d'ADN. La quantité de dégâts causés par des facteurs externes ou dus au fonctionnement de la cellule (liés au métabolisme, entre autres) n’est pas triviale, et des chiffres allant de mille à un million de lésions par cellule et par jour ont été avancés.
Correction, réparation
Il existe de multiples mécanismes au niveau cellulaire qui assurent d’une part la correction lors de la copie du brin d’ADN, et d’autre part la réparation de l’ADN endommagé. L'efficacité des mécanismes de correction est dépendante du mécanisme impliqué, du compartiment cellulaire (nucléaire, mitochondrial ou chloroplastique), du type de cellules et de l'organisme. Les mécanismes de correction sont également dépendants du type de dommage. Certaines modifications sont spécifiques d’un seul type de bases (formation de dimères de thymidine après irradiation), d’autres touchent l’intégrité du brin d’ADN (ruptures simple et double brin). Par exemple, les bactéries corrigent les erreurs dans leur ADN en repérant et en corrigeant les mésappariements de bases dans la double hélice d’ADN recombinant. On sait expérimentalement que les gènes bactériens impliqués dans la réparation des mésappariements d’ADN, lorsqu’ils sont mutés, provoquent des déficiences dans le système de réparation, et donc de véritables bouffées de mutations dans les génomes bactériens, avec pour conséquence une accélération du taux d’évolution de l’ADN. Cet état est délétère pour beaucoup de bactéries mais permet la présence d’une plus grande variabilité parmi celles qui restent, et donc potentiellement d’une plus grande adaptabilité.
Les modifications touchant plus de quelques nucléotides
Cependant, il existe d’autres types de modifications qui peuvent entraîner la modification de plusieurs dizaines ou centaines de paires de bases, voire de chromosomes entiers. Pour la plupart d’entre eux, il n’y a pas de mécanisme permettant le retour à l’état initial.
Éléments mobiles et rétrovirus
Une part appréciable des génomes est composée d’éléments mobiles (ou éléments transposables). Bien que ces éléments aient été longtemps considérés comme de l’ADN « poubelle », et bien que la majorité des copies de ces éléments n’aient probablement aucun rôle dans le fonctionnement cellulaire, plusieurs exemples sont maintenant connus de protéines impliquées dans diverses fonctions indispensables qui sont dérivées de protéines codées par des éléments mobiles ou des rétrovirus.
Il existe plusieurs types d’éléments mobiles. Certains se déplacent par un mécanisme d’excision/réinsertion (éléments à ADN), tandis que d’autres sont transcrits en ARN, puis subissent une transcription inverse en ADN, la copie étant ensuite réinsérée ailleurs dans le génome (rétroéléments). Leur longueur va de 80 bases à plusieurs milliers. C’est leur excision (pour les éléments à ADN), et insertion (pour tous) qui causent des modifications importantes sur le génome.
Plusieurs types et groupes d’éléments mobiles ont été observés chez la plupart des eucaryotes. Dans certaines espèces, bien que d’autres éléments mobiles soient présents, une proportion notable du génome est occupée par un même type d’élément (généralement un rétroélément) : 10 % du génome de Danio rerio, le poisson-zèbre, sont constitués d’un rétroélément appelé DANA, et le génome humain comporte également plus de 500 000 rétroéléments Alu. Il a été évalué que les insertions d’éléments Alu, à elles seules, sont responsables de 0,1 % des maladies génétiques humaines, et qu’il se produit en moyenne une nouvelle insertion toutes les 200 naissances (voir Deininger & Batzer 1999, texte intégral en anglais).
Recombinaison, duplications, transpositions
En plus des crossing-over inégaux qui peuvent produire des délétions et des duplications, parfois de grande taille, d’autres mécanismes, tels les recombinaisons entre séquences qui se ressemblent (par exemple des éléments mobiles, présents en un grand nombre de copies semblables) peuvent produire des délétions, des duplications ou des inversions sur des régions entières. De plus, des séquences se trouvant près d’éléments mobiles peuvent être entraînés lors de la transposition, et des fragments d’exons ou des exons entiers peuvent être ainsi dupliqués et insérés ailleurs dans le génome.
L’impact des mutations
Le taux très élevé de mutations et autres événements modifiant les séquences peut sembler présenter un danger constant et important pour les êtres vivants. De fait, il est beaucoup plus facile d'introduire dans une séquence une modification qui en supprimera ou en modifiera la fonction qu'une mutation qui l'améliorerait. Mais il faut tenir compte ici d’un grand nombre de facteurs pour évaluer l’impact réel.
La transmission des modifications : la séparation soma-germen
L’un de ces éléments est la séparation des lignées cellulaires somatiques et germinales. L’hypothèse de la transmission des caractères acquis était relativement largement acceptée jusqu’à la fin du XIXe siècle (y compris par Charles Darwin). Bien que soutenant au début l’hérédité des caractères acquis, le biologiste allemand F. L. A. Weismann (1834-1914) proposa par la suite (1883) l’hypothèse de l’existence d’un plasma germinatif. Cette hypothèse, telle qu’elle avait été formulée à l’époque, a été réfutée depuis. Mais le concept de séparation dès les stades embryonnaires précoces d’une lignée de cellules qui conduira aux cellules germinales, et des lignées qui conduiront aux autres cellules de l’individu est un concept important de la biologie contemporaine. Cette séparation implique que seuls les changements se produisant dans les cellules de la lignée germinale peuvent être transmis à la descendance (notons toutefois en exergue que des changements comportementaux sont aussi héritables par voie culturelle et non génétique).
Ce fait est loin d’être sans conséquence. Le nombre de divisions cellulaires menant des précurseurs des cellules germinales aux gamètes est faible par rapport au nombre conduisant aux cellules somatiques. Le nombre de générations de cellules étant limité, le nombre d'erreurs de copies est également limité (mais non nul).
Dans la suite de ce texte, nous nous intéresserons seulement aux mutations qui touchent la lignée germinale, puisque ce sont les seuls changements génétiques qui peuvent être transmis à la descendance.
L’importance de la localisation de la modification
L’impact de la mutation/modification (si elle n’a pas été corrigée) sur l’organisme qui se développera à partir de la cellule germinale touchée dépend de la nature du changement d’acide aminé codé (les mutations ne provoquant pas de changement dans l’acide aminé n’ont pas d’effet), et de la région touchée à l’intérieur de la protéine. L’effet d’une mutation peut s’étendre à toute la protéine, modifiant sa séquence (par exemple lorsqu’une insertion ou une délétion provoquent un décalage du cadre de lecture, que la mutation génère ou supprime un codon stop, ou qu’elle modifie un site impliqué dans l’épissage de l’ARN, Figure 5), ou sa forme finale (suppression ou introduction d’un acide aminé qui interagit avec d’autres). D’autre part, des mutations dans les régions non codantes, mais impliquées dans le contrôle du site et du moment de l’expression d’un gène peuvent avoir des effets majeurs.
De nombreux éléments à prendre en compte
Mais il faut tenir compte d’autres éléments pour évaluer l’impact réel sur l'individu qui porte les mutations.
- 98% du génome humain n'est pas codant. Même en ajoutant à cela les séquences non codantes, mais importantes pour l'expression des gènes, ainsi que les séquences ribosomiques, plus de 90% du génome n'a pas de fonction connue, et une grande partie est probablement composée de débris d'éléments transposables, et de microsatellites. Les modifications se produisant dans ces régions ajoutent à la variabilité, mais n'ont pas d'influence sur le phénotype et la valeur sélective.
- Le code génétique est redondant, certains acides aminés pouvant être codés par plusieurs codons différents. Une mutation qui ne change pas l'acide aminé codé (mutation synonyme) ne provoque aucune modification dans la ou les protéines produites, et n'a donc de nouveau aucune influence.
- Lorsque la mutation est non synonyme, cela ne signifie pas pour autant que le fonctionnement de la protéine est modifié. Souvent, seules certaines parties de la molécule ne supportent aucun changement, tandis que les autres parties peuvent supporter le remplacement d'un acide aminé par un autre, en général à condition que les propriétés physiques (taille, forme) et chimiques de celui-ci ne soient pas trop différentes de celui qui était présent à l'origine. C'est ce qu'on observe en comparant des protéines homologues entre espèces. Il y a des différences entre les séquences protéiques, mais les protéines sont fonctionnelles, et souvent leur taux d'activité et fonctionnement sont très semblables.
- Dans un certain nombre de cas, il suffit d’une seule copie fonctionnelle du gène pour que la fonction soit tout de même assurée, partiellement ou dans son entier. Les hétérozygotes porteurs d’un allèle avec une modification qui serait théoriquement létale peuvent n’être pas ou très peu affectés, et seuls les homozygotes seront contre-sélectionnés. Des allèles comportant des mutations à effet très négatif peuvent ainsi se maintenir dans les populations, « sous le radar » de la sélection naturelle, qui agit sur les phénotypes uniquement.
- De nombreuses mutations non synonymes voient probablement leurs effets compensés par des mécanismes du type canalisation. Très schématiquement, il existe des protéines (protéines chaperons) dont le rôle est d'assurer l'acquisition de la bonne conformation d'autres protéines même si la séquence de celles-ci est modifiée.
- De nombreuses voies métaboliques comprennent des redondances, de sorte qu’une inactivation complète de la protéine codée par un gène peut ne provoquer aucun changement notable dans le fonctionnement de l'organisme touché. De même, lorsqu'un gène a été dupliqué, la modification même radicale de l'une des copies ne provoquera aucun désagrément à l'organisme, puisqu’il existe une deuxième copie fonctionnelle.
Tous ces éléments font qu'une proportion importante des mutations et modifications sont neutres (pas d’effet sur la valeur sélective des individus). Cela explique une certaine stabilité de l’espèce au cours du temps. Les mutations qui « parviennent » à passer et à avoir des effets constitueront le « carburant » de l’évolution.
Acquisition de nouveauté génétique
Il faut garder ici à l'esprit que ces changements se produisent sur de très grandes durées, de très grands nombres de groupes et d'individus, et que les génomes eux-mêmes sont de grande taille. Il est donc question de milliards d'altérations, duplications, mutations.
La redondance permet le changement
Ainsi que cela a été évoqué plus haut, l’un des moyens de diminuer l’impact potentiellement néfaste des mutations sur l’organisme est la redondance, que ce soit par le nombre de copies (diploïdie tout d'abord, mais également duplications) ou par la présence de plusieurs voies pour produire un produit d’importance vitale
Cette redondance permet que l’une des voies ou des copies subisse des modifications sans que cela ne soit préjudiciable à l’organisme. Si dans une grande majorité des cas, étant donné que les mutations sont aléatoires, cela conduit à l’inactivation de l’une des copies, il arrive que certaines copies surnuméraires acquièrent au fil du temps de nouvelles propriétés, et parfois une nouvelle et importante fonction dans l’organisme.
La plupart des gènes dans le génome humain font ainsi partie de familles multigéniques, et résultent de la divergence plus ou moins ancienne de copies d'une seule séquence ancestrale.
Modularité des gènes
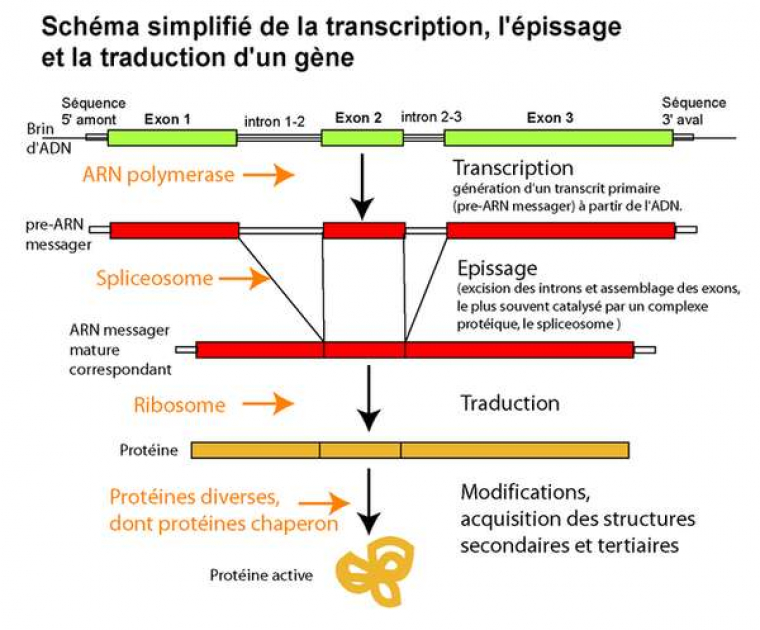
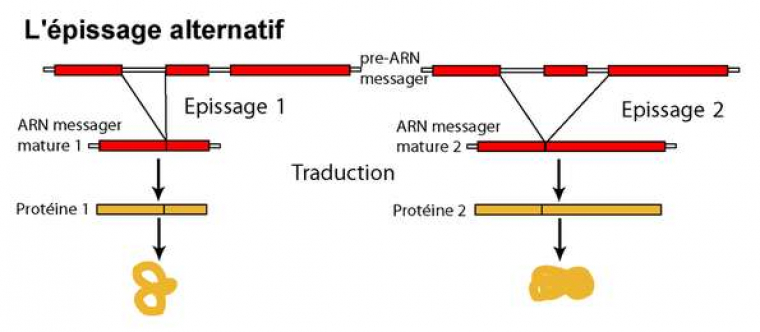
La plupart des gènes chez les eucaryotes présentent des introns : des parties de la séquence qui seront éliminés après la transcription, mais avant la traduction (voir figure introns-exons). Ces régions ne se retrouvent donc pas dans la protéine obtenue. Chez les vertébrés, la plupart des exons a une longueur comprise entre 50 et 400 bases, certains peuvent en faire plusieurs milliers. De même, la longueur des introns varie entre quelques dizaines et plusieurs dizaines de milliers de bases, et peut être très variable même entre espèces proches. Le nombre d’exons et d’introns peut varier d’une espèce à l’autre pour des protéines homologues. Par exemple, le gène MLL4 présente 53 exons chez le fugu Takifugu rubripes mais 41 chez une autre espèce de la même famille, Tetraodon nigroviridis, et 51 chez le poisson-zèbre Danio rerio, beaucoup plus éloigné phylogénétiquement (source : ENSEMBL V37). Dans ce cas, il est possible de faire correspondre (aligner) les séquences sur la majeure partie de leur longueur : ce sont simplement le nombre et la position des interruptions qui changent. Mais cette organisation des gènes en « modules » permet dans certains cas de produire plusieurs produits à partir d’un seul gène, en fonction des exons qui sont assemblés au final (c'est l'épissage alternatif, voir Figure 6), tous n’étant pas inclus dans tous les produits. Les ARN messagers issus du gène Dmrt8, par exemple, sont présents en plusieurs variantes dont la présence varie selon les organes testés chez la souris : certains comportent les exons 1 à 7, d’autres un exon alternatif 3’ et les exons 4 à 8...
D’autre part, cette modularité est favorable à la création de nouveaux gènes à partir d’une juxtaposition d’exons de gènes existants, ainsi qu’à l’acquisition de nouvelles fonctions en déplaçant les sites de reconnaissance de début ou de fin des introns.
À partir d'un même transcrit primaire, plusieurs ARNm matures différents peuvent être obtenus par des combinaisons variables des différents exons possibles.
Non codant ne signifie pas sans importance : les régions régulatrices
Les gènes ne sont pas les seules unités importantes du génome. Il existe de nombreuses portions de séquences non codantes qui sont conservées entre des organismes parfois très éloignés, et qui sont indispensables au fonctionnement ou au développement des individus : les séquences régulatrices. Celles-ci peuvent se trouver en amont ou en aval du gène lui-même, parfois jusqu’à plusieurs milliers de bases de distance. Ces séquences sont des sites qui permettent la fixation de protéines spécifiques, qui peuvent bloquer ou au contraire permettre la transcription du gène. Il existe ainsi des cascades de régulation où les produits de certains gènes agissent sur l’expression d’autres gènes, qui à leur tour influencent l’expression d’autres gènes… Certaines protéines régulatrices ne se fixent pas directement sur l’ADN, mais sur d’autres protéines, qui peuvent interagir directement avec l’ADN, ou avec encore d’autres protéines…
Ces interactions complexes sont soumises à une régulation très fine, permettant de déterminer dans quel type de cellules, quelle région du corps, et à quel stade du développement certains gènes sont exprimés. Un changement, même léger, dans une telle cascade, par une modification sur une séquence régulatrice par exemple, peut avoir des conséquences importantes sur l’organisme.
La mise en place d’une nouvelle région régulatrice pour un gène peut se faire sans modifications à celles qui étaient précédemment en place, et donc sans nuire à leur fonctionnement.
De nombreux chercheurs pensent que ce type de modifications est l’une des clés pour comprendre la diversité de forme des organismes. C’est l’une des pistes privilégiées pour la compréhension des différences entre les humains et les chimpanzés, maintenant que le génome entier est disponible et peut être comparé pour ces deux espèces et des groupes externes.
Brassage génétique et recombinaison chez les organismes sexués
Enfin, il est nécessaire d’évoquer les processus de brassage génétique aléatoire, qui produisent une grande diversité de génotypes dans la descendance, par combinaison originale des allèles : brassage intrachromosomique par crossing-over, et brassage interchromosomique lors de la distribution des chromosomes homologues durant la meïose, et combinaison originale de deux des gamètes en un œuf. S'il est impossible de prédire le résultat d'un brassage génétique particulier, ces événements sont soumis à des lois probabilistes qui permettent de faire des prédictions quantifiées lorsqu'il s'agit d'un très grand nombre de descendants. Chaque reproduction crée ainsi un environnement génomique original, dans lequel vont être exprimés les différents allèles. La modélisation de ces interactions n'est pas encore entièrement maîtrisée, du fait de la complexité des interactions et du nombre d'éléments qui interviennent.