Dernière représentante de la sous-tribu des hominines, notre espèce, Homo sapiens, est l’objet de nombreux débats touchant à son origine, sa définition, sa diversité et ses relations avec les autres taxons d’hominines plus anciens ou contemporains. À travers la revue des données paléoanthropologiques et génétiques dont nous disposons actuellement, il est possible de discuter du degré de parenté et d’interaction durant le Pléistocène moyen et supérieur entre les différents représentants de notre espèce et leurs contemporains eurasiatiques dont font partie, entre autres, les Néandertaliens et les Dénisoviens.
Données paléoanthropologiques
Les débats sur l’origine d’Homo sapiens, sa diversité passée et ses niveaux d’interaction avec ses contemporains durant le Pléistocène moyen (781 – 126 ka) et supérieur (126 – 11 ka) pourraient se résumer en une question : quel était le degré d’isolement entre les différentes populations d’hominines1 fossiles depuis la première sortie d’Afrique connue, aux alentours de 1,8 Ma [1-2], jusqu’à l’apparition des premiers représentants de notre espèce ? En d’autres termes, existait-il un flux génétique constant entre les premiers représentants du genre Homo ou étaient-ils assez isolés géographiquement pour que ces groupes humains soient sujets à des phénomènes de spéciation ?
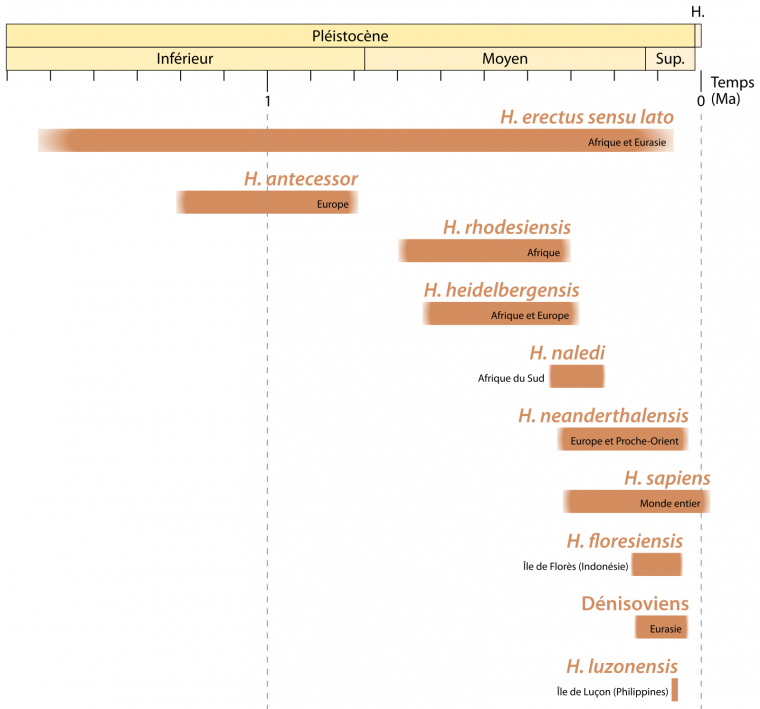
À la fin du Pléistocène inférieur (c’est-à-dire vers 800 ka), une grande partie du monde, à l’exception des Amériques et de l’Océanie, est peuplée de groupes humains associés à des espèces paléontologiques différentes. Il y a notamment Homo erectus en Asie [3-4], Homo antecessor en Europe [5], ou encore Homo ergaster en Afrique [6-7]. La distinction entre ces taxons est basée sur des critères géographiques et morphologiques, comme l’expression de certains traits dérivés – par exemple la crête sagittale chez Homo erectus ou la rétention d’une morphologie juvénile de la face chez Homo antecessor [4]. Les fossiles africains primitifs ne présentant aucune des autapomorphies des H. erectus asiatiques sont quant à eux définis comme appartenant à l’espèce H. ergaster. Cependant, certains auteurs considèrent que ces deux taxons africains et asiatiques ne présentent pas assez de différences pour être considérés comme des espèces distinctes et utilisent dès lors le terme Homo erectus sensu lato pour les regrouper (Figure 1) [9].
Seules les espèces mentionnées dans l'article sont figurées. D'autres espèces du genre Homo ont existé, notamment à des périodes plus anciennes (H. rudolfensis, H. habilis...). Les données utilisées proviennent d'une figure de Sandrine Prat, à laquelle ont été ajoutées les espèces H. rhodesiensis et H. luzonensis.
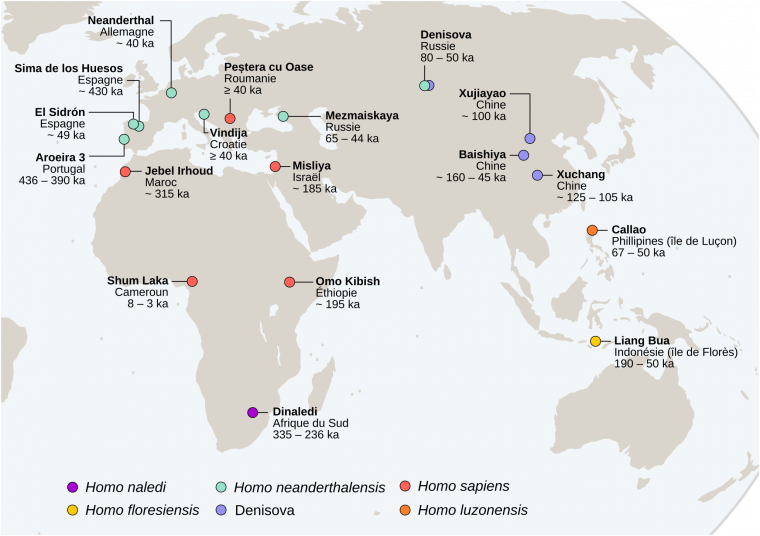
Les sites présentés correspondent à ceux évoqués dans le texte et ne correspondent bien entendu pas à une cartographie exhaustive des sites associés à des fossiles du genre Homo. Le fond de carte provient du site Khartis.
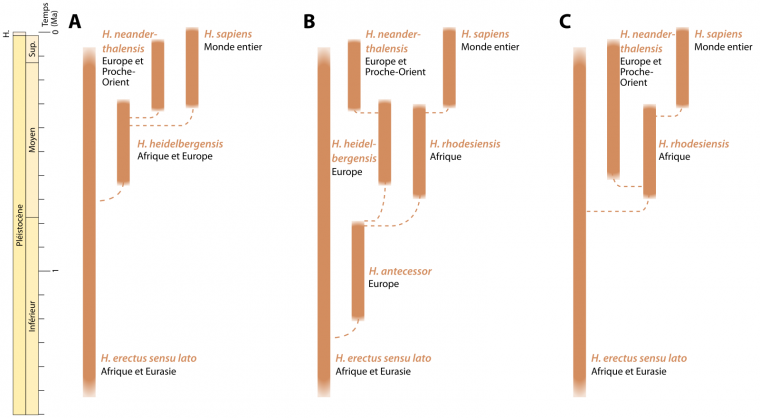
La pauvreté du registre fossile durant une grande partie du Pléistocène moyen (781 – 126 ka), et la diversité phénotypique caractérisant les spécimens de cette période sont à l’origine de l’introduction de nouveaux taxons dont les relations avec les espèces plus anciennes ou postérieures sont sujettes à débat, comme en témoigne la diversité des hypothèses exprimées dans la Figure 3 [10].
Les barres pleines représentent la durée d'existence estimée pour chaque taxon (date de première et dernière apparition). Les lignes tiretées indiquent les liens probables des ancêtres avec les descendants (voir à ce sujet l'encadré Définition et classification des espèces fossiles).
A. Scénario identifiant Homo heidelbergensis comme descendant d’Homo erectus. Après s’être largement répandu en Afrique et en Eurasie occidentale au début du Pléistocène moyen, Homo heidelbergensis serait l’ancêtre des Néandertaliens européens et des Homo sapiens.
B. Interprétation selon laquelle Homo antecessor serait le descendant d’Homo erectus. À son tour, Homo antecessor aurait évolué en Homo heidelbergensis en Europe pour ensuite donner Néandertal, et en Homo rhodesiensis en Afrique, ancêtre d’Homo sapiens. Cette hypothèse souffre cependant du fait que les seuls fossiles d’Homo antecessor connus à ce jour sont européens.
C. Hypothèse dans laquelle Homo rhodesiensis serait l’espèce à partir de laquelle tous les hominines ultérieurs auraient évolué. En Europe, une lignée de Néandertal pourrait être reconnue au début du Pléistocène moyen, alors qu’en Afrique, Homo rhodesiensis serait l’ancêtre des Homo sapiens.
Définition et classification des espèces fossiles
Les paléoanthropologues travaillent notamment à partir de restes fossiles, souvent fragmentaires (pour certains spécimens, seul un crâne, une mandibule ou une dent sont retrouvés…) et ayant des âges variés. Une des questions qui se pose est de savoir comment assigner ces restes fossiles à une espèce donnée. La réponse est délicate car une espèce fossile est définie sur un certain intervalle de temps, au cours duquel de nombreux caractères des populations formant cette espèce évoluent, non pas de manière discrète, mais de façon continue. Les bornes fixées pour définir telle ou telle espèce contiennent donc nécessairement une part d’arbitraire. Ainsi, certains scientifiques différencieront deux espèces là où d’autres n’en verront qu’une. C’est parce que tous les paléoanthropologues ne s’accordent pas sur la définition des espèces fossiles que différents scénarios, incluant un nombre variable d’espèces, sont présentés sur la figure 3.
Une seconde difficulté consiste à établir les relations de parenté entre espèces fossiles. Alors que la cladistique ne permet que de répondre à la question « qui est plus proche de qui ? », il est courant en paléoanthropologie de fournir des représentations où une espèce fossile est l’ancêtre d’une ou plusieurs autres espèces (voir figure 3). Si de telles relations d’ancêtres à descendants sont en réalité inaccessibles par des analyses phylogénétiques, elles constituent des hypothèses de travail fréquemment employées en paléoanthropologie.
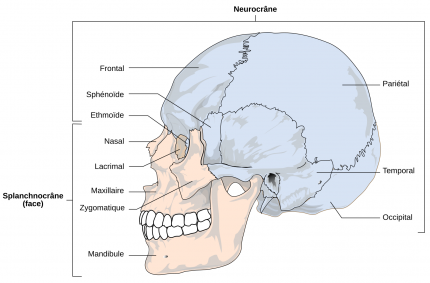
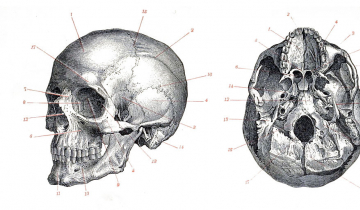
Le crâne des Vertébrés est composé d’un neurocrâne (en bleu), qui protège l’encéphale et les organes sensoriels pairs et d’un splanchnocrâne (en orange) situé autour des cavités buccale et pharyngienne.
Les taxons du Pléistocène moyen se différencient des fossiles plus anciens par l’augmentation de leur capacité crânienne et de la longueur de la face (splanchnocrâne, voir Figure 4), ainsi que par la diminution de l’angulation de l’occipital, c’est-à-dire de l’angle formé par les deux parties de cet os que sont le plan occipital et le plan nuchal [9]. Nommés Homo heidelbergensis en Europe ou Homo rhodesiensis en Afrique, ou considérés par certains comme un seul taxon afro-européen1 [11], ces spécimens possèdent tous un torus supraorbitaire (ou bourrelet susorbitaire) continu, un os frontal plat et fuyant et une face longue et massive projetée antérieurement par rapport au neurocrâne [10]. Parmi ces fossiles, certains comme ceux de Sima de los Huesos en Espagne (datés d’environ 430 ka, [12]) pourraient déjà appartenir à la lignée menant aux Néandertaliens vu la présence de certains traits dérivés propres à ces derniers (par exemple l’espace rétromolaire2 sur les mandibules ; [12]) ; quand d’autres, comme le crâne d’Aroeira 3 au Portugal, daté de la même période (entre 436 et 390 ka), ne présentent aucun de ces traits dérivés [14]. Enfin, en Afrique du Sud, une dernière espèce fossile, Homo naledi, est documentée entre environ 335 et 236 ka dans la grotte de Rising Star. Les milliers de restes humains découverts à cet endroit présentent des traits ancestraux qui les rapprochent des premiers représentants du genre Homo, voire des Australopithèques, ce qui contraste avec leur âge géologique [15-16]. La diversité phénotypique des hominines du Pléistocène moyen, dont la variation inter et intrataxons est difficile à cerner à travers les archives fossiles disparates dont nous disposons, pourrait témoigner de dynamiques de peuplement complexes incluant des remplacements, des isolements et/ou des mélanges de populations diverses [14].
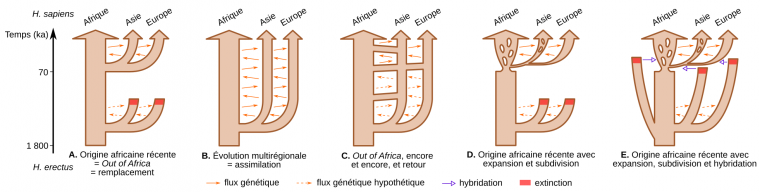
Dès lors, la transition vers les premiers représentants d’Homo sapiens en Afrique et la caractérisation des populations eurasiatiques de la fin du Pléistocène moyen (~300 à 126 ka) restent assez floues. Cet état de fait est à l’origine du développement de deux modèles distincts pour expliquer l’origine d’Homo sapiens : la théorie de remplacement « Out-of-Africa » et la théorie de continuité « multirégionale » [17-18]. Ces modèles se déclinent selon différentes variantes en fonction du niveau d’isolement ou de flux génique supposés entre les taxons (Figure 5) [19].
A. Modèle de l’origine africaine récente (également appelé Out of Africa ou remplacement). Les flèches oranges tiretées indiquent un flux génétique putatif entre les populations d’Homo erectus de différents continents, dont l’effet aurait été effacé par le remplacement de ces populations archaïques par Homo sapiens lors de sa dernière sortie d’Afrique. Les flèches oranges pleines indiquent un flux génétique continu entre les continents. La taille des flèches menant à l’Europe et à l’Asie est volontairement plus petite pour indiquer un ou des goulots d’étranglement potentiels au moment de quitter l’Afrique.
B. Modèle de l’évolution multirégionale (assimilation). Dans ce modèle, les pools génétiques africains, européens et asiatiques auraient divergé au Pléistocène moyen mais seraient restés connectés par un flux génétique continu entre les populations des différents continents. Ce modèle s’oppose à l’hypothèse d’un remplacement complet des descendants eurasiatiques de H. erectus par Homo sapiens.
C. Représentation schématique de l’hypothèse d’Alan Templeton de l’évolution humaine qui comprend une série de grandes migrations hors d’Afrique, une importante migration récente vers l’Afrique depuis l’Asie et un flux génétique continu mais restreint entre les continents. Les flèches tiretées sont des échanges génétiques hypothétiques entre les continents qui se seraient produits avant les dernières grandes migrations hors d’Afrique. Bien que cette hypothèse rejette également l’idée d’un remplacement complet des descendants eurasiatiques de H. erectus par H. sapiens, elle souligne l’importance des récentes grandes migrations hors d’Afrique.
D. Le modèle d’origine africaine récente avec subdivision de la population à l’intérieur des continents et taux d’expansion variable. Dans cette hypothèse, les Homo sapiens auraient émergé de l’une des subdivisions existant en Afrique, et se seraient répandus en Asie après un goulot d’étranglement. L’Europe aurait été colonisée plus tard depuis l’Asie occidentale. La subdivision des flèches marrons représente celle des populations en sous-populations au sein des continents. Cette hypothèse suggère un remplacement complet des descendants eurasiatiques de H. erectus par les Homo sapiens sur les trois continents. Il diffère également du modèle simple de l’origine africaine récente (voir sous-figure A) en soulignant l’importance des subdivisions internes et dynamiques au sein des continents, et la colonisation progressive du monde par une série d’expansion des aires de répartition à partir d’endroits géographiquement restreints mais inconnus.
E. Représentation schématique du modèle d’hybridation. Selon cette dernière hypothèse, basée sur le modèle d’origine africaine récente, des évènements d’hybridation avec les populations archaïques descendants des H. erectus eurasiatiques auraient eu lieu hors d’Afrique avant la disparition de ces taxons plus anciens.
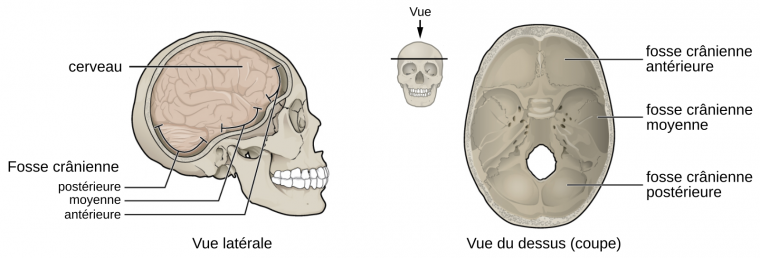
Ces débats taxonomiques et phylogénétiques sont également liés au fait qu’il n’existe pas d’holotype1 pour définir l’espèce Homo sapiens [20]. La première définition anatomique est associée à la description des fossiles d’Omo Kibish (découverts en 1967 en Éthiopie), dont un des individus, Omo Kibish 1, était considéré à cette époque comme le plus ancien représentant de notre espèce [21]. Les critères morphologiques principaux pour définir Homo sapiens sont la présence d’un menton, l’absence de torus supraorbitaire continu, et une série de caractéristiques craniométriques associées à un neurocrâne plus globuleux (Figure 4). Cet inventaire de traits a ensuite été intégré à la définition des deux autapomorphies caractérisant les différences de conformations crâniennes entre les représentants d’Homo sapiens actuels et anciens, et les spécimens archaïques, à savoir la sphéricité du neurocrâne et la rétraction faciale, c’est-à-dire le recul de la face en direction du neurocrâne [22]. Ces traits semblent apparaître de façon très précoce durant l’ontogenèse et seraient liés à un changement combiné de l’angle de la base du crâne, des dimensions et de l’orientation des fosses crâniennes antérieure et moyenne (Figure 6), et de la longueur de la face [9, 23-24].
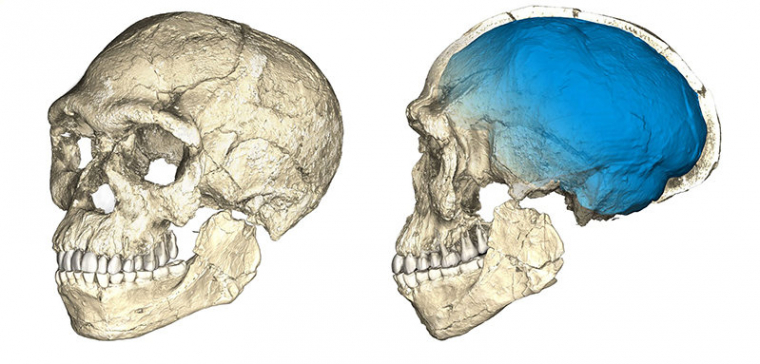
Ces définitions sont basées sur des référentiels actuels et quelques individus fossiles du Pléistocène supérieur, mais leur application au registre fossile plus ancien, souvent fragmentaire, ne permet cependant pas toujours une identification claire des plus anciens représentants de notre espèce. Parmi ceux-ci, les fossiles de Jebel Irhoud (~315 ka) retrouvés au Maroc présentent une combinaison de traits archaïques et dérivés (la face est décrite comme courte et rétractée sous le neurocrâne, alors que ce dernier conserve une conformation allongée plutôt que globulaire) qui documenteraient les premiers stades du clade Homo sapiens (Figure 7) [25]. Si l’identification des plus anciens représentants de notre espèce reste un défi, leur origine africaine fait peu débat [26].
Reconstruction d'un crâne à partir de plusieurs fragments fossiles datés à environ 315 ka et retrouvés à Jebel Irhoud (Maroc). Ce crâne présente à la fois des caractéristiques modernes (face courte et rétractée sous le neurocrâne) et archaïques (neurocrâne allongé plutôt que globulaire).
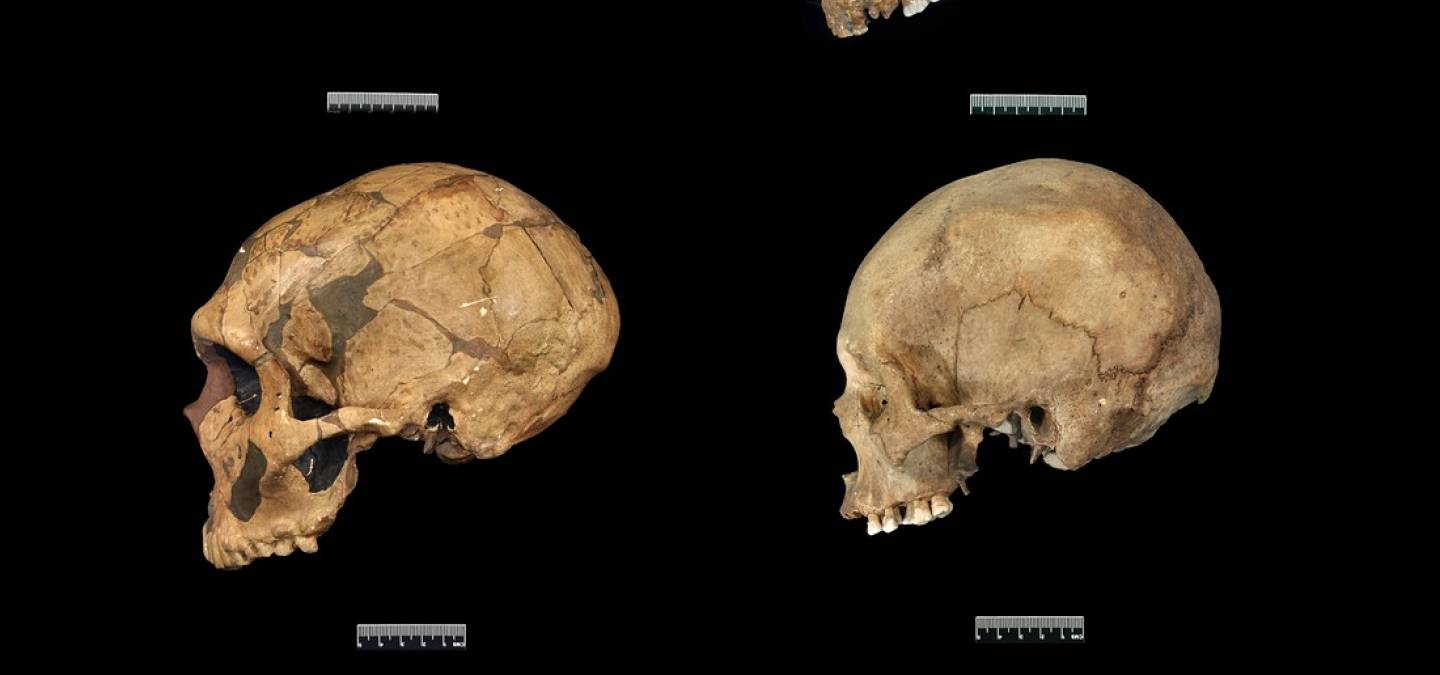
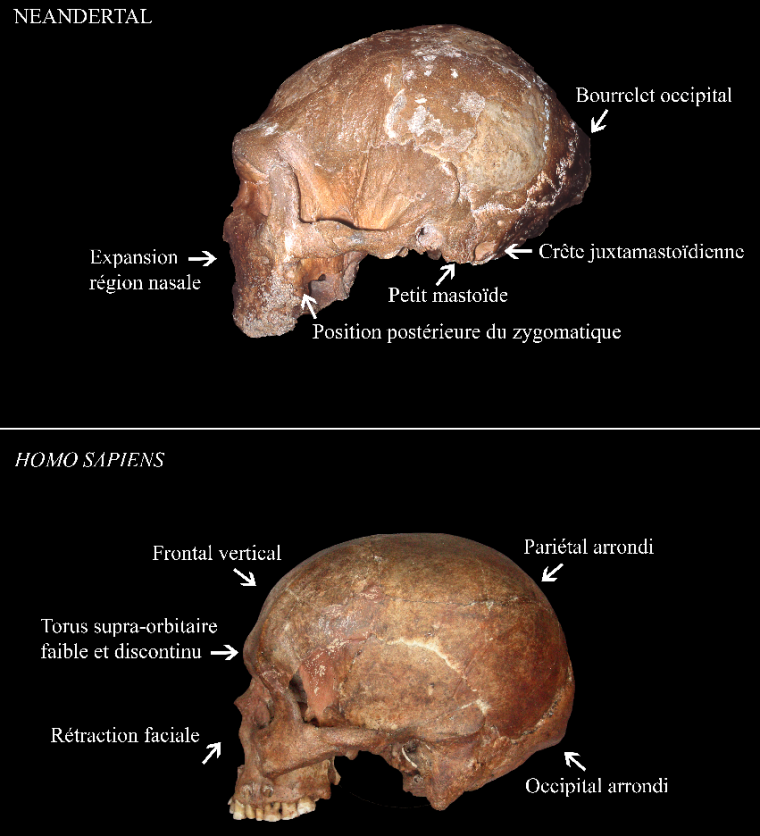
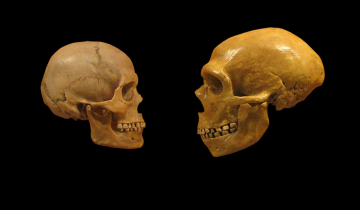
Ensuite, vers 200 ka la présence d’Homo sapiens est attestée aux abords du continent africain dans la grotte de Misliya en Israël [27]. Cette découverte suggère que des dispersions anciennes d’Homo sapiens hors d’Afrique ont pu avoir lieu avant la plus récente et la mieux documentée située entre 80 et 50 ka [28-32]. À cette époque l’Eurasie est peuplée d’autres groupes humains dits « archaïques », c’est-à-dire ne présentant pas les autapomorphies d’Homo sapiens. Il s’agit des Néandertaliens en Eurasie [33], de populations d’hominines archaïques dits « tardifs1 » en Asie [34-36], d’Homo floresiensis en Indonésie [37] et, découvert plus récemment, d’Homo luzonensis aux Philippines (Figures 1 et 2) [38]. Les Néandertaliens, s’ils conservent une conformation crânienne plésiomorphe (par exemple une voûte crânienne longue et basse, une absence de menton, etc.), présentent également une série de traits dérivés au niveau du crâne, des dents et du squelette appendiculaire qui les distinguent à la fois des spécimens archaïques asiatiques contemporains et des Homo sapiens (Figure 8) [9, 39-42]. À cet égard, leur identification en tant qu’espèce paléontologique distincte au sein du genre Homo, Homo neanderthalensis, se justifie [43].
D’après [9]. Photographie du crâne de Guattari (en haut) par Erik Trinkaus et du crâne d'Homo sapiens (en bas) par Isabelle Crevecoeur.
Le degré d’interaction des populations d’Homo sapiens arrivant en Europe et en Asie au milieu du Pléistocène supérieur avec les populations archaïques autochtones est difficile à appréhender à partir du registre fossile. Mettre au jour un individu hybride de première génération relèverait d’un incroyable coup de chance mais constituerait une découverte riche en enseignements. En effet, nous n’avons actuellement aucune donnée nous permettant d’anticiper la polarité d’expression des caractères morphologiques sur un hybride, si tant est qu’un squelette complet ait pu être préservé pour cette période charnière. Si l’hypothèse d’un croisement avec Néandertal a été avancée pour expliquer la morphologie de la mandibule de Peştera cu Oase 1 (≥ ~40 ka, Roumanie, [44]), ce sont maintenant les données génétiques qui permettent de confirmer cette hypothèse [45] et qui apportent à plus large échelle les informations nécessaires à la discussion des relations phylogénétiques entre ces groupes humains.
Diversité génétique actuelle
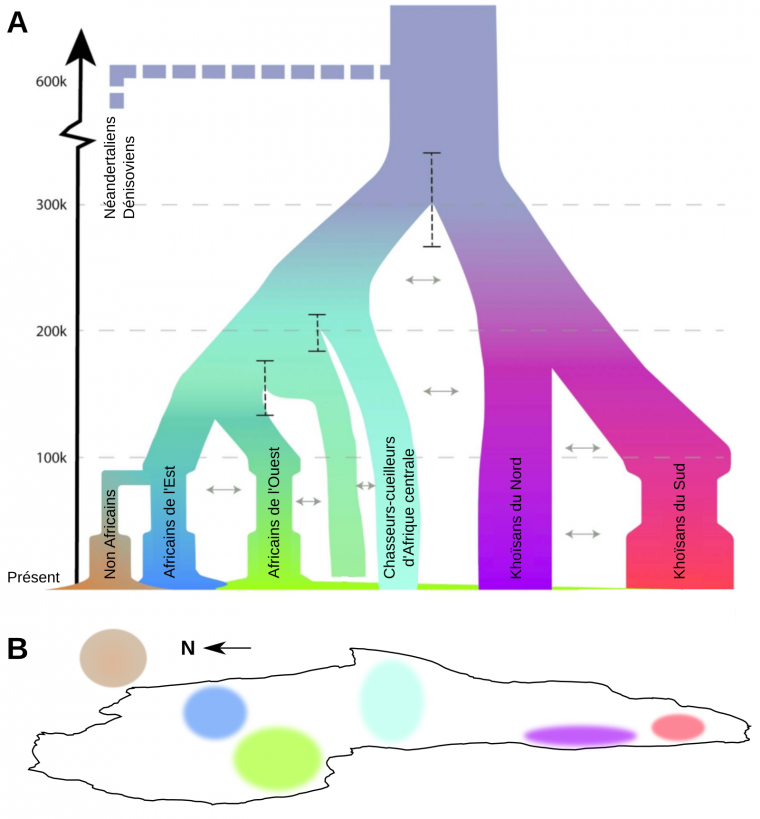
Que ce soit à travers l’étude de l’ADN mitochondrial, du chromosome Y ou du génome nucléaire complet des individus, les études génétiques menées sur les populations actuelles ont permis de montrer que la diversité génétique était plus grande en Afrique que dans le reste du monde, et qu’elle avait une origine récente sur ce même continent, soutenant dès lors le modèle « Out-of-Africa » [46-47]. Cette origine commune se situerait en Afrique entre 350 et 250 ka. Il s’ensuivit une première phase de diversification durant la fin du Pléistocène moyen et le début du Pléistocène supérieur au sein du continent africain avant que les ancêtres des populations actuelles d’Homo sapiens ne migrent sur les autres continents1 [47]. Au sein des populations africaines actuelles, les Khoïsans d’Afrique du Sud présentent la plus grande diversité génétique. Ils sont les représentants des lignées les plus divergentes par rapport aux autres populations actuelles dont ils se sont séparés il y a près de 200 ka, ce qui suggère une sous-structuration ancienne des populations d’Homo sapiens au sein du continent africain (Figure 9) [48-49]. En outre, les données génétiques actuelles témoignent d’une réduction de la diversité génétique des populations passées à partir de 100 ka, peut-être en lien avec les changements climatiques de la dernière période glaciaire [49]. Cette réduction de la diversité est surtout marquée au sein des populations humaines actuelles non-africaines. L’origine de ce goulot d’étranglement daté à partir d’environ 80 à 70 ka serait en lien avec la dernière sortie d’Afrique d’Homo sapiens à l’origine de la diversité des populations humaines actuelles non-africaines [50-52].
A. Les divergences entre les différentes populations africaines sont représentées par différentes branches colorées. Les lignes tiretés verticales indiquent les intervalles de confiance des périodes de séparation entre populations. La largeur de chaque branche représente la taille de population.
B. Zones occupées par les différentes populations sur une carte de l’Afrique (la flèche indique le Nord).
Données paléogénétiques
Les données génétiques actuelles nous offrent une lecture biaisée de l’histoire évolutive de notre espèce car elles ne nous informent que sur les lignées d’individus qui se sont perpétuées jusqu’à aujourd’hui. Par contre, elles ne donnent aucun renseignement sur les lignées éteintes. Les récentes avancées méthodologiques dans l’analyse de l’ADN ancien des fossiles européens, asiatiques et africains permettent une vision plus complète de l’histoire évolutive de notre espèce et de ses interactions avec les populations archaïques contemporaines. C’est grâce à ces avancées qu’en 2010 une ébauche du génome néandertalien a pu être proposée à partir de l’analyse de trois individus européens (Neanderthal (Feldhofer 2), El Sidron & Vindija ; environ 40-49 ka) et d’un individu eurasiatique (Mezmaiskaya 1 ; environ 60-70 ka) [53], révélant l’existence d’un flux génique des Néandertaliens vers les populations Homo sapiens non africaines (Figure 10). Ces événements de métissages auraient eu lieu entre 80 et 50 ka, au moment de la dernière sortie d’Afrique d’Homo sapiens et seraient responsables de la présence, chez tous les non-Africains, d’une proportion d’ancestralité néandertalienne comprise entre environ 1 et 3 %1 [50, 53-55]. Ce flux génique ancien qui s’est sans doute produit en Asie du Sud-Ouest avant la dispersion des Homo sapiens en Europe et en Asie n’est pas un phénomène isolé.
En effet, d’autres introgressions génétiques2 provenant de populations archaïques ont été détectées grâce au séquençage du génome dénisovien. Actuellement représentés par trois dents, un fragment de phalange de main et une mandibule, les Dénisoviens, cousins des Néandertaliens d’Eurasie, se seraient séparés de la lignée menant à Homo sapiens il y a près de 700 ka, et de celle des Néandertaliens vers 400 ka [54, 59]. De l'ADN dénisovien a été extrait de quelques fossiles de la grotte de Denisova en Sibérie, et plus récemment dans des sédiments du site archéologique de Baishiya sur le plateau tibétain [56-58]. L'étude de cet ADN a montré que les Dénisoviens auraient contribué à la diversité génétique actuelle de certaines populations chinoises et mélanésiennes3 à hauteur de 1 à 4 % [50,57]. La présence des Dénisoviens en Sibérie et sur les plateaux tibétains est attestée depuis le Pléistocène moyen (~160 ka) et pourrait être aussi récente que 45 ka [58,60]. À l’heure actuelle, l’identification des Dénisoviens au sein du registre paléoanthropologique asiatique repose uniquement sur ces critères génétiques. En effet, à ce jour, les rares fossiles identifiés, en plus d’être fragmentaires, ne semblent pas présenter de caractères dérivés propres, et ne partagent pas nécessairement ceux des Néandertaliens [60-61]. La mandibule dénisovienne de Xiahe (Grotte de Baishiya, environ 160 ka) possède notamment une morphologie plésiomorphe caractéristique des hominines du Pléistocène moyen [60]. Des similarités morphologiques existent entre les restes dénisoviens connus jusqu’ici et les fossiles chinois de Xujiayao et Xuchang, dont certains montrent des affinités avec les Néandertaliens sans pour autant présenter la suite de traits dérivés caractéristiques de ces derniers [35,62]. Dans l’attente de confirmation génétique, il est dès lors fort à parier que les fossiles de Xujiayao et Xuchang puissent être attribués aux Dénisoviens et que ces populations soient en fait déjà bien représentées dans le registre fossile chinois du Pléistocène moyen et supérieur [35,60,62].
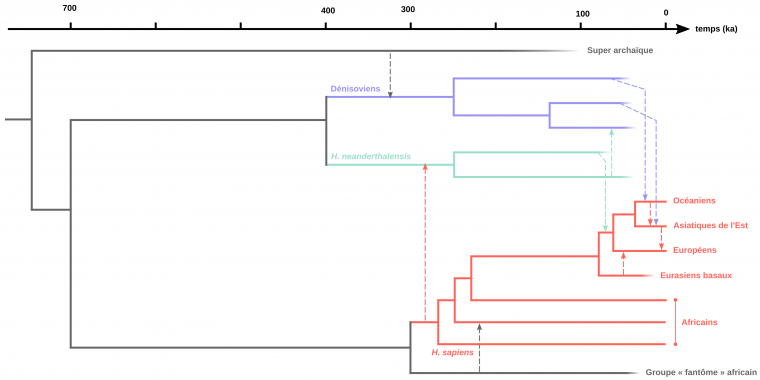
Avec l’augmentation du nombre d’individus néandertaliens et dénisoviens séquencés depuis 2010, les relations phylogénétiques entre ces groupes humains se sont précisées, et ont révélé une certaine complexité (Figure 10). En effet, ces travaux ont notamment mis en évidence l’existence de plusieurs populations néandertaliennes divergentes [55,63-64], de flux géniques anciens entre Néandertaliens et Dénisoviens4 [65] et du remplacement total de l’ADN mitochondrial et du chromosome Y des Néandertaliens par ceux de populations ancestrales à Homo sapiens, entre environ 430 et 270 ka [48,55,59,64]. Ces résultats ont par ailleurs permis de préciser la position phylogénétique de la collection de Sima de los Huesos (Espagne, voir Figure 2), confirmant son statut transitionnel. En effet, l’ADN mitochondrial de ces individus est plus proche des Dénisoviens que des Néandertaliens plus tardifs séquencés à ce jour, alors que leur ADN nucléaire est plus proche des Néandertaliens. Cette population fait donc bien partie des premiers représentants de ce groupe humain, avant que leur ADN mitochondrial n’ait été remplacé [48].
Enfin, les études paléogénomiques ont révélé des flux géniques insoupçonnés avec des populations dites « fantômes » dont nous n’avons pas d’autres traces que celles laissées dans les génomes dénisoviens, néandertaliens et Homo sapiens actuels. Tout d’abord, l’ADN nucléaire dénisovien porte en lui les traces d’un mélange génétique avec une population d’hominines archaïques non identifiée [50,54]. Ensuite, un individu néandertalien de l’Altaï conserve la trace d’un flux génique entre ses ancêtres et une branche d’Homo sapiens qui n’est pas à l’origine des populations actuelles [50]. Ces Homo sapiens auraient divergé de la lignée menant aux populations actuelles et contribué au patrimoine génétique des ancêtres de ce Néandertalien sibérien vers 100 ka [50]. Cette découverte implique que des populations d’Homo sapiens étaient présentes hors d’Afrique avant 80 ka comme le suggère la découverte à Misliya. Ces derniers n’ont cependant pas contribué à la diversité génétique actuelle. Enfin, l’hypothèse de la contribution d’une population fantôme d’hominines archaïques au génome de certaines populations africaines sub-sahariennes est confirmée par l’analyse génomique de quatre enfants fossiles du site de Shum Laka au Cameroun (datés entre 8 et 3 ka ; [66-67]). Ce flux génique se serait produit vers la fin du Pléistocène supérieur (~35 ka) avec une population qui aurait divergé de la lignée menant à Homo sapiens aux alentours de 700 ka [66].
Représentation des relations de parenté entre différents groupes humains du Pléistocène moyen et supérieur. Les flèches pointillées représentent des flux géniques entre populations. Sont documentés ici, le flux de gènes d’un groupe archaïque inconnu vers les Dénisoviens (flèche bleue), les flux de gènes entre Dénisoviens et Homo sapiens dont la trace se trouve actuellement au sein des populations chinoises et mélanésiennes (flèches noires), le flux de gènes entre les Néandertaliens et les ancêtres non-africains des populations actuelles (flèche noire). En outre, un flux génétique d’une population liée aux Homo sapiens vers une population ancestrale aux Néandertaliens de l’Altaï a pu être identifiée (flèche rouge). Il semble provenir d’une population distincte des ancêtres des populations africaines actuelles. D'après Dannemann et Racimo, 2018 et Choin et coll., 2021.
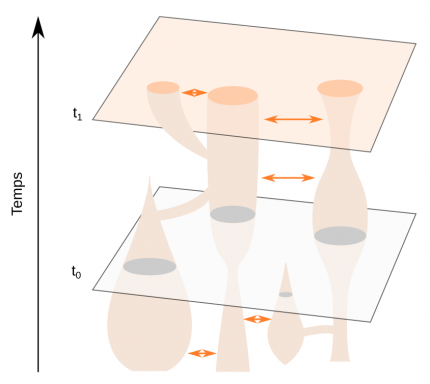
Les temps t0 et t1 représentent des tranches de temps dans le passé et le présent, respectivement. Ce modèle illustre la dynamique d’une métapopulation, qui comprend les fissions de populations, leur fusion, des flux génétiques (flèches oranges) et l’extinction de certaines branches.
Les travaux sur le site de Shum Laka ont confirmé la sous-structuration très forte des populations d’Homo sapiens en Afrique dès 250-200 ka qui amènent maintenant la communauté scientifique à privilégier un modèle évolutif métapopulationnel pour expliquer l’origine et la diversité de notre espèce en Afrique (Figure 11) [68-69]. Ce modèle intègre les notions de fission, de fusion, de flux génique et d’extinction de populations, qui s’accordent au mieux avec les données génétiques et paléoanthropologiques africaines actuelles.
Conclusion
L’ensemble des données paléoanthropologiques, génétiques et paléogénétiques permettent de discuter la définition et l’origine d’Homo sapiens, ainsi que sa diversité et ses relations avec les autres taxons d’hominines dont il a été contemporain. Homo sapiens se distingue des autres espèces du genre Homo par la présence d’un menton, l’absence de torus supraorbitaire continu, un neurocrâne globuleux et une face rétractée. Le plus ancien fossile connu présentant l’ensemble de ces caractères est celui d’Omo Kibish 1, retrouvé en Éthiopie et daté à 195 ka. Cependant, des fossiles plus anciens peuvent présenter certains des caractères dérivés propres à Homo sapiens, en combinaison avec d’autres caractères à l’état ancestral. C’est par exemple le cas de ceux de Jebel Irhoud (Maroc), datés à 315 ka qui documenteraient les premiers représentants du clade Homo sapiens selon certains paléoanthropologues, ou les populations à l’origine de notre espèce pour d’autres. Cet exemple illustre la difficulté que rencontrent régulièrement les paléontologues pour attribuer des fossiles à des espèces précises, ce qui souligne les limites du concept d’espèce.
Quoi qu’il en soit, les données paléontologiques concordent avec les données génétiques pour estimer l’émergence de notre espèce à une période comprise entre 350 et 250 ka. Cette émergence a eu lieu en Afrique, comme l’attestent la localisation des fossiles des premiers Homo sapiens connus, ainsi que la forte diversité génétique des populations africaines actuelles, comparée à celle des populations non africaines.
Concernant la sortie d’Afrique d’Homo sapiens, les données paléontologiques montrent qu’une première sortie s’est déroulée vers 200 ka. D’autres données indirectes, en lien avec des introgressions génétiques présentes chez certains néandertaliens de l’Altaï, suggèrent la présence de populations d’Homo sapiens en Asie vers 100 ka. Cependant, les données génétiques indiquent que ces populations n’ont pas laissé de descendants jusqu’à nos jours, à l’inverse de celles sorties plus tardivement, entre 80 et 50 ka. Ces populations d’Homo sapiens sorties plus tardivement d’Afrique se sont hybridées avec les Néandertaliens, comme l’attestent les 1 à 3 % d’ADN néandertalien contenu dans le génome des toutes les populations non africaines actuelles. En plus de cet héritage néandertalien, les populations d’Asie du Sud-Est et de Mélanésie portent en elles la trace du métissage de leurs ancêtres sapiens avec des populations dénisoviennes. Les relations entretenues entre Homo sapiens et deux autres espèces qu’il aurait pu rencontrer, H. floresiensis et H. luzonensis demeurent inconnues pour le moment, en particulier car les tentatives d’extraction d’ADN de ces deux espèces ont échoué jusqu’ici.
Cette revue des données paléoanthropologiques et génétiques concernant les relations entre les populations d’Homo sapiens et leurs contemporains montre la difficulté d’intégrer les résultats touchant à des corpus différents. Si les flux géniques identifiés peuvent être utilisés pour suggérer une interfécondité entre populations humaines depuis le Pléistocène moyen, et par là questionner la taxonomie utilisée en paléoanthropologie, le fait que la plupart des fossiles présentent un ADN trop dégradé pour être exploité nous pousse à conserver cette dualité. En effet, les différences morphologiques entre fossiles justifient l’utilisation de taxons différents et s'il y a bien eu des flux géniques sur différents continents et à différentes périodes entre des populations génétiquement assez éloignées, leur fréquence et intensité ne semblent pas satisfaire au modèle multirégional d’évolution humaine, mais plutôt à celui d’un Out-of-Africa récent avec hybridation (voir Figure 5E).
Références
[1] C.C Swisher, et al., “Age of the earliest known hominids in Java, Indonesia,” Science, vol. 263, no. 5150, pp. 1118–1121, Feb. 1994.
[2] L. Gabunia and A. K. Vekua, “A Plio-Pleistocenehominid from Dmanisi, East Georgia, Caucasus,” Nature, vol. 373, pp. 509-512, Feb. 1995.
[3] W. W. Howells, “Homo erectus,” Scientific American, vol. 215, no. 5, pp. 46-53, Nov. 1966.
[4] B. Wood and E. K. Boyle, “Hominin Taxic Diversity: Fact or Fantasy?,” Am. J. Phys. Anthropol., vol. 159, suppl. 61, pp. S37-S78, Jan. 2016.
[5] J. M. Bermúdez de Castro, et al., “A hominid from the Lower Pleistocene of Atapuerca, Spain: possible ancestor to Neandertals and modern humans,” Science, vol. 276, no 5217, pp. 1392-1395, May 1997.
[6] B. A. Wood, “Taxonomy and evolutionary relationships of Homo erectus,” Courier Forschunginstitut Senckenberg, vol. 171, pp. 159-165, 1994.
[7] I. Tattersall, “Homo ergaster and Its Contemporaries” in Handbook of Paleoanthropology, Springer, Berlin: Henke and Tattersall, 2013, pp. 2167-2187.
[8] M. Goodman, et al., “Primate evolution at the DNA level and a classification of hominoids,” J. Mol. Evol., vol. 30, no. 3, pp. 260-266, Mar. 1990.
[9] D. E. Lieberman, The evolution of the human head. Boston: Belknap Press, 2011.
[10] G. P. Rightmire, “Homo in the Middle Pleistocene: Hypodigms, Variation, and Species Recognition,” Evol. Anthropol., vol. 17, no. 1, pp. 8‑21, Feb. 2008.
[11] A. Mounier, et al., “Is Homo heidelbergensis a distinct species? New insight on the Mauer mandible,” J. Hum. Evol., vol. 56, no. 3, pp. 219-246, Mar. 2009.
[12] J. L. Arsuaga, et al., “Neandertal roots: cranial and chronological evidence from Sima de los Huesos,” Science, vol. 344, no. 6190, pp.1358-1363, Jun. 2014.
[13] R. G. Franciscus and E. Trinkaus, “Determinants of the retromolar space presence in Pleistocene Homo mandibles,” J. Hum. Evol., vol. 28, no. 6, pp. 577-595, Jun. 1995.
[14] J. Daura, et al., “New Middle Pleistocene hominin cranium from Gruta da Aroeira (Portugal),” Proc. Natl. Acad. Sci. USA, vol. 114, no. 13 pp. 3397-3402, Jan 2017.
[15] L. R. Berger, et al., “Homo naledi, a new species of the genus Homo from the Dinaledi Chamber, South Africa,” eLife, vol. 4, e09560. Sep. 2015.
[16] P. H.G.M. Dirks, et al., “The age of Homo naledi and associated sediments in the Rising Star Cave, South Africa,” eLife, vol. 6, e24231, May 2017.
[17] R. L. Cann, et al., “Mitochondrial DNA and human evolution,” Nature, vol. 325, pp. 31‑36, Jan 1987.
[18] M. H. Wolpoff, et al., “Multiregional, Not Multiple Origins,” Am. J. Phys. Anthropol., vol. 112, no. 1, 129-136. May 2000.
[19] L. Excoffier, “Human demographic history: refining the recent African origin model,” Curr. Opin. Genet. Dev., vol. 12, no. 6, pp. 675-682, Dec. 2002.
[20] C. Linné, Systema naturæ per regna tria naturæ, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis. Vol. Tomus I. Holmiae [Stockholm]: Impensis Direct. Laurentii Salvii, 1758.
[21] M. H. Day and C. B. Stringer, “A reconsideration of the Omo Kibish remains and the erectus-sapiens transition”, in L’Homo erectus et la place de l’Homme de Tautavel parmi les Hominidés fossiles, Tome II, M.A. de Lumley, Nice, France: CNRS, 1982, pp. 814-846.
[23] M. Bastir, et al., “Middle Cranial Fossa Anatomy and the Origin of Modern Humans,” Anat. Rec., vol. 291, no. 2, pp. 130-140, Feb. 2008.
[24] D. E. Lieberman, et al., “The evolution and development of cranial form in Homo sapiens,”Proc. Natl. Acad. Sci. USA, vol. 99, no. 3, pp. 1134-1139, Feb. 2002.
[25] J.-J. Hublin, et al., “New fossils from Jebel Irhoud, Morocco and the pan-African origin of Homo sapiens,” Nature, vol. 546, pp. 289‑292, Jun. 2017.
[26] M. M. Lahr, “The shaping of human diversity: filters, boundaries and transitions,” Phil. Trans. R. Soc. B, vol. 371, 20150241, Apr. 2016.
[27] I. Hershkovitz, et al., “The earliest modern humans outside Africa,” Science, vol. 359, no. 6374, pp. 456‑459, Jan. 2018.
[28] J. M. Bowler, et al., “New ages for human occupation and climatic change at Lake Mungo, Australia,” Nature, vol. 421, pp. 837-840, Feb. 2003
[29] H. Rougier, et al., “Pestera cu Oase 2 and the cranial morphology of early modern Europeans,” Proc. Natl. Acad. Sci. USA, vol. 104, no. 4, pp. 1165‑1170, Jan. 2007.
[30] F. Demeter, et al., “Anatomically modern human in Southeast Asia (Laos) by 46 ka,” Proc. Natl. Acad. Sci. USA, vol. 109, no. 36, pp. 14375-14380, Sep. 2012.
[31] J.-J. Hublin, et al., “Initial Upper Palaeolithic Homo sapiens from Bacho Kiro Cave, Bulgaria,” Nature, vol. 581, pp. 299-302, May 2020.
[32] K. Prüfer, et al., “A genome sequence from a modern human skull over 45,000 years old from Zlatý kůň in Czechia,” Nat. Ecol. Evol., vol. 5, pp. 820-825, Apr. 2021.
[33] K. Harvati and T. Harrison, Neanderthals Revisited. New approaches and Perspectives. Dordrecht: Springer, 2006.
[34] X.-J. Wu, et al., “An enlarged parietal foramen in the late archaic Xujiayao 11 neurocranium from northern China, and rare anomalies among Pleistocene Homo,” PloS ONE, vol. 8, e59587, Mar. 2013.
[35] X.-J. Wu, et al., “Temporal labyrinths of eastern Eurasian Pleistocene humans,” Proc. Natl. Acad. Sci. USA, vol. 111, no. 29, pp. 10509-10513, Jul. 2014.
[36] Y. Rizal, et al., “Last appearance of Homo erectus at Ngandong, Java, 117,000–108,000 years ago,” Nature vol. 577, pp. 381-385, Dec. 2019.
[37] T. Sutikna et al., “Revised stratigraphy and chronology for Homo floresiensis at Liang Bua in Indonesia,” Nature, vol. 532, pp. 366-369, Mar. 2016.
[38] F. Détroit, et al., “A new species of Homo from the Late Pleistocene of the Philippines,” Nature, vol. 568, pp. 181-186, Apr. 2019.
[39] F. Spoor, et al., “The bony labyrinth of Neanderthals,” J. Hum. Evol., vol. 44, pp. 141-165, Feb. 2003.
[40] W. A. Niewoehner, “Neanderthal hands in their proper perspective,” in Neanderthals Revisited: New Approaches and Perspectives, Springer Netherlands : Harvati and Harrison, 2006, pp. 157‑190.
[41] E. Trinkaus, “Modern Human versus Neandertal evolutionary distinctiveness,” Curr. Anthropol., vol. 47, no. 4, pp. 597‑620, Aug. 2006.
[42] S. E. Bailey, et al., “What Lies Beneath? An Evaluation of Lower Molar Trigonid Crest Patterns Based on Both Dentine and Enamel Expression,” Am. J. Phys. Anthropol., vol. 145, no. 4, pp. 505-518, Feb. 2011.
[43] I. Tattersall and J. H. Schwartz, “The distinctiveness and wider systematic context of Homo neanderthalensis,” in Neanderthals Revisited: New Approaches and Perspectives, Springer, Netherlands: Harvati and Harrison, 2006, pp. 9–22.
[44] E. Trinkaus, et al., “An early modern human from the Peştera cu Oase, Romania,” Proc. Natl. Acad. Sci. USA, vol. 100, no. 20, pp. 11231-11236, Sept. 2003.
[45] Q. Fu, et al., “An early modern human from Romania with a recent Neanderthal ancestor,” Nature, vol. 524, pp. 216-219, Jun. 2015.
[46] A. Manica, et al., “The effect of ancient population bottlenecks on human phenotypic variation,” Nature, vol. 448, pp. 346-348, Jul. 2007.
[47] C. M. Sclhebusch and M. Jakobsson, “Tales of Human Migration, Admixture, and Selection in Africa,” Annu. Rev. Genomics Hum. Genet., vol. 19, pp. 405-428, 2018
[48] M. Meyer, et al., “Nuclear DNA sequences from the Middle Pleistocene Sima de los Huesos hominins,” Nature, vol. 531, pp. 504-507, Mar. 2016.
[49] C. M. Schlebusch, et al., “Khoe-San Genomes Reveal Unique Variation and Confirm the Deepest Population Divergence in Homo sapiens,” Mol. Biol. Evol., vol. 37, no. 10, pp. 2944-2954, Jul. 2020.
[50] M. Kuhlwilm, et al., “Ancient gene flow from early modern humans into Eastern Neanderthals,” Nature, vol. 530, pp. 429-433, Feb. 2016.
[51] A.-S. Malaspinas, et al., “A genomic history of Aboriginal Australia,” Nature, vol. 538, pp. 207-214, Sept. 2016.
[52] S. Mallick, et al., “The Simons Genome Diversity Project: 300 genomes from 142 diverse populations,” Nature, vol. 538, pp. 201-206, Sept. 2016.
[53] R. G. Green, et al., “A Draft Sequence of the Neandertal Genome,” Science, vol. 328, no. 5979, pp. 710‑722, May 2010.
[54] K. Prüfer, et al., “The complete genome sequence of a Neanderthal from the Altai Mountains,” Nature, vol. 505, pp. 43-49, Jan. 2014.
[55] C. Posth, et al., “Pleistocene Mitochondrial Genomes Suggest a Single Major Dispersal of Non-Africans and a Late Glacial Population Turnover in Europe,” Curr. Biol., vol. 26, no. 6, pp. 827-833, Mar. 2016.
[56] J. Krause, et al., “The complete mithocondrial DNA genome of an unknown hominin from southern Siberia,” Nature, vol. 464, pp. 894-897, Mar. 2010.
[57] D. Reich, et al., “Genetic history of an archaic hominin group from Denisova Cave in Siberia,” Nature, vol.468, pp. 1053‑1060, Dec. 2010.
[58] D. Zhang, et al., “Denisovan DNA in Late Pleistocene sediments from Baishiya Karst Cave on the Tibetan Plateau,” Science, vol. 370, no. 6516, pp. 584-587, Oct. 2020.
[59] M. Petr, et al., “The evolutionary history of Neanderthal and Denisovan Y chromosomes,” Science, vol. 369, no. 6511, pp. 1653-1656, Sept. 2020.
[60] Chen, et al., 2019. A late Middle Pleistocene Denisovan mandible from the Tibetan Plateau. Nature 569, 409-412.
[61] E. A. Bennett, et al., “Morphology of the Denisovan phalanx closer to modern humans than to Neanderthals,” Science Advances, vol. 5, no 9, eaaw3950, Sep. 2019.
[62] Z.-Y. Li, et al., “Late Pleistocene archaic human crania from Xuchang, China,” Science, vol. 355, no. 6328, pp. 969‑972, Mar. 2017.
[63] M. Hajdinjak, et al., “Reconstructing the genetic history of late Neanderthals,” Nature, vol. 555, pp. 652-656, Mar. 2018.
[64] F. Mafessoni, et al., “A high-coverage Neandertal genome from Chagyrskaya Cave,” Proc. Natl. Acad. Sci. USA, vol. 117, no. 26, pp. 15132-15136, Jun. 2020.
[65] V. Slon, et al., “The genome of the offspring of a Neanderthal mother and a Denisovan father,” Nature, vol. 561, pp. 113-116, Aug. 2017.
[66] M. F. Hammer, et al., “Genetic evidence for archaic admixture in Africa,” Proc. Natl. Acad. Sci. USA, vol. 108, no. 37, pp. 15123‑15128, Sept. 2011.
[67] M. Lipson, et al., “Ancient West African foragers in the context of African population history,” Nature, vol. 577, pp. 665-670, Jan. 2020.
[68] B. M. Henn, et al., “Clarifying distinct models of modern human origins in Africa,” Curr. Opin. Genet. Dev., vol. 53, pp. 148-156, Dec. 2018.
[69] E. Scerri, et al., “Beyond multiregional and simple out-of-Africa models of human evolution,” Nat.Ecol. Evol., vol. 3, pp. 1370–1372, Sept. 2019.
[70] G. Lecointre, Guide critique de l’évolution. Paris : Belin édition, 2009.