Les régimes alimentaires des populations humaines se sont modifiés au cours de leur histoire évolutive, que ce soit suite à des migrations dans de nouveaux écosystèmes ou à des innovations culturelles (maîtrise du feu, domestication de plantes et d'animaux, transformation des aliments, etc.). Ces changements alimentaires ont exercé (et continuent d'exercer) des pressions de sélection sur les populations humaines, dont les traces sont visibles dans leurs génomes.
Les populations humaines présentent des régimes alimentaires variés. Les modes de subsistance des populations peuvent en effet être grossièrement classifiés en trois groupes : i) chasseurs-cueilleurs-pêcheurs, ii) agriculteurs ou agropasteurs, et iii) éleveurs. Ces catégorisations représentent l’activité principale des populations mais la réalité est souvent complexe. Par exemple, l’alimentation des éleveurs est majoritairement tournée vers les produits d’origine animale (viande et produits laitiers), mais inclut également des aliments d’origine végétale, cueillis, cultivés et/ou obtenus par échange avec d’autres populations. De plus, une grande variabilité existe au sein de chaque classe (pensez aux chasseurs-pêcheurs du grand Nord par rapport aux chasseurs-cueilleurs de la forêt équatoriale…). Cette diversification de régimes alimentaires est à la fois le fruit des milieux écologiques contrastés colonisés par l’Homme, mais également des choix culturels effectués par chaque population pour exploiter les ressources naturelles. En effet, bien que l’Homme ait eu un mode de vie nomade basé sur la chasse et la cueillette pendant la majorité de son histoire évolutive, certaines populations humaines ont commencé à se sédentariser et à pratiquer l’agriculture et l’élevage assez récemment, lors de la révolution néolithique, il y a environ 10 000 ans. Cependant, les populations humaines ont eu le temps de s’adapter génétiquement (au moins en partie) à ces changements, et il est possible d’identifier les mutations avantageuses propres à chaque groupe.
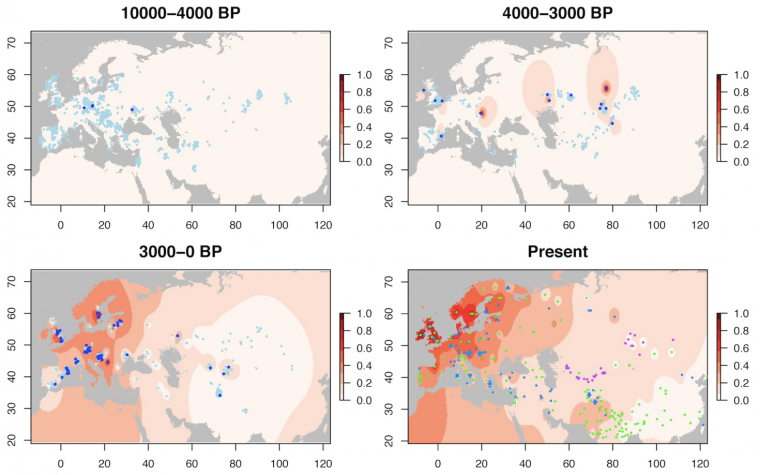
Le cas le plus emblématique d’adaptation génétique à l’alimentation est sans doute celui de l’adaptation à la consommation de lait (voir Ségurel et Bon, 2017, pour une revue). En effet, chez les mammifères, et dans la plupart des populations humaines, la lactase – l’enzyme permettant de digérer le lactose, seul sucre présent dans le lait – cesse d’être exprimée après le sevrage. Les adultes ne peuvent plus digérer le lactose et donc bénéficier d’un apport en glucides (sucres) en buvant du lait. De plus, la présence de lactose non digéré dans l’intestin entraîne des diarrhées et des crampes abdominales, du fait entre autres de la fermentation du lactose par les bactéries intestinales. Cependant, dans les populations pastorales ou agro-pastorales buvant du lait depuis la domestication de certaines espèces au Néolithique (vache en Afrique et en Europe, dromadaire en Arabie saoudite, buffle en Inde du Nord), la fréquence de certaines mutations permettant de maintenir l’expression de la lactase à l’âge adulte (phénotype de persistance de la lactase) a augmenté du fait de la sélection naturelle (les porteurs de ces mutations ayant en moyenne plus d’enfants que les non-porteurs). De manière intrigante, les éleveurs d’Asie centrale (Kazakhs, Kirghizes, Mongols…) ne présentent pas une fréquence élevée de ces mutations (Ségurel et coll. 2020). Il est possible que cela soit dû au fait que ces éleveurs boivent systématiquement le lait sous forme transformée, mais jamais sous forme de lait cru. Or, soit ces produits laitiers ne présentent plus de lactose (fromage, crème, beurre), soit celui-ci est toujours bien présent (yaourt, boisson fermentée), mais en association avec des bactéries lactiques qui réduisent les symptômes intestinaux. Ces différences de modes de consommation du lait pourraient également expliquer pourquoi le phénotype de persistance de la lactase présente une prévalence beaucoup plus importante en Europe du Nord (importante consommation de lait frais) par rapport à l’Europe du Sud (importante consommation de fromage et yaourts).
L’allèle –13.910*T est responsable du phénotype de persistance de la lactase en Eurasie. Les points représentent des individus anciens (trois premières cartes, 1434 individus au total) et modernes (dernière carte) chez lesquels cet allèle a été étudié. Ces données ont ensuite été extrapolées pour représenter la fréquence de l’allèle –13.910*T en Eurasie sous la forme d’un dégradé de rouge. Dans d’autres régions du monde, ce sont des mutations différentes qui sont responsables du phénotype de persistance de la lactase. BP : before present.
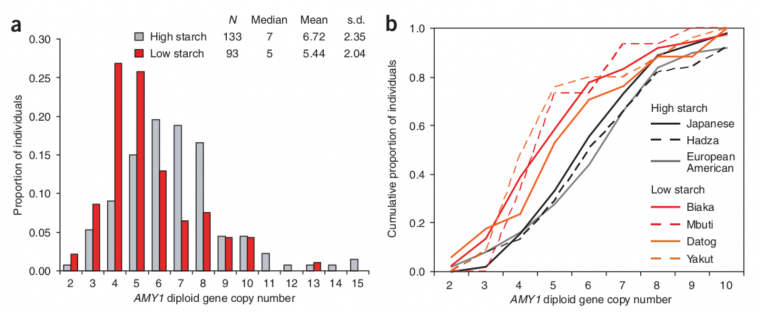
Une autre molécule a créé d’importantes pressions de sélection dans le génome au moment de la domestication des plantes : l’amidon. En effet, plusieurs populations ont domestiqué des céréales lors de la transition néolithique : blé et orge au Proche-Orient puis en Europe ; riz et millet en Asie de l’Est ; mil et sorgho en Afrique (Bellwood, 2005). Cette arrivée massive des céréales dans l’alimentation a entrainé de nombreuses modifications physiologiques souvent délétères, visibles sur les squelettes des premiers agriculteurs. Il s’agit notamment de rachitisme (désordre de la croissance osseuse qui se manifeste par une déformation des os), probablement dû à des carences en calcium, et de l’apparition de caries. En effet, les céréales contiennent de grandes quantités de sucre sous forme d’amidon, un polymère de glucose digéré notamment grâce à l’amylase salivaire1. De manière intéressante, plus le nombre de copies du gène AMY1, codant l’amylase salivaire, est élevé dans le génome d’un individu et plus celui-ci exprime d’amylase dans sa salive et donc est efficace pour obtenir de l’énergie à partir d’une alimentation riche en amidon. Ainsi, les chercheurs ont observé que par rapport au chimpanzé, dont le génome contient seulement deux copies du gène, les génomes des populations humaines en contiennent entre deux et quinze copies (Perry et coll., 2007) ! Cette augmentation du nombre de copies du gène de l’amylase chez l’Homme est certainement due à l’importance grandissante des tubercules et des racines dans l’alimentation humaine grâce à la cuisson des aliments permise par la maîtrise du feu. La date de cet événement reste débattue mais est au moins postérieure à − 400 000 ans. Des études ont par ailleurs montré que les duplications du gène AMY1 sont propres à Homo sapiens, et notamment absentes chez Homo neanderthalensis. Cela montre qu’au cours de l’histoire évolutive récente d’Homo sapiens, l’amidon est devenu une ressource plus importante que chez d’autres membres de la lignée humaine ou que chez nos cousins les grands singes. Cependant, on observe également une différence significative du nombre de copies du gène AMY1 entre les populations actuelles consommant peu d’amidon (éleveurs, certains chasseurs-pêcheurs) qui ont en moyenne 5 copies et les populations actuelles ayant une alimentation riche en amidon (agriculteurs et certains chasseurs-cueilleurs consommant beaucoup de tubercules) qui ont en moyenne 7 copies (Perry et coll. 2007). Dans cet exemple d’adaptation, ce n’est donc pas une mutation ponctuelle d’une seule paire de base qui a été sélectionnée (ce qui était le cas dans l’exemple du phénotype de persistance de la lactase), mais bien un changement du nombre de copies d’un gène. La diversité phénotypique soumise à la sélection naturelle peut donc avoir pour origine des mutations de nature variée.
a : Comparaison du nombre de copies diploïdes du gène AMY1 chez des individus ayant un régime alimentaire traditionnellement riche en amidon (en gris) ou pauvre en amidon (en rouge).
b : Proportion cumulative du nombre de copies diploïdes du gène AMY1 dans les sept populations utilisées pour construire le graphique a. Les populations ayant un régime alimentaire traditionnellement riche en amidon sont représentées en gris, celles ayant un régime pauvre en amidon sont figurées en rouge. Les Hadza sont des chasseurs-cueilleurs de Tanzanie qui consomment de grandes quantités de racines et tubercules riches en amidon. Les Biaka (République centrafricaine) et les Mbuti (République démocratique du Congo) sont des chasseurs-cueilleurs des forêts tropicales, les Datog des pasteurs de Tanzanie et les Yakut des pasteurs-pêcheurs de Sibérie.
Deux autres mutations, affectant les gènes KCNQ1 (codant un canal potassique) et PLRP2 (codant une lipase impliquée dans la digestion des graisses) présentent des fréquences systématiquement plus élevées dans les populations d’agriculteurs par rapport aux éleveurs et aux chasseurs-cueilleurs (Hancock et coll., 2010). Bien que la première mutation soit associée à un risque plus élevé de diabète de type 2 et que la deuxième corresponde à un codon stop qui rende la protéine plus efficace, nous ne savons pas précisément ce qui rend ces mutations avantageuses et donc pourquoi elles ont été sélectionnées dans les populations agricoles.
Comment savoir si des allèles ont été soumis à sélection naturelle ?
Lorsqu’une mutation apparaît dans une population, sa fréquence est très faible (elle vaut 1/(2N), avec N le nombre d’individus dans la population). Cette fréquence va ensuite fluctuer et, dans la plupart des cas, la mutation va disparaître. Dans certains cas, cependant, la fréquence augmente suffisamment au cours du temps, que ce soit par sélection naturelle ou par dérive (hasard), pour que la mutation soit maintenue dans la population. Ces deux processus peuvent être discriminés en regardant si l’augmentation en fréquence de l’allèle considéré est rapide, et donc caractéristique d’une pression de sélection, ou lente, et donc dépendante de la dérive. Pour évaluer cette vitesse d’évolution, on compare les patrons de diversité génétique autour de cette mutation avec d’autres mutations dans le génome ayant la même fréquence.
Sans recombinaison, une mutation qui apparaît chez un individu est transmise à sa descendance en même temps que tout le chromosome qui la porte. Cependant, de génération en génération, les événements de recombinaison homologue se produisant lors de la méiose font qu'il y a une diminution progressive de la portion d’ADN présente autour de la mutation d’intérêt et qui est toujours la même que la séquence portée par l’individu fondateur. Ainsi, en regardant dans une population humaine actuelle la longueur du fragment d’ADN incluant la mutation d’intérêt et partagé par toute la population, il est possible i) d’évaluer si cette longueur est atypiquement longue et donc signe de sélection, et ii) de déterminer l’âge de la mutation. Si le fragment d’ADN conservé autour de la mutation est long, c’est que la mutation est récente ; s’il est court, c’est qu’elle est ancienne.
Lorsqu’une mutation connue est associée à un phénotype suspecté d’être avantageux, la méthode décrite ci-dessus permet de confirmer ou d’infirmer l’hypothèse d’une évolution de cette mutation par sélection naturelle. À l’inverse, la détection de longs fragments de chromosomes conservés dans une population signe la sélection naturelle de ces fragments. Comme ceux-ci comprennent plusieurs mutations, il n’est pas forcément simple d’identifier celle (ou celles) conférant un avantage. En effet, les autres mutations présentes sur ce fragment d’intérêt ont été transmises au cours des générations du fait de leur proximité avec la mutation avantageuse (effet d’autostop génétique) mais elles ne procurent pas forcément elles-mêmes d’avantages. Pour distinguer la nature avantageuse ou non de ces mutations, il est possible mener des études in vitro ou in vivo (par exemple en introduisant ces mutations dans des souris) afin d’en observer les effets ou, par des études bio-informatiques, de voir celles qui seraient susceptibles de modifier la séquence régulatrice d’un gène ou la structure de la protéine codée.
D’autres exemples d’adaptations locales à l’alimentation existent, sans être en lien avec la transition néolithique. Par exemple, les régimes alimentaires riches en racines et tubercules sont particulièrement pauvres en folate (vitamine B9), une molécule indispensable au métabolisme des cellules1. Il a ainsi été observé que dans les populations de chasseurs-cueilleurs, une mutation du gène MTRR permettant d’économiser du folate pendant la synthèse de méthionine a été sélectionnée (Hancock et coll., 2010).
Deux études ont également montré que les populations du grand Nord semblent avoir bénéficié d’adaptations génétiques spécifiques permettant la vie en milieu extrême. La première a montré que les populations du nord de la Sibérie présentent un fort signal de sélection naturelle dans une région du génome contenant le gène CPT1A. Ce gène est impliqué dans le métabolisme des acides gras à longue chaîne, des molécules contenues en quantité importante dans le régime alimentaire très riche en graisses animales (poissons et viandes) de ces populations (Cardona et coll., 2014). Une autre étude a montré que les gènes FADS1, FADS2 et FADS3 ont été sous forte sélection naturelle dans les populations inuites du Groenland (Fumagalli et coll., 2015). Ces trois gènes codent des désaturases, des enzymes réduisant les acides gras et augmentant donc leur nombre d’insaturation. Les mutations sélectionnées chez les Inuits rendent ces enzymes moins efficaces, ce qui diminue le taux de conversion de ces acides gras et réduit ainsi la concentration de lipides et de cholestérol dans le sang. Il a de plus été montré que ces mutations ont été sélectionnées il y a environ 20 000 ans, soit juste après que ces populations aient colonisé ce milieu extrême. Dans les deux cas, ces mutations ont permis aux populations d’adopter un régime alimentaire très gras et riche en protéines marines sans souffrir de complications cardiovasculaires.
Tous ces cas d’adaptations à l’alimentation sont de beaux exemples d’interaction entre la biologie et la culture : des choix alimentaires culturels laissent des traces dans le patrimoine génétique des populations humaines.
Références
- Bellwood, P. (2005). "First farmers: the origin of agricultural societies", Edt Blackwell
- Cardona, A., Pagani, L., Antao, T., Lawson, D. J., Eichstaedt, C. A., Yngvadottir, B., Shwe, M. T., Wee, J., et coll. (2014). "Genome-wide analysis of cold adaptation in indigenous Siberian populations." PLoS One 9(5): e98076.
- Fumagalli, M., Moltke, I., Grarup, N., Racimo, F., Bjerregaard, P., Jørgensen, M. E., et coll. (2015). "Greenlandic Inuit show genetic signatures of diet and climate adaptation" Science 349(6524), 1343-1347
- Hancock, A. M., Witonsky, D. B., Ehler, E., Alkorta-Aranburu, G., Beall, C., Gebremedhin, A., Sukernik, R., Utermann, G., et coll. (2010). "Colloquium paper: human adaptations to diet, subsistence, and ecoregion are due to subtle shifts in allele frequency." Proc Natl Acad Sci U S A 107 Suppl 2: 8924-8930.
- Perry, G. H., Dominy, N. J., Claw, K. G., Lee, A. S., Fiegler, H., Redon, R., Werner, J., Villanea, F. A., et coll. (2007). "Diet and the evolution of human amylase gene copy number variation." Nat Genet 39(10): 1256-1260.
- Segurel, L. and Bon, C. (2017). "On the Evolution of Lactase Persistence in Humans." Annu Rev Genomics Hum Genet, 10.1146/annurev-genom-091416-035340.
- Segurel, L., Guarino-Vignon, P., Marchi, N., Lafosse, S., Laurent, R., Bon, C., Fabre, A., Hegay, T., et coll. (2020). "Why and when was lactase persistence selected for? Insights from Central Asian herders and ancient DNA." PLoS Biol 18(6): e3000742.