Les différentes espèces qui peuplent la planète ne vivent pas isolées, mais sont au contraire liées par des réseaux d'interactions complexes. Ces interactions, de différentes natures, structurent les réseaux trophiques, permettent la reproduction de nombreuses espèces et ont ainsi de nombreuses conséquences écologiques et évolutives.
En se promenant dans le bocage normand, il est possible d’observer des prairies servant de pâture à bovins : l’herbe y est rase et les végétaux nitrophiles (orties, rumex) poussent à proximité des lieux de nourrissage. Les prairies en friche présentent un aspect différent : l’herbe y est plus haute, les espèces végétales plus diversifiées, des buissons envahissent le milieu… Cette simple observation montre l’importance écologique des interactions entre espèces au sein de l’écosystème prairial.
Quels sont les différents types d’interactions interspécifiques ? Comment ces interactions entre espèces jouent-elles sur la structuration spatiale et la dynamique temporelle d’un écosystème ?
Cet article commence par illustrer la diversité des relations interspécifiques, puis leur intervention dans la nutrition des organismes ainsi que dans la modulation des réseaux trophiques et dans le recyclage de la matière organique. Ensuite, l’impact des relations interspécifiques dans la reproduction et la dispersion des individus est abordé. Une dernière partie présente les conséquences écologiques et évolutives des relations interspécifiques.
Les différents types de relations interspécifiques
Les relations interspécifiques peuvent être classées en fonction du résultat de la relation sur chacun des partenaires en termes de valeur sélective (fitness).
| Type de relation | Espèce A | Espèce B | Exemples |
|---|---|---|---|
| Prédation/Herbivorie | + | − | Vache mangeant de l’herbe |
| Parasitisme | + | – | Tique sur un mammifère |
| Compétition interspécifique | − | – | Compétition pour la lumière des végétaux |
| Commensalisme | + | 0 | Plantes épiphytes Bactéries présentes sur la peau d’un organisme |
| Symbiose | + | + | Lichen Nodosités à Rhizobium sp. des Fabacées Mycorhizes Micro-organismes du rumen de la vache |
| Mutualisme | + | + | Plantes et insectes pollinisateurs |
| Amensalisme | 0 | − | Vache qui piétine des plantes |
| Neutralisme | 0 | 0 | Cohabitation pics noirs/blaireaux dans une forêt |
Les interactions à bénéfices réciproques
Les relations à bénéfices réciproques sont qualifiées de mutualismes. Par exemple, la relation entre une fleur et son insecte pollinisateur est un mutualisme : la fleur voit sa valeur sélective augmentée par l’interaction, car sa reproduction est facilité par l’insecte. Ce dernier voit sa valeur sélective augmenter, car la fleur lui permet de se nourrir (pollen et/ou nectar) 1.
Si la relation est étroite et pérenne, ce mutualisme est une symbiose 2. La symbiose est donc un type particulier de mutualisme. La relation entre un être humain et les bactéries hébergées dans son tube digestif constitue une symbiose : l’individu profite des capacités de digestion des bactéries, de la libération de certains métabolites (vitamine K) par celles-ci et du fait qu’elles occupent l’espace, rendant plus difficile la colonisation par des bactéries pathogènes. Les bactéries du tube digestif bénéficient quant à elle d’un environnement de développement optimal : température contrôlée, apport régulier de nutriments…
Les lichens sont des organismes symbiotiques résultant de l’association d’un champignon, d’une cyanobactérie ou algue verte et, souvent, de levures (Figure 1) 1.
À gauche : une abeille sur l’inflorescence d’une Astéracée. Les abeilles se nourrissent du nectar et/ou du pollen des fleurs qu’elles visitent et participent à la reproduction de celles-ci en transportant le pollen de fleurs en fleurs.
À droite : le lichen Xanthoria parietina est formé de l’association d’un partenaire photosynthétique (photobionte), d’un partenaire fongique (mycobionte) et de levures.
Sources des images : Abeille sur une inflorescence de pissenlit : Jean-Raphaël Guillaumin, CC-BY-SA, Flickr. Xanthoria parietina : hedera.baltica, CC-BY-SA, Flickr.
Les interactions mutualistes mettent fréquemment en jeu des adaptations des deux partenaires. Par exemple, chez les végétaux, un dialogue moléculaire s’établit entre les extrémités racinaires et les hyphes des champignons mycorhiziens, orchestré par des facteurs qui diffusent dans le sol : des facteurs myc émis par les champignons sont reconnus par la plante, qui y répond par une cascade moléculaire favorisant l’installation du champignon 1.
Les relations d’exploitation
Les relations où l’un des partenaires tire des bénéfices alors que l’autre en pâtit sont appelées des relations d’exploitation (Figure 3). Ces relations peuvent être classées en différents types en fonction de la durée et de l’intensité de la pression exercée (plus ou moins létale).
| Faiblement létale | Fortement létale | |
|---|---|---|
| Durée courte (quelques secondes) | Herbivorie | Prédation |
| Durée longue (plusieurs jours) | Parasitisme | Parasitoïde |
L’herbivorie constitue généralement une interaction peu durable et peu létale, dans la mesure où l’animal ne consomme qu’une partie de l’appareil végétatif de la plante. Par exemple, dans le cas d’une girafe broutant un acacia, l’interaction est positive pour la girafe, qui en tire de la nourriture, mais négative pour l’acacia qui voit sa surface photosynthétique diminuer.
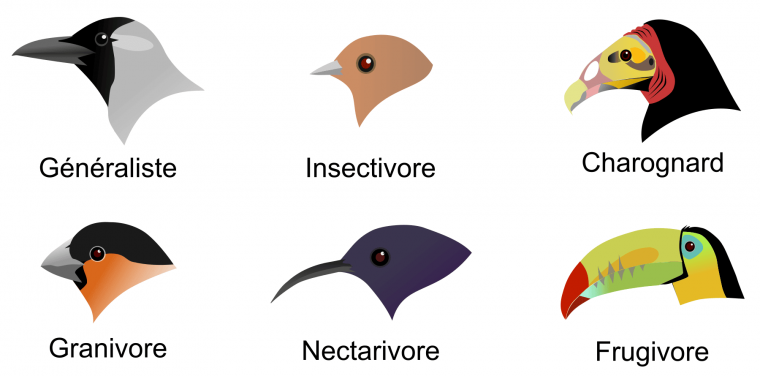
La prédation, où un animal en consomme un autre, est une interaction létale : le guépard tue la gazelle en quelques instants, puis la mange. La forme du bec chez différentes espèces d’oiseaux est un bel exemple d’adaptation à la prédation (consommation de petits invertébrés aquatiques, de mammifères, etc.) ou à l’herbivorie au sens large (consommation de graines, de nectar, etc.) (Figure 2).
Généraliste : corbeau familier (Corvus splendens) ; Insectivore : gobemouche brun stylisé (Muscicapa dauurica) ; Charognard : urubu à tête jaune (Cathartes burrovianus) ; Granivore : bouvreuil pivoine (Pyrrhula pyrrhula) ; Nectarivore : souimanga stylisé (basé sur le genre Nectarinia) ; Frugivore : toucan à carène (Ramphastos sulfuratus).
Les interactions d’herbivorie et de prédation impliquent des adaptations des deux partenaires. Par exemple, les animaux phytophages ou prédateurs sont dotés de caractéristiques anatomiques adaptées à la nourriture qu’ils consomment : molaires développées chez les Mammifères phytophages, canines volumineuses chez les carnassiers… Les plantes peuvent quant à elle posséder des épines, produire des composés toxiques… tandis que les proies peuvent présenter des cornes, une certaine vitesse ou endurance à la course, une vie en troupeaux, etc.
Le parasitisme constitue une interaction durable et de létalité variable : les tiques piquent le renard et lui prélèvent un peu de sang, pendant plusieurs jours ou semaines, sans entraîner sa mort. Cependant d’autres parasites peuvent entraîner la mort de leurs hôtes. C’est en particulier le cas de micro-organismes, qu’il s’agisse de parasites eucaryotes (avec par exemple les parasites du genre Plasmodium, responsables du paludisme), de bactéries (par exemple Mycobacterium tuberculosis, agent de la tuberculose) ou de virus (VIH, causant le sida). Les parasites présentent souvent de nombreuses adaptations : appareil pour piquer ou mordre l’hôte, mécanismes d’évitement du système immunitaire, etc. À quelques exceptions près (comme le coucou gris Cuculus canorus), les parasites sont bien plus petits, que leurs hôtes.
Les parasitoïdes, eux, finissent par tuer leur hôte : c’est le cas des hyménoptères parasitoïdes, des guêpes microscopiques qui immobilisent d’autres insectes (blattes, scarabées…) et pondent à l’intérieur. La procédure d’immobilisation suppose des adaptations remarquables : par exemple, la guêpe émeraude (Ampulex compressa) cible avec son dard un groupe de neurones de seulement quelques dizaines de micromètres dans les ganglions cérébraux d’une blatte, et y injecte un venin qui rend la blatte incapable de se déplacer seule. Juste après, la guêpe part chercher une cavité pour « stocker » la blatte, puis elle pond son œuf à proximité d’une membrane articulaire de la blatte 1 ! La larve de guêpe perce la membrane articulaire et pénètre dans le corps de la batte ; elle se développe en dévorant progressivement la blatte de l’intérieur. Cette interaction est donc à la fois durable et fortement létale.
De gauche à droite et de haut en bas :
Herbivorie : Une chenille de paon-du-jour (Aglais io) mange une feuille de grande ortie (Urtica dioica).
Prédation : une famille de lions dévore un buffle d’Afrique.
Parasitisme : une tique en train de mordre un humain.
Parasitoïde : un ichneumon (guêpe parasite, Ctenochares bicolorus) s’apprêtant à pondre dans une chenille de goutte-de-sang, ou écaille du séneçon (Tyria jacobaeae).
Sources des images : Chenille de paon-du-jour mangeant une feuille de grande ortie : Quartl, CC-BY-SA, Wikimedia ; Lions mangeant un buffle d’Afrique : Luca Galuzzi, CC-BY-SA, Wikimedia ; Tique : Navaho, CC-BY-SA, Wikimedia ; Ichneumon et chenille de goutte-de-sang : Ian Alexander, CC-BY-SA, Wikimedia ;
Les relations de compétition
Les relations qui pâtissent aux deux partenaires sont les relations de compétition. Par exemple, lorsque deux espèces coexistent sur une même niche écologique, il arrive fréquemment que l’une d’elles, plus performante, élimine l’autre du territoire qu’elles partageaient. Par ailleurs, il existe des cas de compétition « active », où l’un des partenaires empoisonne l’autre (Figure 4). Certaines plantes émettent des composés allélopathiques au niveau de leurs racines, qui diffusent dans le sol et sont toxiques pour les autres plantes (par exemple la juglone produite par le noyer) 1. De même, certaines bactéries éliminent d’autres espèces par antibiose, c’est-à-dire en libérant dans l’environnement des composés antibiotiques auxquels elles sont elles-mêmes insensibles.
Les relations unilatérales ou neutres
Parmi les relations unilatérales, on distingue le commensalisme, où l’un des individus bénéficie de l’interaction alors qu’elle s’avère neutre pour l’autre partenaire et l’amensalisme, où l’un des individus pâtit de l’interaction alors qu’elle s’avère neutre pour l’autre. Un exemple de commensalisme est l’épiphytisme : des lichens, mousses ou fougères poussent sur le tronc des arbres en s’en servant comme support. L’interaction est neutre pour l’arbre et positive pour les végétaux épiphytes. Un exemple d’amensalisme correspond au piétinement des plantes par les gros Mammifères. L’appareil aérien des plantes peut être endommagé, sans que cette interaction n’affecte les animaux.
Les interactions neutres pour les deux partenaires n’affectent pas la valeur sélective (Figure 5).
À gauche : un cas de neutralisme : dans un pré, une vache cohabite avec une nuée d’étourneaux.
À droite : un exemple de commensalisme : la fougère Platycerium bifurcatum poussant sur un arbre.
Source : Vache et étourneaux : Péter Kövesi, Pexels ; Platycerium bifurcatum : Peter Nijenhuis, CC-BY-NC-ND, Flickr.
Les différents exemples développés montrent que tous les aspects du phénotype peuvent être modifiés par la mise en place d’une relation interspécifique. Celles-ci peuvent présenter des bénéfices ou au contraire des coûts, plus ou moins prononcés et durables, pour les différents partenaires. L’ensemble de ces interactions structure les réseaux trophiques et conditionne les flux de matière et d’énergie qui parcourent les écosystèmes.
Les relations interspécifiques impliquées dans les interactions trophiques
L’organisation d’un réseau trophique
Un réseau trophique représente les interactions entre « mangeurs et mangés » au sein d’un écosystème.
Par exemple, les végétaux de la prairie sont autotrophes au carbone, ce qui en fait des producteurs primaires : leur capacité photosynthétique leur permet de produire de la matière organique à partir de CO2, en utilisant l’énergie lumineuse. Les herbivores (aussi appelés phytophages) qui consomment l’herbe sont des consommateurs primaires, et les carnivores sont des consommateurs secondaires voire tertiaires. Le rendement de la photosynthèse est d’environ 1 %, c’est-à-dire que 1 % de l’énergie solaire reçue est effectivement convertie en énergie chimique de liaison contenue dans la biomasse. Pour les autres niveaux trophiques, le rendement désigne la production d’un niveau trophique N divisée par celle du niveau trophique N-1, exprimé en pourcentage. Ce rendement est d’environ 10 % chaque fois que l’on s’élève d’un échelon dans la chaîne trophique, même s’il existe des variations autour de cette valeur.
À noter que certains écosystèmes privés de lumière, comme les fonds abyssaux, reposent sur un autre type d’autotrophie : les producteurs primaires sont des bactéries chimiolithotrophes.
Anciennement, on parlait de chaînes alimentaires mais la connotation trop linéaire de cette expression lui a fait préférer l’appellation actuelle de réseau trophique (Figure 6). En effet, la plupart des consommateurs se nourrissent de différentes espèces, situées à différents niveaux trophiques (par exemple, des espèces omnivores comme l’ours peuvent être vues comme des consommateurs primaires ou secondaires, voire tertiaires), et sont eux-mêmes la cible de différents prédateurs.
Ainsi, la circulation de matière et d’énergie au sein des écosystèmes repose en grande partie sur les interactions d’herbivorie et de prédation qui caractérisent les réseaux trophiques. Les faibles rendements expliquent, d’une part, que l’on ne peut pas avoir plus de 5 ou 6 niveaux trophiques dans un réseau et, d’autre part, que les polluants persistants, comme le mercure, tendent à se concentrer chez les espèces des niveaux trophiques supérieurs.
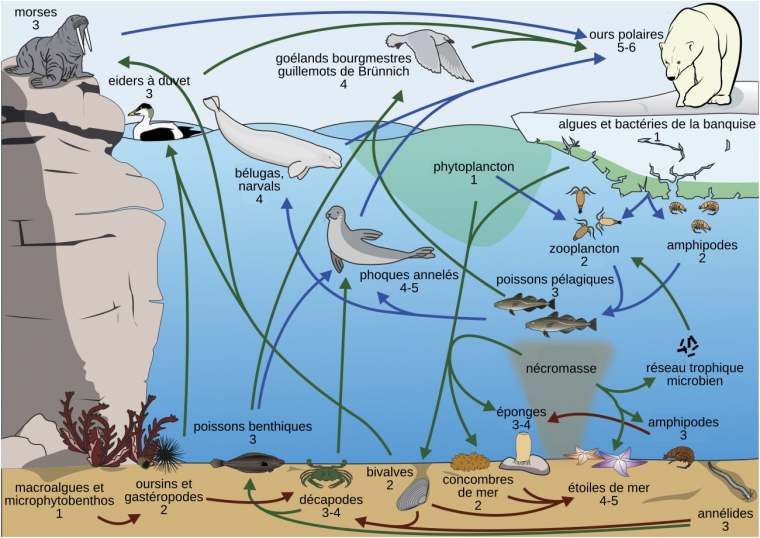
Les niveaux trophiques des différentes espèces ou groupes d’espèces sont indiqués par un nombre. Lorsque deux éléments du réseau sont pélagiques (vivant dans toute la tranche d’eau), ils sont reliés par des flèches bleues, lorsqu’ils sont tous deux benthiques (vivant au fond de l’eau), ils sont reliés par des flèches marron, et dans les autres cas par des flèches vertes. Pour réaliser ce réseau trophique, les scientifiques ont utilisé 881 échantillons appartenant à 97 espèces benthiques et 699 échantillons appartenant à 53 espèces pélagiques, dans les eaux Arctiques du Nunavut (Canada). Ils ont ensuite quantifié le fractionnement isotopique de l’azote (δ15N) dans les échantillons collectés, puisque la valeur de celui-ci est corrélée à la position dans le réseau trophique. Les étoiles de mer sont les principaux superprédateurs des zones benthiques (cela veut dire que dans ces zones, ce sont les étoiles de mer qui se trouvent généralement au sommet des réseaux trophiques) alors que les ours polaires sont les superprédateurs des zones pélagiques. Cette étude souligne le fait que les écosystèmes benthiques, essentiellement composés d’invertébrés, possèdent des réseaux trophiques complexes et autonomes, et ne doivent pas être seulement considérés comme un « réservoir de nourriture » pour les espèces pélagiques. Par ailleurs, cette étude montre une forte interconnexion entre les deux réseaux : par exemple, les cadavres d’espèces pélagiques sont consommés par les espèces benthiques.
Les symbioses ayant un rôle clé dans la nutrition des organismes
L’établissement d’une symbiose avec un cortège de micro-organismes variés et complémentaires peut augmenter le rendement d’un niveau trophique à l’autre, notamment grâce à une syntrophie entre ces microorganismes, les déchets des uns formant les substrats des autres. Par exemple, le rendement de digestion de la vache est très efficace en raison de la symbiose ruminale. Pour s’en convaincre, on peut observer que dans les bouses de vache, il reste très peu de matières végétales intactes, alors que le crottin de cheval, qui ne dispose pas de ce type de symbiose, est bien plus riche en débris végétaux.
Les symbioses interviennent également dans la nutrition hydrominérale des végétaux. Notamment, de nombreuses Angiospermes ou Pinophytes sont mycorhizées, c’est-à-dire que leurs extrémités racinaires sont en association étroite avec des champignons qui les aident à prélever l’eau et les ions minéraux du sol. En échange, la plante cède au champignon une partie des sucres issus de la photosynthèse 1.
Les filaments blancs sont des hyphes mycéliens. Ils facilitent l’absorption hydrominérale des racines et reçoivent en échange des sucres issus de la photosynthèse.
Un autre exemple de symbiose est celle des Fabacées (Légumineuses) avec des bactéroïdes du genre Rhizobium, qu’elles hébergent au sein de nodosités racinaires. Les bactéroïdes possèdent l’enzyme nitrogénase, capable de fixer et réduire le diazote atmosphérique N2 en ions ammonium NH4+, exportés vers la plante pour sa synthèse d’acides aminés. Grâce à cette symbiose, les Fabacées peuvent se développer sur un sol pauvre en azote. La nitrogénase étant inhibée par le dioxygène, les nodosités racinaires sont riches en leghémoglobine, une hémoglobine végétale qui empêche l’O2 de diffuser librement 1. En échange, la Fabacée cède des sucres aux bactéroïdes. Les symbioses avec des bactéries diazotrophes, c’est-à-dire fixant le diazote, s’observent également chez les aulnes, en symbiose avec des bactéries du genre Frankia. Au total, jusqu’à 20 % des glucides produits par photosynthèse peuvent être cédés aux partenaires symbiotiques racinaires.
Ces nodosités hébergent des bactéries diazotrophes du genre Rhizobium. Celles-ci fixent le diazote atmosphérique N2 et le convertissent en ions ammonium NH4+ utilisables par la plante, en échange de sucres issus de la photosynthèse.
Les dynamiques et régulations impliquant différents niveaux trophiques
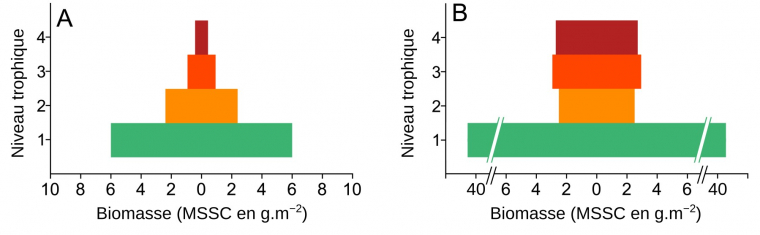
La quantification de la biomasse ou de l’énergie contenue dans les différents niveaux trophiques peut être présentée sous la forme de pyramides (Figure 9).
MSSC : masse sèche sans cendres. Les deux sites sont éloignés de 5 km mais présentent des conditions écologiques très différentes. Dalby Bay est une baie ouverte sur le large avec peu d’apports anthropiques, alors que Kertinge Nor est une baie très fermée, avec d’importants apports en nitrates et en phosphates issus de l’agriculture et des rejets d’eaux usées qui ont conduit à une eutrophisation. Les espèces ont été collectées dans les deux sites durant le mois de juin 2011. L’estimation des niveaux trophiques se base à la fois sur le suivi de certains isotopes (13C et 15N), le contenu de l’estomac et les données issues de la littérature scientifique pré-existante. On note que les formes des pyramides diffèrent ; des données complémentaires montrent aussi que les réseaux trophiques sont moins complexes à Kertinge Nor.
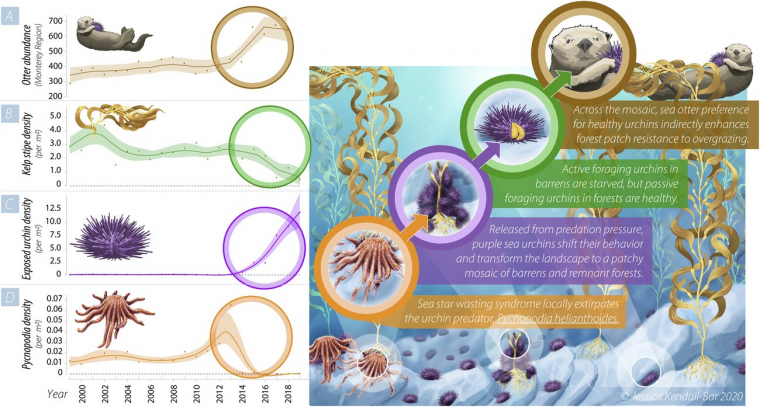
La dynamique des écosystèmes peut être régie par des effets ascendants (bottom-up), où ce sont les niveaux inférieurs qui contrôlent la dynamique des niveaux supérieurs, ou descendants (top-down), où c’est l’inverse. Par exemple, une augmentation de biomasse végétale peut favoriser une augmentation des populations d’herbivores, suivie d’une augmentation des populations de carnivores : c’est l’effet bottom-up. L’effet inverse est illustré dans le cas d’un écosystème particulier, les forêts de laminaires (également appelées forêts de kelp ou varech et formées par des algues brunes de grande taille) (Figure 10). Lorsque les loutres sont présentes, elles consomment les oursins brouteurs de kelp et la forêt de kelp est bien développée ; en l’absence des loutres, les oursins prolifèrent et endommagent le kelp : c’est l’effet top-down. Comme le réseau trophique est ramifié, d’autres espèces peuvent contribuer à cet effet. Par exemple, la disparition des étoiles de mer, également prédatrice des oursins, peut entraîner une prolifération locale de ceux-ci, qui ravagent certaines portions de la forêt de kelp. Dans cet habitat mosaïque, les oursins qui habitent les portions « surpâturées » sont en moins bonne santé que les oursins vivant dans les zones encore préservées de la forêt de kelp. La préférence des loutres pour les oursins en bonne santé contribue à préserver les portions non endommagées de la forêt de kelp.
Les étoiles de mer subissent parfois des épisodes de mortalité élevée, probablement en raison d’une infection virale (syndrome du dépérissement de l’étoile de mer). Comme ce sont des prédateurs majeurs au sein des écosystèmes benthiques, leur absence entraîne alors une prolifération de leurs proies, les oursins violets, qui dévorent les forêts de laminaires (un type de macroalgue brune). Certaines zones sont davantage surpâturées que d’autres, les oursins qui les peuplent manquent de nourriture et sont en mauvaise santé. Les loutres de mer montrent une préférence pour les oursins en bonne santé, présents dans les zones préservées. Les loutres empêchent donc le surpâturage de ces zones, ce qui maintient le caractère hétérogène de l’habitat, avec la coexistence de zones préservées et de zones dévastées par les oursins. L’effet top-down est donc ici dû à la fois à l’influence des loutres et des étoiles de mer, deux superprédateurs, c’est-à-dire des prédateurs de niveaux trophiques élevés.
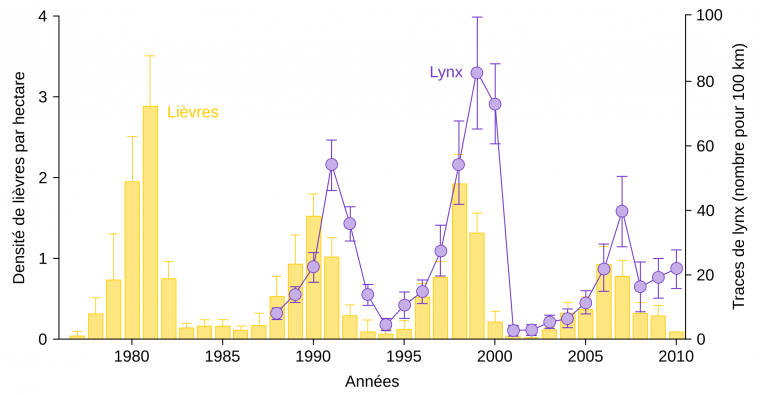
Par ailleurs, des prédictions peuvent être réalisées sur la dynamique temporelle des populations en interaction au sein d’un réseau trophique : de nombreux modèles mathématiques prévoient des fluctuations cycliques ; parmi ces derniers, le plus simple est le modèle de Lotka et Volterra. Celui-ci prévoit des fluctuations cycliques des populations d’une proie et de son prédateur, avec un léger décalage : la variation à la hausse ou à la baisse de la population de proies est suivie par une variation similaire de la population de prédateurs, avec un peu de retard (Figure 11). Néanmoins, la prédation n’est pas le seul facteur susceptible de faire varier l’effectif d’une population : elle peut par exemple être affectée par des parasites ou encore par des événements météorologiques extrêmes.
La densité des lièvres a été déterminée entre 1977 et 2010 dans la région du lac Kluane (Yukon, Canada). Le nombre de lynx a été estimé, de 1988 à 2010, à partir des traces de pas laissées dans la neige. Les barres associées aux valeurs représentent les intervalles de confiance à 95 %.
Le cas particulier des décomposeurs et des parasites
Enfin, les parasites et les décomposeurs occupent une place particulière dans les réseaux trophiques. En effet, les parasites consomment bien une partie de la matière organique de leurs hôtes, mais ils sont généralement bien plus petits et plus nombreux que les hôtes (par exemple, les puces piquent le chien, mais ne sont pas véritablement des prédateurs du chien !). Par ailleurs, les réseaux trophiques du sol sont surtout basés sur la décomposition de la matière organique morte (feuilles, branches, cadavres d’animaux…). Ils font intervenir des champignons, des animaux macroscopiques comme les lombrics ou les cloportes, des bactéries… Leur rôle est essentiel pour le recyclage de la matière organique, c’est-à-dire sa minéralisation et la mise à disposition des nutriments minéraux pour les producteurs primaires.
Les interactions interspécifiques jouent donc un rôle clé dans les fonctions de nutrition au sens large, et donc in fine dans les transferts de matière et d’énergie au sein des écosystèmes. Elles interviennent également dans une autre grande fonction du vivant : la reproduction.
Les relations interspécifiques dans la reproduction et la dispersion des espèces
La pollinisation : une affaire de mutualisme
La pollinisation entomophile (synonyme de « entomogame »), c’est-à-dire le transport de pollen par les insectes, est un mutualisme essentiel à la reproduction de nombreuses Angiospermes. Les grains de pollen des fleurs à pollinisation entomophile sont plutôt gros et s’accrochent aux insectes grâce aux ornementations de leur paroi externe, l’exine. D’autres adaptations ont été sélectionnées par l’évolution, tant chez les plantes que chez les insectes pollinisateurs. Par exemple, les fleurs pollinisées par les hyménoptères (abeilles, bourdons…) possèdent des motifs dans l’ultraviolet, que perçoivent ces insectes. Par ailleurs, les sauges (genre Salvia, famille des Lamiacées) présentent une configuration particulière de leurs étamines : lorsque l’insecte s’enfonce dans la fleur, il appuie sur une sorte de pédale liée aux étamines, qui basculent et viennent lui tapoter le dos, le recouvrant ainsi de pollen (Figure 12).
Une abeille solitaire du genre Anthophora pollinise une fleur de sauge (genre Salvia, famille des Lamiacées). L’abeille a été attirée par la coloration de la fleur, sa symétrie bilatérale et son odeur. On distingue les étamines « à bascule » qui lui tapotent le dos. Les poils de l’abeille permettent au pollen de s’accrocher efficacement.
De nombreux papillons possèdent une trompe qu’ils utilisent pour se nourrir du nectar des fleurs1 2. La plupart des espèces de papillons se nourrissant de nectar sont opportunistes, c’est-à-dire capables de se nourrir sur de nombreuses espèces de plantes en adaptant la longueur de leur trompe à la profondeur des nectaires.
La dispersion des semences végétales par les animaux
Par ailleurs, divers animaux sont impliqués dans la dissémination des fruits et des graines, par zoochorie. Ils permettent donc la colonisation de nouveaux milieux par les végétaux. Dans le cas de l’épizoochorie, les graines ou fruits s’accrochent aux poils ou plumes de l’animal : c’est le cas de la bardane ou du gaillet gratteron, qui possèdent de nombreux petits crochets. Dans le cas de l’endozoochorie, l’animal consomme les fruits, dont les graines transitent alors par son tube digestif : c’est le cas du gui (Viscum album), un hémiparasite qui pousse sur les branches d’autres arbres. Les baies de gui sont consommées par les grives : lorsque celles-ci fientent sur les arbres, la substance collante qui entoure le noyau permet à la graine de rester collée à la branche et d’y germer. Les gros animaux peuvent être aussi responsables du transport des petits invertébrés : par exemple, les oiseaux peuvent transporter accidentellement sur leurs pattes des œufs de crustacés ou de mollusques, qu’ils véhiculent ainsi d’un lac à l’autre.
Les cortèges microbiens du sol favorisant ou limitant la germination des plantules
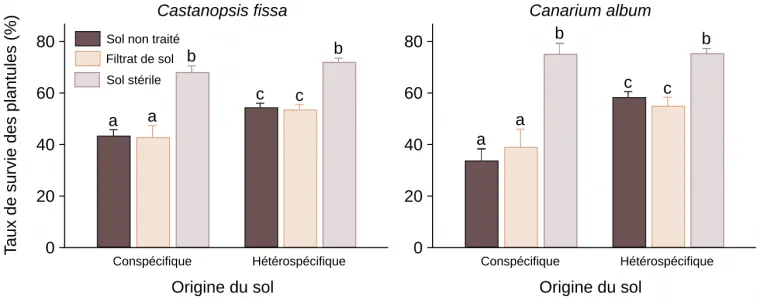
Enfin, les interactions interspécifiques jouent un rôle important dans la répartition des différents individus d’une population végétale. Par exemple, il peut arriver que les graines ou plantules d’une espèce donnée se développent moins bien dans un sol prélevé au pied de plantes adultes de la même espèce que dans un sol prélevé au pied de plantes adultes d’espèces différentes. Cela s’explique par le fait que les racines d’une plante donnée attirent parfois un cortège de parasites et de pathogènes spécifiques de cette espèce, qui sont néfastes aux jeunes plantes. Il existe donc un compromis entre la dispersion des graines (qui diminue avec l’éloignement à la plante mère) et la probabilité de développement des graines et plantules (qui, à l’inverse, augmente avec l’éloignement à la plante mère). En résumé, il se peut qu’une graine ou qu’une plantule ne puisse pas bien se développer si elle est trop proche de la plante-mère : ce phénomène s’appelle l’effet Janzen-Connell (Figures 13 et 14) 3.
Des graines de deux espèces d’arbres, Castanopsis fissa et Canarium album, ont été collectées une forêt subtropicale du sud de la Chine. En même temps, des échantillons de sol situés au même endroit que les graines, où à distance, ont été prélevés. Plus tard, en laboratoire, des plantules de Castanopsis fissa ou de Canarium album ont été plantées dans un sol non traité, dans un sol stérilisé par passage à l’autoclave ou dans un sol stérilisé puis mélangé avec un filtrat non stérilisé du même sol. Ces expériences ont été menées avec du sol de deux origines : soit le sol prélevé au même endroit que les graines (conspécifique), soit du sol situé à distance (hétérospécifique). Des lettres différentes indiquent des résultats statistiquement différents. Les résultats montrent que la survie des plantules est meilleure lorsqu’elles poussent dans un sol hétérospécifique par rapport à un sol conspécifique. Lorsque le sol est stérilisé, cet effet disparaît. Cela signifie que des éléments vivants du sol diminuent la capacité des plantes à pousser dans un sol conspécifique. Comme l’utilisation d’un filtrat de sol mène au même résultat qu’avec le sol non traité, on en déduit que ce ne sont pas les macro-organismes qui sont responsables de l’effet Janzen-Connell, mais les micro-organismes du sol.
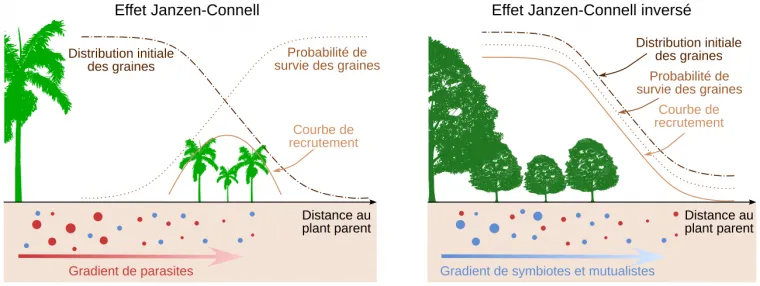
Parfois, on observe plutôt un « effet Janzen-Connell inverse » : les partenaires symbiotiques, eux aussi plus concentrés à proximité de la plante-mère, l’emportent sur les pathogènes 1. Dans ce cas, la probabilité de développement des plantules est donc plus élevée à proximité des arbres de la même espèce (Figure 14).
On observe parfois que des graines ou des plantules se développent moins bien sur un sol prélevé à proximité d’une plante de la même espèce que sur un sol prélevé à proximité d’une plante d’une espèce différente. Cela est dû au fait que le système racinaire d’une plante donnée attire des pathogènes et des parasites spécifiques, qui peuvent réduire la survie des graines et plantules. La probabilité de survie des graines et plantules augmente alors avec la distance au plant mère, mais comme la probabilité de dispersion diminue avec cette distance, il existe un éloignement pour lequel on observe un maximum de germination et de survie des plantules (« courbe de recrutement ») : c’est l’effet Janzen-Connell. Cela tend à éloigner les plants d’une même espèce au sein d’un écosystème et à favoriser la diversité spécifique.
Il se peut, à l’inverse, que l’influence des symbiotes et mutualistes du sol (comme les champignons mycorhiziens, les bactéries du genre Rhizobium, etc.) prédomine sur celle des pathogènes. Les graines et plantules se développent mieux à proximité du plant mère : c’est l’effet Janzen-Connell inversé. Celui-ci conduit à des peuplements moins diversifiés en termes d’espèces.
Il convient toutefois de noter que les effets Janzen-Connell et Janzen-Connell inversé ne suffisent pas, à eux seuls, à expliquer la répartition des espèces végétales dans un écosystème donné. Plusieurs autres facteurs peuvent entrer en jeu, qu’ils soient abiotiques (inégale répartition des ressources nécessaires à la croissance de l’espèce considérée) ou biotiques (compétition intraspécifique, allélopathie…) 1.
Source des images : Veitchia arecina, Mason McNair, CC-BY, Phylopic ; Quercus rubra, Gabriela Palomo-Munoz, CC-BY, Phylopic ;
Ainsi, les interactions interspécifiques contribuent à la reproduction et à la dispersion des espèces, et mettent en jeu des adaptations qui résultent de la sélection naturelle.
Les conséquences écologiques et évolutives des relations interspécifiques
Les conséquences évolutives des interactions interspécifiques : coévolution, arbres en miroir et effet Reine Rouge
Lorsque deux espèces interagissent, quelle que soit l’interaction, une modification du phénotype de l’une peut créer une pression de sélection sur l’autre et ainsi entraîner une modification de son phénotype 1. Un exemple est donné par les orchidées de l’espèce Angraecum sesquipedale, qui présentent un éperon à nectar extrêmement long. En les observant, Darwin a prédit l’existence d’un papillon à très longue trompe, à l’origine de la pollinisation de celles-ci. Ce papillon a fini par être découvert : il fut nommé Xanthopan morganii praedicta ! En effet, il y a coévolution entre la profondeur de l’éperon et la taille de la trompe des papillons pollinisateurs. Les papillons possédant de longues trompes peuvent se nourrir sur une grande variété de fleurs. En retour, les orchidées à long éperon « forcent » les papillons à s’enfoncer profondément dans la fleur pour pouvoir boire le nectar, ce qui augmente la probabilité que les pollinies se fixent à l’insecte et soient transportés jusqu’à une autre orchidée.
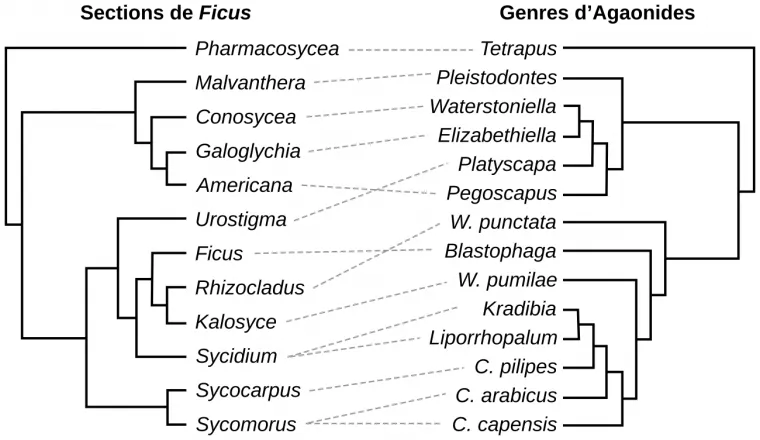
Lorsque les relations sont très étroites, presque exclusives, les arbres phylogénétiques des espèces considérées peuvent être en miroirs. Un exemple est donné par l'interaction entre les figuiers du genre Ficus et leurs guêpes pollinisatrices Agaonides (Figures 15 et 16).
Le genre Ficus contient environ 800 espèces, ce qui en fait l’un des plus diversifiés de la flore tropicale. Les espèces y sont regroupées en sections, chaque section contenant quelques dizaines d’espèces : il y a par exemple la section Urostigma, la section Rhizocladus, etc. L’une des sections porte le même nom que le genre, à savoir Ficus. Pour l’arbre des Agaonides, certains noms indiquent parfois des espèces (par exemple, W. punctata) et parfois des taxons plus larges (par exemple, le genre Blastophaga). Les traits en pointillés gris indiquent les interactions entre taxons. Ces phylogénies « en miroir » (plus ou moins parfait) témoignent d’un phénomène de coévolution : la spéciation des figuiers entraîne celle des guêpes mutualistes et réciproquement.
Ces arbres en miroir se retrouvent parfois aussi dans les interactions hôte-parasite, où ils résultent d’une course aux armements : les êtres vivants sont contraints d’évoluer, pour maintenir leur valeur sélective face aux espèces avec lesquelles ils coévoluent. On parle de l’effet Reine Rouge, en référence au roman De l’autre côté du miroir (la suite d’Alice au Pays des Merveilles), où la reine de cœur « court pour rester au même endroit » 1.
Gardons à l’esprit que les figuiers et les orchidées sont des exemples un peu particuliers. Dans le cas des interactions entre plantes entomophiles et insectes pollinisateurs, la spécialisation n’est souvent que dans un seul sens : beaucoup d’insectes ne pollinisent qu’un seul type de plante, mais beaucoup de plantes sont pollinisées par de nombreux insectes différents.
Les interactions interspécifiques impliquées dans la structure et les variations des niches écologiques
La niche écologique désigne l’ensemble des conditions d’existence d’une espèce : paramètres climatiques, disponibilité des habitats, des ressources alimentaires… La niche écologique potentielle désigne la niche écologique théorique que posséderait une espèce donnée placée seule dans un milieu : elle dépend donc essentiellement des ressources alimentaires et des paramètres abiotiques. La niche écologique réalisée désigne la niche réelle occupée par l’espèce. Souvent, la niche réalisée d’une espèce est plus étroite que sa niche potentielle, en raison des interactions négatives qu’elle peut subir de la part d’autres espèces : compétition, prédation, parasitisme. Par exemple, la compétition pour la lumière est un facteur majeur du développement des forêts. En plaine de zone tempérée, le chêne rouvre (Quercus petraea), espèce héliophile, germe et grandit plus vite que le hêtre (Fagus sylvatica). Toutefois, les graines de hêtre peuvent germer à l’ombre (espèce sciaphile), les jeunes hêtres grandissent et finissent par faire de l’ombre aux chênes. Les hêtres étant en moyenne plus hauts que les chênes, la chênaie est progressivement remplacée par une hêtraie, qui constitue le climax de la succession écologique… sauf dans les milieux chauds et secs, où le hêtre se développe mal. La niche écologique réalisée du chêne est donc limitée par la compétition avec les hêtres.
Par ailleurs, des espèces clé de voûte et des espèces ingénieurs jouent un rôle déterminant dans la structuration de l’écosystème. Une espèce clé de voûte est une espèce dont la disparition change profondément le fonctionnement de l’écosystème, et ce de manière non proportionnelle à son abondance ou à sa biomasse (une espèce qui aurait un impact important en raison d’une biomasse énorme ne serait pas considérée comme « clé de voûte »). Par exemple, les loutres de mer Enhydra lutris consomment les oursins (Strongylocentrotus polyacanthus) et limitent ainsi la consommation des laminaires : en l’absence des loutres, l’écosystème peut être considérablement modifié 2.
Le concept d’espèce clé de voûte
Le concept d’espèce clé de voûte a initialement été proposé par Robert Paine (1933-2016) en 1969 1. Il avait publié, trois ans plus tôt, un article montrant que le retrait expérimental de l’étoile de mer Pisaster ochraceus modifiait profondément la diversité des espèces présentes sur un estran rocheux du Pacifique 2. En l’absence de ce superprédateur, la communauté était dominée par des moules, alors qu’elle était bien plus diversifiée en présence de l’étoile de mer.
Depuis sa première formulation, de nombreuses espèces ont été qualifiées de clé de voûte, le plus souvent en considérant qu’elles avaient sur l’écosystème un effet disproportionné par rapport à leur abondance ou à leur biomasse 3. Cependant, cette définition souffre de nombreuses limites. D’une part il est très généralement impossible de quantifier l’abondance ou la biomasse de l’ensemble des espèces d’un écosystème. D’autre part, la nature de l’effet mesuré varie selon les études : richesse spécifique, productivité, cycle biogéochimiques… Enfin, la quantification de l’effet peut être difficile et le seuil retenu pour qualifier une espèce de clé de voûte n’est pas univoque.
Les bovins, des clés de voûte de l’écosystème prairial ?
En l’absence de bovins, les prairies peuvent évoluer vers des écosystèmes de type forêt. En effet, en broutant les jeunes pousses et en piétinant le sol, les bovins ne permettent pas le développement des arbres et contribuent donc à maintenir l’écosystème sous forme de prairie. Cependant, les bovins constituent une espèce prédominante dans l’écosystème prairial et ne répondent donc pas à la définition d’espèce clé de voûte qui ne s’applique qu’aux espèces ayant une biomasse ou une abondance faible dans l’écosystème.
Une espèce ingénieur est une espèce qui modifie la structure de l’écosystème, créant de nouvelles niches écologiques pour d’autres espèces. Le pic noir est une espèce ingénieur en milieu forestier, car il creuse des cavités qui sont ensuite utilisées par d’autres oiseaux (chouettes, sittelles…).
Conclusion
Les relations interspécifiques de type « relations d’exploitation » sont responsables de l’architecture et de la dynamique des réseaux trophiques et conditionnent la circulation de matière et d’énergie au sein d’un écosystème. Les relations interspécifiques à bénéfices réciproques (mutualismes, symbioses) améliorent les rendements ainsi que la reproduction et la dispersion des végétaux. La compétition et les relations d’exploitation restreignent les niches écologiques. L’espèce humaine joue un rôle déterminant dans la répartition des autres espèces au sein des écosystèmes : les êtres humains et leurs animaux d’élevage représentent près de 95 % de la biomasse totale des Mammifères ! L’appauvrissement de la biodiversité lié aux monocultures et aux systèmes d’élevages intensifs rend les écosystèmes moins résilients face à des attaques de pathogènes ou des modifications du milieu. Des techniques agroécologiques actuelles prônent le maintien d’une certaine diversité interspécifique au sein des zones cultivées (maintien de haies, coculture, etc.).