Les écosystèmes, tout comme les populations des différentes espèces qui y vivent en interaction, sont des entités très dynamiques. La biomasse ainsi que les effectifs des multiples populations animales et végétales peuvent fluctuer fortement au cours du temps, à cause des interactions entre les espèces et de perturbations de l’environnement physique.
Un écosystème se caractérise donc par un équilibre dynamique susceptible d’être bousculé par des facteurs internes et externes.
Alors que le programme de SVT de première mentionne qu’un écosystème est dans « un équilibre dynamique », ce concept peut être interprété de plusieurs manières. Par définition, un équilibre est un état où un système s’immobilise, souvent par l’action de forces opposées. L’équilibre peut être stable, comme dans le cas d’un rocher situé au fond d’une vallée, ou instable, si le même rocher est posé en haut d’une montagne. Un équilibre dynamique peut référer à une situation où l’équilibre est stable mais créé par des processus dynamiques, comme dans le cas d’une réaction chimique où des mécanismes de destruction et création d’une molécule amènent progressivement à une concentration constante de cette molécule, même si la réaction continue. La quantité de biomasse carbonée dans un écosystème et les effectifs de populations particulières sont soumis à des mécanismes similaires, puisque les naissances et les morts peuvent s’équilibrer pour donner une valeur fixe de la variable d’état considérée (biomasse ou effectif). Mais un équilibre dynamique peut aussi correspondre à une variable fluctuante au cours du temps, par exemple d’une année à l’autre, selon un régime de fluctuation stable au fil des ans – la dynamique de l’écosystème, ou des populations qui le composent, apparaît alors instable sur le court terme mais potentiellement stable sur le long terme. Un exemple typique de cette situation peut s’observer dans le Grand Nord canadien.
La dynamique des lynx et des lièvres au Canada
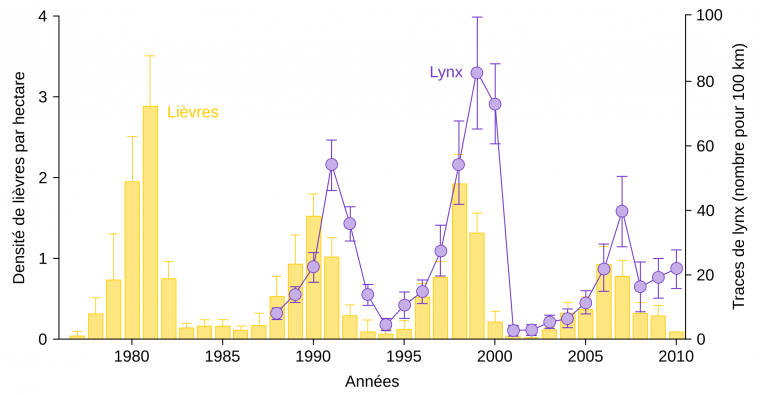
Le lynx du Canada (Lynx canadensis) et le lièvre d’Amérique (Lepus americanus) sont deux espèces emblématiques des écosystèmes du Grand Nord canadien, et des cas d’études fondateurs de l’écologie scientifique [1]. Le lièvre peut représenter en outre une part importante de la biomasse des herbivores de la forêt boréale, ce qui fait de ses effectifs une variable clé pour comprendre le devenir de l’écosystème [2]. Or ses effectifs fluctuent d’une année à l’autre, de manière relativement régulière, avec une périodicité d’environ 10 ans, tout comme le lynx [1]. La raison principale est liée au fait que les dynamiques des populations de lynx et de lièvres sont couplées par le phénomène de prédation. En effet, l’augmentation des populations de lynx, qui mangent les lièvres, génère des déclins des populations de lièvres lorsque les premiers arrivent à des densités très élevées (Fig. 1). La chute de la population de lièvres produit alors, avec un certain délai, une chute de la quantité de lynx.
La densité des lièvres a été déterminée entre 1977 et 2010 dans la région du lac Kluane (Yukon, Canada). Le nombre de lynx a été estimé, de 1988 à 2010, à partir des traces de pas laissées dans la neige. Les barres associées aux valeurs représentent les intervalles de confiance à 95 %.
Ces dynamiques sont prédites par les modèles théoriques couplés dits « proie-prédateur », dont les équations de Lotka-Volterra sont la version la plus simple (voir [3] pour des versions avancées appliquées au lièvre et au lynx). Dans ces modèles mathématiques, l’état stable ne correspond pas à deux valeurs fixes, une pour le prédateur et une pour la proie, mais à des trajectoires cycliques où le nombre de prédateurs « suit » celui des proies. Cependant, si l’on regarde les variations de populations non pas à l’échelle de quelques années, mais à celle de plusieurs décennies ou siècles, la gamme de valeurs prises par l’effectif des populations apparaît comme relativement stable : la stabilité est donc question d’échelle de temps.
Néanmoins, il est rare que les dynamiques de deux espèces s’expliquent intégralement l’une par rapport à l’autre. De fait, certains aspects de la dynamique du lièvre d’Amérique, comme la phase de basse densité qui suit l’effondrement de la population, sont encore mal comprises et n’ont probablement qu’un rapport indirect à la prédation. Un exemple mieux compris de dynamique aux causes multiples vient également du Nord américain, avec l’Isle Royale, sur le lac Supérieur.
La dynamique des loups et des élans sur l’Isle Royale
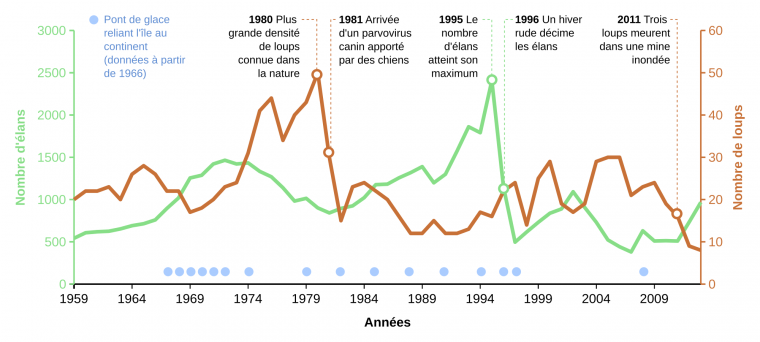
De prime abord, on pourrait penser que la dynamique des loups (Canis lupus) et des élans (Alces alces) sur l’Isle Royale (Fig. 2) suit le même genre de dynamique proie-prédateur que les lièvres et les lynx. Mais ce serait négliger une grande richesse dans les causes des variations des effectifs sur l’Isle Royale. Dans les années 1980, les loups atteignent la plus grande densité connue alors qu’ils sont arrivés en 1949 (les élans vers 1900), grâce à la glace d’hiver qui leur a permis de traverser depuis le bord du lac. L’observateur de 1980 pensait sans doute voir un cycle proie-prédateur de 1959 à 1980, avec diminution de la population d’élans due en partie à la prédation par le loup. Mais celle-ci n’est pas due qu’au loup, elle est également due à des hivers rigoureux qui font diminuer la survie des élans [4]. La série temporelle s’éloigne encore plus d’un cycle proie-prédateur en 1981, où le fort déclin de la population de loups est dû à un virus. De 1981 à 1996, la population d’élans croit de nouveau jusqu’à une taille de population très importante, suite à des années de faible prédation et un environnement favorable, mais un hiver très rigoureux en 1996, peu de nourriture disponible, ainsi qu’une abondance de tiques est responsable d’un déclin massif (60 %) de la population d’élans cette année-là [4,5]. Par ailleurs, dans la suite de l’étude les chercheurs ont montré que les tiques ont eu un impact sur le déclin continuel de la population d’élans [6], alors que la population de loups a fini par être affectée par la consanguinité (post-2006, après la mort d’un reproducteur provenant d’une autre population). La population de loups s’est réduite par l’action conjuguée d’accidents et de la consanguinité, alors que le lien avec le continent par la glace d’hiver n’est plus maintenu.
L’Isle Royale est située sur le lac Supérieur, le plus vaste des Grands Lacs d'Amérique du Nord, et situé à cheval entre les États-Unis et le Canada.
Bien que la taille de l’Isle Royale (535 km2) ne permette pas de tirer des conclusions générales sur les effets de la prédation par les loups sur la dynamique des proies, cette étude particulièrement poussée des causes des fluctuations d’effectifs de deux espèces-clé de l’écosystème permet de faire le constat pragmatique suivant [4] : même deux espèces a priori fortement interagissantes ont des dynamiques qui fluctuent non seulement l’une par rapport à l’autre, mais également en raison d’autres facteurs, en particulier les événements météorologiques extrêmes ou les agents pathogènes.
En résumé, pour ces espèces comme pour beaucoup d’autres, l’abondance d’une population ne tend pas vers une valeur constante, comme ce qui est prédit par le modèle de croissance logistique. Au moins deux phénomènes empêchent l’atteinte d’un état d’équilibre fixe :
- des interactions entre les espèces qui produisent des oscillations au long cours (parfois même des interactions intra-espèces comme dans les cas de cannibalisme chez les insectes, poissons… [8]) ;
- des variations de l’environnement « externe » (phénomènes météorologiques extrêmes, variations climatiques, maladies…)1.
Cette interaction entre une dynamique intrinsèque et des perturbations externes s’observe non seulement lorsque seules quelques espèces sont en interaction, mais aussi dans le cas de communautés riches (ensemble de populations de nombreuses espèces) voire d’écosystèmes entiers (incluant également les variables abiotiques, par exemple la chimie du sol). Nous prenons maintenant l’exemple des perturbations fréquentes des écosystèmes forestiers.
Les forêts et leurs perturbations
De nombreuses zones favorables à l’établissement d’un écosystème forestier suivent ce que l’on appelle une succession écologique, au sens où des espèces végétales dites pionnières commencent à coloniser un sol nu, qui ensuite s’enfriche, faisant place à des arbustes, puis des arbres, avec de temps à autre une espèce d’arbre qui finit par dominer, comme dans la forêt boréale. Les tempêtes, le feu et parfois les pathogènes des arbres ont pour effet de perturber l’état final de la succession, de « remettre les pendules à zéro » en quelque sorte. Pourvu que les effets du feu ou des tempêtes ne soient pas spatialement uniformes, ces perturbations rares à l’échelle humaine (quelques-unes par siècle) mais récurrentes sur l’échelle temporelle de la dynamique des forêts (plusieurs siècles voire millénaires) permettent de maintenir une diversité des paysages et des espèces végétales [9, 10, 11].
En septembre 1988 (à gauche), peu de temps après un feu dans ce peuplement de douglas (Pseudotsuga menziesii) dans le parc national de Yellowstone, le sol ressemblait à un « fond de barbecue », selon l'écologiste Jay Anderson, de l'Idaho State University. Mais au mois de juillet suivant (à droite), un tapis de plantes herbacées s’était développé à partir des racines et des graines qui avaient survécu dans le sol.
En effet, bien que souvent envisagés comme des phénomènes dramatiques, les feux de forêt n’ont pas que des impacts négatifs sur ces écosystèmes, et peuvent même avoir des effets positifs sur la biodiversité [11]. De petits feux fréquents peuvent empêcher l’accumulation de biomasse qui constitue sinon un substrat propice au développement de grands feux plus dommageables. Ils créent également une mosaïque de milieux (de grands feux constituent à l’inverse une forte perturbation spatialement uniforme). Dans les forêts boréales, le régime de perturbation par le feu permet ainsi le maintien d’une diversité floristique et faunistique (Fig. 3), avec recolonisation rapide des zones brûlées par les graines venant de la banque de graines du sol ainsi que des plantes des milieux environnants. Cela dit, l’effet bénéfique de ces perturbations par le feu n’est pas généralisable à tous les écosystèmes. D’autres forêts, comme la forêt tropicale humide, sont bien plus sensibles aux incendies. Cette sensibilité est également observable pour des écosystèmes anthropisés : une forêt de plantation en milieu tempéré à aride, par exemple, risque de bien moins supporter les incendies que la forêt boréale même si cette dernière est également dominée par un petit nombre d’espèces d’arbres. Les avantages comparés des différentes stratégies de gestion du feu dans des forêts gérées sont l’objet de recherches actuelles [13], notamment dans un contexte de changement climatique où la suppression totale des feux est délicate.
En revanche, d’autres écosystèmes sont intégralement dépendants du régime de feu pour le maintien de la diversité, comme les prairies et savanes des milieux tropicaux [14]. Il convient de bien remarquer que ces écosystèmes ne sont pas de simples forêts dégradées, mais un état alternatif de l’écosystème avec sa propre dynamique et biodiversité [15]. Dans ces écosystèmes, la perturbation par le feu est très fréquente et les espèces y ont eu le temps de s’y adapter (au travers de leurs racines, graines… cf. [15]). Par contre, les savanes et prairies sont beaucoup plus sensibles aux perturbations anthropiques (par exemple au bétail introduit, à l’agriculture, à l’exploitation minière ou encore à l’afforestation) qu’elles n’ont pas rencontré dans leur histoire évolutive [16].
Résumé des points principaux
-
En fonction de l’échelle de temps considérée, un même écosystème peut être décrit comme instable ou stable. Par exemple, une espèce dont les effectifs fluctuent fortement sur quelques années peut apparaître comme stable à l’échelle de quelques décennies ou siècles, si le régime de fluctuations temporelles ne change pas.
-
Dans certains cas, les fluctuations de composantes d’un écosystème (en effectifs ou en biomasse) peuvent être attribuées à une cause principale (par exemple un prédateur ; cas de la relation lièvre-lynx). Dans la majorité des cas néanmoins, des facteurs multiples vont interagir : interactions proie-prédateur mais aussi hôte-parasite, phénomènes météorologiques, barrières aux migrations (cas de la relation élan-loup).
-
Les événements météorologiques « extrêmes » (feu, canicule, gel précoce, tempêtes…) ont souvent une influence marquée sur la dynamique des écosystèmes, mais celle-ci est difficile à déceler sur quelques années pendant lesquelles les phénomènes ne se produisent pas nécessairement vu leur nature aléatoire. Ceci peut conférer aux écosystèmes une apparence trompeuse de constance de leur état (par exemple en forêt).
-
Les perturbations naturelles générées par le climat peuvent ainsi engendrer une dynamique à long-terme sur de nombreux écosystèmes, en remettant à zéro les successions écologiques, ainsi qu’une diversité spatiale de ces écosystèmes, si ces perturbations ne sont pas trop synchronisées spatialement.
-
Ces perturbations récurrentes sont à différencier de phénomènes directionnels, que ceux-ci soient d’origine plutôt biologique (par exemple, évolution des caractéristiques morphologiques des herbivores) ou plutôt géologique (par exemple, changement climatique liés à la modification des concentrations en gaz à effet de serre dans l’atmosphère).
Références
[1] Elton, C., & Nicholson, M. (1942). The ten-year cycle in numbers of the lynx in Canada. Journal of Animal Ecology,11(2), 215-244. https://doi.org/10.2307/1358
[2] Krebs, C. J. (2011). Of lemmings and snowshoe hares : the ecology of northern Canada. Proceedings of the Royal Society B : Biological Sciences, 278(1705), 481-489.
https://doi.org/10.1098/rspb.2010.1992
[3] King, A. A., & Schaffer, W. M. (2001). The geometry of a population cycle : a mechanistic model of snowshoe hare demography. Ecology, 82(3), 814-830. https://doi.org/10.2307/2680200
[4] Peterson, R. O., Vucetich, J. A., Bump, J. M., & Smith, D. W. (2014). Trophic cascades in a multicausal world : Isle Royale and Yellowstone. Annual Review of Ecology, Evolution, and Systematics, 45, 325-345. https://doi.org/10.1146/annurev-ecolsys-120213-091634
[5] Vucetich, J. A., & Peterson, R. O. (2009). Wolf and moose dynamics on Isle Royale. In Recovery of gray wolves in the great lakes region of the United states (pp. 35-48). Springer, New York, NY. https://link.springer.com/chapter/10.1007/978-0-387-85952-1_3
[6] https://isleroyalewolf.org/overview/overview/at_a_glance.html
[7] Mlot, C. (2013). Ecology. Are Isle Royale's wolves chasing extinction?. Science (New York, NY), 340(6135), 919-921. https://science.sciencemag.org/content/340/6135/919
[8] Bjørnstad, O. N., & Grenfell, B. T. (2001). Noisy clockwork : time series analysis of population fluctuations in animals. Science, 293(5530), 638-643. https://doi.org/10.1126/science.1062226
[9] Romme, W. H. (1982). Fire and landscape diversity in subalpine forests of Yellowstone National Park. Ecological Monographs, 52(2), 199-221. https://doi.org/10.2307/1942611
[10] Kulakowski, D., Seidl, R., Holeksa, J., Kuuluvainen, T., Nagel, T. A., Panayotov, M.,… & Bebi, P. (2017). A walk on the wild side : disturbance dynamics and the conservation and management of European mountain forest ecosystems. Forest ecology and management, 388, 120-131. https://doi.org/10.1016/j.foreco.2016.07.037
[11] He, T., Lamont, B. B., & Pausas, J. G. (2019). Fire as a key driver of Earth's biodiversity. Biological Reviews, 94(6), 1983-2010. https://doi.org/10.1111/brv.12544
[12] Baskin, Y. (1999). Yellowstone fires : a decade later : ecological lessons learned in the wake of the conflagration. BioScience, 49(2), 93-97. https://academic.oup.com/bioscience/article/49/2/93/240373 Autres sources d’informations sur les effets des feux de forêt dans le Yellowstone https://www.arcgis.com/apps/Cascade/index.html?appid=a1df1854a8f44b3995ff2bb5b605db26
[13] Curt, T., & Frejaville, T. (2018). Wildfire policy in Mediterranean France : how far is it efficient and sustainable ? Risk analysis, 38(3), 472-488. https://doi.org/10.1111/risa.12855
[14] Bond, W. J., & Parr, C. L. (2010). Beyond the forest edge : ecology, diversity and conservation of the grassy biomes. Biological conservation, 143(10), 2395-2404. https://doi.org/10.1016/j.biocon.2009.12.012
[15] Veldman, J. W., Buisson, E., Durigan, G., Fernandes, G. W., Le Stradic, S., Mahy, G.,… & Bond, W. J. (2015). Toward an old‐growth concept for grasslands, savannas, and woodlands. Frontiers in Ecology and the Environment, 13(3), 154-162. https://doi.org/10.1890/140270
[16] Le Stradig, S., Buisson, E. (2022). Restaurer les savanes et les écosystèmes herbacés tropicaux, Encyclopédie de l’Environnement, [ISSN 2555-0950] https://www.encyclopedie-environnement.org/vivant/restaurer-savanes-ecosystemes-herbaces-tropicaux/