La plasticité cérébrale correspond à la faculté du cerveau à pouvoir se remodeler tout au long de la vie, à différentes échelles (synapses, neurones, réseaux neuronaux). Ce processus, indispensable aux apprentissages et à la mémoire, est également mis en jeu suite à des lésions cérébrales.
Le cerveau n’est pas un enregistreur passif de nos expériences mais un système dynamique qui traite les informations et se modifie en conséquence. La clé de cette capacité à construire et à élaborer sans cesse une représentation du monde réside dans la propriété du cerveau de pouvoir remodeler en permanence ses propres circuits neuronaux, c’est la plasticité cérébrale. Elle peut être définie comme la capacité du système nerveux à modifier son activité en réponse à des stimuli internes ou externes en réorganisant sa structure, ses fonctions ou ses connexions. Les recherches menées au cours du siècle dernier ont montré que la plasticité cérébrale est une propriété fondamentale des systèmes nerveux chez de nombreuses espèces, retrouvée aussi bien chez les insectes que chez l’être l’humain par exemple. Elle se manifeste au niveau du fonctionnement et de la structure des synapses, dans des modifications d’excitabilité des neurones et peut également être supportée par la genèse de nouveaux neurones. Ce phénomène de plasticité cérébrale est impliqué dans l’apprentissage et la mémoire, le développement et l’homéostasie du cerveau, l’entraînement sensoriel, mais aussi dans la récupération après des lésions cérébrales.
Un peu d’histoire
Au XIXe siècle, le neuroanatomiste espagnol Santiago Ramón y Cajal est le premier à définir le neurone comme l’unité cellulaire et physiologique du système nerveux. Ses travaux ont largement stimulé et influencé les premières théories sur les synapses, la transmission synaptique et la plasticité synaptique. Dès les années 1890, il faisait déjà l’hypothèse que l’apprentissage conduirait à la modification structurale des synapses connectant les neurones entre eux 1.
Au cours du XXe siècle, les modalités de stockage de l’information dans le cerveau stimule un nombre considérable de travaux axés sur la transmission synaptique. Le Canadien Donald Hebb est un des premiers à formuler une théorie concernant les mécanismes neuronaux pouvant sous-tendre l’apprentissage et la mémoire 2. Il suggère qu’un groupe de neurones déchargeant simultanément forme alors une « assemblée cellulaire » dont l’activité pourrait persister après l’événement déclencheur. En d’autres termes, il postule que lors d’un apprentissage, suite à leur activation, certaines synapses excitatrices d’une assemblée cellulaire développeraient une augmentation persistante de leur excitabilité, aboutissant ainsi à une efficacité de transmission accrue au sein de ces assemblées cellulaires de manière à les stabiliser. De plus, selon Hebb, l’activité neuronale pourrait induire un renforcement des connexions synaptiques préexistantes, mais également la croissance de nouvelles synapses afin d’augmenter l’efficacité de la transmission synaptique au sein du réseau neuronal activé. À la même période, un an avant Hebb, le polonais Jerzy Konorski postulait également que des changements morphologiques dans les connexions neuronales pouvait être le substrat de l’apprentissage 3. Conjointement, l’hypothèse Hebb-Konorski constitue l’un des fondements essentiels de la plupart des modèles neurobiologiques de la mémoire. Mais il faudra attendre l’élaboration de nouveaux outils techniques dans les années 70, vingt ans après l’énoncé de la théorie de Hebb, pour que des preuves expérimentales viennent étayer cette hypothèse avec la mise en évidence de la potentialisation à long terme dans l’hippocampe par Timothy Bliss et Terje Lømo 4.
La plasticité développementale
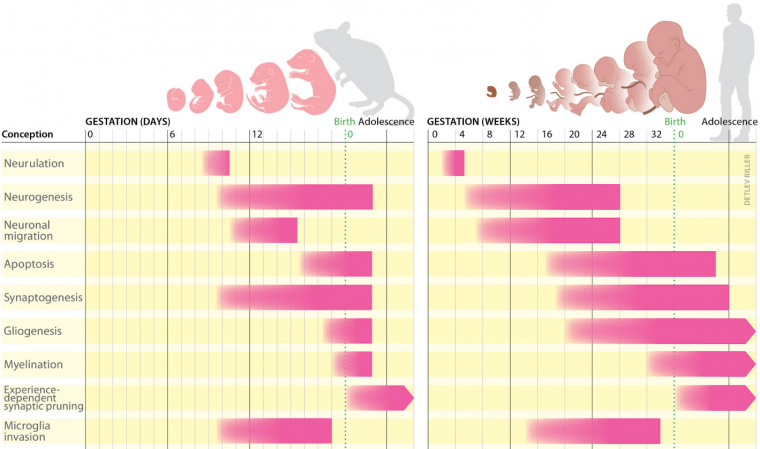
La structure de base du cerveau est établie avant la naissance par les gènes. La poursuite de son développement après la naissance et la formation des principaux circuits cérébraux dépendent d’un processus appelé plasticité développementale. Dans le cerveau immature, ce processus comprend : la création ou la perte de synapses, la migration et la maturation des neurones à travers les structures cérébrales en cours de développement, le guidage axonal ou encore l’établissement des connexions neuronales (Figure 1).
À la naissance, seule une fraction des connexions neuronales retrouvée à l’âge adulte sont présentes, la plupart se formant plus tard. Au fur et à mesure du développement postnatal, les neurones individuels deviennent matures, d’abord en envoyant de multiples axones dans toutes les directions puis en augmentant le nombre de contacts synaptiques (synaptogenèse). Si à la naissance, chaque neurone du cortex cérébral possède environ 2500 synapses, à l’âge de 2 ou 3 ans, à mesure que le nourrisson explore le monde qui l’entoure et acquiert de nouvelles compétences, le nombre de synapses par neurone passe à environ 15 000 56 !
À l’inverse, à l’âge adulte, le nombre de synapses diminue de moitié, un processus appelé l’élagage synaptique. Il y a donc une surproduction de connexions au cours des premières années de la vie (pic de plasticité), pour ensuite sélectionner certaines de ces connexions. Les activités auxquelles l’enfant participe, ses expériences, ses apprentissages ou encore ses interactions sociales participent à la structuration de son cerveau.
Chez les deux espèces, le développement du cerveau commence par la neurulation, un processus qui aboutit à la formation du tube neural. Celui-ci contient des cellules souches neurales qui permettront la production de neurones, c’est la neurogenèse. Au début du développement humain, à la quatrième semaine de gestation, la partie antérieure du tube neural commence à se subdiviser en régions distinctes. Jusqu’à la 26e semaine environ, certains des neurones précédemment produits migrent vers ces différentes régions cérébrales. Au cours du deuxième trimestre de la grossesse, la synaptogenèse, la gliogenèse et l’apoptose permettent de modeler les connexions cérébrales. En parallèle, les microglies envahissent le cerveau. Au milieu du troisième trimestre, les gaines de myéline se mettent en place autour des neurones. Peu après la naissance, les connexions neuronales précédemment établies sont réduites en fonction de l’activité neuronale.
À l’âge adulte, l’être humain conserve sa capacité à apprendre de nouvelles compétences et connaissances, grâce à sa plasticité cérébrale. Celle-ci est néanmoins limitée et bien moins importante que chez l’enfant.
Qu’est-ce que la plasticité cérébrale ?
La plasticité cérébrale, également connue sous le nom de neuroplasticité, désigne la capacité du cerveau à modifier sa structure et son fonctionnement en réponse à des stimuli internes ou externes. Il ne s’agit pas d’un état occasionnel du cerveau mais plutôt de son état normal tout au long de la vie. La plasticité du fonctionnement nerveux permet l’adaptation du comportement aux contraintes du milieu 1. Sans cette capacité, le cerveau serait incapable de se développer et d’apprendre tout au long de la vie ou de se remettre d’une lésion cérébrale.
Chaque seconde, le cerveau se modifie en fonction des expériences vécues, en réponse aux stimuli sensoriels, moteurs et cognitifs auxquels il est soumis. C’est un processus physiologique d’adaptation du système soumis à l’influence de facteurs environnementaux, génétiques et épigénétiques. La plasticité est une propriété présente à tous les niveaux d’organisation du cerveau, de la molécule aux réseaux neuronaux.
Il existe plusieurs mécanismes de plasticité cérébrale que l’on peut regrouper en trois catégories :
- la plasticité synaptique ;
- la modification des réseaux neuronaux ;
- la genèse de nouveaux neurones chez l’adulte.
La plasticité synaptique
Une propriété fondamentale des neurones est leur capacité à modifier la force et l’efficacité de la transmission synaptique par le biais d’un nombre varié de mécanismes dépendant de l’activité même des synapses, ce que l’on appelle généralement la plasticité synaptique. Les modèles de la plasticité décrivent soit une facilitation soit une diminution de l’efficacité synaptique. Les mécanismes de plasticité synaptique à long terme restent le modèle expérimental le plus communément accepté pour expliquer le maintien durable de traces mnésiques dans différentes structures cérébrales.
La plasticité synaptique repose principalement sur le principe de Hebb, présenté précédemment, qui fait l’hypothèse que des neurones qui s’activent ensemble, se connectent alors ensemble. Un neurone reçoit des milliers d’informations provenant d’autant de neurones qui le contactent via des connexions appelées synapses. Le neurone qui transmet l’information est appelé neurone présynaptique et le neurone qui reçoit l’information est appelé neurone post-synaptique. Lorsque le neurone présynaptique est actif et qu’au même moment le neurone post-synaptique est lui-même fortement activé, alors la synapse formée est renforcée. En d’autres termes, les neurones qui présentent une synchronisation dans leurs décharges voient leurs connexions se renforcer. L’activation du neurone post-synaptique par le neurone pré-synaptique sera ainsi facilitée.
Depuis sa formulation, le principe de Hebb a été étendu : la force d’une synapse peut également diminuer. Lorsque le neurone présynaptique est actif et qu’au même moment le neurone post-synaptique n’est que faiblement activé, alors la synapse formée va s’affaiblir. En d’autres termes, les neurones qui ne présentent pas de synchronisation dans leurs décharges voient leur relation s’affaiblir.
La plasticité synaptique est donc liée à une corrélation des activités pré et post-synaptiques. Cette théorie ne suppose pas la création de synapses mais des variations de leur force. Si le réseau neuronal est plus ou moins fixe, mais que la force des synapses est variable, cela permet une plasticité très rapide des structures cérébrales.
La plasticité synaptique a historiquement été mise en évidence dans l'hippocampe
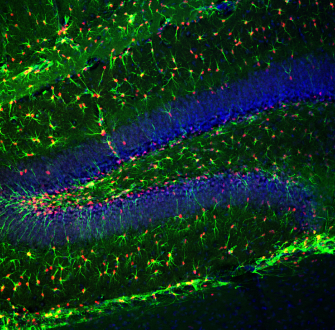
Les phénomènes de plasticité synaptique ont historiquement pu être mis en évidence suite à des expériences réalisées sur des hippocampes de petits mammifères (lapins, rats). L’hippocampe présente l’avantage d’être structuré en différentes zones facilement distinguables, dont le gyrus denté et les champs ammoniens 1 et 3, notés CA1 et CA3 (Figure 2). La voie perforante est formée par les axones en provenance du cortex enthorinal et établit des synapses sur les cellules granulaires du gyrus denté. Ces cellules granulaires projettent via leurs axones, qui forment les fibres moussues, sur les cellules pyramidales de la zone CA3. Les axones de ces cellules constituent les collatérales de Schaffer qui forment des synapses avec les neurones pyramidaux de la zone CA1.
A. La potentialisation à long terme et la dépression à long terme ont historiquement été mises en évidence suite à des expériences réalisées sur des hippocampes de petits mammifères (lapins, rats). L’hippocampe présente l’avantage d’être structuré en différentes zones facilement distinguables, dont le gyrus denté et les champs ammoniens 1 et 3, notés CA1 et CA3. La voie perforante est formée par les axones en provenance du cortex enthorinal et établit des synapses sur les cellules granulaires du gyrus denté. Ces cellules granulaires projettent via leurs axones, qui forment les fibres moussues, sur les cellules pyramidales de la zone CA3. Les axones de ces cellules constituent les collatérales de Schaffer qui forment des synapses avec les neurones pyramidaux de la zone CA1. Les traits gris représentent la disposition des corps cellulaires des neurones.NB : La morphologie des neurones (cellules granulaires pour le gyrus denté et cellules pyramidales pour les zones CA1 et CA3) n'est pas respectée sur ce schéma.
Schéma de neurone : SVG Repo, licence CC0.
B. Coupe d'hippocampe de souris observée en microscopie confocale. Les neurones pyramidaux de la zone CA1 apparaissent en vert (anticorps anti-cadhérine-10), ceux de la zone CA2 en rouge (anticorps anti-RGS14), tandis que les points de contacts entre neurones de la zone CA3 et neurones du gyrus denté apparaissent en bleu (marquage non précisé).
Crédit : Raunak Basu, université de l'Utah, Salt Lake City, licence CC BY-NC, Flickr.
La facilitation de l’efficacité synaptique ou potentialisation à long terme
La potentialisation à long terme (PLT) correspond à une augmentation durable de l’efficacité synaptique, mesurée par une augmentation de la réponse post-synaptique de neurones après une brève stimulation à haute fréquence d’une voie afférente à ces neurones (Figure 3) 12.
A. L’hippocampe de lapin. La potentialisation à long terme a historiquement été mise en évidence suite à des expériences réalisées in vivo sur des lapins. L’hippocampe présente l’avantage d’être structuré en différentes zones facilement distinguables. Dans leurs travaux de 1973, Timothy Bliss et Terje Lømo 1 ont travaillé au niveau du gyrus denté, où les axones en provenance des neurones du cortex enthorinal établissent des synapses avec les cellules granulaires.
B. Disposition des électrodes de stimulation et d’enregistrement. L’électrode de stimulation est placée au niveau de la voie perforante, formée par les axones en provenance du cortex enthorinal et faisant synapses sur les cellules granulaires du gyrus denté de l’hippocampe. L’électrode d’enregistrement est placée dans le milieu extracellulaire, au niveau des corps cellulaires des cellules granulaires.
C. Enregistrement du potentiel post-synaptique excitateur (PPSE) dans le milieu extracellulaire au niveau des cellules granulaires. Après une période de stimulation à un niveau de base de 0,5 Hz (une stimulation toutes les deux secondes), une stimulation haute fréquence (100 Hz pendant 3 à 4 secondes) est induite (flèche), avant que le niveau de stimulation ne revienne au niveau basal. Suite à la stimulation haute fréquence, l’amplitude du PPSE est augmentée de manière durable. Cette potentialisation des synapses liant la voie perforante aux cellules granulaires est qualifiée de potentialisation à long terme, car cette sensibilité accrue des neurones à la stimulation est mesurée pendant plusieurs minutes (données visibles sur la figure) et même plusieurs heures (données non montrées) dans les expériences fondatrices de Bliss et Lømo (1973). Plus tard, d’autres expériences réalisées in vivo ont même montré qu’elle pouvait durer plus d’un an après la stimulation à haute fréquence induite expérimentalement !
Schéma de neurone : SVG Repo, licence CC0.
Cette capacité à modifier la force de la transmission synaptique d’une manière dépendante de l’activité représente une propriété fondamentale de très nombreuses synapses excitatrices des structures corticales et sous-corticales du cerveau, comme l’hippocampe, l’amygdale, le striatum, les aires corticales sensorielles, motrices ou associatives.
Les grandes étapes des mécanismes moléculaires de la potentialisation à long terme sont aujourd’hui bien connues 1. Elle possède une phase à court terme, qui peut être consolidée à long terme selon le nombre de répétitions et l’espacement entre les stimulations.
Plusieurs types de récepteurs post-synaptiques interviennent dans la plasticité synaptique : les récepteurs NMDA et AMPA 2. Ce sont des récepteurs post-synaptiques ionotropes3, activés par le glutamate et perméables au sodium, au potassium et au calcium. Les récepteurs AMPA s’activent et s’inactivent de façon très rapide (moins d'une milliseconde) après la libération de glutamate par un potentiel d’action au niveau pré-synaptique. Cette capacité leur permet ainsi de suivre des trains de potentiels d’action très rapide (fréquence supérieure à 100 Hz) donnant lieu à des libérations de glutamate séparées par des temps de l’ordre de 10 ms. Les récepteurs AMPA permettent donc d’effectuer un codage rapide de l’information. À l’inverse, les récepteurs NMDA présentent une cinétique bien plus lente, lié au temps de liaison élevé du glutamate sur les récepteurs NMDA et à la présence d’un blocage du canal par un ion Mg2+. Lorsque le glutamate se fixe sur ce récepteur et que la membrane plasmique est à son potentiel de repos, le canal calcique est bloqué par Mg2+. La membrane doit être dépolarisée que ce blocage soit levé. C’est ce qui se produit lors d’une stimulation à haute fréquence et qui induit une potentialisation à long terme. En effet, cette stimulation haute fréquence entraîne l’activation de nombreux récepteurs AMPA, donc la dépolarisation de la membrane et l'activation des récepteurs NMDA, qui permettent l’entrée massive de calcium dans la cellule.
Une fois entré dans la cellule par les récepteurs NMDA, le calcium active de nombreuses voies de signalisation neuronales impliquant à la fois des kinases et des phosphatases. Ceci entraîne la phosphorylation des récepteurs AMPA, augmentant leur conductance, et favorise également l’insertion d’un nombre accru de nouveaux récepteurs AMPA à la membrane post-synaptique, rendant la synapse plus sensible à toute activation ultérieure. De plus, ces voies de signalisation permettent de convertir des synapses dites silencieuses en synapses actives grâce à la mobilisation de mécanismes de transport et d’ancrage des récepteurs AMPA au niveau des synapses.
À l’issue de cette première étape, les modifications synaptiques peuvent être stabilisées sur le long terme par l’expression de gènes activés par la voie des MAP kinases. Une première vague d’expression de gènes, dits précoces, permet la synthèse de protéines ayant un rôle direct dans le fonctionnement de la synapse, ainsi que de facteurs de transcription activant plus tardivement des gènes codant des protéines remodelant durablement les réseaux neuronaux. In fine, ces mécanismes aboutissent à un véritable remodelage fonctionnel et structurel des synapses activées, et aboutissent au renforcement des synapses existantes ainsi qu’à la croissance de nouvelles connexions synaptiques.
La diminution de l’efficacité synaptique ou dépression à long terme
Si de très nombreuses études montrent que les mécanismes de renforcement synaptique de type potentialisation à long terme jouent un rôle crucial dans la consolidation mnésique, des mécanismes inverses de dépression à long terme (DLT) sont également impliqués et très fréquents. Au contraire de la potentialisation à long terme, la dépression à long terme aboutit à un affaiblissement durable de l’efficacité synaptique (Figure 4). Elle a été mise en évidence dans le cervelet, mais s’observe également dans diverses structures dont l’hippocampe (Figure 4).
A. Coupe transversale d’hippocampe de rat. La dépression à long terme a en particulier été étudiée in vitro sur des coupes d’hippocampe de rat, suffisamment épaisses (400 µm) pour laisser intacts la plupart des circuits. Il est alors possible de distinguer facilement différentes zones de l’hippocampe, dont les zones CA3 et CA1 (CA pour champs ammoniens), composées de neurones pyramidaux. Les axones des neurones de la zone CA3 constituent les collatérales de Schaffer qui forment des synapses avec les neurones de la zone CA1.
B. Disposition des électrodes de stimulation et d’enregistrement. L'électrode de stimulation se situe sur une collatérale de Schaffer, tandis que l'électrode d’enregistrement est placée dans le milieu extracellulaire environnant les neurones CA1.
C. Enregistrement du potentiel post-synaptique excitateur (PPSE) dans le milieu extracellulaire au niveau des neurones CA1. Après une période de 30 minutes de stimulation à un niveau de base de 0,03 Hz (deux stimulations par minute), une période de stimulation basse fréquence à 1 Hz pendant 15 minutes est induite par l’électrode de stimulation, avant que le niveau de stimulation ne revienne au niveau basal. L’électrode d’enregistrement placée en CA1 montre que l’amplitude du PPSE diminue de manière durable. La baisse de l’activité post-synaptique est qualifiée de dépression à long terme, car cette diminution de la sensibilité du neurone post-synaptique à la stimulation par le neurone présynaptique dure pendant plusieurs minutes. D’après 1.
Schéma de neurone : SVG Repo, licence CC0.
L’induction de la dépression à long terme est également permise par l’activation des récepteurs NMDA mais contrairement à la potentialisation à long terme, l’entrée d’ions calcium est lente et prolongée. La dépression à long terme passe par la déphosphorylation des récepteurs AMPA par les phosphatases induisant une diminution de leur conductance, et l’internalisation des récepteurs induisant une diminution du nombre de récepteurs AMPA à la synapse 1.
La dépression à long terme représente un mécanisme d’oubli de l’information mais peut également, en affaiblissant les connexions inutilisées, renforcer les connexions restantes. Il a d’ailleurs été montré que l’induction d’une potentialisation à long terme dans certaines synapses est toujours associée à une dépression à long terme dans d’autres synapses de la même population de neurones 2.
Expérimentalement, une même synapse peut subir soit une potentialisation soit une dépression à long terme en fonction des paramètres de la stimulation. Au laboratoire, c’est la fréquence de stimulation de la voie afférente qui détermine le sens de la modification d’efficacité synaptique : une haute fréquence de stimulation induit une potentialisation à long terme, alors qu’une basse fréquence de stimulation induit une dépression à long terme. En conditions physiologiques, les neurones font partie d’un réseau et sont donc soumis à de multiples stimulations, à la fois excitatrices et inhibitrices.
La plasticité synaptique à modulation temporelle relative (spike timing-dependent plasticity)
Ces dernières années, un nouveau concept de forme de plasticité synaptique est apparu, qui met l’accent sur le délai entre l’activation du neurone présynaptique et celle du neurone postsynaptique, plutôt que sur la fréquence de décharge du neurone présynaptique. C’est la plasticité synaptique à modulation temporelle relative (spike timing-dependent plasticity) 345.
Cette forme de plasticité dépend de la corrélation temporelle entre l’activité du neurone présynaptique et celle du neurone post-synaptique 6. C’est une forme de plasticité synaptique associative dans laquelle le délai entre les potentiels d’action présynaptiques et post-synaptiques détermine la direction de la plasticité (Figure 5). Si l’activité du neurone présynaptique précède (d’une dizaine de millisecondes par exemple) l’activité du neurone post-synaptique, alors la synapse est renforcée (potentialisation à long terme). Au contraire, si l’activité du neurone post-synaptique précède l’activité du neurone présynaptique, alors la synapse est affaiblie (dépression à long terme). Cette forme de plasticité s’observe aussi bien au niveau des synapses excitatrices que des synapses inhibitrices.
Si le neurone présynaptique décharge avant le neurone post-synaptique, alors il y a potentialisation à long terme. Si, au contraire, c'est le neurone post-synaptique qui décharge avant le neurone présynaptique, on observe alors une dépression à long terme. Contrairement aux figures précédentes, ce n’est ici pas le potentiel post-synaptique excitateur (PPSE) qui est mesuré, mais le courant post-synaptique excitateur (CPSE). D’après 1.
Réarrangements synaptiques
Chaque neurone peut évaluer son niveau d’activité et ajuster le poids de ses différentes synapses afin de maintenir un niveau constant d’activité et compenser ainsi les modifications de transmission de type potentialisation ou dépression à long terme ayant affecté certaines de ses synapses. Cela permet de garantir une certaine stabilité fonctionnelle des réseaux neuronaux. Les neurones sont capables de percevoir les modifications de leur taux d’activité et de les compenser par des ajustements synaptiques, comme des modifications du nombre de récepteurs AMPA à la membrane du neurone post-synaptique. Par ailleurs, il est aujourd’hui bien connu que le sommeil est un facteur primordial des apprentissages, notamment pour la phase de consolidation. Durant les phases de sommeil lent, les neurones impliqués dans les apprentissages de la journée se réactivent. Au cours de cette période de réactivation, un tri est fait entre les informations à retenir et celles à oublier. Il a été montré que durant cette phase de sommeil et de réactivation, les synapses subissent des modifications de leur composition notamment en récepteurs AMPA 1. Le sommeil favorise également la formation d’épines dendritiques post-synaptiques après un apprentissage 2.
La potentialisation à long terme induit des changements d’expression de nombreux gènes et la synthèse de nouvelles protéines dont certaines sont impliquées dans des changements morphologiques et fonctionnels des épines dendritiques 345. Elle est associée à un véritable remodelage fonctionnel et structurel des synapses activées avec une augmentation rapide du nombre de synapses, de la surface de contact entre éléments présynaptiques et post-synaptiques, de la taille des épines et par l’émergence de nouvelles épines (synaptogenèse) 6. Au contraire, l’induction d’une dépression à long terme s’accompagne d’un rétrécissement des épines 7.
Plasticité homéostatique de l’excitabilité
Un neurone, tout comme un réseau neuronal, doit maintenir un certain niveau d’activité et de connectivité pour assurer le maintien du transfert de l’information. Cette plasticité se définit par des modifications d’excitabilité neuronale en fonction de l’expérience du neurone. Ces modifications des propriétés d’excitabilité du neurone mettent en jeu l’intégralité de la cellule et non pas uniquement les synapses comme ce qui a été présenté dans le cas de la plasticité synaptique. Lorsque l’excitabilité du neurone est augmentée, celui-ci répondra plus facilement à une excitation présynaptique. Inversement, lorsque l’excitabilité du neurone diminue, celui-ci sera moins sensible aux excitations présynaptiques. Ceci se traduit par une modification de la fréquence de décharge des neurones en réponse à une stimulation 89. Celle-ci passe par des changements soit des propriétés passives de la membrane plasmique des neurones (résistance de la membrane, constante de temps, potentiel de repos, potentiel du seuil d’émission d’un potentiel d’action) soit des propriétés actives (fréquence d’émission de potentiels d’action, patron temporel de la décharge). Ces modifications reposent notamment sur un changement de la composition de la membrane plasmique en canaux ioniques (canaux potassiques ou canaux sodiques) nécessaires à la propagation des signaux nerveux le long de l’axone. Ces changements peuvent s’établir à court terme, lorsque seul l’état des canaux ioniques présents est transitoirement modifié, ou à long terme, lorsque les canaux ioniques sont remplacés par d’autres. Cette plasticité assure deux fonctions : l’homéostasie de l’excitabilité du neurone et la potentialisation de l’excitabilité du neurone.
Le remodelage des réseaux neuronaux
Historiquement, les scientifiques pensaient que la structure du cerveau et des neurones était fixe à partir de l’âge adulte pour assurer la stabilité des réseaux neuronaux et des apprentissages. Or, il a depuis été montré que les apprentissages induisent un remodelage fonctionnel des réseaux neuronaux impliqués 10. Cette forme de plasticité cérébrale se traduit par la mobilisation accrue de certaines régions cérébrales pour assurer de nouvelles fonctions et capacités, et ce de façon réversible. De nombreux exemples attestent de la flexibilité de l’organisation des réseaux neuronaux :
-
Une étude d’IRM réalisée chez des chauffeurs de taxi londoniens a permis de montrer que leur hippocampe, une structure qui contrôle la représentation de l’espace, est bien plus développé, et ce de façon proportionnelle au nombre d’années d’expérience de la conduite du taxi 11.
-
Chez des mathématiciens professionnels, il a été observé un épaississement des régions impliquées dans le calcul et la représentation visuelle et spatiale 12.
-
La pratique de la méditation induit des modifications structurelles et fonctionnelles dans les régions cérébrales impliquées dans l’attention, l’anxiété ou la peur 13.
-
La pratique intentionnelle d’un sport s’accompagne de modifications structurelles et fonctionnelles des réseaux neuronaux 14. Par exemple, la pratique du jonglage chez des adultes entraîne un épaississement des régions spécialisées dans la vision et la coordination des mouvements des bras et des mains 15. Si l’entraînement cesse, ces zones rétrécissent.
-
L’apprentissage d’une nouvelle langue chez de jeunes adultes provoque une augmentation de la densité de la matière grise dans les structures impliquées dans le langage, et ce de façon corrélée avec les capacités de compréhension de cette nouvelle langue 16.
-
L’engagement artistique, par exemple lors de l’apprentissage d’un instrument de musique, entraîne des modifications de connexions neuronales et augmente la flexibilité cognitive, ce qui rend l’activité plus facile et plus automatique au fil du temps 17. La pratique du violon accroît considérablement la dextérité d’une seule main. La représentation corticale des doigts de cette main est considérablement augmentée, la représentation de l’auriculaire devient équivalente à la représentation du pouce 18.
La neurogenèse adulte
Alors que l’on pensait la structure du cerveau fixe pendant plus d’un siècle, la mise en évidence d’une production de nouveaux neurones au sein du cerveau adulte a ouvert un tout nouveau champ d’étude de la plasticité cérébrale. L’intégration permanente de nouveaux neurones au sein des réseaux neuronaux permet aux systèmes d’être plus plastiques et ainsi de s’adapter à des nouveaux environnements 19.
La neurogenèse adulte est la formation de nouveaux neurones au sein du cerveau adulte. Elle désigne les processus qui, à partir de la division des cellules progénitrices neurales, donnent naissance à des cellules capables de se différencier en neurones qui vont ensuite s’intégrer dans les circuits neuronaux préexistants. C’est un phénomène que l’on retrouve chez de nombreuses espèces animales y compris chez l’humain. Néanmoins, cette neurogenèse n’est pas présente partout dans le cerveau adulte, elle est confinée principalement dans deux structures du cerveau, appelés niches neurogéniques : la zone sous-ventriculaire, qui alimente le bulbe olfactif, et le gyrus denté de l’hippocampe. L’architecture et le fonctionnement de ces zones neurogéniques constituent un microenvironnement favorable pour la prolifération, la différenciation, la migration et l’intégration fonctionnelle des nouveaux neurones au sein des réseaux neuronaux. Ces nouveaux neurones jouent un rôle dans les processus d’apprentissage et de mémoire.
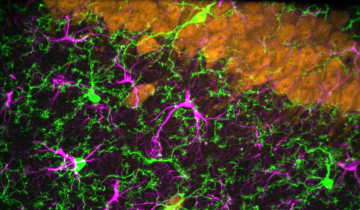
Plasticité et cellules gliales
Les modifications liées à la plasticité ont longtemps été considérées comme étant uniquement dépendantes de l’activité des réseaux neuronaux. La compréhension de plus en plus fine des mécanismes gliaux a permis de préciser l’implication directe et indirecte des cellules gliales dans la plasticité cérébrale. Elles se révèlent être des actrices de la modulation des mécanismes de plasticité en modifiant l’environnement neuronal via la recapture des neurotransmetteurs et la libération de nombreux facteurs 1.
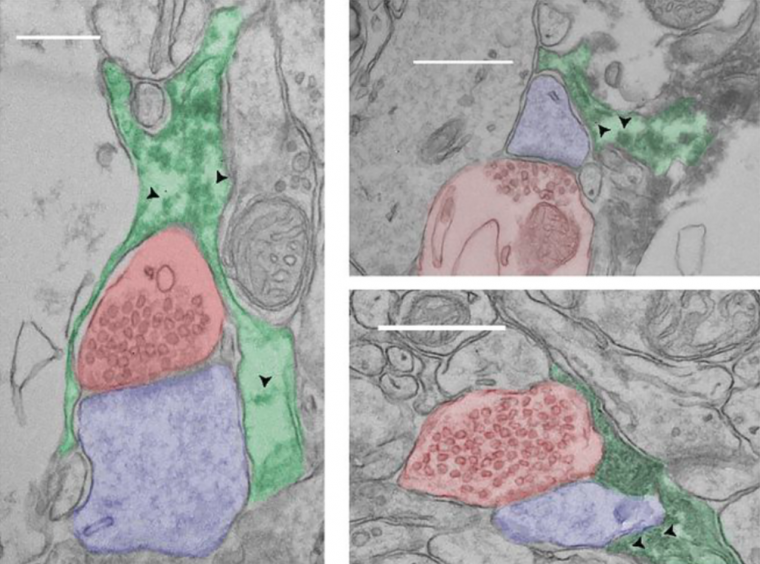
Les astrocytes sont des acteurs primordiaux dans les processus de régulation de la transmission synaptique. Grâce à leurs fins prolongements, ils interagissent étroitement à la fois avec les éléments pré et post-synaptiques et constituent des partenaires à part entière de certaines synapses appelées synapses tripartites (Figure 6).
Électronographies montrant des synapses tripartites dans le cortex de souris. L’axone du neurone présynaptique a été colorisé en rouge, l’épine dendritique en bleu et l’astrocyte en vert. Les têtes de flèche indiquent des ribosomes. Barre d’échelle : 500 nm.
L’impact des astrocytes sur la communication synaptique résulte de leur activité métabolique et des informations bidirectionnelles qu’ils échangent avec les neurones, mais aussi de la barrière physique qu’ils constituent à la diffusion des neurotransmetteurs. Ils sont d’importants régulateurs de la densité des connexions synaptiques. Les capacités de plasticité des astrocytes se traduisent par des modifications réversibles de la forme de leurs corps cellulaires et de leurs prolongements 1. Ces mouvements peuvent être très rapides, de l’ordre de la minute. La plasticité astrocytaire s’accompagne de modifications d’expression de protéines spécifiques. De nombreux travaux ont confirmé l’existence d’une modulation astrocytaire de la plasticité synaptique, notamment par la libération de différents facteurs et par la recapture des neurotransmetteurs à la synapse 2.
Un autre type de cellules gliales, les cellules microgliales, sont également impliquées dans la plasticité synaptique. Ces cellules immunitaires, présentes au sein du système nerveux central, participent en effet à la formation et à l’élimination des synapses, au contrôle des processus apoptotiques, et à la libération de nombreux facteurs qui agissent sur les réseaux neuronaux 3.
Modulation de la plasticité cérébrale
La plasticité synaptique peut être influencée par différents facteurs tels que l’exercice physique, la motivation ou certains neuromédiateurs ou hormones.
L’activité physique augmente la production de facteurs neurotrophiques qui favorisent la croissance et la survie des neurones. Pratiquée sur une période de plusieurs mois, l’activité physique induit une augmentation de la matière grise dans différentes structures cérébrales impliquées dans la mémoire, le contrôle cognitif, les fonctions motrices et la récompense, dont l’hippocampe, le cervelet et le cortex préfrontal 12.
Les propriétés fonctionnelles des neurones et des synapses peuvent également être modifiées de manière réversible par la libération transitoire de molécules de signalisation spécifiques, telles que l’acétylcholine, la dopamine, la noradrénaline ou encore la sérotonine. Cette neuromodulation par des neuromédiateurs et hormones crée les conditions nécessaires à l’induction de la plasticité synaptique pour répondre de façon flexible à la demande cognitive. Elle contribue notamment au contrôle de la plasticité synaptique à modulation temporelle relative en modifiant l’excitabilité et la dynamique des circuits neuronaux, en déclenchant l’activation synaptique des récepteurs au glutamate et en inhibant directement les cascades de signalisation intracellulaire impliquées dans la plasticité synaptique 3.
Vieillissement et plasticité cérébrale
Le vieillissement cérébral est un processus normal. Il se caractérise par un certain nombre de changements comme une diminution de la masse cérébrale, de la neurotransmission et du débit sanguin dans le cerveau, une augmentation du volume des ventricules, et des modifications de la neurotransmission ainsi que de la structure de la substance blanche et de la substance grise. Bien que la plasticité cérébrale se maintienne tout au long de la vie, toutes ces modifications liées au vieillissement conduisent à des modifications de l’efficacité synaptique 45. Par ailleurs, bien que la neurogenèse adulte persiste durant toute l'existence, elle diminue au cours du vieillissement, en partie à cause de modifications locales et environnementales des niches neurogéniques. La sénescence et la perte de neurones peuvent cependant être partiellement prévenues. Rester actif de façon quotidienne, aussi bien physiquement que cognitivement (stimulations environnementales et sociales), permet de favoriser la formation et la croissance de nouvelles connexions ainsi que la production et l’intégration de nouveaux neurones au sein des réseaux neuronaux.
Plasticité cérébrale et santé
Rôle de la plasticité cérébrale dans différents types de lésions
Les processus de plasticité sont mis en jeu de manière différente dans diverses pathologies et lésions cérébrales. Dans le cas d’un accident vasculaire cérébral (AVC), la zone qui n’est plus irriguée subit une perte neuronale entraînant des déficiences directes sur les fonctions qu’occupaient ces neurones. Une personne touchée par un AVC peut cependant recouvrir partiellement ou complètement les fonctions perdues. En effet, une partie des neurones survivants à proximité ou au sein de la structure peut progressivement reprendre à son compte la fonction des neurones détruits grâce à un remodelage des réseaux neuronaux. Ils sont capables de développer de nouveaux axones et dendrites, et ainsi de former de nouvelles connexions. Les synapses sont également capables d’optimiser leurs performances pour accélérer la communication entre neurones. Par ailleurs, les aires neuronales voisines prennent en partie le relai, ce qui permet de récupérer une partie des capacités correspondant à la zone lésée.
À titre d'exemple, l'amputation d'un membre se traduit au niveau cérébral par la perte des entrées sensorielles liées au membre perdu. La représentation cérébrale du membre amputé n’est alors plus stimulée. Au fil du temps, il se produit une réallocation de la zone cérébrale inutilisée vers la représentation d’autres membres ou zones du corps humain. Par exemple, lors de la perte d’une main, la zone cérébrale précédemment associée à la sensibilité manuelle peut être partiellement réaffectée au traitement des sensations du bras ou du visage. Ce type de plasticité se produit également sur de grandes distances entre les hémisphères gauche et droit du cerveau. En effet, il a été montré que lorsque le cerveau est privé des informations d’une main amputée, la zone du cerveau jusque-là dédiée à cette main se réorganise et devient dédiée à la main restante 1.
Cette réallocation des ressources cérébrales s’observe également dans le cas de la perte d’un sens. Les zones cérébrales non utilisées par la fonction sensorielle perdue sont réallouées à d’autres aires sensorielles permettant d’augmenter la sensibilité des autres sens et de compenser en partie la perte. Ce phénomène de plasticité intermodale est par exemple observé chez les personnes qui perdent la vue et qui acquièrent des capacités auditives plus importantes. Certaines de ces personnes développent même des capacités d’écholocation, en générant des clics (des sons brefs produits par la langue) pour mieux se repérer et naviguer dans leur environnement 2. La détection des échos des clics semble être prise en charge par des régions cérébrales consacrées à la vision, et non pas à l’audition.
En cas de perte de l’audition, le cortex auditif subit une réorganisation avec une reconversion vers d’autres fonctions sensorielles, notamment la vision 3 et le toucher 4. Les personnes sourdes ont une meilleure attention visuelle périphérique, une meilleure capacité de détection des changements de mouvements, présentent une recherche visuelle plus efficace et une plus grande sensibilité dans la détection des changements de fréquence des vibrations. Le développement de ces capacités est lié à une réaffectation d’aires cérébrales, notamment du cortex auditif primaire. Cependant, un tel niveau de plasticité est observé lorsque la perte du sens survient assez tôt au cours du développement. La perte d’un sens à l’âge adulte induit un plus faible niveau de plasticité entre les structures.
Utilisation thérapeutique de la plasticité cérébrale
Contrôler ou faciliter le recrutement de nouveaux neurones représente un enjeu thérapeutique important pour traiter les personnes atteintes de lésions cérébrales, afin de permettre au cerveau de se réorganiser et de préserver au mieux ses capacités. Plusieurs types de thérapies sont actuellement à l’étude : médicaments, thérapie de mouvement, stimulation électrique, entraînement physique, méditation, thérapie par l’art ou encore réalité virtuelle.
Selon les cas, plusieurs options thérapeutiques peuvent être utilisées pour guider la neuroplasticité dans la restauration de la fonction et le traitement des symptômes indésirables. Le patient atteint de lésions cérébrales est incité à réaliser des expériences dirigées qui augmentent l’activité neuronale afin de mobiliser les processus de plasticité neuronale.
En continuant à explorer et à étudier les mécanismes de plasticité cérébrale et les paramètres qui les influencent, la recherche scientifique devrait être en mesure de développer des thérapies plus ciblées pour aider le cerveau à retrouver ses fonctions plus rapidement et plus complètement. Par exemple, dans le cas de la neurogenèse adulte, il ne suffit pas de générer de nouvelles cellules, encore faut-il qu’elles s’intègrent correctement aux tissus et réseaux neurones existants, au risque sinon d’obtenir un recâblage aberrant.
Conclusion
Les différents processus de plasticité présentés dans cet article apportent de la flexibilité au sein des réseaux neuronaux du cerveau. Tous ces mécanismes de plasticité cérébrale ne sont pas exclusifs les uns des autres mais au contraire étroitement liés. Des accroissements de l’efficacité synaptique sur certaines synapses vont souvent de pair avec une diminution de l’efficacité synaptique sur d’autres. Par ailleurs, accroissements et diminutions de l’efficacité synaptique s’accompagnent de nombreuses modifications morphologiques et structurales des neurones et réseaux neuronaux activés impliquant la croissance de nouvelles connexions synaptiques ou leur élimination fonctionnelle. En outre, ces différents mécanismes de plasticité cérébrale ne se déroulent pas sur la même échelle temporelle. Alors que la plasticité synaptique est un processus plutôt rapide et qui peut durer dans le temps, les modifications des réseaux neuronaux et de leur connectivité ou la neurogenèse adulte sont des processus plus lents. La mise en œuvre de la plasticité synaptique dépend de nombreux paramètres incluant l’âge, la génétique et un certain nombre de paramètres physiologiques et environnementaux. Une combinaison complexe afin de permettre à notre cerveau d’apprendre tout au long de la vie.
Podcast
L'émission La méthode scientifique consacrait en février 2020 un sujet sur la plasticité cérébrale, disponible en podcast.