Depuis les années 50, différentes expériences ont permis d'établir l'existence, dans le cerveau, d'un circuit de la récompense, et d'en caractériser le fonctionnement. Les recherches menées sur ce circuit permettent de mieux comprendre certains comportements, en particulier la sexualité et la consommation de drogues.
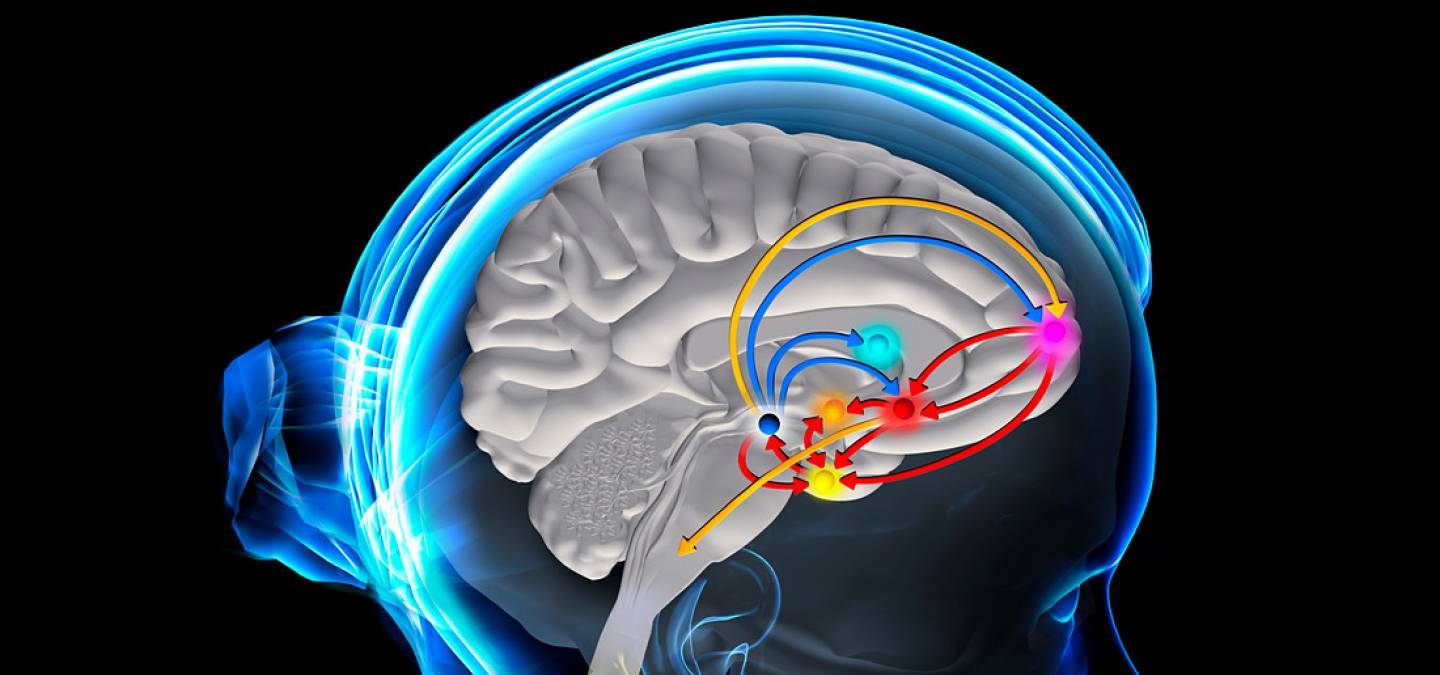
Le cerveau est constitué d’un ensemble complexe de circuits neuronaux qui s’organisent en réseaux pour traiter les entrées sensorielles, les relayer jusqu’au cortex, puis les traduire en sorties comportementales ou psychiques. La variété des comportements nécessite que certains réseaux, et donc certaines structures cérébrales, soient sélectionnés en fonction des différents types de situations vécues par le sujet. Cette sélection est réalisée par les neurones modulateurs. Ceux-ci sont minoritaires dans le système nerveux central puisque, sur les 86 milliards de cellules présentes dans le cerveau, ils n’en représentent environ qu’une sur 100 000. Ils comprennent les neurones libérant de la sérotonine, de la noradrénaline ou de la dopamine. On les qualifie respectivement de sérotoninergiques, noradrénergiques et dopaminergiques (Figure 1). Bien que leur proportion soit très faible, ces neurones apparaissent comme étant la cible principale de la plupart des produits psychotropes, tels que les antipsychotiques (ou neuroleptiques), les antidépresseurs ou les drogues addictives1. Parmi ces trois types de neurones, les cellules dopaminergiques tiendraient le rôle de modulateur final des sorties motrices ou psychiques. C’est pourquoi une atteinte du système dopaminergique peut se traduire aussi bien par des troubles moteurs, comme dans le cas de la maladie de Parkinson, que psychiques, comme dans la schizophrénie.
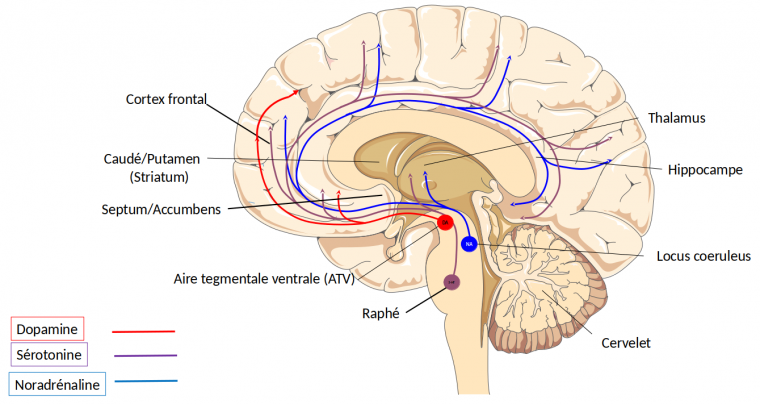
Les corps cellulaires des neurones noradrénergiques, sérotoninergiques et dopaminergiques ont leurs corps cellulaires localisés dans le mésencéphale, respectivement le locus coeruleus, les raphés et l’aire tegmentale ventrale/substance noire (d’après 13).
Le circuit de la récompense
La notion de plaisir n’est a priori pas simple à définir en neurobiologie. Pourtant cette sensation a pu être abordée expérimentalement depuis une soixantaine d’années déjà. Dans une expérience devenue fameuse et dont les résultats furent publiés en 1954, deux Américains, Olds et Milner, ont constaté que des rats à qui des électrodes avaient été implantées à demeure dans certaines régions cérébrales, apprenaient à appuyer sans discontinuer sur une pédale délivrant un courant électrique à la pointe de l’électrode (1). Après l’apprentissage, les rats ne cessaient d’appuyer sur la pédale… jusqu’à en mourir. La seule façon de les faire arrêter était de couper le circuit électrique. L’intensité du courant électrique étant très faible, ce n’était pas la stimulation électrique qui causait leur mort, mais le fait qu’ils arrêtaient de boire et de manger. Les chercheurs en ont déduit que la stimulation de certaines aires cérébrales entraînait une satisfaction si intense qu’elle faisait perdre toute sensation de faim et de soif. Deux sites du cerveau se sont avérés particulièrement efficaces : l’hypothalamus et une région profonde du mésencéphale, l’aire tegmentale ventrale. Si le rôle de l’hypothalamus dans la prise de nourriture et l’activité sexuelle était déjà connu, celui de l’aire tegmentale ventrale l’était beaucoup moins. Il a fallu attendre une dizaine d’années après cette expérience princeps, pour que l’aire tegmentale ventrale fût caractérisée comme la zone de localisation des corps cellulaires des neurones à dopamine (2). Ces cellules innervent de façon divergente différentes structures corticales et sous-corticales. Dans les années qui ont suivi, la conjonction de plusieurs disciplines – l’anatomie, la neurobiologie comportementale et la neuropharmacologie – a permis de définir une entité dénommée « circuit de la récompense », constituée de structures cérébrales en interrelation (noyau accumbens, septum, amygdale, hippocampe, cortex préfrontal), elles-mêmes sous la dépendance des afférences dopaminergiques venant de l’aire tegmentale ventrale.
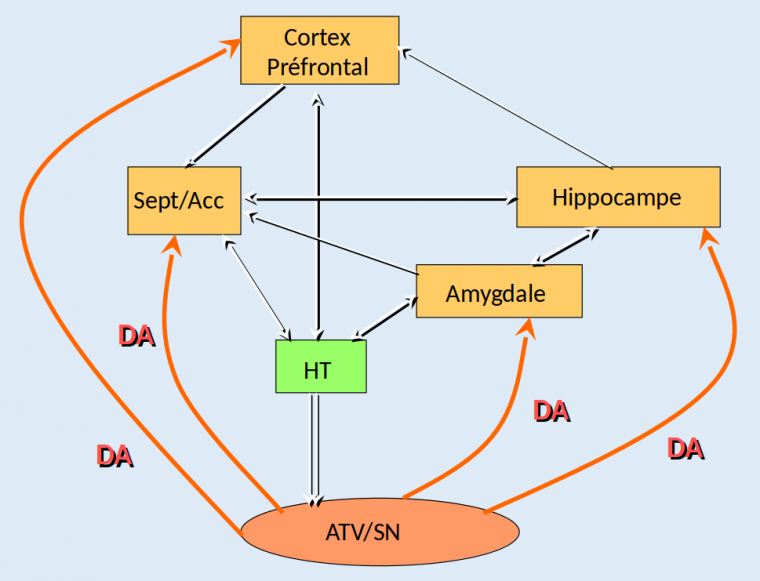
Le cortex préfrontal est impliqué dans la motivation et la focalisation de l’attention, l’amygdale est considérée comme étant le centre des émotions, et l’hippocampe serait le régulateur de la mémoire. Quant au noyau accumbens, il jouerait un rôle d’interface entre les émotions et les sorties motrices. Toutes ces structures se projettent sur l’hypothalamus, qui régule les fonctions neurovégétatives de l’organisme, c’est-à-dire les fonctions vitales telles que le rythme cardiaque ou la régulation thermique, des fonctions métaboliques comme la faim et la soif, et également la reproduction. L’aire tegmentale ventrale, enfin, reçoit les informations de plusieurs régions cérébrales, dont l’hypothalamus, et transmet ses ordres au noyau accumbens et au reste du circuit de la récompense en modifiant la libération de dopamine (Figure 2).
Les différentes structures cérébrales sont en interrelation et sont modulées par la dopamine (DA, en rouge) issue de l’aire tegmentale ventrale (ATV) et de la substance noire (SN). Les données convergent vers l’hypothalamus (HT), lui-même en relation avec l’ATV. Abréviations : Sept/Acc signifie septum et noyau accumbens.
Le singe et la goutte de jus de pomme
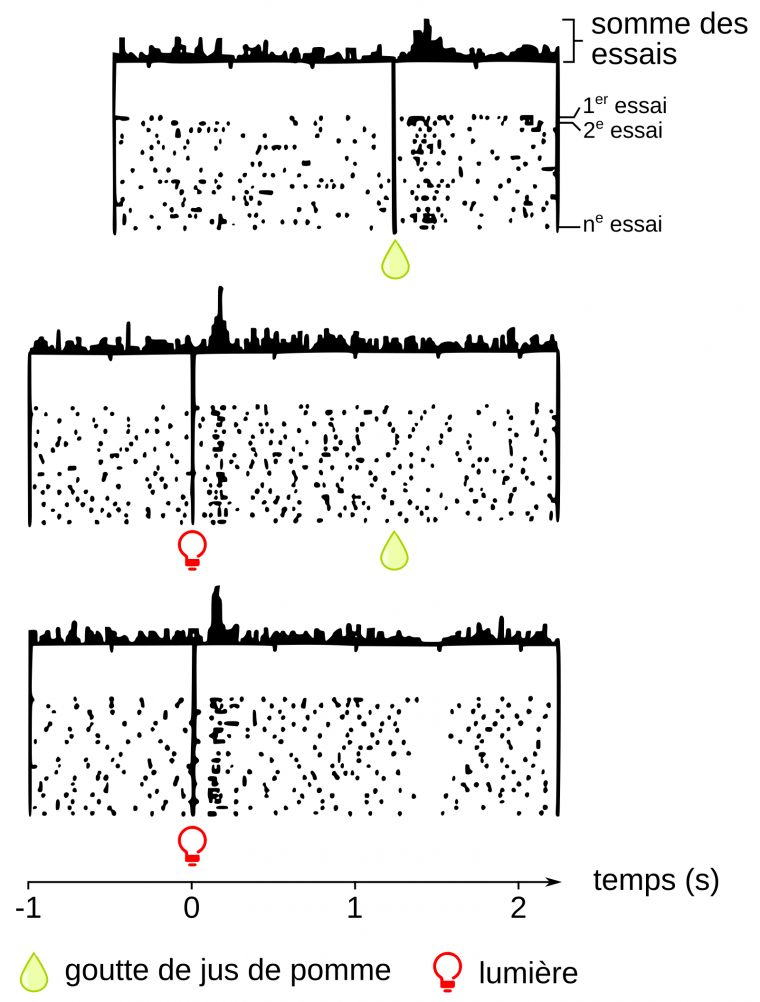
À la fin des années 90 de nouvelles données rendant compte de l’importance du système de récompense dans la vie de l’individu ont été obtenues dans une série d’expériences devenues célèbres réalisées par Wolfram Schultz à Fribourg en Suisse (3). Ces expériences consistent à enregistrer chez des singes éveillés l’activité des neurones à dopamine de l’aire tegmentale ventrale, ceux qui contrôlent le circuit de la récompense. Dans un premier temps, le singe reçoit une goutte de jus de pomme qui lui est délivrée dans la bouche par un cathéter. Le singe adore le jus de pomme et le sucre qu’il contient, et ses neurones à dopamine sont activés pendant quelques fractions de seconde à chaque goutte qui lui est délivrée de façon aléatoire. Dans une seconde expérience, une lumière rouge s’allume une seconde avant l’arrivée – toujours aléatoire – de la goutte de jus de pomme. La répétition de ces conditions expérimentales fait que, progressivement, les neurones à dopamine ne s’activent plus au moment où la goutte de jus de pomme est effectivement délivrée, mais au moment où la lumière s’allume (Figure 3). Ainsi, par l’intermédiaire de l’activation des neurones dopaminergiques, le singe apprendrait à repérer un signal annonciateur d’une récompense. Le cerveau se constituerait ainsi au fil du temps, grâce aux neurones à dopamine, des chaînes de signifiants, c’est-à-dire d’éléments associés à un ou des plaisirs (la vue d’un feu de cheminée quand l’on a froid, d’un plat ou d’un gâteau que l’on apprécie…). Concrètement, les neurones libérant de la dopamine sont d’abord activés par les caractéristiques primaires de la récompense, comme l’odeur, la forme, la texture, la couleur, puis ces divers traits sont progressivement associés aux signaux de l’environnement. Après l’apprentissage, la seule présence de ces signaux active la libération de dopamine qui, en retour, permet de déclencher un comportement adapté à l’obtention de la récompense. Le rôle de l’activation des neurones dopaminergiques de l’aire tegmentale ventrale est donc de diriger l’individu vers ce qui est, a priori, bon pour lui.
Mais c’est la troisième expérience qui nous intéresse particulièrement. Chez un singe qui a appris le lien entre la lumière rouge et le jus de pomme, la lumière rouge est maintenant allumée sans que la goutte de jus de pomme ne soit délivrée. L’absence de récompense dans la seconde qui suit l’allumage de la lumière fait que l’activité des neurones à dopamine diminue rapidement jusqu’à s’arrêter pendant les 250 millisecondes qui suivent le moment où la récompense était attendue. On peut raisonnablement supposer que cette disparition momentanée d’activité des neurones à dopamine est ressentie par l’animal comme un mal-être qui pourrait être assimilé, chez l’humain, à une frustration, une douleur ou une perte. Cette baisse d’activité temporaire pourrait être non seulement le signal que la récompense est absente mais aussi, dans une situation naturelle non expérimentale, être à l’origine d’une nouvelle action pour compenser cette frustration. Ainsi le bébé affamé serait amené à pleurer pour obtenir son biberon ou le prédateur qui a raté sa proie serait incité à recommencer sa chasse. Au contraire, si la récompense est présente, plus rien ne justifie une modification d’activité des neurones dopaminergiques.
L’activité d’un neurone dopaminergique (noir : activité, blanc : repos) est enregistrée lors d’une série d’arrivées aléatoires d’une goutte de jus de pomme dans trois conditions différentes, chez un même singe. Pour chaque condition, la somme des activations du neurone lors des différentes arrivées de jus de pomme est représentée sous la forme d’un histogramme en haut du graphique.
Haut. L’administration aléatoire d’une goutte de jus de pomme (récompense) entraîne, après environ 200 ms, une augmentation de l’activité du neurone dopaminergique. Ce processus, inné, est dans ce cas dû, entre autres, à la présence de sucre dans le jus de pomme et signale à l’organisme une source d’énergie.
Milieu. Après apprentissage de l’association « lumière qui s’allume → goutte de jus de pomme », le neurone dopaminergique s’active juste après le stimulus lumineux et non plus après la récompense. Notons que le temps écoulé entre l’allumage de la lumière rouge et l’arrivée de la goutte de jus de pomme n’est que légèrement supérieur à une seconde, un temps nécessairement court pour que l’association stimulus-récompense puisse avoir lieu.
Bas. Cette fois, le singe ne reçoit plus de jus de pomme après le stimulus lumineux. Ce dernier est cependant toujours associé à l’activation du neurone dopaminergique. En revanche, une seconde et demie après le stimulus lumineux, juste après le moment où la goutte de jus de pomme aurait dû être reçue, le neurone dopaminergique devient silencieux pendant une centaine de millisecondes. Au final, après conditionnement, le neurone dopaminergique signale l’erreur de prédiction de la récompense, c’est-à-dire la différence de valeur entre la récompense attendue et la récompense obtenue. Les neurones dopaminergiques indiqueraient ainsi par leur baisse d’activité l’existence d’un manque et représenteraient un signal incitant à compenser ce dernier.
Et chez l’humain ?
Depuis une vingtaine d’années, l’imagerie cérébrale permet d’étudier les débits sanguins cérébraux chez l’Homme au cours de différentes situations liées au plaisir qu’il soit d’origine émotive, sensorielle ou sexuelle. Dès le milieu des années 90, les premiers travaux de ce type ont montré que certaines zones cérébrales étaient activées lors d’une émotion agréable (cortex préfrontal médian, thalamus, hypothalamus et mésencéphale) alors que d’autres zones étaient préférentiellement activées à l’occasion d’émotions désagréables (cortex occipito-temporal, cervelet, gyrus parahippocampique, hippocampe et amygdale) (4). Quelques années plus tard, une équipe canadienne a établi des résultats voisins en montrant des corrélations entre les débits sanguins cérébraux de certaines zones cérébrales et l’écoute d’une musique déclenchant un plaisir « qui fait frissonner jusqu’à la moelle » (5). Dans cette expérience de plaisir intense, certaines zones voient leur débit sanguin cérébral augmenté, tels le striatum ventral gauche (noyau accumbens), le cortex cingulaire antérieur et le mésencéphale, alors que ce débit sanguin cérébral diminue dans d’autres zones, comme l’amygdale droit, l’hippocampe/amygdale gauche et le cortex préfrontal ventro-médian. L’activation sélective de différentes zones cérébrales est aussi observée chez l’homme lors de l’éjaculation (6). Le débit sanguin cérébral augmente dans l’aire tegmentale ventrale et dans différentes zones corticales droites, alors qu’il diminue dans l’amygdale et le cortex entorhinal. Les auteurs proposent que les désactivations observées dans l’amygdale et le cortex entorhinal correspondent à une disparition de la vigilance vis-à-vis du monde extérieur et de la peur que cette vigilance peut engendrer, deux fonctions dont l’amygdale est responsable. Cette baisse d’activité au niveau de l’amygdale existe aussi lorsque des photographies de l’être aimé sont présentées à des partenaires très amoureux (7) ou à la suite d’un « sniff » de cocaïne. En fait, ce serait l’activation du cortex préfrontal qui aurait pour conséquence la baisse d’activité de l’amygdale.
Les données de neuro-imagerie confirment donc qu’il existe un certain nombre de structures cérébrales qui sont activées par le plaisir, quelle qu’en soit l’origine. Elles apportent aussi une nouvelle donnée selon laquelle l’obtention d’un plaisir intense nécessiterait non seulement l’activation de plusieurs zones cérébrales mais aussi la désactivation de certaines d’entre elles, comme l’amygdale. Ce serait la combinaison de ces activations et désactivations qui permettrait que le plaisir dépasse le seuil de la simple satisfaction. Notons que cette nécessaire désactivation d’une structure pour obtenir du plaisir pourrait apporter une explication neurophysiologique aux troubles sexuels observés à la suite de viols ; en effet, après une agression sexuelle l’hyperréactivité de l’amygdale aurait pour conséquence de bloquer l'accès au plaisir lors d’un contact physique. Quoi qu’il en soit, l’existence d’un « circuit de la récompense », commun à tous les plaisirs, est un concept que toutes les expérimentations confirment. Il n’empêche que la plupart des études se sont surtout focalisées sur les mécanismes d’action des drogues et de la nourriture sur le circuit de la récompense, alors que le lien entre ce circuit et les perceptions d’ordre sexuel reste encore peu documenté.
La sexualité est pourtant la référence en ce qui concerne le plaisir. Le paradoxe de la sexualité est cependant que, malgré son importance pour l’espèce et contrairement à la relation à la nourriture, un individu peut vivre de longues années sans activité sexuelle. Pour que l’acte sexuel ait lieu malgré tout, il faut qu’il existe un lien très fort entre la copulation et le système de récompense, c’est-à-dire le plaisir que la sexualité engendre et la satisfaction qu’elle procure après son accomplissement. Comme nous le verrons chez le rat dans l’exemple qui suit, ce lien entre le système de récompense et l’acte sexuel est non seulement inné mais aussi sans doute le plus puissant parmi les plaisirs physiologiques. On comprend alors mieux que cette place privilégiée de la sexualité dans la hiérarchie des fonctions innées et des plaisirs ait pris chez l’Homme une place fondamentale dans la construction du psychisme et, plus tard, dans les théories psychologiques et psychanalytiques qui ont cherché à en comprendre le développement.
Ainsi, la construction de la sexualité adulte reposerait sur des éléments comportementaux préprogrammés capables d’activer le circuit de la récompense. À partir de cette association initiale, qui repose sur des bases purement neurophysiologiques, toutes formes de comportements sexuels plus ou moins complexes pourraient se mettre en place en fonction des espèces. Chez le rat, certaines situations expérimentales de type « association préprogrammée » ont été définies. Par exemple, la présence (sans contact) d’une femelle réceptive déclenche chez un rat mâle sans aucune expérience sexuelle, non seulement une érection, mais aussi une augmentation de libération de dopamine dans le noyau accumbens (8). Cette augmentation de libération de dopamine n’apparaît pas si la femelle n’est pas réceptive. Selon les hypothèses actuelles, c’est cette libération de dopamine qui conduirait l’animal à rechercher l’activité susceptible de lui apporter la satisfaction, en l’occurrence l’intromission et l’éjaculation, cette dernière accentuant encore plus l’activation du circuit de la récompense. Il est probable que ce sont les phéromones émises par la femelle et reçues par le mâle au niveau de son organe voméronasal qui expliquent l’augmentation de libération de dopamine. Chez l’Homme, il est sans doute délicat de vouloir retrouver tous les éléments purement sexuels associés physiologiquement au circuit de la récompense, d‘autant plus que certains organes, comme l’organe voméronasal, semblent avoir perdu leurs fonctionnalités. On peut plutôt penser que l’enfant se construit, à partir de ses premiers rapports hédonistes, des liens entre les stimuli perçus et le plaisir ressenti, liens qu’il intègre petit à petit. Par la suite, il recherchera dans son environnement des stimuli analogues. À l’adolescence, ces liens pourraient entrer en coalescence avec ceux qui naissent des conséquences de l’afflux d’hormones et du développement des récepteurs hormonaux à cette période de la vie1. Néanmoins, les préférences en termes de choix de partenaire peuvent évoluer au cours de la vie de l’individu, entre autres parce qu’elles dépendent des émotions que ce dernier a pu ressentir au cours de son développement. En particulier, le fait que le système nerveux central de l’Homme possède la propriété de pouvoir créer des liens entre des événements décalés dans le temps – c’est-à-dire un mode de mémorisation très exceptionnel dans l’ensemble du monde animal (13) – expliquerait la grande variabilité des préférences sexuelles chez l’Homme. Cette variabilité résulterait pour l’essentiel de processus acquis au cours de l’histoire de l’individu et non pas d’un déterminisme génétique.
La dopamine, seule responsable du circuit de la récompense ?
Le circuit de la récompense est donc une sorte de « baromètre » qui indique à l’animal – ou à l’individu – l’état physique et psychique dans lequel il se trouve ou va se trouver. Le circuit de la récompense est actif dans tous les cas où nous éprouvons du plaisir de façon naturelle, par exemple lorsque nous mangeons, que nous écoutons de la musique, que nous observons de beaux paysages, ou encore durant les rapports sexuels. Mais il est également activé lors de la consommation de drogues ou dans certains cas pathologiques. En effet, l’étude du mécanisme d’action des drogues2 comme les psychostimulants (amphétamine, cocaïne…) ou les opiacés (morphine, héroïne…) a montré que tous ces produits qui déclenchent du plaisir, mais aussi éventuellement une dépendance, avaient en commun la propriété de provoquer la libération de dopamine et par conséquent d’activer ce « circuit de la récompense » (9, 10). L’analogie entre l’orgasme et le « rush » (ou le flash) des héroïnomanes a été maintes fois décrite et il semble légitime de considérer que tous les plaisirs que nous venons de décrire s’expriment en activant des circuits voisins sinon identiques à ceux activés par les drogues toxicomanogènes.
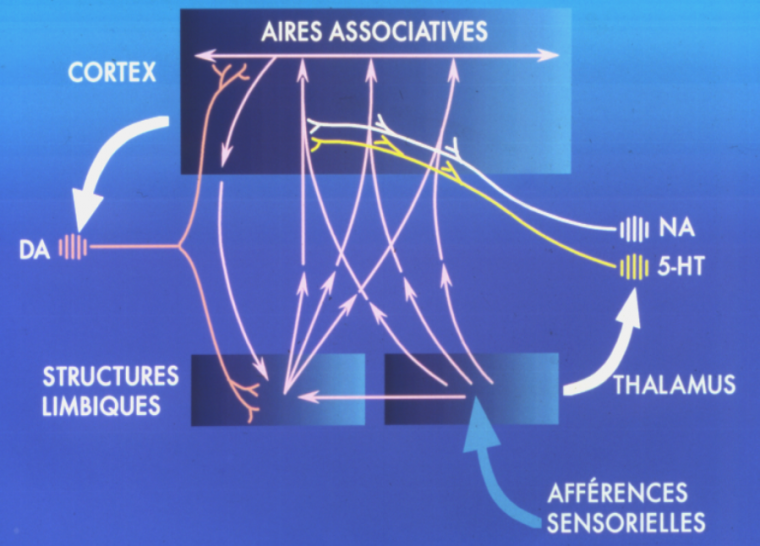
Nous l’avons dit, la dopamine est le modulateur final des entrées physiques et psychiques. Cela signifie qu’en fonction des informations reçues en amont, les neurones dopaminergiques modulent la hiérarchie des structures corticales et sous-corticales de sorte que l’action recherchée (motrice s’il s’agit de courir ou de marcher, ou psychique s’il s’agit de focaliser son attention) puisse être réalisée. La dopamine est ainsi non pas un chef d’orchestre mais plutôt l’exécutante – ou même l’esclave – des informations traitées en amont. Deux autres modulateurs, la noradrénaline et la sérotonine interviennent en effet avant la dopamine (Figure 4). Bien qu’ils aient un grand nombre de caractéristiques communes, les neurones à noradrénaline, sérotonine et dopamine diffèrent sur plusieurs points. Les neurones à noradrénaline réagissent à tout événement nouveau de l’environnement dans un délai extrêmement court (30 ms) en libérant de la noradrénaline. Si l’évènement nouveau se reproduit plusieurs fois, les neurones noradrénergiques ne s’activent plus (on dit qu’ils se désensibilisent). La libération de noradrénaline entraîne, notamment dans le cortex somatosensoriel, une augmentation du rapport signal sur bruit. Autrement dit, lorsque survient un événement saillant, la noradrénaline diminue le bruit de fond, ce qui met en relief le nouveau signal par rapport à l’ensemble des signaux déjà présents et qui constituent le bruit. Ces neurones renforcent la vigilance et la prise de conscience de l’événement par l’individu.
Les afférences sensorielles, après un relais dans des noyaux spécifiques du thalamus, atteignent le cortex par l’intermédiaire des neurones dits exécutifs. Simultanément les neurones noradrénergiques (NA) et sérotoninergiques (5-HT) sont activés et modulent le traitement des informations corticales qui sont associées de l’arrière à l’avant du cortex. Ces informations rejoignent les neurones dopaminergiques (DA) qui déterminent une hiérarchie cortico-sous-corticale afin de répondre de façon adaptée au sens des afférences sensorielles (13). Abréviation : 5-HT signifie 5-hydroxytryptamine (sérotonine).
Les neurones sérotoninergiques, quant à eux, réagissent aussi aux événements extérieurs mais, contrairement aux neurones noradrénergiques, ils ne se désensibilisent pas quand ils reçoivent successivement des stimuli identiques. La libération de sérotonine entraîne une diminution du rapport signal sur bruit, c’est-à-dire qu’elle diminue plus le signal que le bruit de fond. Ainsi, les événements saillants sont « relativisés », ce qui permet de rester vigilant face à ce qui se passe autour de soi. Ce faisant, les neurones à sérotonine semblent protéger le système nerveux central : ils lui permettent de poursuivre le traitement des informations reçues, malgré la présence d’événements extérieurs marquants, qui risqueraient de perturber ce traitement.
Des observations anatomiques puis des expériences biochimiques ont montré que ces neurones noradrénergiques et sérotoninergiques étaient couplés, c’est-à-dire que ces cellules exercent un contrôle réciproque les unes sur les autres. Nous pouvons supposer que cette régulation mutuelle des neurones noradrénergiques et sérotoninergiques limite l’amplitude de l’activation des différents ensembles de neurones par les informations extérieures. Selon ce schéma, les neurones dopaminergiques suivraient les instructions du couple noradrénaline-sérotonine, situé en amont dans le flux de l’information.
Par ailleurs, notre équipe a montré que la prise répétée de drogues, telles que l’amphétamine, la cocaïne, la morphine, l’alcool ou même le tabac (toutes ces drogues entraînent une dépendance), découple les neurones noradrénergiques et sérotoninergiques, c’est-à-dire supprime ce contrôle réciproque qui protège le système global (11, 12). On pourrait comparer la noradrénaline, très réactive et rapide, à un coureur de sprint, et la sérotonine, moins réactive et plus lente, à un coureur de fond, les deux étant liés par une ficelle, symbolisant leur régulation mutuelle. Quand on prend une drogue, ces deux systèmes sont activés de façon synchronisée et, à mesure que les prises se répètent, le lien entre les deux se défait. Dès lors, la noradrénaline s’active à l’occasion de tout événement nouveau ou saillant, et la sérotonine ne parvient plus à la réguler. Donc le coureur de sprint se fatigue, car il court sans contrôle (le coureur de fond ne le ralentit pas). Ainsi, en absence de drogue, le toxicomane serait sujet à des émotions déclenchées par des événements objectivement mineurs, mais il les ressentirait de façon intense et ne pourrait pas les contrôler.
En résumé, si l’on admet qu’il existe trois paliers qui conduisent à la toxicomanie – l’usage, l’abus et la dépendance –, l’activation de la dopamine fait passer de l’usage à l’abus en suggérant à l’individu que ce qui est en train de se passer est bon pour lui. La répétition des prises fait passer de l’abus à la dépendance et au découplage des systèmes noradrénergique et sérotoninergique. Ce découplage entraîne un malaise quasi permanent en l’absence de produit et, pour s’en libérer, le sujet doit reprendre la substance, qui resynchronise de façon artificielle les systèmes.
Conclusion
Des données récentes de la neurobiologie ont permis de montrer que tous les produits qui déclenchent une dépendance chez l’Homme, comme la cocaïne ou l’héroïne, augmentent la libération de dopamine dans une structure sous-corticale, le noyau accumbens. Ce noyau fait partie d’un ensemble de structures cérébrales, qui comprend le septum, l’amygdale, l’hippocampe et le cortex préfrontal et qui est dénommé « circuit de la récompense » car il définit à chaque instant l’état de satisfaction physique et psychique dans lequel se trouve l’animal ou l’individu. Toutes ces structures reçoivent une innervation dopaminergique issue d’une même structure mésencéphalique, l’aire tegmentale ventrale. Les drogues, en modifiant la cinétique et l’amplitude de la production de dopamine, stimulent de façon artificielle les structures du circuit de la récompense et induisent chez l’Homme une sensation de satisfaction.
Dans des conditions physiologiques, l’activité des neurones dopaminergiques augmente à l’occasion de récompenses naturelles (nourriture, boisson, sexualité…). L’apprentissage conduit à ce que ce ne soit plus la récompense qui active les neurones dopaminergiques mais les signaux annonçant l’arrivée de la récompense. Au cours de l’ontogénèse, nous constituons donc un ensemble de signaux qui nous sont propres et dont la perception nous permet d’anticiper une satisfaction et de nous adapter à son obtention. Un signal non suivi de récompense déclenche une frustration. La prise de drogue, en activant les systèmes dopaminergiques, conduit le toxicomane à mémoriser des événements qui n’ont pas de réalité physiologique mais qui, parce qu’ils sont associés à la prise de produit, l’en rendent dépendant.
Même si la conception dopaminergique des processus de récompense et de dépendance représente une avancée considérable dans notre compréhension de la recherche de plaisir et de la toxicomanie, la dopamine n’est vraisemblablement que le dernier maillon d’une chaîne neuronale impliquant d’autres neuromodulateurs tels que la noradrénaline et la sérotonine. La démonstration récente d’un couplage entre les neurones noradrénergiques et sérotoninergiques doit nous inciter à prendre en compte ces interactions.
Un certain nombre de points abordés dans cet article, ainsi que d’autres, ont été développés de façon plus précise dans un livre que je viens de publier chez Dunod (Paris): Les coulisses du cerveau: L’inconscient aux commandes (13).
Références
- Olds J, Milner PM. J. Comp. Physiol. Psychol. 1954; 47 : 419.
- Dahlström A, Fuxe K. Evidence for the existence of monoamine-containing neurons in the central nervous system. Acta Physiol. Scand. 1965; 62: Suppl. 32.
- Schultz W, Dayan P, Montague PR, A neural substrate of prediction and reward. Science 1997; 275: 1593-1599.
- Lane RD, Reiman EM, Bradley MM, Lang PJ et al.Neuroanatomical correlates of pleasant and unpleasant emotion. Neuropsychologia, 1997; 35: 1437-1444.
- Blood AJ, Zatorre RJ. Intensely pleasurable responses to music correlate with activity in brain regions implicated in reward and emotion. Proc. Natl. Acad. Sci. USA, 2001; 98: 11818-11823.
- Holstege G, Georgiadis JR, Paans AMJ, Meiners LC et al., Brain activation during human male ejaculation. J. of Neuroscience, 2003; 23: 9185-9193.
- Bartels A, Zeki S. The neural correlates of maternal and romantic love. NeuroImage, 2004; 21: 1155-1166.
- Wenkstern D, Pfaus JG, Fibiger HC. Dopamine transmission increases in the nucleus accumbens of male rats during their first exposure to sexually receptive female rats. Brain Res. 1993; 30: 41-46.
- Di Chiara G, Imperato A. Drugs abused by humans preferentially increase synaptic dopamine concentrations in the mesolimbic system of freely moving rats. Proc. Natl. Acad. Sci. USA 1988; 85: 5274-5278.
- Tassin JP. La place de la dopamine dans les processus de dépendance aux drogues. Bull. Acad. Natle. Méd., 2002; 186: 295-305.
- Salomon L., Lanteri C., Glowinski J., Tassin J.-P. (2006), « Behavioral sensitization to amphetamine results from an uncoupling between noradrenergic and serotonergic neurons », Proc. Natl. Acad. Sci. USA, 2006; 103: 7476-7481.
- Tassin JP. Uncoupling between noradrenergic and serotonergic neurons as a molecular basis of stable changes in behavior induced by repeated drugs of abuse, Biochemical Pharmacology. 2008; 75: 85-97.
- Tassin JP. Les coulisses du cerveau : L’inconscient aux commandes (Février 2021), Dunod Paris.