De nombreuses cellules et molécules du système immunitaire sont impliquées dans la contrôle de la croissance tumorale. Cependant, la réponse de l'organisme ne suffit pas toujours pour empêcher le développement d'un cancer. L'immunothérapie vise à activer les mécanismes de défense des patients (par l'intermédiaire de cytokines ou de vaccins par exemple) ainsi qu'à pallier une réponse insuffisante par l'administration de molécules ou cellules effectrices (anticorps monoclonaux, cellules CAR-T).
De nos jours, les cancers constituent la deuxième cause de mortalité dans le monde après les maladies cardiovasculaires (plus de 9 millions de décès liés à cette pathologie en 2017). On estime d’ailleurs qu’une personne sur cinq dans le monde mourra probablement d’un cancer, malgré les nombreux traitements existants tels que la chirurgie, la chimiothérapie ou la radiothérapie… La résistance à ces traitements est notamment due à l’hétérogénéité des cellules tumorales et à leur acquisition de nombreuses propriétés leur permettant de se développer dans l’organisme de façon incontrôlée. En particulier, les cellules tumorales sont capables de se multiplier dans le corps tout en échappant au système immunitaire. Ces mécanismes d’échappement sont aujourd’hui très étudiés, afin de comprendre les processus mis en jeu pour pouvoir ensuite les cibler lors de traitements spécifiques d’immunothérapie.
L’immunothérapie consiste à traiter les cancers en utilisant le système immunitaire, soit en administrant au patient des molécules capables d’activer les réponses immunes, soit en administrant directement des molécules ou cellules du système immunitaire. Ces dernières années, ce type de thérapie est en plein essor et les résultats des traitements et essais cliniques actuels sont prometteurs ! C’est ainsi qu’en 2013 le magazine Science a reconnu l’immunothérapie comme l’une des avancées majeures de l’année. Autre signe de l’importance croissante de l’immunothérapie : l’attribution, en 2018, du prix Nobel de physiologie ou médecine à James Allison et Tasuku Honjo pour leurs découvertes à l’origine de l’immunothérapie du cancer.
Cet article présente dans un premier temps les interactions entre le système immunitaire et les cellules tumorales afin de pouvoir ensuite expliquer les principes des traitements d’immunothérapie, qu’ils soient déjà employés en clinique ou en cours de développement.
Interactions entre le système immunitaire et les cellules tumorales
Caractéristiques de la réponse immunitaire antitumorale : notion d’immunosurveillance
Bien que dérivant de cellules de l’organisme (donc, du « soi »), les cellules tumorales sont capables d’être reconnues par le système immunitaire. En effet, les cellules tumorales dérivent de cellules « saines » suite à l’accumulation de nombreuses mutations, et se distinguent alors de ces dernières par l’expression de nouvelles molécules à leur surface. Les cellules tumorales sont ainsi considérées comme du « soi altéré », et peuvent être détectées par les acteurs de la réponse immunitaire.
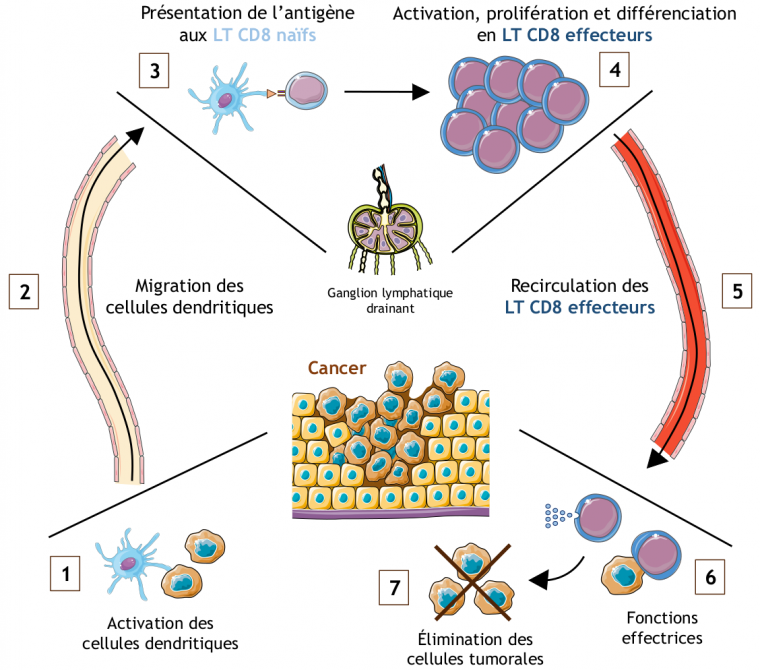
En particulier, lors de la mort de certaines cellules cancéreuses, des antigènes tumoraux sont libérés dans le microenvironnement tumoral et détectés par des cellules dendritiques présentes à cet endroit (Figure 1). Cette reconnaissance de l’antigène entraîne l’activation des cellules dendritiques, et leur migration jusqu’au ganglion lymphatique drainant la tumeur, où elles vont présenter les antigènes tumoraux aux lymphocytes T, dont les lymphocytes T CD8. Les lymphocytes T CD8 spécifiques de ces antigènes sont alors activés, prolifèrent, et migrent jusqu’au microenvironnement tumoral. À cet endroit, les lymphocytes T CD8 activés (ou LTc, pour « lymphocyte T cytotoxique ») reconnaissent les cellules tumorales par interaction entre leurs TCR (T-cell receptor) et les antigènes tumoraux présents à la surface des cellules cancéreuses. Cette reconnaissance conduit à l’élimination de ces dernières par cytotoxicité (sécrétion de perforine et de granzyme par le LTc, et lyse de la cellule cible).
Au niveau de la tumeur, les cellules dendritiques reconnaissent les antigènes tumoraux exogènes (libérés notamment après apoptose des cellules tumorales), les internalisent et les présentent à leur surface sur des molécules de CMH (1). Ces cellules dendritiques activées migrent alors par les vaisseaux lymphatiques jusqu’au ganglion lymphatique drainant (2). À cet endroit, les cellules dendritiques présentent les antigènes tumoraux aux lymphocytes T CD8 naïfs (3) qui sont activés, prolifèrent et se différencient en lymphocytes T CD8 effecteurs (lymphocytes T cytotoxiques) (4). Ces cellules migrent alors via la circulation sanguine jusqu’au site de la tumeur (5) où, grâce à leurs fonctions effectrices (lyse des cellules cibles et sécrétion de cytokines (6)), ils éliminent les cellules tumorales (7).
Les images de cellules, tissus et organes proviennent du site Servier Medical Art.
En parallèle, de nombreux autres acteurs moléculaires et cellulaires de la réponse immunitaire sont impliqués dans la réponse antitumorale. Il s’agit en particulier des cytokines et des cellules tueuses naturelles ou cellules NK (natural killer).
Les cytokines sont impliquées dans la signalisation et la communication au sein du système immunitaire. Elles permettent notamment l’activation, la multiplication et la migration des cellules du système immunitaire. De nombreuses cytokines favorisent la réponse immunitaire antitumorale, par exemple l’interleukine 2 (IL-2) qui permet la prolifération cellulaire ou l’interféron-γ, impliqué dans l’activation des cellules immunitaires.
De leur côté, les cellules NK sont capables de reconnaître les cellules qui présentent une diminution importante de l’expression du CMH I1 à leur surface. Cette baisse d’expression du CMH I s’observe dans de nombreuses tumeurs et permet aux cellules tumorales d’échapper à l’action des lymphocytes T CD8. Cependant, cette diminution d’expression du CMH I active les cellules NK. Ces dernières éliminent alors les cellules cancéreuses, soit directement par cytotoxicité (lyse de la cellule cancéreuse par sécrétion de granzyme et perforine), soit indirectement par la sécrétion de cytokines (activation et recrutement d’autres acteurs du système immunitaire).
Ainsi, une réponse immunitaire est mise en place en cas de tumeur, permettant initialement de contrôler la croissance tumorale : on parle « d’immunosurveillance ». Toutefois, des cellules tumorales résistantes peuvent émerger suite à l’apparition de mutations avantageuses. La tumeur peut alors se développer de façon incontrôlée, grâce à la mise en place de nombreux mécanismes d’échappement au système immunitaire.
Échappement de la tumeur au système immunitaire
De nombreux mécanismes d’échappement au système immunitaire ont été caractérisés, et favorisent la croissance tumorale (Figure 2).
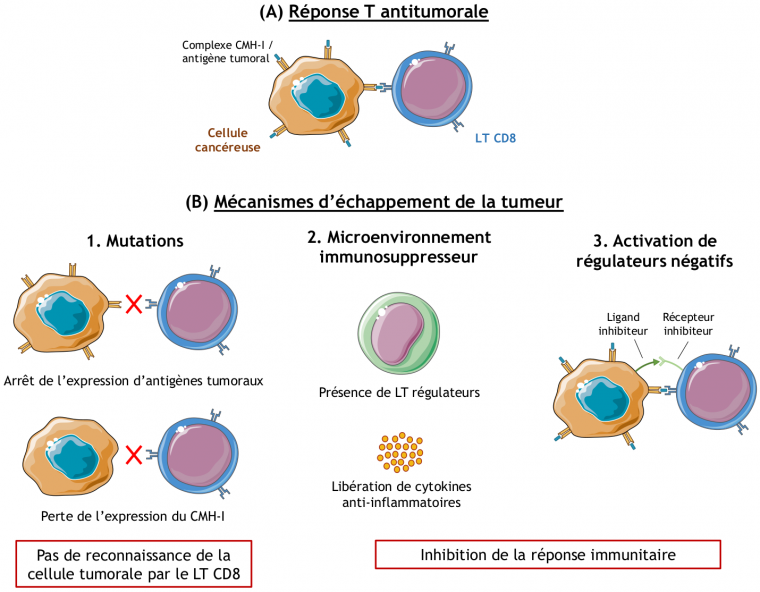
(A) Lors de la phase d’immunosurveillance de la tumeur, une réponse T antitumorale est mise en place suite à la reconnaissance de la cellule tumorale par les lymphocytes T CD8. Au niveau moléculaire, cette reconnaissance passe par l’interaction entre les antigènes tumoraux présentés par le CMH I des cellules tumorales et le TCR des lymphocytes T. Ceux-ci sont alors capables d’éliminer les cellules cancéreuses grâce à leurs fonctions effectrices.
(B) Lors de la phase d’échappement, différents mécanismes limitent la réponse immunitaire :
1. Les cellules tumorales subissent des mutations, pouvant conduire à une perte de l’expression des antigènes tumoraux ou des molécules de CMH I. Les cellules cancéreuses ne peuvent alors plus être reconnues par les lymphocytes T CD8.
2. Au sein de la tumeur, un microenvironnement suppresseur est mis en place, composé notamment de lymphocytes T régulateurs et de cytokines anti-inflammatoires telles que l’IL-10. Ces cellules et molécules inhibent la réponse immunitaire.
3. Les cellules tumorales expriment à leur surface des ligands inhibiteurs (ex : PD-L1), pouvant se lier à des récepteurs inhibiteurs (ex : PD-1) exprimés par les lymphocytes T CD8 activés. L’activité de ces derniers est alors inhibée, et ces cellules meurent par apoptose.
Les images de cellules proviennent du site Servier Medical Art.
Mutations des cellules cancéreuses, empêchant leur reconnaissance
Au cours de leur développement, les cellules tumorales accumulent de nombreuses mutations. Celles-ci peuvent favoriser leur échappement au système immunitaire en diminuant ou en stoppant l’expression de certains antigènes tumoraux immunogènes (c’est-à-dire reconnus et ciblés par la réponse immunitaire), empêchant ainsi leur reconnaissance. D’autres modifications génétiques aboutissent à la diminution de l’expression du CMH I. Les antigènes tumoraux ne sont alors plus présentés en surface des cellules cancéreuses, ce qui empêche leur reconnaissance par les cellules dendritiques ou les lymphocytes T cytotoxiques et la mise en place de la réponse adaptative. Néanmoins, comme indiqué précédemment, cette diminution du CMH I est reconnue par les cellules NK, qui peuvent ainsi éliminer ces cellules, bien que moins efficacement que les lymphocytes T cytotoxiques.
Formation d’un microenvironnement tumoral immunosuppresseur
La structure et la composition du microenvironnement tumoral participent également à l’échappement au système immunitaire. En particulier, les cellules cancéreuses peuvent libérer des cytokines favorisant le recrutement, la prolifération et la survie de lymphocytes T régulateurs. Ces cellules sécrètent des cytokines anti-inflammatoires telles que l’IL-10, qui inhibent la réponse immunitaire et permettent ainsi la croissance tumorale.
Activation de régulateurs négatifs de la réponse immunitaire : exemple du couple PD-1/PD-L1
Certaines cellules tumorales expriment à leur surface la molécule PD-L1. Ce ligand peut se lier à son récepteur PD-1 (programmed cell death 1), exprimé à la surface des lymphocytes T, bloquant ainsi l’activation et la prolifération de ces derniers et pouvant entraîner leur mort par apoptose. La réponse immunitaire adaptative antitumorale est ainsi inhibée.
Bilan
Ces différentes phases d’immunosurveillance et d’échappement de la tumeur au système immunitaire ont été regroupées au sein de la théorie « d’immunoédition » de la tumeur (« cancer immunoediting » en anglais). Ce concept explique comment le système immunitaire façonne la tumeur lors de son développement, avec des conséquences aussi bien bénéfiques que néfastes pour l’organisme. Selon cette théorie, les interactions entre le système immunitaire et la tumeur peuvent être décrites selon trois phases successives :
- Une phase d’élimination durant laquelle une réponse immunitaire active permet de détruire la plupart des cellules cancéreuses.
- Une phase d’équilibre, où la croissance tumorale est maintenue sous contrôle par les réponses immunitaires. Cette pression exercée par le système immunitaire sur les cellules cancéreuses induit toutefois une sélection des cellules tumorales résistantes.
- Une phase d’échappement où les cellules tumorales résistantes prolifèrent, aboutissant à une croissance incontrôlée de la tumeur.
Afin de limiter l’échappement de la tumeur et de renforcer les réponses immunitaires antitumorales, de nombreux traitements d’immunothérapie ont été développés depuis les trente dernières années.
Soigner le cancer grâce à l’immunothérapie
Différents types d’immunothérapie
Comme nous l’avons vu en introduction, l’immunothérapie consiste à traiter le cancer en utilisant le système immunitaire. Si celui-ci ne reconnaît pas la tumeur, l’immunothérapie vise alors à induire une réponse en « éduquant » les acteurs de l’immunité. Si la réponse immunitaire antitumorale est insuffisante pour éliminer la tumeur, l’immunothérapie a pour objectif d’augmenter la réponse.
Différentes techniques existent, afin de répondre à ces objectifs :
- l’immunothérapie passive consiste à administrer des molécules ou cellules du système immunitaire pour augmenter la réponse immunitaire préexistante (ex : anticorps monoclonaux, cellules CAR-T) ;
- l’immunothérapie active correspond à la mise en place, ou à la stimulation, de la réponse immunitaire antitumorale du patient (ex : cytokines, vaccination).
Cytokines
Les cytokines permettent la signalisation et la communication au sein du système immunitaire. En particulier, il a été démontré que les cytokines de la famille des interférons et des interleukines sont capables de stimuler la réponse antitumorale. Les premières études utilisant ces molécules dans des procédés d’immunothérapie ont été réalisées dans les années 1980, et ces traitements sont désormais prescrits dans les cas de leucémies ou de lymphomes pour l’interféron-α, ou de cancers du rein ou de mélanomes pour l’interleukine-2.
Ces traitements ont toutefois l’inconvénient d’être peu spécifiques, et entraînent donc de nombreux effets secondaires (inflammation à l’origine de fortes fièvres, nausées…). Ils sont ainsi peu utilisés en pratique, car ils nécessitent un suivi lourd du patient par une équipe soignante dédiée, afin de contrôler et limiter cette toxicité secondaire. Actuellement, des formes modifiées de ces cytokines sont développées dans le but de limiter leurs effets indésirables sans toutefois diminuer leur efficacité. Des essais cliniques, aux premiers résultats prometteurs, sont en cours.
Anticorps monoclonaux
Des anticorps monoclonaux sont des anticorps produits par un clone, c’est-à-dire une même lignée de lymphocytes B, et qui ciblent donc un seul et unique antigène. En laboratoire, ces molécules sont produites à partir d’hybridomes, des cellules issues de la fusion de lymphocytes B avec des cellules de myélome. Les hybridomes possèdent ainsi les propriétés des deux types cellulaires fusionnés, à savoir la production d’anticorps pour le lymphocyte B, et la forte prolifération et l’immortalité de la cellule de myélome. Les hybridomes formés sont cultivés in vitro et triés, afin de ne garder que ceux d’intérêt, produisant les anticorps monoclonaux souhaités (récupérables dans le surnageant de culture). La mise au point de cette technique de production a valu à ses concepteurs, Georges Köhler, César Milstein et Niels Jerne, de se voir décerner le prix Nobel de physiologie ou médecine en 1984.
Les anticorps monoclonaux sont utilisés depuis plus de vingt ans en immunothérapie, afin de cibler et d’inhiber soit des molécules en surface des cellules tumorales favorisant leur croissance, soit des molécules régulant négativement le système immunitaire.
Anticorps monoclonaux ciblant les cellules cancéreuses
Exemple n°1 : Le premier anticorps monoclonal développé (le rituximab1) est utilisé pour traiter certains lymphomes (des cancers caractérisés par la prolifération des lymphocytes). Dans le cas des lymphomes à lymphocytes B, les plus fréquents, le rituximab permet de cibler la molécule CD20 exprimée par ces cellules, ce qui entraîne une toxicité.
Exemple n°2 : Chez environ 15 % des femmes atteintes de cancer du sein, les cellules tumorales expriment fortement la protéine Her2, un récepteur impliqué dans le développement de l’épithélium mammaire. Une immunothérapie basée sur l’utilisation d’un anticorps monoclonal anti-Her2 (le trastuzumab) est utilisée depuis le début des années 2000 pour bloquer l’activité de ce récepteur et limiter le développement de la tumeur. Cette thérapie est plutôt efficace et permet d’augmenter d’en moyenne cinq ans l’espérance de vie des patientes traitées.
Anticorps monoclonaux immunomodulateurs
Ces anticorps monoclonaux ciblent et inhibent des points de contrôles du système immunitaire, à savoir des molécules de surface contrôlant l’activation ou l’inhibition des réponses immunitaires adaptatives (Figure 3).
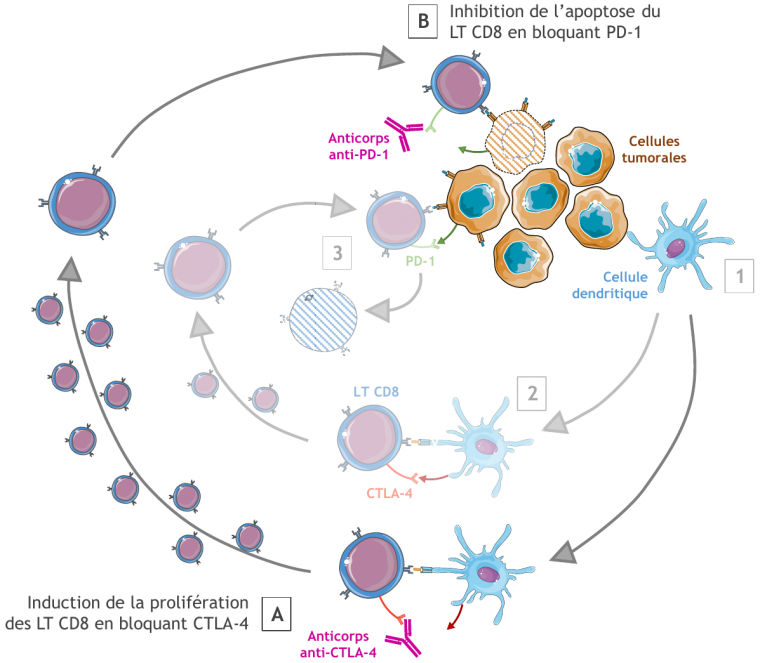
Exemple n°1 : La molécule CTLA-4 (cytotoxic T lymphocyte antigen 4) bloque normalement la prolifération des lymphocytes T après un certain temps d’interaction de ces cellules avec les cellules dendritiques dans les ganglions lymphatiques. L’utilisation d’un anticorps monoclonal anti-CTLA-4 (l’ipilimumab) permet de bloquer cette molécule et d’induire ainsi la multiplication des lymphocytes T. Ce traitement s’est démontré efficace dans la prise en charge de certains mélanomes, pour lesquels il n’existait alors que peu d’autres thérapies. Après traitement à l’ipilimumab, la maladie est en effet contrôlée sur le long terme, entraînant une augmentation de l’espérance de vie des patients de quelques années (au moins trois ans).
Exemple n°2 : Le récepteur PD-1 exprimé en surface des lymphocytes T est une molécule inhibitrice limitant la suractivation des réponses T au sein des tissus périphériques. En cas de cancer, les cellules tumorales expriment son ligand PD-L1. L’interaction PD1/PD-L1 entraîne l’apoptose des lymphocytes T. Des anticorps bloquant anti-PD-1 (le pembrolizumab, ou le nivolumab) ont été développés afin d’inhiber l’activité de PD-1, et ainsi d’empêcher l’apoptose des lymphocytes T. Ce traitement, utilisé chez des patients atteints de mélanomes ou de cancers du rein ou du poumon s’est montré efficace : la tumeur régresse de façon durable, et l’espérance de vie des patients est augmentée de quelques années.
En l’absence de traitement (voie représentée en transparence), le système immunitaire reconnaît les cellules tumorales (1). Toutefois, des points de contrôle peuvent parfois être activés, bloquant l’activation et la prolifération des cellules immunitaires (2). Ces points de contrôle sont parfois induits par les cellules tumorales elles-mêmes (3), pouvant entraîner la mort des lymphocytes impliqués.
L’utilisation d’anticorps monoclonaux (voie représentée en couleurs vives) permet d’outrepasser l’activation des points de contrôle et l’inhibition du système immunitaire. Une première approche (A) consiste à bloquer la molécule CTLA-4, ce qui restaure la prolifération des lymphocytes T. Une seconde approche (B) consiste à bloquer le récepteur PD-1, ce qui empêche les lymphocytes T d’entrer en apoptose et leur permet de lyser les cellules tumorales.
Les images de cellules proviennent du site Servier Medical Art.
L’utilisation des anticorps monoclonaux présente toutefois quelques inconvénients. D’une part, des effets secondaires sont possibles, par exemple l’induction de réponses auto-immunes provoquant des dommages inflammatoires dans divers organes (peau, intestin, rein, poumon…). D’autre part, ces thérapies restent très coûteuses (de l’ordre de la dizaine de milliers de dollars par mois), et peu de patients répondent (20 à 40 % selon les cancers). La réponse au traitement est d’ailleurs très difficile à prévoir, en raison d’une grande variabilité des cellules tumorales et de leur microenvironnement immunosuppresseur entre les patients.
Vaccins thérapeutiques
Cette technique d’immunothérapie vise à déclencher une réponse immunitaire contre les cellules tumorales, en présentant au système immunitaire un antigène tumoral capable d’être reconnu et de déclencher une réponse efficace.
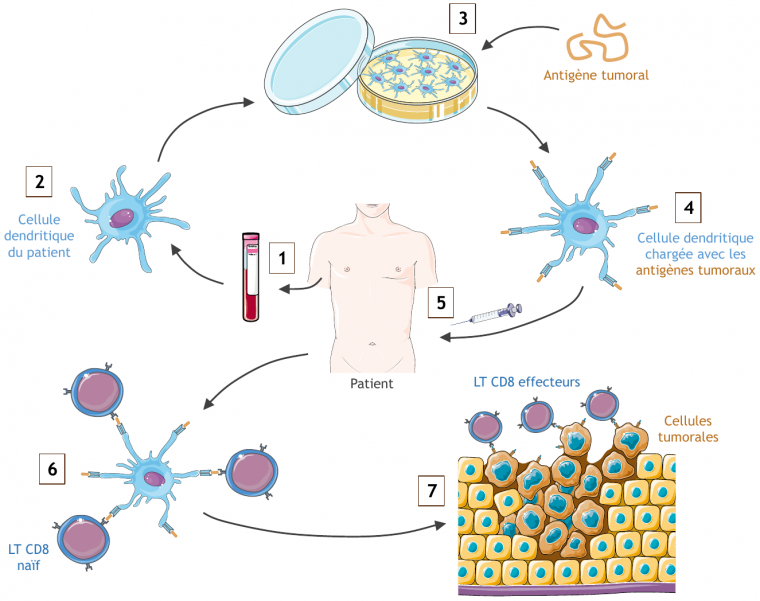
De nos jours, le seul vaccin thérapeutique commercialisé est le Sipuleucel-T, utilisé dans le cas du cancer de la prostate (Figure 4). La première étape de fabrication de ce vaccin consiste à prélever les cellules dendritiques du patient à partir d’un échantillon sanguin. Ces cellules sont ensuite mises en culture dans un milieu qui contient l’antigène tumoral, en l’occurrence la phosphatase acide prostatique, retrouvée dans 95 % des cancers de la prostate. Les cellules dendritiques capturent alors cet antigène puis le présentent via leur CMH. Les cellules dendritiques ainsi activées sont ensuite réinjectées chez le patient, où elles vont pouvoir activer les lymphocytes T dans les ganglions lymphatiques. Afin d’être efficace, ce processus doit être renouvelé trois fois, à deux semaines d’intervalle.
Un échantillon de sang est prélevé au patient (1) puis les cellules dendritiques sont isolées (2) et cultivées in vitro avec des antigènes spécifiques des cellules cancéreuses du patient (3). Cela induit l’activation des cellules dendritiques, qui expriment à leur surface les antigènes tumoraux (4). Une fois réinjectées chez le patient (5), les cellules dendritiques présentent les antigènes aux lymphocytes T CD8 naïfs dans les ganglions lymphatiques (6). Ces derniers sont alors activés, prolifèrent et se différencient en lymphocytes T CD8 effecteurs, qui migrent jusqu’au site de la tumeur pour y éliminer les cellules tumorales présentant les antigènes ciblés (7).
Les images utilisées proviennent du site Servier Medical Art.
Cette technique d’immunothérapie a pour avantage de ne provoquer que très peu d’effets secondaires, à part une légère inflammation au site d’injection. De plus, une réponse T mémoire est mise en place suite à la vaccination, limitant potentiellement les rechutes.
Actuellement, d’autres essais cliniques de vaccins thérapeutiques sont en cours, notamment chez des patients atteints de mélanomes (vaccin en association avec un anticorps monoclonal anti-PD-1). Ce traitement prometteur est pour l’instant en phase III de l’essai clinique.
Les vaccins prophylactiques
En parallèle des vaccins thérapeutiques, utilisés pour traiter les personnes atteintes d’un cancer, il existe des vaccins prophylactiques permettant de prévenir la survenue d’un cancer, tels que les vaccins contre les papillomavirus (virus responsables, entre autres, du cancer du col de l’utérus chez la femme). Ces vaccins font appel à des pseudo-particules virales, de structure quasiment identique à celle du virus sauvage, mais dépourvues de matériel génétique. Cette absence de matériel génétique prive ces particules de tout pouvoir infectieux et oncogène. La protéine virale utilisée pour construire la particule est spécifique du type de papillomavirus ciblé ; en fonction des vaccins, entre deux et neuf types de pseudo-particules virales sont utilisées, ce qui rend ces vaccins polyvalents en leur permettant de cibler différentes souches de papillomavirus.
Après injection, les pseudo-particules virales induisent une réponse immunitaire adaptative, et notamment la production d’anticorps par les lymphocytes B, qui diffusent et se concentrent dans l’épithélium vaginal. Ainsi, en cas d’infection par un papillomavirus, la présence de ces anticorps neutralise le virus et l’empêche d’infecter ses cellules cibles.
Même si la couverture vaccinale contre les papillomavirus reste insuffisante en France (environ 20 % de femmes vaccinées), l’efficacité de ces vaccins a pourtant été démontrée : on observe en effet 50 % de diminution du risque de cancer du col de l’utérus chez les femmes vaccinées, et jusqu’à 90 % de réduction chez les femmes vaccinées avant 17 ans (âge moyen du premier rapport sexuel, donc de l’exposition aux papillomavirus).
Thérapie cellulaire : l’exemple des cellules CAR-T
Les cellules CAR-T (pour chimeric antigenic receptor, ou « récepteur antigénique chimérique » en français) sont fabriquées en ajoutant un récepteur chimérique à des lymphocytes T du patient. Ces récepteurs chimériques, fabriqués sur-mesure, ciblent un antigène tumoral d’intérêt, induisant l’activation des lymphocytes T.
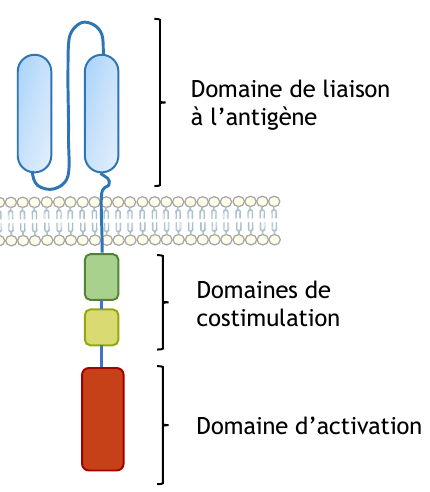
Les récepteurs CAR (Chimeric Antigenic Receptors) sont classiquement constitués de trois domaines : un domaine de liaison à l’antigène, un ou deux domaine(s) de costimulation, et un domaine d’activation.
Ils sont classiquement constitués de trois domaines (Figure 5) :
- un domaine de liaison à l’antigène, qui est dérivé de la partie variable d’un anticorps et qui permet ainsi une reconnaissance non restreinte au CMH, ce qui est un avantage car l’expression de cette molécule est souvent diminuée sur les cellules tumorales ;
- un domaine d’activation du lymphocyte T, qui correspond au domaine de signalisation intracellulaire du TCR ;
- un ou deux domaines de costimulation, dont le domaine intracellulaire du corécepteur CD28, ce qui permet l’activation du lymphocyte T même en l’absence de signaux co-stimulateurs dans l’environnement.
Différentes générations de cellules CAR-T ont été développées afin d’améliorer leur efficacité contre les tumeurs. Aujourd’hui par exemple, certaines cellules CAR-T de quatrième génération sont capables de sécréter des cytokines pro-inflammatoires, tandis que d’autres n’expriment pas de molécules co-inhibitrices ce qui leur permet de mieux faire face à l’environnement immunosuppresseur au sein de la tumeur. Ces modifications des récepteurs permettent un meilleur contrôle de la multiplication des cellules CAR-T, en parallèle d’améliorer leurs fonctions.
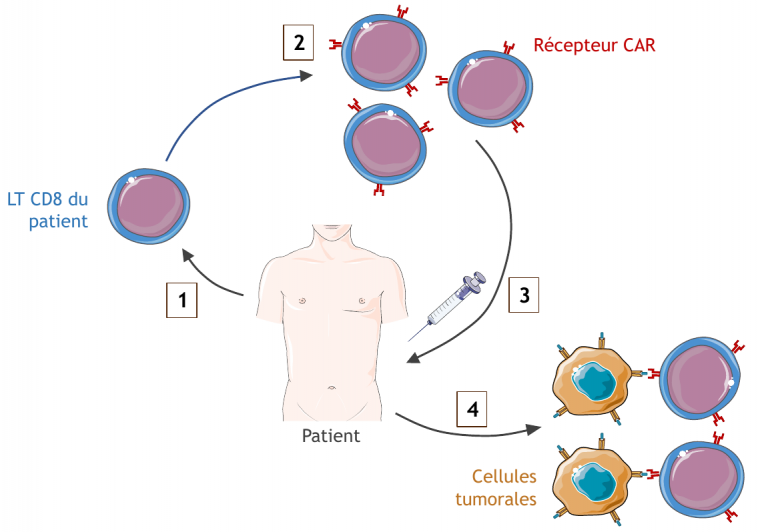
Pour fabriquer les CAR-T, des lymphocytes T sont prélevés chez le patient puis modifiés génétiquement in vitro par ajout d’un gène codant le récepteur chimérique d’intérêt (Figure 6). Pour cela, les lymphocytes T sont infectés avec un virus bénin modifié (des vecteurs lentiviraux ou rétroviraux), codant la molécule complète du récepteur antigénique chimérique d’intérêt. Lors de l’infection, l’entrée puis l’expression de l’ARN viral dans le lymphocyte T lui permet alors d’exprimer le récepteur chimérique à sa surface. Les cellules CAR-T ainsi générées sont cultivées in vitro pour les faire se multiplier, puis réinjectées chez le patient où elles vont pouvoir cibler les cellules tumorales et les éliminer.
Pour fabriquer les cellules CAR-T, des lymphocytes T sont prélevés chez le patient (1). Ces cellules sont modifiées génétiquement in vitro pour leur ajouter le gène codant le récepteur chimérique d’intérêt, puis cultivées afin de permettre leur multiplication (2). Les cellules CAR-T ainsi fabriquées sont réinjectées chez le patient (3), où elles vont pouvoir reconnaître et éliminer les cellules tumorales (4).
Les images utilisées pour cette figure proviennent du site Servier Medical Art.
Toutefois, la difficulté de cette technique réside notamment dans le ciblage d’antigènes tumoraux extracellulaires et spécifiques des cellules tumorales, reconnaissables par les cellules CAR-T. En effet, ce type d’antigène est rare, étant donné que les cellules tumorales dérivent de cellules saines. Les cellules CAR-T sont ainsi utilisées pour traiter des leucémies ou des lymphomes à lymphocytes B, car ces cellules sont les seules cellules de l’organisme à exprimer la molécule CD19 à leur surface, et ce en grande quantité. La molécule CD19 est donc un antigène de choix pouvant être ciblé par des cellules CAR-T spécifiques, conduisant à l’élimination de tous les lymphocytes B de l’organisme, transformés (cellules tumorales) et sains. L’absence de ces derniers est alors compensée par l’injection régulière d’immunoglobulines polyvalentes1.
Les premières cellules CAR-T furent fabriquées par un immunologiste israélien, Zelig Eshhar, en 1989. Les premiers essais avec ces cellules démontrèrent leur fonctionnalité, mais leur activité cytotoxique n’était malheureusement pas durable et le traitement présentait une toxicité secondaire. De nombreux travaux de recherches furent menés par la suite pour développer cette technique, jusqu’au début des années 2010 où une forte régression tumorale fut observée lors d’essais cliniques sur des patients atteints de lymphome ou de leucémie. Les effets secondaires restaient toutefois non négligeables, caractérisés notamment par un orage cytokinique lié à une très forte réponse inflammatoire. Suite à de nouveaux développements, la première thérapie CAR-T fut autorisée par la FDA américaine en 2017 pour traiter la leucémie (utilisation de cellules CAR-T anti-CD19), suite à des résultats très positifs en essai clinique (83 % de rémission sur 70 patients). Un an plus tard, cette immunothérapie fut testée sur près de mille patients atteints de leucémies ou de lymphomes avancés et les résultats furent au-delà des attentes : plus de la moitié de ces patients ont vu leur espérance de vie augmenter de quelques mois voire années, et parmi eux, des centaines semblent en rémission. Depuis 2018, plus de 250 essais cliniques sont en cours sur des cellules CAR-T.
Bien que très prometteuse, cette technique possède néanmoins plusieurs inconvénients. Premièrement, l’injection de ces cellules aux patients induit une forte production de cytokines pro-inflammatoires (TNFα, IFNγ, interleukines…), à l’origine de simples fièvres, ou dans certains cas d’effets plus graves (ex : hyperperméabilité capillaire pouvant causer une insuffisance cardiaque ou des atteintes rénales). De plus, cette thérapie est très coûteuse (environ 400 000 dollars par patient), et la réponse est très variable selon les patients, en lien avec la forte hétérogénéité des cellules tumorales et des mécanismes immunosuppresseurs mis en jeu. Une immunothérapie personnalisée serait donc nécessaire, ce qui n’est malheureusement pas simple à mettre en place. Enfin, comme nous l’avons vu, ce type de thérapie n’est actuellement pas efficace pour traiter des tumeurs solides. Il existe en effet peu d’antigènes spécifiques de ces tumeurs (la plupart des molécules exprimées par ces cellules cancéreuses le sont également par les tissus sains), et le microenvironnement tumoral limite l’accès des cellules immunitaire à la tumeur (présence notamment d’une matrice extracellulaire très fibreuse) ainsi que leur survie et leur multiplication (milieu immunosuppresseur, hypoxique, et contenant peu de nutriments). De nouvelles avancées sont donc nécessaires pour développer et améliorer ce type d’immunothérapie.
Vers de nouveaux développements prometteurs de l’immunothérapie
Utiliser d’autres acteurs du système immunitaire : l’exemple des cellules CAR-NK
Tout récemment, des cellules CAR-NK ont été développées en suivant l’exemple des cellules CAR-T : il s’agit de produire des cellules NK porteuses de récepteurs antigéniques chimériques. Cette nouvelle technique d’immunothérapie, pour l’instant principalement étudiée sur des lignées cellulaires et des modèles murins, est en cours d’essais cliniques de phases I et II et montre des résultats prometteurs dans le traitement de leucémies, de lymphomes et de myélomes. De façon intéressante, une bonne activité antitumorale a également été observée chez la souris dans le cas de tumeurs solides, notamment du sein et de l’ovaire.
Cette technique encourageante est donc à développer, d’autant plus qu’elle a pour avantage d’avoir moins d’effets secondaires que les traitements utilisant des cellules CAR-T (en particulier, pas d’inflammation liée à un orage cytokinique). L’objectif est notamment de trouver des moyens de renforcer l’efficacité de cette thérapie, en surpassant la courte durée de vie de ces cellules et en augmentant leur cytotoxicité, qui reste relativement limitée in vivo. La culture et l’expansion de ces cellules doit également être optimisée : actuellement, cette thérapie nécessite en effet des doses élevées et de multiples injections, qui ont pu conduire à des complications suite à une multiplication et à une activation exacerbées de ces cellules une fois injectées chez les patients.
Moduler le microbiote pour renforcer l’efficacité des traitements
Diverses études menées chez la souris révèlent une influence de la composition du microbiote sur la croissance tumorale. En particulier, des chercheurs de l’université de Chicago ont injecté des cellules de mélanome à deux populations de souris génétiquement identiques, mais possédant chacune un microbiote différent. Quelques semaines plus tard, ils ont pu observer une croissance différentielle des cellules cancéreuses entre les deux types de souris, ainsi qu’une plus forte réponse immunitaire antitumorale chez les souris montrant une croissance tumorale limitée. Le microbiote de ces souris « résistantes » a ensuite été transplanté chez les souris où la croissance tumorale était plus élevée. Résultat : la croissance tumorale a été ralentie chez les souris transplantées avec ce nouveau microbiote. Les selles des différentes souris ont par ailleurs été analysées afin de déterminer la composition du microbiote, et deux espèces de bactéries (Bifidobacterium longum ou Bifidobacterium breve) ont été identifiées comme pouvant être liées à l’activité antitumorale. En particulier, nourrir les souris avec une seule de ces deux espèces bactériennes a permis de stimuler leurs réponses immunitaires et de ralentir le développement des cellules cancéreuses.
Par ailleurs, d’autres études démontrent un impact du microbiote sur l’efficacité des immunothérapies basées sur l’utilisation d’anticorps monoclonaux. En particulier, des études précliniques sur des immunothérapies anti-CTLA-4 ont montré une efficacité limitée de ces anticorps monoclonaux chez des souris axéniques (sans microbiote) ou traitées avec des antibiotiques (induisant une dysbiose). L’efficacité du traitement est néanmoins restaurée chez les souris traitées avec antibiotique suite à l’administration de deux espèces particulières de Bacteroides. Par ailleurs, d’autres équipes de recherche ont montré que les patients répondeurs aux immunothérapies anti-PD-1 ont un microbiote plus diversifié et enrichi en plusieurs souches bactériennes spécifiques. La transplantation fécale du microbiote de ces patients répondeurs dans des souris axéniques atteintes de mélanome a permis de réduire la croissance tumorale dans ces animaux, grâce à une réponse T CD8 accrue. Tous ces résultats mettent en évidence que la réponse antitumorale peut être influencée par la composition du microbiote intestinal ; une dysbiose entraînant une réponse immunitaire limitée et une résistance des patients à l’immunothérapie. Les mécanismes précis par lesquels le microbiote influence la réponse immunitaire restent cependant à élucider…
Suite à ces découvertes récentes, des études sont en cours pour essayer d’utiliser ces résultats dans des essais cliniques, par exemple en couplant de l’immunothérapie à la prise de probiotiques, ou à une transplantation fécale d’un microbiote d’intérêt.
Associer l’immunothérapie à de la virothérapie
La virothérapie est une méthode basée sur l’utilisation de virus oncolytiques, c’est-à-dire de virus capables d’infecter et d’éliminer les cellules tumorales (exemples : virus herpes simplex, adénovirus, virus de la rougeole). Cette méthode a déjà été testée sur plusieurs types de cancers, et les résultats sont prometteurs. Par exemple, lors d’un essai clinique réalisé en 2013 sur des patients atteints d’un mélanome métastatique traités avec un virus Herpes simplex génétiquement modifié, le mélanome a disparu chez 11 % des patients, et les patients ont gagné en moyenne quatre mois d’espérance de vie.
La virothérapie présente plusieurs intérêts. Tout d’abord elle est spécifique et entraîne donc peu d’effets secondaires, car les virus ciblent uniquement les cellules cancéreuses. Dans le cas du virus de la rougeole par exemple, cette spécificité provient du fait que les récepteurs et corécepteurs à ce virus sont fortement exprimés par les cellules cancéreuses. De plus, ces cellules peuvent présenter des anomalies dans la voie des interférons de type I, qui protègent normalement les cellules des infections virales. Deuxièmement, la virothérapie provoque avec une forte efficacité la mort des cellules cancéreuses, que celle-ci intervienne par apoptose ou suite à la lyse des cellules lors de la libération des virions. De plus, le fait que les virus ciblent plusieurs processus cellulaires à la fois empêche l’apparition de résistances au traitement. Les virus utilisés peuvent par ailleurs être modifiés génétiquement pour renforcer leur spécificité vis-à-vis des cellules tumorales ou pour leur conférer d’autres propriétés anticancéreuses (par exemple en améliorant leur capacité à amplifier la réponse immunitaire). Enfin, l’utilisation de virus présente pour avantage de favoriser le recrutement de cellules immunitaires sur le site de la tumeur, en réponse à l’infection.
La virothérapie est donc une méthode encourageante pour limiter le développement de la tumeur. Grâce à son action sur le système immunitaire, cette technique pourrait notamment être employée en parallèle de traitements d’immunothérapie, pour stimuler la réponse immunitaire induite et outrepasser les mécanismes immunosuppresseurs mis en place par la tumeur.
Conclusion
L’immunothérapie promet d’être une véritable révolution dans les années à venir. De plus en plus de traitements d’immunothérapie sont autorisés, tandis que d’autres sont encore en cours de développement. En 2018, dans le monde, 200 000 patients étaient impliqués dans des essais cliniques liés à de l’immunothérapie ; et ce n’est pas près de s’arrêter ! Néanmoins, l’un des problèmes majeurs reste actuellement le coût prohibitif de ces traitements ; le marché global des médicaments anticancéreux approche en effet les 100 milliards de dollars par an. Il est donc nécessaire d’améliorer les systèmes de production de ces médicaments, et de mieux adapter les durées de traitement et les doses prescrites, pour limiter ces coûts et rendre ces traitements accessibles au plus grand nombre de patients possibles.
L’immunothérapie est une technique d’avenir, aux nombreuses perspectives. Des approches combinatoires sont actuellement développées, alliant différents types d’immunothérapies mais également associant l’immunothérapie avec d’autres traitements plus classiques comme la chimiothérapie. Cette combinaison immuno-chimiothérapie pourrait notamment se révéler intéressante dans le cas où les tumeurs sont peu infiltrées par des cellules immunitaires activables, par exemple dans les cancers du sein et de l’ovaire. Par ailleurs, les tumeurs étant très hétérogènes, il serait utile de développer des immunothérapies personnalisées, notamment pour estimer l’efficacité probable d’un traitement et limiter la survenue de résistance. Bien que cela soit possible grâce au développement de nouvelles techniques de séquençage, il n’existe néanmoins pas assez de biomarqueurs des tumeurs pour distinguer les patients. Des pistes sont explorées (notamment sur l’utilisation de PD-L1 en tant que biomarqueur), mais les résultats obtenus ne sont pas encore suffisants pour valider cette approche.
Références
- Catros V. (2019). Les CAR-T cells, des cellules tueuses spécifiques d’antigènes tumoraux. Medecine/Sciences 35: 316-326.
- Esfahani K. et al. (2020). A review of cancer immunotherapy: from the past, to the present, to the future. Current Oncology27(S2): 87-97.
- June C. et al. (2018). CAR T cell immunotherapy for human cancer. Science359: 1361-1365.
- Marofi F. et al. (2021). CAR-NK cells in cancer immunotherapy; A promising frontier. Cancer Science00: 1-10.
- Waldman A. et al. (2020). A guide to cancer immunotherapy: from T cell basic science to clinical practice. Nature Reviews Immunology20: 651-668.
- York A. (2018). Gut microbiota sways response to cancer immunotherapy. Nature Reviews Microbiology16: 121.
- Punt J. et al. (2018). Kuby Immunology - Eighth Edition. W.H. Freeman & Co Ltd.
- Cancer, l’arsenal des nouvelles thérapies. Hors-série Pour La Science n°99 (2018).
- Céline Giustranti (2017). Immunothérapie : La révolution attendue contre le cancer. Institut Curie. Consulté en août 2021. https://curie.fr/dossier-pedagogique/immunotherapie-la-revolution-attendue-contre-le-cancer
- Eric Vivier et al. (2019). Immunothérapie des cancers. Agir sur le système immunitaire pour lutter contre la maladie. Inserm. Consulté en août 2021.https://www.inserm.fr/dossier/immunotherapie-cancers/