Les interférons sont des protéines produites suite à une infection virale. En se fixant sur leurs cellules cibles, ces cytokines déclenchent chez celles-ci diverses réactions permettant la mise en place d'un état de résistance aux virus.
Les interférons (abrégés IFN) sont des glycoprotéines de la famille des cytokines (des molécules de signalisation contrôlant le système immunitaire). Ils ont été découverts en 1957 par Isaacs et Lindenmann, qui ont remarqué que des cellules de poulet infectées par le virus de la grippe produisaient un facteur permettant à d’autres cellules de devenir résistantes à ce virus [1]. Ce facteur fut nommé interféron, car il permet l’interférence virale, c’est-à-dire l’acquisition de la résistance à un virus par une cellule. Il a été mis en évidence par la suite que ce facteur était en réalité composé de différentes protéines de la même famille, dont on a découvert qu’elles jouent des rôles variés chez les vertébrés. Les IFN sont classés en 3 types : les types I et III sont impliqués dans l’immunité innée antivirale dans la plupart des cellules de l’organisme, tandis que le type II joue un rôle prépondérant de molécule de communication entre des cellules spécialisées du système immunitaire.
La diversité des interférons
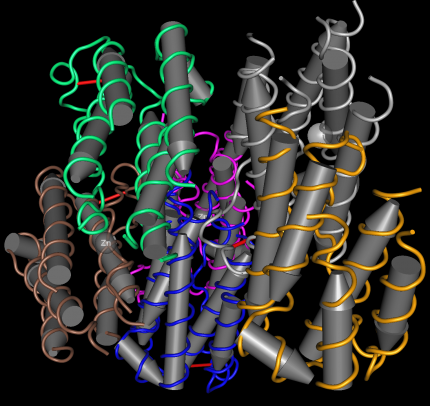
Cette représentation de la structure tridimensionnelle d'un interféron α met en évidence les nombreuses hélices alpha qui le composent (signalées par les cylindres gris), organisées en domaines indiqués chacun par une couleur.
Les interférons de type I sont eux-mêmes divisés en plusieurs sous-types : les IFN-α et β, les plus courants et les plus étudiés, mais aussi les IFN-ω [2], ε et κ [3], qui sont moins étudiés et dont l’action est limitée à certains organes, au contraire des IFN-α et β qui sont quasiment ubiquitaires dans l’organisme. Le type II comprend uniquement l’IFN-γ, qui joue un rôle très semblable aux autres cytokines, c’est-à-dire principalement une fonction de communication entre cellules du système immunitaire. Par conséquent, les propriétés de l’IFN-γ ne seront pas développées dans cet article. Le type III regroupe les IFN-λ, découverts récemment et dont les fonctions biologiques sont encore débattues [4]. Cependant, il semble que leurs fonctions soient très proches de celles des IFN de type I : les IFN-λ induisent un état non spécialisé de résistance antivirale et utilisent la même voie de transduction que les IFN de type I, à l’exception de leur récepteur.
L’être humain possède 21 gènes codant des interférons : 13 pour les IFN-α, 3 pour les IFN-λ, et un seul pour chacune des classes ß, ω, ε, κ et γ [5]. Le regroupement de plusieurs gènes dans un même sous-type est dû à la très forte homologie des leurs séquences : on dit que ces gènes constituent une famille multigénique.
La production des interférons
Chez les vertébrés, la quasi-totalité des cellules est capable de produire des interférons de type I. Ceux de type III sont produits et induisent un état de résistance antiviral dans de nombreux types cellulaires, mais semblent plutôt spécifiques des tissus fortement exposés aux infections virales, comme les muqueuses. Enfin, il est à noter que des cellules immunitaires spécialisées capables de produire des quantités phénoménales d’interférons en réponse à une infection virale ont été identifiées : les cellules dendritiques plasmacytoïdes ou pDC. Ces cellules sanguines produisent jusqu’à 10 000 fois plus d’IFN-α que les autres cellules et, à ce titre, sont qualifiées d’IPC (interferon producing cells).
La production d’interférons est activée par la perception de signaux indiquant une infection virale. Cette perception est assurée par les PRR (pattern recognition receptors), une vaste classe de protéines de l’hôte qui reconnaissent des PAMP (pathogen-associated molecular patterns) présentés par les pathogènes. Cette réponse immunitaire est innée, c’est-à-dire immédiatement mobilisable lors de la première rencontre avec un pathogène donné. Elle ne nécessite pas une longue période « d’éducation » du système immunitaire comme c’est le cas pour la réponse immunitaire dite adaptative qui est caractérisée par la production d’anticorps et de lymphocytes hautement spécifiques de l’agent pathogène.
Les PAMP peuvent être des acides nucléiques présents dans un compartiment cellulaire particulier : par exemple, la présence d’ARN double-brin ou d’ADN dans le cytosol indique à la cellule qu’elle est infectée, parce que, physiologiquement, les cellules des vertébrés ne produisent pas d’ARN double-brin libre, et confinent leur ADN dans leur noyau ou leurs mitochondries. Or de nombreux virus soit ont un génome d’ARN double brin ou d’ADN qui est libéré dans le cytosol lors d’une infection, soit produisent au cours de leur cycle réplicatif une telle molécule dans le cytosol. Leur génome est alors répliqué et exprimé directement dans le cytosol. Ces molécules stimulent la réponse immunitaire innée et en particulier la production d’interférons. Les PAMP regroupent encore d’autres molécules.
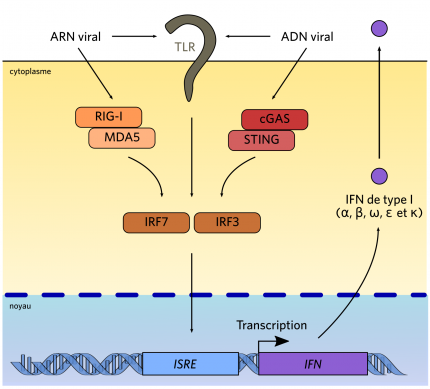
Les ADN et ARN viraux sont des PAMP qui peuvent activer plusieurs types de PRR : ici sont représentés TLR, RIG-1 (un RLR) et cGAS. Via des protéines adaptatrices, ces PRR activent IRF3 ou IRF7, qui induisent la production d’interférons, qui sont sécrétés dans le milieu extracellulaire (d’après Khiar et al., 2015).
Les PRR impliqués dans la réponse interféron appartiennent, pour la plupart, à deux familles protéiques : les TLR (Toll-like receptors ) et RLR (RIG-I-like receptors). Les TLR 3, 7, 8 et 9 sont impliqués dans la reconnaissance des acides nucléiques viraux présents dans le milieu extracellulaire ou dans les voies endosomales. TLR3 est un récepteur localisé à la membrane plasmique ou à la membrane des endosomes (des organites chargés du recyclage ou de la dégradation des produits d’endocytose ; ils constituent la zone d’entrée dans la cellule pour de nombreux virus), qui reconnaît les ARN double-brin situés dans les endosomes ou le milieu extracellulaire [6]. Quand il fixe son ligand, il active TRIF, une protéine adaptatrice, qui à son tour active IRF3. Cette protéine migre alors dans le noyau et induit l’expression des gènes codant les interférons. De même, les TLR 7 et 8 reconnaissent l’ARN simple-brin dans les endosomes et le milieu extracellulaire, et le TLR 9 est activé par l’ADN présent dans les endosomes.
De même, les voies de signalisation activées par de nombreux PRR convergent vers IRF3 ou IRF7, qui induisent la synthèse des interférons. Cette synthèse peut également être induite par l’intermédiaire de membres de la famille des RLR, notamment RIG-I et MDA5, en réponse à la présence d’ARN viraux dans le cytosol. Enfin, une famille hétérogène de récepteurs cytosoliques à l’ADN, comprenant notamment le couple cGAS/STING, a été caractérisée ces dernières années, et permet l’induction d’une réponse interféron dans les cellules infectées par un virus à ADN.
La voie de transduction des interférons
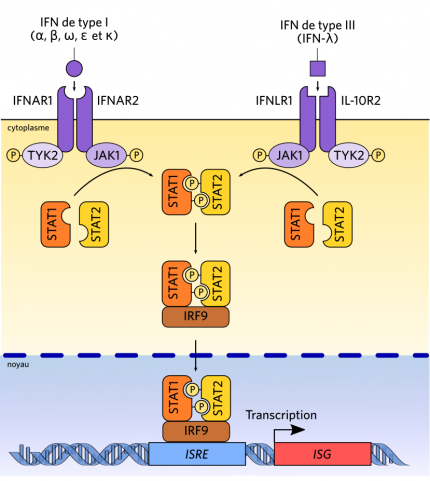
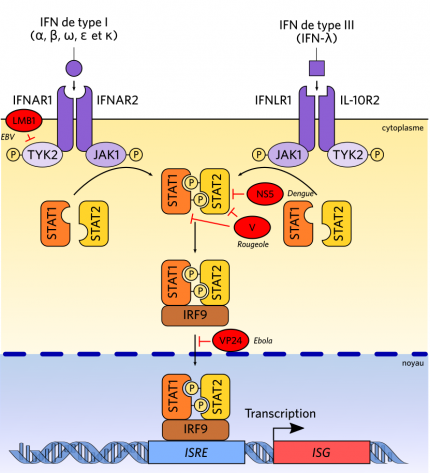
En tant que molécules de communication intercellulaire, les IFN sont des petites protéines qui sont sécrétées par les cellules productrices et diffusent dans le milieu extracellulaire. Elles se fixent à leurs récepteurs quand elles les rencontrent, ce qui induit une cascade de signalisation intracellulaire. Les interférons α et β disposent d’un récepteur commun, qui est à l’état activé un hétérodimère des sous-unités IFNAR1 et IFNAR2. Les interférons λ se fixent sur un récepteur qui leur est spécifique.
La fixation d’un IFN entraîne l’activation des JAK du récepteur, qui phosphorylent le récepteur et s’auto-phosphorylent. Ainsi activées, elles phosphorylent des protéines STAT, qui dimérisent, s’associent avec la protéine accessoire IRF9 (formant ainsi le complexe ISGF3) et relocalisent dans le noyau, où elles induisent l’expression des ISG (interferon-stimulated genes).
La fixation d’un IFN par un récepteur membranaire, alors à l’état monomérique entraîne sa dimérisation avec un autre monomère, ce qui entraîne un changement de leurs conformations respectives, et par conséquent l’activation d’une protéine qui est liée au récepteur, une kinase de la famille JAK. Sur l’un des monomères, il s’agit de JAK1, sur l’autre de TYK2. Ces deux protéines s’activent mutuellement quand les deux sous-unités du récepteur dimérisent. et phosphorylent alors des protéines STAT, qui sont des protéines cytosoliques libres. La phosphorylation des protéines STAT favorise leur dimérisation, qui provoque un changement de conformation révélant des séquences de localisation nucléaire. Le dimère STAT1/STAT2 peut alors se fixer sur la séquence consensus qu’il reconnaît, nommée ISRE (interferon-stimulated response element). On retrouve cette séquence dans les promoteurs de plusieurs gènes, qui sont activés par la fixation du dimère STAT. Cette voie de transduction est nommée voie JAK/STAT.
La réponse interféron
Les IFN de type I et III activent environ 300 à 400 gènes, nommés ISG (interferon-stimulated genes), qui assurent une réponse antivirale complète ciblant toutes les étapes des cycles réplicatifs des différents virus. Par exemple, Mx2 s’associe à la capside du VIH, et, par un mécanisme encore méconnu, empêcherait ainsi sa réplication ; les IFITM modifient vraisemblablement la structure des membranes et le pH des endosomes, inhibant la fusion des membranes virales avec les membranes cellulaires ; en plus de nombreux rôles dans la régulation de la réponse immunitaire, ISG15 se fixe sur certaines protéines virales et les inactive, et la tetherine inhibe la libération des particules virales du VIH en les séquestrant à la membrane des cellules infectées [7]. De plus, d’autres gènes activés par les IFN conduisent à une surexpression des PRR, renforçant la vigilance des cellules aux signaux de danger, ou bien répriment la traduction de nouvelles protéines, ce qui permet d’empêcher le virus de produire ses protéines et d’allouer l’essentiel des ressources cellulaires à la défense antivirale (les ARNm codés par les ISG échappant à la répression traductionnelle).
En outre, certains des ISG sont eux-mêmes des facteurs de transcription qui activent ou inhibent d’autres gènes, assurant une amplification du signal interféron. La réponse interféron est ainsi diversifiée dans ses cibles et a une amplitude considérable, puisque presque toute l’activité de la cellule est modifiée, et désormais consacrée en grande partie à sa défense.
Enfin, notons deux autres fonctions des interférons de type I et III : d’une part, la réponse interféron peut induire l’apoptose (mort cellulaire programmée) de la cellule cible ; d’autre part, ces interférons ont un rôle de modulateur de la réponse immunitaire adaptative. Ainsi, les IFN-α et β participent à la différenciation de certains lymphocytes T [8] et les IFN-λ interviennent dans la maturation de lymphocytes T et B [9].
Le contournement des interférons par certains virus
Les interférons étant des antiviraux puissants, les virus capables de contourner ce système ont été fortement sélectionnés au cours de l’évolution. Ainsi, les virus disposent de différents mécanismes leur permettant d’échapper aux interférons et ainsi de contourner les défenses de leur hôte.
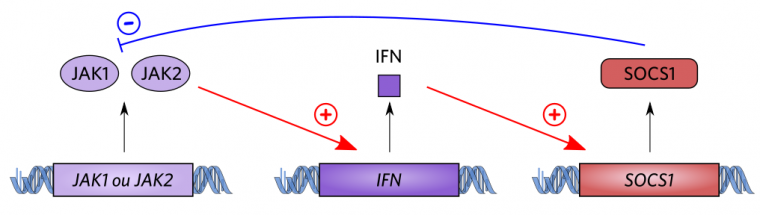
En temps normal, la synthèse des interférons est régulée grâce à des systèmes de rétrocontrôle. En effet, un maintien trop prolongé de la réponse interféron nuirait à l’organisme, car les cellules concernées cessent d’accomplir beaucoup de leurs fonctions quand elles sont en état de défense antivirale. De plus, une surproduction d’IFN conduit parfois à des maladies autoimmunes telles que le lupus érythémateux [10]. Il existe plusieurs voies de désensibilisation des cellules aux interférons, mais la principale est directement activée par les interférons eux-mêmes. Entre autres mécanismes, les IFN induisent la synthèse de protéines SOCS, qui se fixent sur les JAK et les récepteurs aux IFN, bloquant ainsi les phosphorylations nécessaires à la transduction du signal en aval des récepteurs d’interférons.
La production d’interférons entraîne la synthèse de la protéine SOCS1, qui inhibe les activateurs de la synthèse d’interférons : de ce fait, la synthèse d’interférons est limitée dans le temps.
De nombreux virus freinent la production d'interférons en agissant sur la voie de signalisation JAK/STAT. Par exemple, des protéines des virus de l’hépatite C (HCV) et de la dengue (DenV) inhibent une STAT qui est requise pour l’activation de la transcription des gènes stimulés par les interférons. Les cellules infectées ne peuvent donc pas entrer en état de résistance antivirale.
Cette voie physiologique de désensibilisation aux interférons est utilisée par certains virus. Par exemple, le virus de l’encéphalite japonaise (nommé JEV) réprime un miRNA cellulaire qui lui-même inhibe SOCS-5 : le virus active donc l’expression de cette protéine [11].
Les virus disposent d’une grande diversité de facteurs de virulence qui inhibent une ou plusieurs étapes de la réponse interféron qui les ciblent. Tous les stades de la réponse interféron, en amont comme en aval des IFN, sont ciblés par plusieurs virus.
Par exemple, le virus de la dengue induit des déformations de la membrane du réticulum endoplasmique qui empêchent les PRR de reconnaître l’ARN double-brin produits lors de sa réplication, ce qui lui permet de passer inaperçu [12] ; l’EBV cible en particulier TYK-2, une JAK nécessaire à la transduction du message interféron, dont il empêche l’activation.
L’utilisation clinique des interférons
La découverte de l’efficacité des interférons dans la lutte antivirale a permis d’envisager leur utilisation thérapeutique. Des molécules d’interférons recombinants sont produites par des bactéries, des levures ou des cellules humaines en culture dans lesquelles a été cloné l’un des gènes d’interféron humain : on parle d’IFN recombinants. Cette méthode permet d’obtenir de grandes quantités d’interférons purs.
Ces molécules sont utilisées principalement pour traiter les hépatites B et C car elles permettent d’induire un état de résistance antivirale, utilisées conjointement avec d’autres médicaments à action antivirale directe. Elles peuvent cependant être la source d’effets secondaires, comme des fièvres ou des migraines, mais elles restent bien tolérées par la plupart des patients.
Conclusion
Les interférons sont des molécules au fonctionnement très complexe, impliquées dans de nombreuses voies biologiques d’importance capitale : en effet, les souris dont tout ou partie des gènes codant les IFN ont été invalidés (souris KO) meurent de la moindre infection virale. Les interférons sont donc l’une des bases de notre immunité… et de l’évolution des virus qui la contournent.
Références
- Isaacs A., Lindenmann J.(1957) Virus interference. I. The interferon. Proc. R. Soc. London Ser. B 147:258–267.
- Liu, YJ (2005). IPC: professional type 1 interferon-producing cells and plasmacytoid dendritic cell precursors. Annu Rev Immunol. 23 : 275–306.
- CE Samuel. Antiviral Actions of Interferons. Clin. Microbial. Rev. October 2001 vol. 14 no. 4 778-809 1, doi: 10.1128/CMR.14.4.778-809.2001 .
- Vilcek J (January 2003). Novel interferons. Nat. Immunol. 4 (1): 8–9.
- http://www.imgt.org/IMGTrepertoireRPI/LocusGenes/overview_locusRepresentation/Interferons/Interferons.php
- Khiar S. et al. (2015). Stimuler la réponse interféron de type I avec des petites molécules : le renouveau d’une vieille idée. Biologie Aujourd’hui, 209 (2), 145-159
- Schneider M. et al. (2014). Interferon-Stimulated Genes: A Complex Web of Host Defenses. Annu Rev Immunol. 513–545
- Gonzalez-Navajas J et al . (2013). Immunomodulatory functions of type I interferons. Nat Rev Immunol. ; 12(2): 125–135
- Egli A et al. (2014). The impact of the interferon-lambda family on the innate and adaptive immune response to viral infections. 3 e51
- Rönnblom L. The type I interferon system in etiopathogenesis of autoimmune diseases. Upsala J.Med. Sci. 2011; 116:227–237
- Schultz K. et al. (2016). Viral evasion strategies in type I interferon signaling – a summary of recent developments. Front. Immunol. 7:498.
- Uchida L et al . The dengue virus conceals double-stranded RNA in the intracellular membrane to escape from an interferon response. Sci Rep. 2014; 4:7395