Le système nerveux central fut longtemps considéré comme un organe « d’immunité privilégiée ». Isolé des autres organes par la barrière hémato-encéphalique et les méninges, le dogme prévalent était que les cellules résidentes de ce système se chargeaient seules du maintien de son homéostasie et de son intégrité. Cependant, la redécouverte des systèmes immunitaires et lymphatiques méningés met en exergue l’ampleur et l’importance physiologique du dialogue entre systèmes nerveux et immunitaire.
Caractéristiques anatomiques et histologiques des méninges
Le système nerveux central est isolé du reste de l’organisme par trois barrières :
- La barrière hémato-encéphalique, au niveau des vaisseaux sanguins, limite l’infiltration de cellules et molécules sanguines périphériques vers le parenchyme nerveux ;
- Les plexus choroïdes, tapissant les ventricules cérébraux et producteurs de liquide céphalorachidien ;
- Les méninges, enveloppant le système nerveux central et permettant le drainage du liquide céphalorachidien.
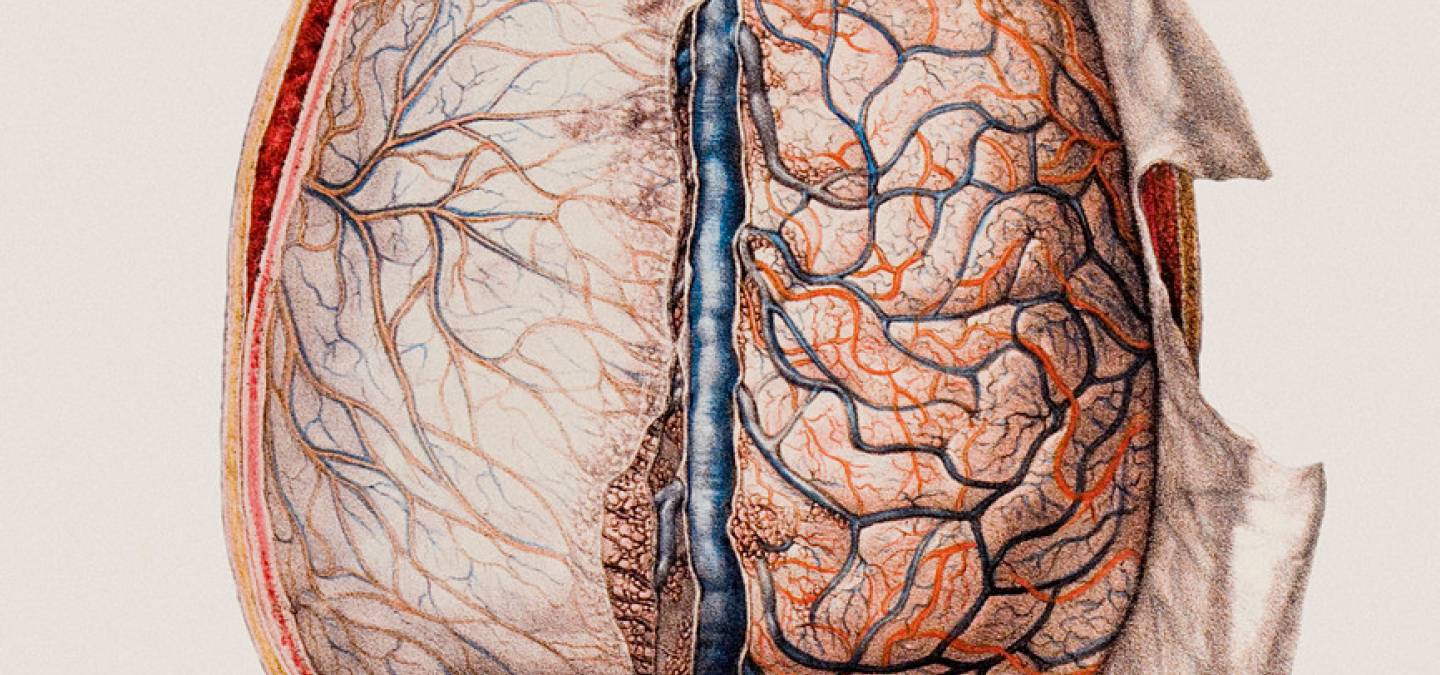
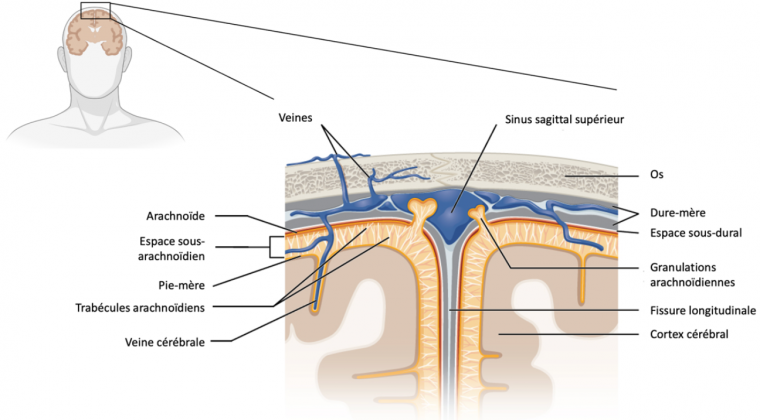
Les méninges sont composées de trois couches avec, de l'extérieur vers l'intérieur : la dure-mère, située sur la face interne du crâne et du canal vertébral, l’arachnoïde et la pie-mère, en contact avec le parenchyme nerveux [1]. La dure-mère est un tissu conjonctif riche en collagène, abondamment innervé, et contenant de nombreux vaisseaux sanguins et lymphatiques. Ces derniers se situent principalement dans des espaces au sein de la dure mère appelés sinus duraux. La redécouverte des vaisseaux lymphatiques de la dure-mère vers 2015 a permis d’envisager le potentiel de ces vaisseaux dans le drainage des antigènes du cerveau vers les organes lymphoïdes secondaires, permettant ainsi un dialogue entre le système nerveux central et le système immunitaire [2]. L’arachnoïde est composée de cellules reliées entre elles par des jonctions serrées, régulant le passage de cellules et de molécules venant de la dure-mère de manière similaire à la barrière hémato-encéphalique [3]. Elle est reliée à la pie-mère par des faisceaux de collagène dans l’espace sous-arachnoïdien, où circule le liquide céphalorachidien avant d’être drainé par la circulation sanguine [4]. Enfin, la pie-mère est une mince couche de tissu conjonctif recouvrant le parenchyme du cerveau et de la moelle épinière et qui est semi-perméable au liquide céphalorachidien. Elle est elle-même recouverte, à sa face interne, par des astrocytes (cellules de soutien du système nerveux central) formant la glia limitans [1].
Les méninges : une interface entre système nerveux central et système immunitaire en cas de dommages ou d’infections
Au-delà de leur rôle de barrière et de drainage, les méninges constituent une interface immunitaire importante. Dès 1948, Peter Medawar a démontré, par des expériences d’allogreffe de peau dans le cerveau de souris, la capacité des méninges à déclencher une réponse immunitaire adaptative. Lorsque le greffon se situait au sein du parenchyme cérébral, il provoquait un rejet retardé par rapport à des allogreffes dans des tissus périphériques (c’est-à-dire en dehors du système nerveux), à moins que les souris n’aient été préalablement exposées aux antigènes du greffon en périphérie. Ces expériences ont souligné que le drainage lymphatique du cerveau n’est pas toujours suffisant pour déclencher une première activation de la réponse immunitaire adaptative, en particulier lorsque le niveau d’antigènes est faible. Néanmoins, si le greffon était implanté près des méninges ou des plexus choroïdes, il engendrait un rejet dans les mêmes délais qu’une allogreffe en périphérie. Ces résultats permirent de démontrer le rôle des méninges comme lieu de communication privilégié avec le système immunitaire adaptatif [5,6].
La littérature scientifique récente confirme ces résultats précurseurs, en montrant que de nombreuses cellules immunitaires d’origine périphérique résident dans la dure-mère et l’espace sous-arachnoïdien : cellules dendritiques, lymphocytes B, lymphocytes T, macrophages, mastocytes, etc. [7]. Elles occupent un rôle clé tant en agissant sur l’homéostasie du système nerveux central (mise en place et maintien des fonctions neuronales, régulation des phénotypes des cellules gliales…) qu’en défendant le système nerveux central face à une lésion [8].
Le dialogue entre les systèmes nerveux et immunitaire implique plusieurs voies. Suite à des dommages ou à une infection dans le système nerveux central, une première voie d’activation de l’immunité adaptative passe par le drainage lymphatique méningé. Outre leur accumulation dans la dure-mère, les antigènes du système nerveux central sont drainés par les vaisseaux lymphatiques (sous forme soluble, ou transportés par les cellules dendritiques qui migrent) vers les ganglions lymphatiques cervicaux où ils vont activer les lymphocytes T spécifiquement dirigés contre eux. Ce phénomène induit l’amplification de cellules T spécifiques du pathogène ou de la tumeur, et est suivi par la migration et l’infiltration des lymphocytes vers les méninges et/ou le parenchyme nerveux, grâce à l’expression de récepteurs aux chimiokines (molécules de migration) et de métalloprotéases (diminuant l’intégrité des barrières) [9]. Ainsi, les méninges permettent d’organiser une réponse immunitaire pour le système nerveux central de manière similaire à celle pour les organes périphériques.
Après migration vers les méninges, les cellules T peuvent subir, au niveau de la dure-mère, une réactivation qui renforce leurs capacités inflammatoires. En effet, une étude récente a démontré que les antigènes du système nerveux central1 sont drainés vers les sinus duraux où ils sont capturés par des cellules présentatrices d’antigènes. Ces dernières présentent ensuite les antigènes aux lymphocytes T patrouillant dans les méninges ce qui active ou réactive une réponse immunitaire chez ceux-ci. L’imagerie deux photons in vivo montre que les lymphocytes T circulants ralentissent, voire s’arrêtent, au niveau de la dure-mère, ce qui permet leur interaction avec les cellules présentatrices d’antigène, par exemple dans le cas de l’encéphalite auto-immune. S’ils sont réactivés, ces lymphocytes sécrètent des cytokines altérant de manière significative l’homéostasie cérébrale, en modifiant les phénotypes des cellules gliales vers des profils pro-inflammatoires. Ainsi, cette activation locale dresse un axe de communication entre le système nerveux central et le système immunitaire [9].
Interactions neuro-immunes méningées dans l’homéostasie du système nerveux central
Le rôle de l’immunité adaptative dans la régulation du système nerveux central, en particulier de l’immunité lymphocytaire T, était déjà connu avant la redécouverte du système lymphatique méningé. En effet, les souris dépourvues de lymphocytes T montrent des dysfonctions cognitives, affirmant le rôle fondamental du système immunitaire pour la mise en place des fonctions neuronales [10]. La mise en lumière plus récente de l’interface méningée soulève la question du rôle des cellules immunitaires méningées dans cette régulation des circuits neuronaux.
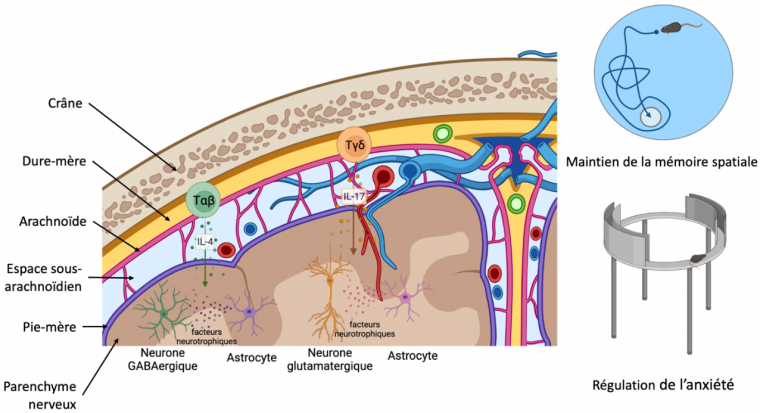
Durant les vingt dernières années, de nombreuses données ont mis en évidence le rôle crucial de la sécrétion de cytokines par les cellules immunitaires méningées pour le bon fonctionnement du système nerveux central. Cet effet implique notamment des récepteurs spécifiques à ces molécules, présents sur les cellules du système nerveux central et les y rendant sensibles. Ainsi, des études ont montré que dans la dure-mère résident une grande variété de sous-populations de lymphocytes T capables de réguler l’apprentissage, la mémoire à court terme, l’anxiété et la neurogenèse adulte au niveau de l’hippocampe [11]. Ces lymphocytes T peuvent être divisés en deux grandes catégories :
- Les lymphocytes Tαβ, dits conventionnels, et qui sont les plus impliqués dans les réponses immunitaires ;
- Les lymphocytes Tγδ, dits non conventionnels et qui sont davantage présents dans les tissus que dans la circulation.
Il a été démontré que par leur sécrétion d’IL-4, les lymphocytes Tαβ peuvent agir sur la mise en place des fonctions cognitives et de l’apprentissage en modulant directement ou indirectement les neurones. Premièrement, les neurones GABAergiques inhibiteurs sont sensibles à cette interleukine via leur récepteur IL-4R. Des études comportementales chez des modèles murins immunodéficients ou dépourvus de ce récepteur montrent que la sécrétion d’IL-4 par les lymphocytes T méningés et son interaction avec les neurones GABAergiques est nécessaire à la construction de la mémoire contextuelle [12]. De surcroît, l’IL-4 est aussi importante pour la mémorisation spatiale : en effet l’IL-4 dérivée des lymphocytes T a une action indirecte sur les neurones en promouvant la sécrétion de facteurs neurotrophiques par les astrocytes et les microglies [11,13].
Les lymphocytes Tγδ sécréteurs d’IL-17 jouent également un rôle essentiel dans la mémoire et l’anxiété. Leurs sécrétions vont agir sur les récepteurs à l’IL-17 présents sur les neurones corticaux glutamatergiques ainsi que sur les astrocytes en induisant une expression augmentée de facteur neurotrophique dérivé du cerveau (BDNF). Par ces deux voies, l’IL-17 augmente la plasticité synaptique, ce qui a pour effets de maintenir la mémoire à court terme et de réduire l’anxiété [14,15].
Une étude de 2016 montre également que l’interféron γ (IFNγ) sécrété par les lymphocytes T méningés joue un impact sur la sociabilité chez des modèles murins. En effet, cette cytokine, impliquée également dans les réponses immunitaires adaptatives, agit directement sur les neurones GABAergiques inhibiteurs ce qui induit des comportements sociaux. Outre les modèles murins, des méta-analyses montrent que, chez plusieurs espèces, il y a une élévation des voies de signalisation de l’interféron γ associée au comportement social. Cette étude suggère donc un lien co-évolutif entre les réponses aux pathogènes et la sociabilité [16].
L’action des populations immunitaires méningées ne se limite pas à celle des lymphocytes T. Les macrophages résidents jouent également un rôle clé dans l’élimination des déchets issus du système nerveux central (déchets métaboliques, agrégats pathologiques, cellules apoptotiques, cellules infectées…) ainsi que dans la régulation de la barrière hémato-encéphalique. Ils sont également sensibles aux signaux émis par les lymphocytes T qui, en condition physiologique, les orientent vers un phénotype anti-inflammatoire permettant de bonnes performances cognitives [17].
Illustration de la sécrétion de cytokines par les lymphocytes T conventionnels (Tαβ) et non conventionnels (Tγδ) depuis la dure-mère. Ces cytokines vont induire la sécrétion de facteurs neurotrophiques par les astrocytes. Ce soutien neuronal permet de maintenir la mémoire spatiale et de réguler l’anxiété dans des modèles murins. Schéma réalisé avec BioRender.
Interactions neuro-immunes méningées en pathologie
L’interface neuro-immune méningée est capable, en dehors de son rôle dans l’homéostasie du système nerveux central, de soutenir une réponse face à des lésions nerveuses.
Réponses aux lésions aiguës
Les méninges constituent potentiellement l’un des premiers points d’entrées des pathogènes neurotropiques tels que le virus de l’immunodéficience humaine (VIH), ainsi que les bactéries Neisseria meningitidis (méningocoque), Haemophilus influenzae et Streptococcus pneumoniae (pneumocoque). Le compartiment méningé représente donc une première barrière contre l’entrée de ces pathogènes dans le système nerveux central, notamment via le recrutement et l’activation de cellules immunitaires [1]. Ce rôle peut être observé chez des souris infectées par le parasite Toxoplasma gondii : l’inflammation provoquée par le parasite remodèle l’architecture des trabécules sous-arachnoïdiens afin de dresser des chemins de migration pour les lymphocytes T CD8+. Le recrutement de ces derniers sur le site de l’infection est donc facilité et engendre la mise en place d’une niche immunitaire efficace pour détruire le pathogène [18].
L’inflammation méningée peut également être provoquée par des lésions stériles telles que les traumatismes crâniens. Ces derniers sont associés à une infiltration immunitaire et à des morts cellulaires pouvant endommager le parenchyme nerveux sous-jacent. Suite à la lésion, les mastocytes duraux sont activés et libèrent des molécules pro-inflammatoires telles que l’histamine [19]. Les macrophages méningés, sensibles à la pression mécanique et aux espèces réactives de l’oxygène, meurent immédiatement et libèrent des signaux de danger qui déclenchent le recrutement de cellules immunitaires périphériques, notamment des neutrophiles. Cette étape est essentielle pour minimiser les dégâts et la mort cellulaire dans le parenchyme nerveux à proximité du traumatisme [20,21].
Enfin, les méninges peuvent également répondre à des lésions ayant lieu au sein du parenchyme cérébral. Lors d’accidents vasculaires cérébraux (AVC) ischémiques, la réponse méningée joue un rôle clé dans l’ampleur et la vitesse de développement de la pathologie. Bien qu’il y ait un recrutement immunitaire au niveau de la lésion parenchymateuse, celui-ci est précédé par la réponse méningée : les mastocytes duraux sont activés par les signaux d’alarme des cellules endommagées et attirent des monocytes et neutrophiles vers le site d’ischémie. L’induction d’un AVC ischémique chez des souris dépourvues de mastocytes duraux est de meilleur pronostic que chez des souris témoins, suggérant que l’inflammation méningée amplifie les dommages parenchymateux dans la pathologie [22]. De manière similaire, des études suggèrent que le recrutement des neutrophiles par les lymphocytes Tγδ sécréteurs d’IL-17 a un effet néfaste sur la pathologie, renforçant le rôle délétère de l’inflammation méningée dans les AVC [1].
Le méningocoque Neisseria meningitidis
La bactérie Neisseria meningitidis (appelée méningocoque) est une des principales causes de méningite infectieuse en France, constituant 90 % des cas de méningite bactérienne entre 15 et 24 ans. Cette bactérie provoque une inflammation des méninges pouvant s’étendre à l’encéphale, laissant des séquelles neurologiques à long terme. La méningite est donc une urgence thérapeutique, notamment pour les jeunes enfants. En fonction de la composition de la capsule bactérienne, douze sérogroupes de Neisseria meningitidis sont actuellement distingués : A, B, C, W, X, Y… En France, la vaccination contre le méningocoque C est obligatoire chez les nourrissons depuis 2018. La vaccination contre le méningocoque B est quant à elle disponible depuis 2014.
Réponses aux lésions chroniques
L’interface neuro-immune joue un rôle central dans les maladies neurodégénératives, bien que moins clairement défini que dans les lésions aiguës. Une des premières pathologies dans laquelle l’immunité méningée a été mise en évidence est la sclérose en plaques. Cette maladie auto-immune est caractérisée par la démyélinisation des neurones sous l’attaque de lymphocytes B et T autoréactifs. La myéline permettant aux neurones de mieux conduire les potentiels d’action, sa destruction résulte en des défauts moteurs et cognitifs et éventuellement en une dégénérescence des neurones. Alors que la sclérose en plaques est associée à une invasion des lymphocytes directement dans le parenchyme cérébral, des études cliniques ont démontré que l’inflammation méningée à proximité des plaques est liée à une exacerbation de l’inflammation gliale et de l’infiltration immunitaire [23]. De surcroît, le drainage des antigènes par les vaisseaux lymphatiques méningés réactive les lymphocytes T et B spécifiques des antigènes de myéline au niveau des ganglions cervicaux et les recrutent vers les méninges [11]. Ces dernières se présentent donc comme une porte d’entrée et un support dans le développement de la pathologie.
Ce rôle est également retrouvé dans d’autres pathologies telles que la maladie d’Alzheimer et la maladie de Parkinson, pour lesquelles le lien avec l’immunité adaptative est connu mais moins clair que dans la sclérose en plaques. Ces deux maladies sont liées à des agrégats de protéines pathologiques menant à la destruction des neurones. Contrairement à la sclérose en plaques, le drainage lymphatique permet d’évacuer ces dépôts pathologiques. Lors du vieillissement cérébral et de certaines pathologies, le drainage lymphatique perd en efficacité ce qui provoque une accumulation plus importante des agrégats [24], exacerbe l’activation des lymphocytes T méningés et accroît les déficits moteurs et cognitifs [25,26]. Au-delà du drainage, les cellules résidentes des méninges jouent un rôle local par la sécrétion de cytokines pro-inflammatoires telles que l’IFNγ et le TNFα. Ces dernières vont orienter les cellules gliales vers un phénotype réactif pouvant avoir des effets neurotoxiques [11].
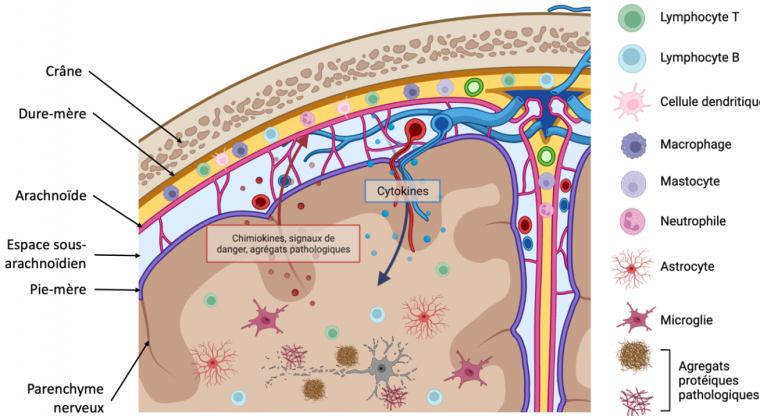
En situation pathologique, les cellules du cerveau émettent des signaux de danger et des chimiokines, ce qui active et recrute les cellules immunitaires méningées. Ces dernières sécrètent en retour des cytokines, voire infiltrent le parenchyme cérébral. Schéma réalisé avec Biorender.
Perspectives et conclusion
Les méninges occupent un rôle central en tant que barrière contre les agents pathogènes, mais également en tant que lieu de dialogue entre le système nerveux central et le système immunitaire. Elles sont nécessaires au maintien de fonctions cognitives normales et à l’homéostasie du parenchyme nerveux. Néanmoins, l’hyperactivation de ce système immunitaire méningé peut exacerber le développement de pathologies neurodégénératives. Depuis la redécouverte et la caractérisation de cette interface, elle s’est imposée comme une cible thérapeutique prometteuse pour le traitement de pathologies du système nerveux central [11], avec notamment le développement de molécules augmentant le drainage lymphatique pour le traitement de la maladie d’Alzheimer [24]. Les méninges représentent ainsi un enjeu majeur dans la recherche biomédicale et translationnelle.
Références
[1] R. Rua and D. B. McGavern, “Advances in Meningeal Immunity,” Trends Mol. Med., vol. 24, no. 6, pp. 542–559, Jun. 2018, doi: 10.1016/j.molmed.2018.04.003.
[2] A. Louveau et al., “Structural and functional features of central nervous system lymphatic vessels,” Nature, vol. 523, no. 7560, pp. 337–341, Jul. 2015, doi: 10.1038/nature14432.
[3] B. J. Balin, R. D. Broadwell, M. Salcman, and M. El-Kalliny, “Avenues for entry of peripherally administered protein to the central nervous system in mouse, rat, and squirrel monkey,” J. Comp. Neurol., vol. 251, no. 2, pp. 260–280, 1986, doi: 10.1002/cne.902510209.
[4] R. Spector, S. Robert Snodgrass, and C. E. Johanson, “A balanced view of the cerebrospinal fluid composition and functions: Focus on adult humans,” Exp. Neurol., vol. 273, pp. 57–68, Nov. 2015, doi: 10.1016/j.expneurol.2015.07.027.
[5] P. B. Medawar, “Immunity to homologous grafted skin; the fate of skin homografts transplanted to the brain, to subcutaneous tissue and to the anterior chamber of the eye,” Br. J. Exp. Pathol., vol. 29, no. 1, pp. 58–69, 1948.
[6] A. Louveau, B. A. Plog, S. Antila, K. Alitalo, M. Nedergaard, and J. Kipnis, “Understanding the functions and relationships of the glymphatic system and meningeal lymphatics,” J. Clin. Invest., vol. 127, no. 9, pp. 3210–3219, Sep. 2017, doi: 10.1172/JCI90603.
[7] B. Korin et al., “High-dimensional, single-cell characterization of the brain’s immune compartment,” Nat. Neurosci., vol. 20, no. 9, Art. no. 9, Sep. 2017, doi: 10.1038/nn.4610.
[8] J. Kipnis, “Multifaceted interactions between adaptive immunity and the central nervous system,” Science, vol. 353, no. 6301, pp. 766–771, Aug. 2016, doi: 10.1126/science.aag2638.
[9] J. Rustenhoven et al., “Functional characterization of the dural sinuses as a neuroimmune interface,” Cell, vol. 184, no. 4, pp. 1000-1016.e27, Feb. 2021, doi: 10.1016/j.cell.2020.12.040.
[10] J. Kipnis, H. Cohen, M. Cardon, Y. Ziv, and M. Schwartz, “T cell deficiency leads to cognitive dysfunction: Implications for therapeutic vaccination for schizophrenia and other psychiatric conditions,” Proc. Natl. Acad. Sci., vol. 101, no. 21, pp. 8180–8185, May 2004, doi: 10.1073/pnas.0402268101.
[11] T. Ma, F. Wang, S. Xu, and J. H. Huang, “Meningeal immunity: Structure, function and a potential therapeutic target of neurodegenerative diseases,” Brain. Behav. Immun., vol. 93, pp. 264–276, Mar. 2021, doi: 10.1016/j.bbi.2021.01.028.
[12] J. Herz et al., “GABAergic neuronal IL-4R mediates T cell effect on memory,” Neuron, vol. 109, no. 22, pp. 3609-3618.e9, Nov. 2021, doi: 10.1016/j.neuron.2021.10.022.
[13] A. M. Fenn, J. C. E. Hall, J. C. Gensel, P. G. Popovich, and J. P. Godbout, “IL-4 Signaling Drives a Unique Arginase+/IL-1 + Microglia Phenotype and Recruits Macrophages to the Inflammatory CNS: Consequences of Age-Related Deficits in IL-4R after Traumatic Spinal Cord Injury,” J. Neurosci., vol. 34, no. 26, pp. 8904–8917, Jun. 2014, doi: 10.1523/JNEUROSCI.1146-14.2014.
[14] M. Ribeiro et al., “Meningeal γδ T cell–derived IL-17 controls synaptic plasticity and short-term memory,” Sci. Immunol., vol. 4, no. 40, p. eaay5199, Oct. 2019, doi: 10.1126/sciimmunol.aay5199.
[15] K. Alves de Lima et al., “Meningeal γδ T cells regulate anxiety-like behavior via IL-17a signaling in neurons,” Nat. Immunol., vol. 21, no. 11, pp. 1421–1429, Nov. 2020, doi: 10.1038/s41590-020-0776-4.
[16] A. J. Filiano et al., “Unexpected role of interferon-γ in regulating neuronal connectivity and social behavior,” Nature, vol. 535, no. 7612, pp. 425–429, Jul. 2016, doi: 10.1038/nature18626.
[17] N. C. Derecki, K. M. Quinnies, and J. Kipnis, “Alternatively activated myeloid (M2) cells enhance cognitive function in immune compromised mice,” Brain. Behav. Immun., vol. 25, no. 3, pp. 379–385, Mar. 2011, doi: 10.1016/j.bbi.2010.11.009.
[18] E. H. Wilson et al., “Behavior of Parasite-Specific Effector CD8+ T Cells in the Brain and Visualization of a Kinesis-Associated System of Reticular Fibers,” Immunity, vol. 30, no. 2, pp. 300–311, Feb. 2009, doi: 10.1016/j.immuni.2008.12.013.
[19] R. Moretti et al., “Contribution of mast cells to injury mechanisms in a mouse model of pediatric traumatic brain injury,” J. Neurosci. Res., vol. 94, no. 12, pp. 1546–1560, 2016, doi: 10.1002/jnr.23911.
[20] T. L. Roth, D. Nayak, T. Atanasijevic, A. P. Koretsky, L. L. Latour, and D. B. McGavern, “Transcranial amelioration of inflammation and cell death after brain injury,” Nature, vol. 505, no. 7482, Art. no. 7482, Jan. 2014, doi: 10.1038/nature12808.
[21] M. V. Russo, L. L. Latour, and D. B. McGavern, “Distinct myeloid cell subsets promote meningeal remodeling and vascular repair after mild traumatic brain injury,” Nat. Immunol., vol. 19, no. 5, pp. 442–452, May 2018, doi: 10.1038/s41590-018-0086-2.
[22] A. Arac et al., “Evidence that Meningeal Mast Cells Can Worsen Stroke Pathology in Mice,” Am. J. Pathol., vol. 184, no. 9, pp. 2493–2504, Sep. 2014, doi: 10.1016/j.ajpath.2014.06.003.
[23] O. W. Howell et al., “Meningeal inflammation is widespread and linked to cortical pathology in multiple sclerosis,” Brain, vol. 134, no. 9, pp. 2755–2771, Sep. 2011, doi: 10.1093/brain/awr182.
[24] S. Da Mesquita, Z. Fu, and J. Kipnis, “The Meningeal Lymphatic System: A New Player in Neurophysiology,” Neuron, vol. 100, no. 2, pp. 375–388, Oct. 2018, doi: 10.1016/j.neuron.2018.09.022.
[25] Q. Ma, B. V. Ineichen, M. Detmar, and S. T. Proulx, “Outflow of cerebrospinal fluid is predominantly through lymphatic vessels and is reduced in aged mice,” Nat. Commun., vol. 8, no. 1, p. 1434, Dec. 2017, doi: 10.1038/s41467-017-01484-6.
[26] W. Zou et al., “Blocking meningeal lymphatic drainage aggravates Parkinson’s disease-like pathology in mice overexpressing mutated α-synuclein,” Transl. Neurodegener., vol. 8, no. 1, p. 7, Mar. 2019, doi: 10.1186/s40035-019-0147-y.