Les papillomavirus humains sont responsables de plusieurs centaines de milliers de décès chaque année. Or des vaccins très prometteurs existent et pourraient, si la couverture vaccinale était suffisante, diminuer drastiquement le nombre de cancers causés par ces virus.
Introduction : cancers et maladies infectieuses
Plus d’un cancer sur six dans le monde est d’origine infectieuse et au total, chaque année, 2,2 millions de nouveaux cas de cancers découleraient d’une infection. On estime qu’environ 30 % des cancers sont d’origine infectieuse dans les pays en développement contre moins de 10 % dans les pays occidentaux (1).
Parmi les agents cancérigènes classés comme certains par le Centre international de recherche sur le cancer, deux types d’infections sexuellement transmissibles, celle par le virus de l’hépatite B et celles par les papillomavirus humains (PVH) sont évitables par la vaccination. Le vaccin contre l’hépatite B a été mis au point à Tours en 1976 par le virologue français Philippe Maupas et celui contre les PVH par les Australiens Jian Zhou et Ian Frazerdans les années 90 (2).
L’Organisation mondiale de la santé (OMS) estime que sur les 18 millions de nouveaux cas de cancers estimés dans le monde en 2018, 700 000 (environ 4 %) sont attribuables aux papillomavirus humains et que ceux-ci sont responsables de plus de 300 000 décès sur les 9,6 millions dus aux cancers. Ces virus sont responsables de plus de 7 % des cancers chez les femmes et jusqu’à 15 % des cancers chez celles des pays en développement. Plus de la moitié des cas de cancer du col de l’utérus (CCU) survient dans les pays à revenu faible ou intermédiaire où l’accès au vaccin PVH est très limité (3,4).
Comment a-t-on montré que les papillomavirus humains étaient la cause nécessaire du cancer du col de l’utérus ?
Le cancer du col de l’utérus (CCU) a été identifié comme une maladie à part entière autour des années 1900. Dans les années 40, il a été montré qu’il était possible de faire le diagnostic des lésions précancéreuses (néoplasies intraépithéliales cervicales, CIN en anglais) et cancéreuses par la détection à l’examen au microscope optique d’anomalies morphologiques de cellules prélevées sur le col de l’utérus (technique du frottis cervico-utérin). À partir des années 60, le dépistage organisé par frottis et le traitement chirurgical des lésions précancéreuses a permis de diviser d’un facteur 2 à 4 le nombre de cas de cancers du col de l’utérus dans les pays industrialisés, pour atteindre une incidence qui reste stable depuis une vingtaine d’années (5).
Aujourd’hui, il est établi que l’infection par certains types de papillomavirus humains, dits PVH à haut risque (PVH HR), précède les lésions précancéreuses et qu’elle est la cause nécessaire du cancer du col de l’utérus ainsi que celle de nombreux autres cancers (vulve, pénis, anus…), sur la base d’arguments épidémiologiques, biologiques et vaccinaux.
Les arguments épidémiologiques
L’association entre papillomavirus humains et cancer du col de l’utérus est très forte, cohérente, spécifique et universelle. Les études épidémiologiques initiales, essentiellement des études cas-témoins, ont montré que ces virus étaient entre 100 et 500 fois plus fréquents dans les cellules cervicales du col de l’utérus des femmes souffrant d’un cancer que dans celles des femmes en bonne santé. À titre de comparaison, le risque de développer un cancer du poumon chez un fumeur est « seulement » 10 fois plus élevé que chez un non-fumeur (6).
Les arguments biologiques
La découverte du lien de causalité entre l’infection par les papillomavirus humains et le cancer du col de l’utérus a été réalisée en 1983 lorsque Harald zur Hausen et ses collègues ont cloné le génome du PVH 16 à partir de cellules cancéreuses et mis en évidence sa présence dans environ 50 % des cas de cancers du col de l’utérus. Avec les techniques actuelles, au moins un PVH HR est détecté dans 99 % de ces cancers.
Des études en laboratoire menées dans les années 1980 ont abouti à la caractérisation des propriétés carcinogènes des PVH HR, notamment celles d’immortalisation et de transformation des cellules infectées par les protéines virales E6 et E7 (7,8).
La prévention par la vaccination
Bien que la corrélation entre cancer du col de l’utérus et infection par des PVH HR soit extrêmement forte, elle n’implique pas nécessairement que toutes les tumeurs soient causées par ces infections. La vaccination, en neutralisant spécifiquement le facteur clé et en réduisant l’incidence du cancer du col de l’utérus et/ou la mortalité associée permettra d’apporter la preuve directe et définitive de la relation de cause à effet entre l’infection à papillomavirus humains et cancer du col de l’utérus.
Que sont les papillomavirus humains ?
Les papillomavirus humains sont des virus non enveloppés constitués d’une capside icosaédrique de 45 à 55 nm de diamètre formée de 72 capsomères et d’un génome d’ADN bicaténaire circulaire dont un seul brin est codant.
À partir de la séquence génomique de L1, gène codant la principale protéine de la capside, plus de 200 types de PVH ont été identifiés et caractérisés chez l’Homme (9).
Les PVH peuvent être catégorisés de nombreuses manières, notamment selon leur spécificité tissulaire (types cutanés ou muqueux) et selon leur capacité à induire un cancer (types à haut risque ou à faible risque). Le Centre international de recherche sur le cancer a défini 12 types de PVH HR associés à des cancers chez l’être humain (types 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58 et 59). Les autres types ne sont pas carcinogènes, mais certains sont pathogènes (par exemple, le PVH 1 est responsable des verrues vulgaires et les PVH 6 et 11 des verrues génitales).
Quelles sont les maladies associées à l’infection par les papillomavirus humains ?
Si le cancer du col de l’utérus est le deuxième cancer le plus fréquent chez les femmes à l’échelle mondiale, l’infection par les papillomavirus humains est également responsable de nombreux cancers et autres maladies, dans les deux sexes.
L’infection par les PVH
La prévalence mondiale moyenne des PVH (le nombre de porteurs d’un PVH à tout instant) est d’environ 10 % des adultes indemnes de toutes lésions.
Seul un très faible nombre d’individus développe un cancer suite à une infection par un PVH HR indiquant qu’il existe d’autres facteurs de risque qui se surajoutent à l’infection virale. Mais comme l’infection est très fréquente, le nombre annuel de nouveaux cas est très élevé (environ 700 000 cas de cancers en 2018 dans le monde) (9).
Les maladies associées aux PVH
L’infection génitale par un PVH peut être asymptomatique ou produire des lésions bénignes telles que des verrues génitales externes ou anales (condylomes) et des lésions précancéreuses à faible potentiel carcinogène (dites lésions de bas grade ou CIN 1) du col de l’utérus, de l’anus, de la vulve, du vagin ou du pénis.
La plupart de ces infections sont spontanément résolutives, les lésions cervicales de bas grade et l’infection disparaissant au bout de 6 à 12 mois.
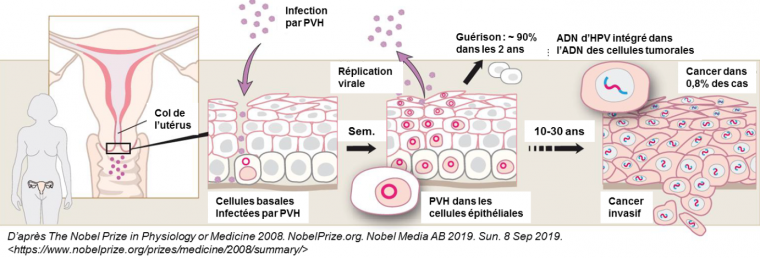
Cependant, chez certains individus, l’infection persiste. Si elle est causée par un PVH HR, une infection persistante peut conduire à une lésion précancéreuse de haut grade (CIN 2 ou CIN 3) pouvant éventuellement évoluer vers un cancer invasif. Le délai entre l’acquisition de l’infection à PVH et la transformation en cancer est de 20 ans ou plus (7) (Figure 1).
Après contage (contamination), le virus gagne les cellules basales de l’épithélium de la muqueuse cervico-utérine à la faveur de micro-abrasions. Le processus de production virale, qui s’effectue à la faveur de celui du renouvellement cellulaire de l’épithélium, s’arrête spontanément dans plus de 90 % des cas dans les deux ans qui suivent l’infection. Cependant, en cas d’infection par un PVH à haut risque, il peut y avoir une progression vers un cancer du col de l’utérus dix à trente ans après l’infection initiale.
Le cancer du col de l’utérus
L’OMS estime à 630 000 le nombre de cas annuels de cancers liés aux PVH survenant chez les femmes, dont 530 000 (84 %) sont des cas de cancers du col de l’utérus. Le nombre de décès associés est estimé à 266 000 à l’échelle mondiale, soit 8 % des décès féminins dus à un cancer (données 2012).
La grande majorité (>85 %) des cas de cancers du col de l’utérus (445 000 par an) surviennent dans les régions du monde les moins développées, où ils représentent près de 12 % des cancers féminins. Par comparaison, dans les régions plus développées, le cancer du col de l’utérus représente moins de 1 % de tous les cas de cancers chez la femme (83 000 cas par an). Le taux de mortalité varie de façon importante d’un pays à l’autre : il est inférieur à 2 décès pour 100 000 femmes dans les pays industrialisés, mais de 28 pour 100 000 dans certains pays en développement.
Les autres cancers associés aux PVH chez l’homme et la femme
Les infections à PVH de la zone anogénitale peuvent entraîner des cancers ou des tumeurs bénignes de la peau et des muqueuses.
L’infection par un PVH HR est aussi à l’origine de 25 % des 44 000 cas des cancers de la vulve, de 75 % des 18 000 cas des cancers du vagin, de 90 % des 50 000 cas de cancers anaux (la moitié survenant chez les femmes), de la moitié des 34 000 cas des cancers du pénis et du tiers des 90 000 cancers de l’oropharynx.
Les maladies non cancéreuses associées au PVH
L’infection par des PVH à faible risque provoque des condylomes anogénitaux (condylomes acuminés ou verrues génitales) chez les hommes et les femmes. Plus de 90 % de ces cas sont associés aux types 6 et 11. L’intervalle de temps médian entre l’infection et l’apparition de condylomes est de 11 à 12 mois chez les hommes et de 5 à 6 mois chez les jeunes femmes. Les condylomes sont difficiles à traiter et peuvent, dans de rares cas, évoluer vers une forme maligne. Enfin, des transmissions (mère-enfant) des PVH 6, 11 et 32 sont responsables des rares, mais très difficiles à traiter, papillomatoses laryngées (9).
En France, environ 2 800 nouveaux cas de cancers du col de l’utérus, responsables de 1 100 décès, sont diagnostiqués chaque année. Le nombre de cas annuel de cancers de l’anus, estimé à partir des données de registres, est d’environ 1 100 cas (800 cas pour les femmes et 300 cas pour les hommes) (10).
Le nombre estimé de nouveaux cas de verrues génitales chez les individus âgés de 20 à 30 ans est de l’ordre de 43 000 par an, avec une prévalence maximale entre 20 à 25 ans et une baisse assez nette après 30 ans (11).
Comment se fait l’infection par les PVH ?
Les PVH sont des virus résistants qui persistent plusieurs heures sur des surfaces. Ils peuvent donc être transmis sur un mode direct (contact avec une personne infectée), mais aussi indirect (contact avec des objets souillés). Les PVH à tropisme muqueux sont le plus souvent transmis lors de relations sexuelles, sans qu’il y ait forcément pénétration : il a été estimé que 70 % à 80 % des adultes sexuellement actifs sont infectés au cours de leur vie, le plus souvent très tôt, dès les premiers rapports. Le comportement sexuel des individus et de leur(s) partenaire(s) constitue un facteur de risque d’acquisition des PVH génitaux. La contagiosité serait de 70 % après un rapport avec un partenaire porteur d’un PVH et il n’est pas exceptionnel d’être infecté par plusieurs génotypes. Les préservatifs ont une efficacité limitée (70 %) sur la prévention de la transmission des PVH. Les rapports oro-génitaux constituent quant à eux le mode de transmission invoqué dans les cancers ORL (12,13).
Comment le vaccin a-t-il été découvert et mis au point ?
Les vaccins prophylactiques « classiques » à base de virus vivants atténués ou inactivés se sont révélés très efficaces contre d’autres virus, tels que ceux causant la poliomyélite et la rougeole. Mais ces techniques n’ont pas pu être utilisées pour le vaccin PVH pour deux raisons : 1) l’impossibilité de cultiver le virus in vitro et 2) le risque à administrer chez l’Homme des génomes viraux contenant des oncogènes, c’est-à-dire des gènes susceptibles de causer des cancers. L’approche « pseudo-particules virales » (PPV) permet de résoudre ces deux difficultés.
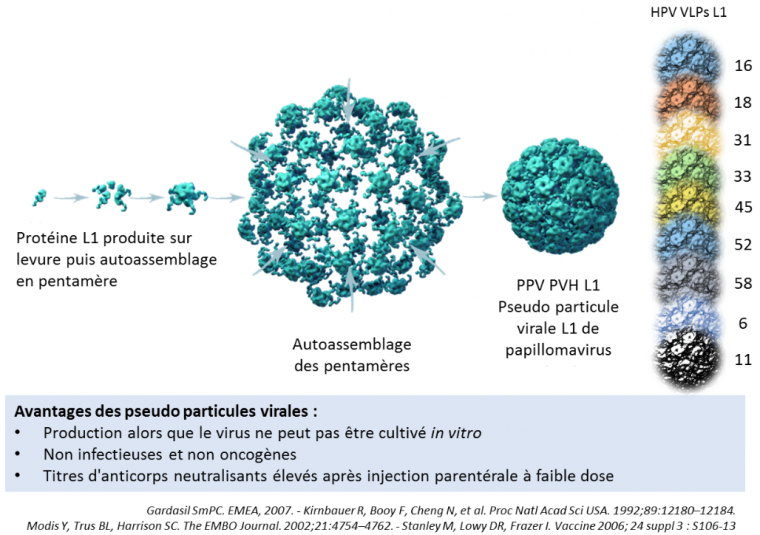
Les pseudo-particules virales ont une conformation quasi-identique à celle du virus sauvage, mais sont totalement dépourvues de matériel génétique. Elles sont obtenues par l’assemblage spontané de 72 copies de la protéine principale de la capside, la protéine L1, dans le milieu de culture. Celle-ci est exprimée par un système cellulaire (Saccharomyces cerevisiae ou cellules d’insectes infectées par un baculovirus) dont le génome a été recombiné avec le gène codant la protéine. Les pseudo-particules virales ne sont donc, par construction, ni infectieuses ni oncogènes (14).
La protéine L1 est spécifique du type de PVH. En fonction des vaccins, entre 2 et 9 types de pseudo-particules virales sont donc utilisées (15) (Figure 2).
Les papillomavirus humains ne peuvent être cultivés in vitro. Pour produire un vaccin contre ces virus, on utilise donc des techniques de génie génétique pour faire produire à un système cellulaire (par exemple des levures) la protéine de capside L1 d’un type de papillomavirus. Ces protéines s’autoassemblent alors pour former des pseudo-particules virales L1. Ces dernières possèdent certains avantages par rapport aux vaccins classiques (virus inactivés ou virus atténués). En effet les pseudo-particules virales obtenues sont (i) non infectieuses et non oncogènes et (ii) permettent de produire un taux d’anticorps neutralisants élevé après une injection parentérale à faible dose.
Quel est le mécanisme de protection conféré par la vaccination ?
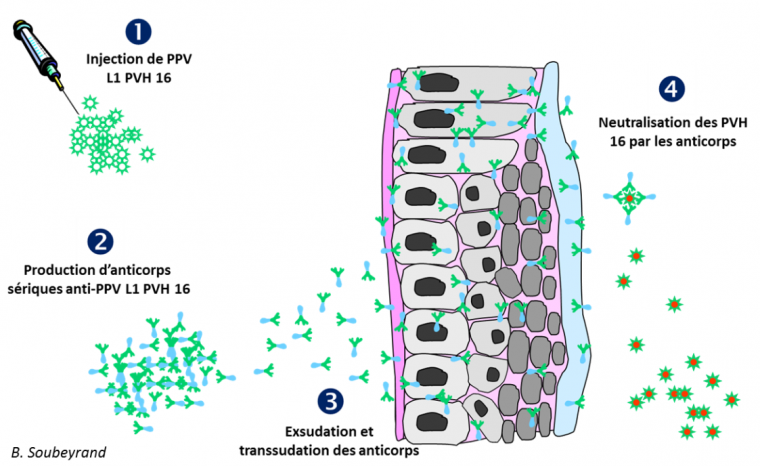
Après injection intramusculaire, les pseudo-particules virales L1 induisent des titres d’anticorps sériques neutralisants très élevés, beaucoup plus qu’après infection naturelle (x 100 à 1 000). Chez les vaccinés, les anticorps sont le principal, sinon le seul, mécanisme de protection contre les PVH. Au niveau de l’appareil génital féminin, ces anticorps (IgG) diffusent à partir du plasma dans le mucus cervico-vaginal selon deux mécanismes : une exsudation directe passive (les anticorps passent entre les cellules de l’épithélium) et une transsudation active (les anticorps transitent à travers les cellules) conduisant à des titres d’IgG environ dix fois plus élevés localement que ceux présents dans le plasma. Lors d’une exposition aux papillomavirus humains, la présence des anticorps spécifiques les empêche d’infecter leurs cellules cibles : les cellules basales de l’épithélium muqueux (16) (Figure 3).
Comment ont été démontrées l’efficacité et la tolérance du vaccin chez l’Homme ?
Le principe
Dans son principe, la démonstration de l’efficacité d’un vaccin est simple. La méthode consiste à conduire une étude contrôlée (c’est-à-dire comparer l’effet du candidat vaccin à l’effet d’un produit dont on sait qu’il n’en a aucun, un placebo, habituellement du sérum physiologique), randomisée (l’attribution aléatoire par tirage au sort du candidat vaccin ou du placebo à chaque participant), en double aveugle (ni celui qui administre le produit ni celui qui le reçoit ne sait s’il s’agit du candidat vaccin ou du placebo). À la fin de l’étude la différence entre le nombre de cas de maladie observé dans chaque groupe permet de calculer la valeur de l’efficacité du candidat vaccin. Les caractéristiques de l’histoire naturelle de l’infection par un papillomavirus humain et du cancer du col de l’utérus compliquent singulièrement la mise en œuvre de ce type d’essai.
En effet, le fait que le cancer du col de l’utérus survienne 20 à 30 ans après l’infection et les raisons éthiques liées à la pratique du dépistage et du traitement des lésions précancéreuses imposent d’utiliser comme critère d’efficacité dans les essais cliniques la prévention des lésions précancéreuses (CIN) et non celle du cancer du col à proprement parler. La démonstration stricto sensu de la prévention de ce cancer par la vaccination ne peut donc être apportée que par des études conduites en population, une fois le vaccin enregistré (c’est-à-dire ayant obtenu une autorisation de mise sur le marché) et utilisé.
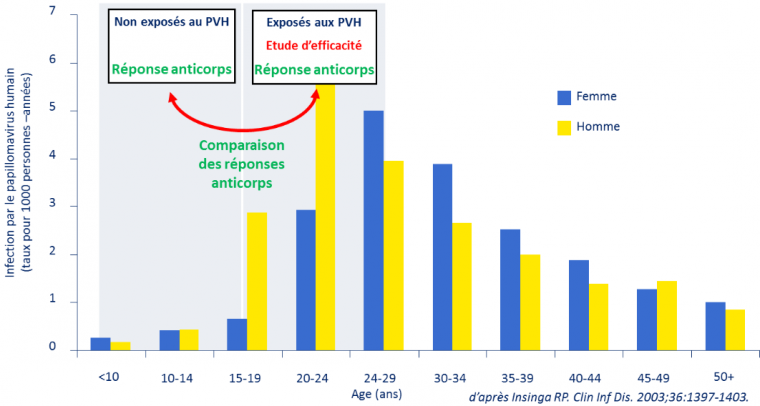
Pour savoir si un vaccin PVH peut-être efficace pour protéger des adolescent(e)s n’ayant pas encore eu de rapports sexuels on réalise des études dites de bridging. Cela consiste à comparer le taux d’anticorps anti-PVH produits suite à la vaccination au taux d’anticorps présents chez des femmes sexuellement actives chez lesquelles l’efficacité du vaccin a été démontrée (protection contre les lésions précancéreuses). Si le taux d’anticorps détecté chez les premières est au moins supérieur à celui mesuré chez les secondes, alors on considère que le vaccin confère bien une protection clinique aux adolescent(e)s. C’est bien le cas pour les vaccins PVH actuellement disponibles (Figure 4). En revanche, et bien que les titres d’anticorps postvaccinaux observés chez les adolescent(e)s étaient deux fois plus élevés que ceux observés chez les femmes, la connaissance de la durée de protection conférée par une vaccination vers l’âge de 10 ans pour une exposition à l’infection qui survient 10 à 50 ans plus tard ne peut être apportée que par des études conduites en population, une fois le vaccin enregistré (14).
Les études d’efficacité clinique (protection contre la maladie) ne sont pas possibles pour les maladies sexuellement transmissibles chez les préadolescents alors qu’ils sont la cible de la vaccination. L’efficacité du vaccin est inférée chez les adolescents si la réponse anticorps anti-PVH induite par la vaccination est non inférieure à celle induite chez des femmes pour lesquelles la protection clinique par la vaccination a été démontrée.
Les résultats – les vaccins actuels
Trois vaccins sont indiqués en prévention des maladies génitales induites par les papillomavirus humains. Les pseudo-particules virales L1 des PVH 16 et 18, virus associés à environ 70 % des cas de cancers du col de l’utérus, sont présentes dans un seul vaccin (Cervarix). Les deux autres vaccins contiennent également les pseudo-particules virales L1 des types 6 et 11, responsables de 90 % des verrues génitales, et celles des types 31/33/45/52/58 (Gardasil 9). Globalement, ce dernier confère donc une protection contre les sept types de PVH HR les plus fréquents, responsables de 90 % des cas de cancers du col de l’utérus, de 80 % des lésions précancéreuses et de 90 % des verrues génitales.
La figure 5 présente les résultats de la première étude d’efficacité conduite avec le premier candidat vaccin (preuve du concept) et les données d’efficacité des vaccins sur le marché en prévention des lésions précancéreuses.
Depuis, aucun cas d’échec vaccinal n’a encore été identifié de manière catégorique parmi les vaccinés dans le cadre des études cliniques dans lesquelles ont été enrôlés au total plus de 50 000 individus (9, 14).
Les vaccins PVH sont généralement bien tolérés : dans les essais cliniques contrôlés contre placebo les effets indésirables recueillis étaient des réactions au site d’injection se manifestant essentiellement sous forme de douleur au site d’injection et de fièvre. Ces réactions générales survenaient chez environ 10 % des personnes qui recevaient le vaccin contre à peu près 8 % de celles qui avaient reçu le placebo (9, 14).
Sur la base des résultats d’efficacité et de tolérance obtenus par les essais cliniques, les premiers vaccins PVH ont obtenu une autorisation de mise sur le marché, initialement chez les individus de sexe féminin en 2007, puis secondairement pour tous les individus âgés de plus de 9 ans.
Quelles sont les stratégies de vaccination ?
Les performances de prévention au niveau d’une population, même pour les vaccins très efficaces, dépendent étroitement de la façon dont ils sont utilisés (population cible, nombre de doses, etc.). Ceci explique que la plupart des vaccins fassent l’objet de programmes nationaux de vaccination définis par les autorités de santé qui émettent des recommandations d’utilisation, voire des obligations, assorties d’une prise en charge financière et de campagnes de sensibilisation de la population.
Comme pour tous les vaccins recommandés en routine, la vaccination PVH, pour être la plus efficace possible, doit avoir lieu avant que les individus ne soient exposés à l’infection. La plupart des pays a donc initialement recommandé la vaccination des filles âgées de 9 à 13 ans étendue transitoirement aux femmes jusqu’à l’âge de 26 ans, avec comme objectif la prévention du cancer du col de l’utérus.
Les programmes scolaires se sont montrés très performants pour les adolescents(es), en permettant d’obtenir une forte couverture vaccinale au Royaume-Uni et en Australie par exemple. Les programmes de vaccination non organisés des adolescents ont eu des résultats mitigés, allant de taux de couverture élevés au Danemark à des taux de couverture relativement faibles aux États-Unis et bien sûr en France où environ 30 % seulement des adolescentes sont vaccinées (17,18).
En 2019, plus de 90 pays recommandent la vaccination en routine des jeunes filles et la plupart préconisent aussi la vaccination des homosexuels masculins, des personnes infectées par le virus de l’immunodéficience humaine et des immunodéprimés. En raison de la fréquence de survenue de cancers induits par les papillomavirus humains chez les hommes, les recommandations de vaccination en routine ont été récemment étendues aux préadolescents et adolescents masculins dans de nombreux pays (23 fin 2018 : États-Unis, Canada, Australie, Brésil, Italie, Autriche…). Il est attendu que cette mesure, outre la protection individuelle directe des vaccinés, induise un effet synergique avec la vaccination féminine, conduisant à une augmentation globale de la couverture vaccinale de la population afin de réduire la circulation des virus dans la population assurant une meilleure protection indirecte des non vaccinés (protection de groupe).
En France, la politique de vaccination est élaborée par le ministère chargé de la Santé qui fixe les conditions d’immunisation, énonce les recommandations nécessaires et rend public le calendrier des vaccinations après avis de la Haute autorité de santé. Ce calendrier fixe les vaccinations applicables aux personnes résidant en France en fonction de leur âge, émet les recommandations vaccinales « générales » et des recommandations vaccinales « particulières » propres à des conditions spéciales (risques accrus de complications, d’exposition ou de transmission) ou à des expositions professionnelles.
La vaccination PVH est recommandée pour toutes les jeunes filles et jeunes femmes de 11 à 19 ans révolus. À partir de 25 ans, toutes les jeunes femmes vaccinées ou non vaccinées doivent continuer à bénéficier du dépistage.
Pour les hommes ayant des relations sexuelles avec des hommes, la vaccination PVH par Gardasil ou Gardasil 9 est recommandée jusqu’à l’âge de 26 ans, en prévention des lésions précancéreuses anales, des cancers anaux et des condylomes.
La vaccination contre les papillomavirus est recommandée chez les garçons et les filles immunodéprimés aux mêmes âges que dans la population générale (10).
Quels sont les premiers résultats observables des programmes de vaccination ?
Pourquoi est-il important de suivre et d’évaluer les programmes de vaccination ?
Tout vaccin nouvellement mis sur le marché fait l’objet d’un suivi actif réglementaire par le détenteur de la licence et, indépendamment, par les autorités de santé nationales et par les autorités de santé supranationales, telles que l’Agence européenne des médicaments et l’Organisation mondiale de la santé. Ce suivi a pour double objectif de répondre aux questions qui restent en suspens au moment de la délivrance de l’autorisation de mise sur le marché et d’évaluer la performance des programmes afin de procéder aux adaptations éventuellement nécessaires (15).
Les données d’efficacité et de tolérance générées par les essais cliniques préenregistrements le sont grâce à un suivi relativement bref (quelques années) de l’administration contrôlée du vaccin dans un échantillon sélectionné et homogène (quelques milliers d’individus en bonne santé) de la population générale.
Lors de la mise en place des programmes de vaccination des PVH en prévention du cancer du col de l’utérus, le recul sur la durée d’efficacité était de l’ordre de 4-5 ans, sans savoir si les adolescentes vaccinées seraient protégées 10, 20 ou 40 ans plus tard, si des injections de rappels seraient nécessaires, si la vaccination préviendrait la survenue de cancer du col stricto sensu ou dans quelle mesure les vaccinés pourraient indirectement protéger les non vaccinés.
Les effectifs des essais cliniques sont généralement définis pour évaluer l’efficacité d’un vaccin. Ils sont insuffisants pour détecter des effets indésirables rares d’une fréquence inférieure de l’ordre de 1/3 000 à 1/10 000 vaccinés. Le suivi de la tolérance en population est donc impératif.
L’efficacité de la vaccination PVH en population
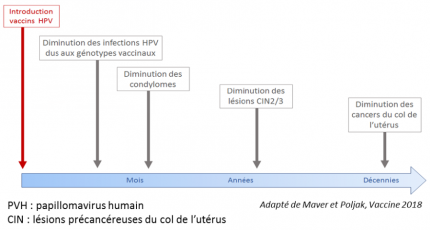
L’évaluation de l’efficacité des vaccins PVH en prévention des cancers est tributaire de l’histoire naturelle de la maladie, qui s’étend sur plusieurs années. La figure 6 indique les délais attendus pour observer l’efficacité de la vaccination PVH en fonction de la maladie considérée.
Une revue systématique des données provenant de 60 millions de personnes et jusqu’à 8 ans de suivi post-vaccination publiée en 2019 montre déjà un impact considérable des programmes de vaccination sur les infections à PVH, sur les lésions précancéreuses chez les filles et les femmes et sur les verrues anogénitales dans les deux sexes. À titre d’exemple, la vaccination systématique chez les filles âgées de 12 à 13 ans en Écosse a entrainé une réduction de 89 % des néoplasies intraépithéliales cervicales de grade 3 ou plus (CIN3+), de 88 % des CIN2+ et de 79 % des CIN1. L’effet de protection indirecte des non vaccinés par les vaccinés est d’autant plus important que le nombre de vaccinés est élevé (17). Par exemple, en Australie, dans les années qui ont suivi la vaccination des seules adolescentes et jeunes filles (83 % de vaccinées), les diagnostics de verrues génitales ont diminué de plus de 92 % chez les jeunes femmes et de près de 82 % chez jeunes hommes hétérosexuels (mais pas chez les homosexuels) (19).
Enfin, des premiers résultats d’efficacité sur la prévention du cancer du col de l’utérus ont été obtenus en Finlande récemment. L’analyse du suivi à long terme des femmes qui ont participé aux essais cliniques initiaux, montre qu’entre juin 2007 et décembre 2015, 10 cas de cancers du col de l’utérus dus au PVH sont survenus chez des femmes non vaccinées alors qu’aucun cas n’est survenu chez des femmes vaccinées PVH (ce qui est statistiquement significatif bien que l’intervalle de confiance soit large). Dans le même temps, les taux d’incidence des autres cancers courants non associés au PVH ne différaient pas entre les deux groupes (20).
Depuis l’homologation en 2006 des vaccins PVH, plus de 270 millions de doses de vaccins ont été distribuées au monde. Les autorités réglementaires nationales, supranationales et l’OMS analysent régulièrement les données de tolérance recueillies dans le monde entier. Le Comité consultatif mondial de la sécurité vaccinale (GACVS) de l’OMS a examiné les données cumulées relatives à l’innocuité et à la tolérance des vaccins PVH en 2007, 2008, 2009, 2013, 2014, 2015 et 2017. Les dernières conclusions du Comité indiquent qu’il n’a pas été identifié d’évènement indésirable préoccupant et que l’acceptation de la vaccination PVH reste essentiellement une question de communication puisqu’il n’y a pas de problème de tolérance de ces vaccins (9, 21).
Quelles perspectives pour le contrôle des maladies dues au PVH ?
L’expérience de l’Australie, qui a été le premier pays au monde à lancer un programme national de vaccination contre les PVH financé par des fonds publics et à documenter ses effets, suggère que l’élimination mondiale des maladies dues à ces virus est un objectif réaliste à moyen terme.
Sur la base des données recueillies durant les dix premières années du programme, une modélisation montre, à condition que la vaccination et le dépistage soient bien suivis, que le cancer du col de l’utérus pourrait être quasiment éliminé dans les 20 ans qui viennent. En 2100, l’incidence de cette maladie atteindrait 0,57 cas pour 100 000 femmes, soit une réduction de 91 % par rapport à 2006 et la mortalité serait réduite à moins de trois cas par million de femmes (22).
Un impact comparable est attendu dans les pays développés qui ont instauré un programme vaccination PVH bien suivi. Ces résultats extraordinaires, alors que neuf femmes sur dix n’ont pas accès au vaccin dans les pays en développement, ont conduit le directeur général de l’OMS à appeler, en mai 2018, à mettre tout en œuvre pour que chaque fille soit vaccinée contre les papillomavirus humains et que chaque femme âgée de plus de 30 ans bénéficie du dépistage et du traitement des lésions précancéreuses (23).
Références
- Les cancers d’origine infectieuse [Internet]. Institut Pasteur. 2017 [cité 23 juill 2019]. Disponible sur : https://www.pasteur.fr/fr/journal-recherche/dossiers/cancers-origine-infectieuse
- McNeil C. Who Invented the VLP Cervical Cancer Vaccines ? JNCI : Journal of the National Cancer Institute [Internet]. 5 avr 2006 [cité 11 sept 2019] ; 98(7) :433‑433. Disponible sur : https://academic.oup.com/jnci/article/98/7/433/2522050
- Organisation Mondiale mondiale de la Santé. Hépatite B [Internet]. [cité 11 sept 2019]. Disponible sur : https://www.who.int/fr/news-room/fact-sheets/detail/hepatitis-b
- Organisation Mondiale de la Santé. HPV immunization schedules and strategies — Background paper for SAGE deliberations [Internet]. Organisation Mondiale de la Santé ; 2016. Disponible sur : https://www.who.int/immunization/sage/meetings/2016/october/1_HPV_vaccine_background_document_27Sep… ? ua=1,
- Petry K-U, Bollaerts K, Bonanni P, Stanley M, Drury R, Joura E, et al. Estimation of the individual residual risk of cervical cancer after vaccination with the nonavalent HPV vaccine. Human Vaccines & Immunotherapeutics [Internet]. 19 mars 2018 [cité 20 mars 2018] ; 0(ja) :1‑23. Disponible sur : https://doi.org/10.1080/21645515.2018.1450125
- Bosch FX, Lorincz A, Munoz N, Meijer CJLM, Shah KV. The causal relation between human papillomavirus and cervical cancer. Journal of Clinical Pathology [Internet]. 1 avr 2002 [cité 15 août 2018] ; 55(4) :244‑65. Disponible sur : http://jcp.bmj.com/cgi/doi/10.1136/jcp.55.4.244
- Anderson J. The discoveries of human papilloma viruses that cause cervical cancer and of human immunodeficiency virus [Internet]. Karolinska Institutet ; 2008. Disponible sur : https://www.nobelprize.org/uploads/2018/06/advanced-medicineprize2008.pdf
- zur Hausen H. Papillomaviruses in the causation of human cancers — a brief historical account. Virology [Internet]. févr 2009 [cité 25 juill 2019] ; 384(2) :260‑5. Disponible sur : https://linkinghub.elsevier.com/retrieve/pii/S0042682208007721
- WHO | Weekly Epidemiological Record, 12 May 2017, vol. 92, 19 (pp. 241–268) [Internet]. WHO. [cité 8 sept 2019]. Disponible sur : http://www.who.int/wer/2017/wer9219/en/
- Haut conseil de Santé publique France. Avis relatif à la place du vaccin GARDASIL 9® dans la stratégie actuelle de prévention des infections à papillomavirus humains [Internet]. 2017. Disponible sur : https://www.hcsp.fr/Explore.cgi/avisrapports
- Aynaud O, Judlin P, Carcopino X, Jacquard AC, Okais C, Leocmach Y, et al. Incidence rates of genital warts in young women and men in France. European Research Organisation on Genital Infection and Neoplasia (EUROGIN) Lisbon, Portugal, May 8-11, 2011 [Internet]. 2011 ; 1‑1. Disponible sur : http://webposter/biblio2006/intrabib46660.pdf
- Santé Publique France. Infections à papillomavirus – Santé publique France.pdf [Internet]. Disponible sur : https://www.santepubliquefrance.fr/maladies-et-traumatismes/maladies-a-prevention-vaccinale/infecti…
- Denis F, Hantz S. Vaccination anti-HPV – Le point de vue du virologue. La Lettre du Cancérologue [Internet]. janv 2017 ; XXVI-n° 1-janvier 2017(1) :15‑20. Disponible sur : https://www.edimark.fr/lettre-gynecologue/vaccination-anti-hpv-point-vue-virologue
- Schiller JT, Markowitz LE, Hildesheim A, Lowy DR. Human Papillomavirus Vaccines. In : Plotkin SA, Orenstein WA, Offit PA, Edwards KM, éditeurs. Plotkin’s Vaccines (Seventh Edition) [Internet]. Elsevier ; 2018. p. 430-455.e10. Disponible sur : http://www.sciencedirect.com/science/article/pii/B9780323357616000304
- Committee for Medicinal Products for Human Use (CHMP). gardasil-9-epar-public-assessment-report_en.pdf [Internet]. [cité 21 sept 2019]. Disponible sur : https://www.ema.europa.eu/en/documents/assessment-report/gardasil-9-epar-public-assessment-report_e…
- Schiller JT, Lowy DR. Understanding and learning from the success of prophylactic human papillomavirus vaccines. Nat Rev Microbiol [Internet]. oct 2012 [cité 23 juill 2019] ; 10(10) :681‑92. Disponible sur : http://www.nature.com/articles/nrmicro2872
- Drolet M, Bénard É, Pérez N, Brisson M, Ali H, Boily M-C, et al. Population-level impact and herd effects following the introduction of human papillomavirus vaccination programmes : updated systematic review and meta-analysis. The Lancet [Internet]. août 2019 [cité 11 sept 2019] ; 394(10197) :497‑509. Disponible sur : https://linkinghub.elsevier.com/retrieve/pii/S0140673619302983
- Institut National du Cancer. Vaccination contre les HPV et dépistage régulier : la combinaison gagnante pour vaincre le cancer du col de l’utérus [Internet]. 2019. Disponible sur : https://www.e-cancer.fr/content/download/274480/3892598/file/CP%20-%20Vaccination%20anti-HPV%20et%2… %A9pistage_la%20combinaison%20gagnante%20contre%20le%20cancer%20du%20col%20de%20l'ut%C3 %A9rus%202019.pdf
- Ali H, Donovan B, Wand H, Read TRH, Regan DG, Grulich AE, et al. Genital warts in young Australians five years into national human papillomavirus vaccination programme : national surveillance data. BMJ [Internet]. 18 avr 2013 [cité 18 févr 2019] ; 346(apr18 1) : f2032‑f2032. Disponible sur : http://www.bmj.com/cgi/doi/10.1136/bmj.f2032
- Luostarinen T, Apter D, Dillner J, Eriksson T, Harjula K, Natunen K, et al. Vaccination protects against invasive HPV-associated cancers : Letter to the editor. International Journal of Cancer [Internet]. 15 mai 2018 [cité 10 févr 2019] ; 142(10) :2186‑7. Disponible sur : http://doi.wiley.com/10.1002/ijc.31231
- HPV_vaccination_safety_report_AHTA_dec17.pdf [Internet]. [cité 8 sept 2019]. Disponible sur : https://www.who.int/vaccine_safety/HPV_vaccination_safety_report_AHTA_dec17.pdf
- Hall MT, Simms KT, Lew J-B, Smith MA, Brotherton JM, Saville M, et al. The projected timeframe until cervical cancer elimination in Australia : a modelling study. The Lancet Public Health [Internet]. oct 2018 [cité 10 oct 2018] ; Disponible sur : https://linkinghub.elsevier.com/retrieve/pii/S246826671830183X
- Ghebreyesus TA. Cervical Cancer : An NCD We Can Overcome [Internet]. WHO. 2018 [cité 21 sept 2019]. Disponible sur : https://www.who.int/reproductivehealth/DG_Call-to-Action.pdf