Alors qu’elles sont souvent schématiquement représentées sous la forme de gélules toutes identiques, les mitochondries sont en réalité des organites dont la structure varie selon le type cellulaire et même au sein d’une cellule. Le réseau mitochondrial constitue en effet un système dynamique, capable de changer de forme en réponse à des stimuli internes et externes aux cellules. La fission, la fusion et le transport des mitochondries sont essentiels au bon fonctionnement des cellules.
Les mitochondries sont des organites présents dans la majorité des cellules eucaryotes. Elles possèdent une membrane interne ainsi qu’une membrane externe, vestige de la membrane phagocytaire témoignant de l’origine endosymbiotique de l’organite. Ces membranes délimitent deux compartiments, l’espace intermembranaire et la matrice, qui peuvent dès lors avoir des compositions biochimiques et donc des fonctions distinctes de celles du cytosol. La membrane externe contient notamment des transporteurs actifs et passifs, ainsi que des enzymes impliquées dans le métabolisme. La membrane interne forme des crêtes et constitue le support de la chaîne respiratoire et de l’ATP synthase ; c’est donc un élément essentiel du catabolisme 1. La matrice mitochondriale, quant à elle, contient les enzymes du cycle de Krebs, ainsi que plusieurs copies de l’ADN mitochondrial circulaire, de l’ARN, et les équipements de transcription et de traduction mitochondriaux. Bien qu’il comprenne plus de 1500 protéines, seule une petite fraction du protéome mitochondrial est codée par le génome mitochondrial : 13 protéines chez l’humain 2.
Les mitochondries ont été reconnues comme des entités dynamiques de la cellule dès le début du XXe siècle. Notamment, Margaret et Warren Lewis observent des mitochondries de cellules cardiaques embryonnaires de poulet et rapportent leurs observations en 1914 dans le journal Science, des années avant l’émergence de la vidéomicroscopie : « Les mitochondries ne sont presque jamais au repos, mais changent continuellement de position et aussi de forme. Les changements de forme sont vraiment remarquables non seulement par la grande variété des formes, mais aussi par la rapidité avec laquelle elles passent d'une forme à une autre. […] Elles ont été vues s'allonger de plusieurs fois leur longueur d'origine, s'étendre à travers le cytoplasme et s'anastomoser en un réseau compliqué. Environ quinze minutes plus tard, ce réseau s'est rompu et s'est contracté en fils, anneaux, boucles, tiges et granules. » 3.
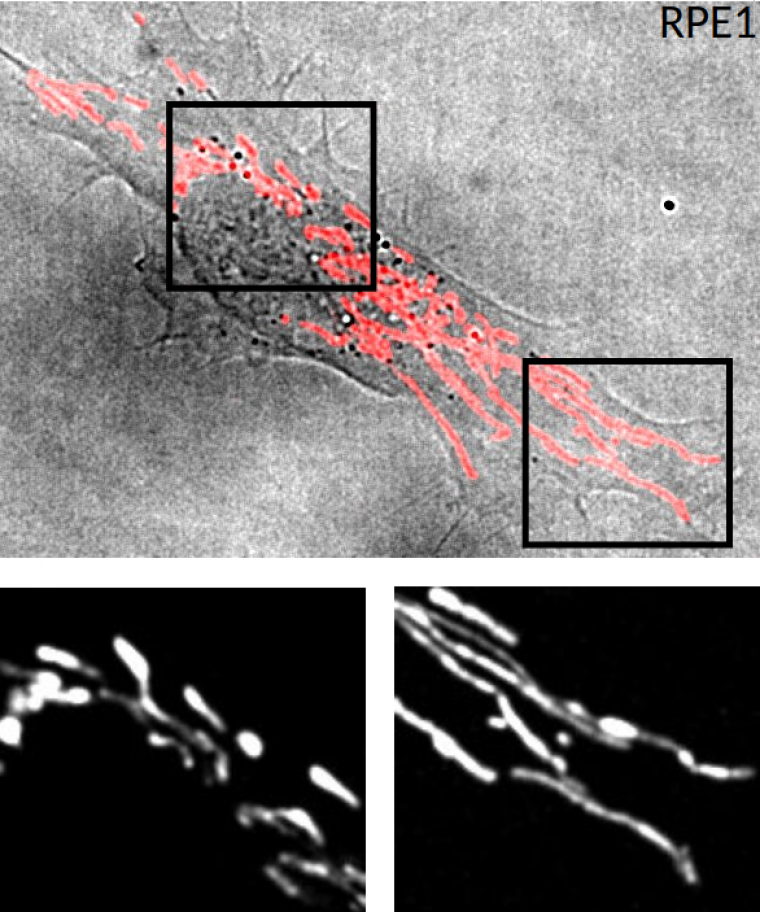
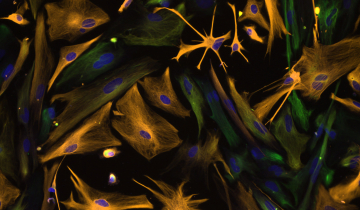
Images de microscopie à fluorescence d’une cellule RPE1 (Retinal Pigment Epithelial) sur une lamelle de verre. Les mitochondries sont mises en évidence par addition de Mitotracker Red. Haut : superposition d’une image de microscopie en fond clair (cellule) avec une image de fluorescence des mitochondries, en rouge. Bas : deux agrandissements de l’image de fluorescence, montrant, à gauche, les mitochondries proches du noyau, petites et d’aspect plus arrondi, et à droite, les mitochondries en périphérie de la cellule, plus fines et longues.
Aujourd’hui, lorsqu’on parle de dynamique mitochondriale, on désigne généralement la fusion, la fission et le transport des mitochondries. La fusion de deux mitochondries est caractérisée par l’entrée en contact de leurs matrices, ce qui permet aux métabolites, aux enzymes, aux génomes et aux produits des gènes mitochondriaux de se mélanger. La fission permet de fractionner le réseau, ainsi que de séparer les sections endommagées d'une mitochondrie pour les préparer à être dégradées par mitophagie. Il est largement reconnu que des altérations de la dynamique mitochondriale sont nocives à la vie cellulaire. La dynamique mitochondriale assure le bon fonctionnement de la cellule en assurant une répartition appropriée des mitochondries en son sein.
En effet, en raison de leur rôle dans la production d'énergie cellulaire, les mitochondries sont exposées à des niveaux élevés d'espèces réactives de l'oxygène, ce qui les rend particulièrement vulnérables à des mutations de l'ADN mitochondrial et à des erreurs de repliement de protéines. Lorsqu’une mitochondrie est endommagée, elle ne maintient plus un potentiel de membrane normal et peut libérer des facteurs apoptotiques (comme le cytochrome c, Smac/Diablmo ou AIF de l’espace intermembranaire). Les mitochondries défectueuses sont éliminées par un processus spécifique d’autophagie, appelé mitophagie, au cours duquel elles sont encapsulées par une endomembrane et dégradées par un autolysosome 12.
Ainsi, les processus de fusion et de fission mitochondriales permettent de maintenir dans chaque type cellulaire une structure et une répartition appropriée du réseau mitochondrial. Le transport orienté de mitochondries saines à travers la cellule permet l’exécution d’événements cellulaires tels que la migration, la division et la polarisation.
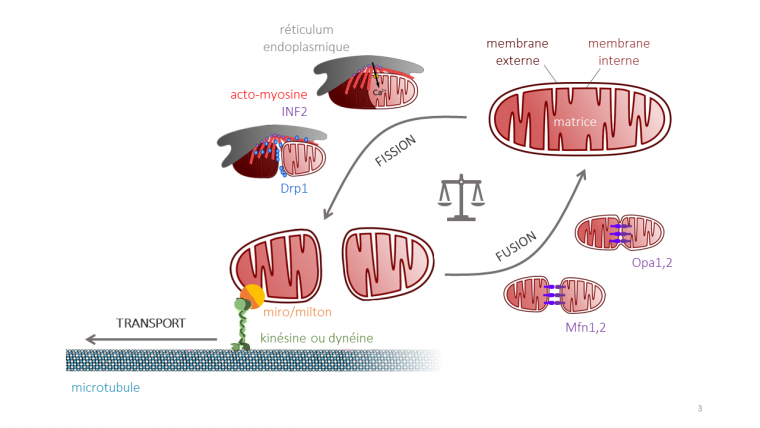
La fission mitochondriale
La fission, processus par lequel une mitochondrie se divise pour donner place à deux mitochondries distinctes, implique d’abord la membrane interne, puis la membrane externe. Au niveau de la zone de fission, la mitochondrie subit une constriction, c’est-à-dire un rétrécissement de son diamètre, qui passe d’environ 800 nm au repos à une centaine de nanomètres 3. Chacune des deux membranes subit d’abord une constriction, puis une scission de la membrane couplée à sa recombinaison avec elle-même pour refermer le compartiment mitochondrial. Une fois que la membrane interne puis la membrane externe se sont divisées, la matrice mitochondriale est séparée en deux unités non communicantes : deux nouvelles mitochondries sont nées 4.
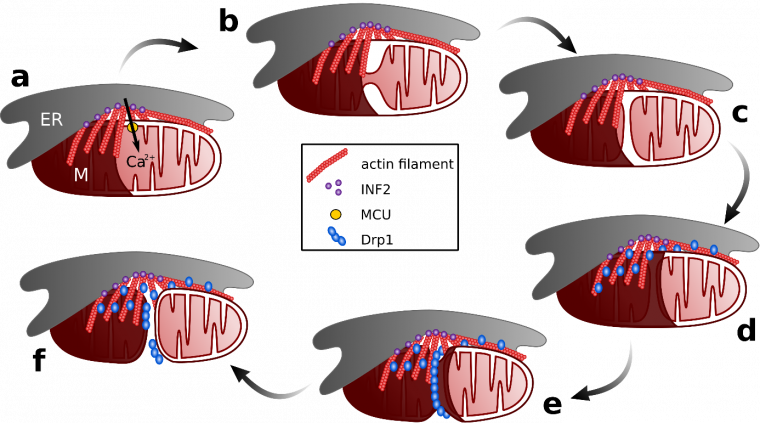
Des deux membranes mitochondriales, la membrane interne se divise en premier (Figure 2). La constriction et la division de la membrane interne font suite à une augmentation du taux de calcium mitochondrial 5. Ces ions calcium proviennent du réticulum endoplasmique, qui en stocke de grandes quantités : ceci explique que les événements de fission se produisent presque toujours à proximité de sites de contact entre celui-ci et les mitochondries 6. Une fois libéré par le réticulum endoplasmique, le calcium est importé dans les mitochondries au travers de la membrane externe, puis de la membrane interne. La proximité du réticulum endoplasmique permet donc l’entrée rapide d’une grande quantité d’ions Ca2+ dans la matrice 7.
a) La formine INF2 ancrée dans le réticulum intervient dans la polymérisation de l'actine pour stabiliser les sites de contact réticulum endoplasmique- mitochondrie, permettant à la mitochondrie d'absorber le calcium émis par le réticulum endoplasmique à travers le MCU (Mitochondrial Calcium Uniporter). b) De fortes concentrations de calcium sont nécessaires pour la constriction de la membrane mitochondriale interne. c) La constriction de la membrane interne entraîne la division de la matrice mitochondriale en deux entités. d) Drp1 est recruté à la membrane mitochondriale externe. e) Drp1 forme un anneau qui resserre la membrane externe. f) La constriction de la membrane externe entraîne la division de la mitochondrie.
Les sites de contact mitochondrie-réticulum forment également une plate-forme grâce à laquelle d’autres protéines impliquées dans la fission sont recrutées au site de la constriction. La mise en place de l’équipement de fission commence par la polymérisation de filaments d’actine, grâce à l’intervention de la formine INF2 (Inverted Formin 2). La polymérisation rapide d'actine précède le pic de calcium mitochondrial observé au niveau des sites de fission, et la présence d’INF2 et d’actine lui sont nécessaires. Le réseau dense de filaments d’actine formé grâce à INF2 renforce le contact entre réticulum endoplasmique et mitochondries, ce qui facilite le flux de calcium 12. En particulier, la présence d’INF2 et d’actine permet l’accumulation de myosine II non musculaire aux sites de fission. La myosine joue en effet un rôle important dans le transfert du calcium vers les mitochondries et la fission mitochondriale, en fournissant la tension contractile nécessaire au rapprochement entre réticulum et mitochondries 34.
De plus, la protéine Spire1C, capable de liaison aux formines et de nucléation d’actine, est présente aux zones de contact. Plus précisément, elle se localise à la surface mitochondriale, se lie à INF2 et favorise l’assemblage d’actine à proximité de la mitochondrie. Son rôle dans la polymérisation d’actine est essentiel au bon déroulement de la fission mitochondriale 5.
Suite à la constriction locale de la mitochondrie et à l'augmentation de la concentration en calcium mitochondrial, la membrane interne se contracte et se divise. La membrane externe se divise environ 30 secondes plus tard, empêchant ainsi la perte de matériel mitochondrial 6. La formine INF2 et le cytosquelette d’actine jouent également un rôle dans la constriction et la division de la membrane externe. En effet, ces deux protéines sont nécessaires au recrutement de la protéine Drp1 (Dynamin-related protein 1) aux sites de contact 789.
Drp1 est le principal acteur de la fission de la membrane externe. C’est une protéine de forme allongée et de masse moléculaire de 80,5 kDa. Elle possède un domaine GTPase à son extrémité N-terminale, et est capable d’une interaction directe avec les filaments d’actine 1011. Drp1 forme des dimères qui peuvent ensuite s’assembler entre eux, ce qui augmente leur affinité avec l’actine 12. Dans les cellules, Drp1 s’accumule au niveau des filaments d’actine dont la polymérisation est permise par INF2, ce qui est le cas des filaments impliqués dans la fission mitochondriale 13.
Sur la membrane externe des mitochondries, le récepteur Mff (Mitochondrial fission factor) permet de recruter Drp1 aux sites de fission. L’interaction entre Mff et Drp1 dépend de l’état d’oligomérisation (trimérisation) de Mff, et de la présence de filaments d’actine 14. Ancrée par Mff, Drp1 peut ensuite s’oligomériser en un anneau autour de la membrane externe. L’hydrolyse de GTP permet un changement de conformation de Drp1, ce qui donne lieu à une contraction de la membrane 1516. À la suite de cette contraction, la mitochondrie entière se divise, et la fission se termine par la séparation des deux nouvelles mitochondries 1718.
La fusion mitochondriale
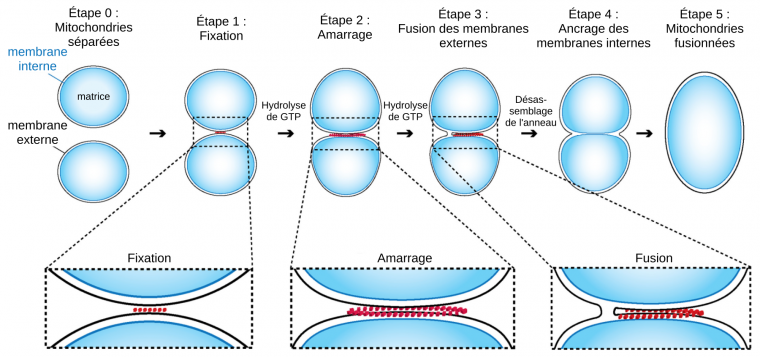
Événement inverse de la fission, la fusion mitochondriale permet l’allongement du réseau mitochondrial, augmentant sa connectivité. Lors de fusion de deux mitochondries, les membranes externes entrent en contact et fusionnent, puis la fusion des membranes internes permet la rencontre des matrices 19. Deux ensembles de GTPases de la famille des dynamines sont nécessaires pour la fusion : les mitofusines Mfn1 et 2 sur la membrane externe et Opa1 sur la membrane interne.
La première étape de la fusion nécessite la présence de mitofusines sur les membranes externes des deux mitochondries impliquées. Initialement, les mitochondries sont attachées l’une à l’autre grâce aux interactions entre mitofusines, tout en restant distantes d’environ 7 nm 2021. Cet espace intermitochondrial contient un ensemble de protéines qui se réorganisent en un anneau d’amarrage le long du contact membranaire (Figure 3). Puis, par hydrolyse de GTP, les mitofusines opèrent un changement de conformation, rapprochant les membranes externes de 1 à 3 nm. À cette distance, la fusion des membranes peut avoir lieu par la formation d’un pore de fusion, par lequel les espaces intermembranaires des deux mitochondries entrent en contact. L’élargissement du pore de fusion conduit à une fusion complète de la membrane externe 22.
Les membranes internes fusionnent par la suite. La GTPase Opa1, ancrée à la membrane interne via un domaine transmembranaire, est l’acteur principal de la fusion des membranes internes. Opa1 est modifiée par les protéases Yme1L et Oma1, générant ainsi trois isoformes d’une longueur différente, nécessaires à la fusion membranaire 2324.
Le transport des mitochondries
La fission et la fusion des mitochondries permettent de maintenir la structure du réseau mitochondrial, mais ces deux processus ne suffisent pas à assurer leur bonne répartition, nécessaire à l’accomplissement de nombreuses fonctions cellulaires. La distribution des mitochondries au sein des cellules est notamment importante dans les neurones, cellules asymétriques de très grande taille, où les mitochondries sont parmi les organites et vésicules continuellement transportés le long de l’axone afin de nourrir la population de mitochondries saines et fonctionnelles et d’apporter l’énergie nécessaire à la mise en place de synapses 1.
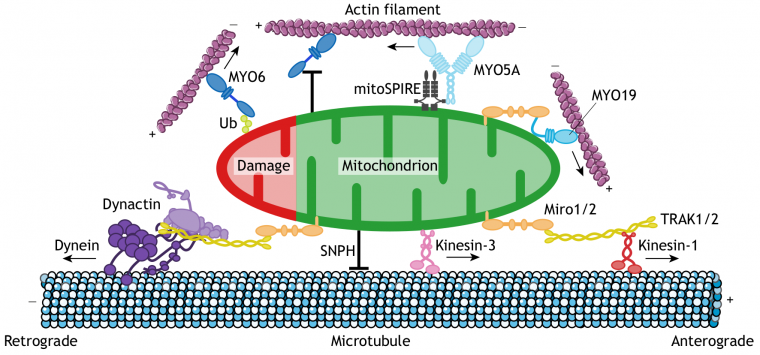
Le transport des mitochondries s'effectue par un mouvement motorisé le long des microtubules. La dynéine et la kinésine sont les protéines motrices impliquées dans le transport respectivement rétrograde et antérograde des mitochondries le long des microtubules (Figure 4) 2.
Les protéines motrices associées aux microtubules, la dynéine (en violet) et la kinésine (en rouge), forment le complexe moteur/adapteur avec les protéines Milton/TRAK1/2 (en jaune) et Miro (en orange), ces dernières étant insérées dans la membrane externe mitochondriale. La dynéine assure le transport vers le pôle − des microtubules, la kinésine vers le pôle +.
Les mitochondries peuvent également se déplacer le long des microfilaments d'actine grâce à différentes formes de myosine.
Aux protéines motrices s’ajoutent les protéines Miro et Milton pour former un complexe dit moteur/adapteur, nécessaire à la motilité des mitochondries dans presque tous les organismes 1. Le complexe Miro/Milton permet l’ancrage du moteur moléculaire à la mitochondrie : Miro est une GTPase de la membrane externe mitochondriale, et Milton fait la liaison avec les protéines motrices impliquées 2.
La bonne répartition des mitochondries dans une cellule dépend de la régulation de leur transport. L’activité de Miro peut être modulée par son interaction avec les ions calcium. Ainsi, la concentration de calcium affecte le transport des mitochondries, notamment dans les neurones où des niveaux élevés de Ca2+ inhibent le transport antérograde et rétrograde 345.
Les protéines kinases Pink1 et Parkin régulent le transport mitochondrial en intervenant dans la dégradation protéasomale de Miro : la sérine/thréonine kinase Pink1 active Parkin par phosphorylation, lui permettant d’ubiquitinyler Miro 6. De plus, dans les neurones, Pink1 joue un rôle supplémentaire selon la forme sous laquelle elle se trouve : la forme tronquée de Pink1 permet le mouvement antérograde des mitochondries, tandis que sa forme complète favorise le mouvement rétrograde 7.
Importance de la dynamique du réseau mitochondrial
L’importance physiologique des événements de fission, de fusion et de transport mitochondriaux est sans conteste : les pathologies résultant de son mauvais fonctionnement sont nombreuses et variées. Du fait de la présence de mitochondries dans presque toutes les cellules du corps humain (à l’exception des globules rouges), les pathologies mitochondriales peuvent affecter tous les organes mais ont souvent des manifestations spécifiques à des tissus particuliers 8.
En particulier, du fait de la grande taille des neurones et de l’importance des mitochondries dans le fonctionnement des synapses, les altérations de la fission et de la fusion mitochondriales sont liées à la pathogenèse de nombreuses maladies neurodégénératives. Par exemple, des mutations pathogènes des protéines de fusion mitochondriales Opa1 (membrane interne) et de Mfn2 (membrane externe) provoquent respectivement une atrophie optique autosomique dominante et la maladie Charcot-Marie-Tooth, tandis que des mutations de la protéine de fission mitochondriale Drp1 sont retrouvées dans le syndrome néonatal létal associant microcéphalie, anomalies du développement cérébral, atrophie optique, hypoplasie et acidose lactique 9. De plus, des dysfonctionnements de la dynamique mitochondriale sont retrouvés, entre autres, dans les maladies d'Alzheimer, de Huntington, de Parkinson, la sclérose latérale amyotrophique (SLA) et la maladie de Charcot-Marie-Tooth (CMT) 10. Cependant, l’impact des dysfonctionnements des systèmes de dynamique mitochondriale au niveau cellulaire est moins clair. Alors que la nécessité de la fission mitochondriale est évidente dans toute cellule qui se divise, ainsi que dans un contexte de mitophagie, il est plus difficile de replacer la fusion mitochondriale dans un processus cellulaire, en plus de sa participation à l’équilibre entre fission et fusion, qui permet à chaque type cellulaire d’avoir un phénotype mitochondrial propre qui se transmet de génération en génération cellulaire. Cependant, la fusion mitochondriale garde une importance dans son rôle d’échange de protéines et complexes protéiques (dont respiratoires), et de nucléoïdes, ainsi que celui de transmission du potentiel de membrane d’une mitochondrie à l’autre 11.
Fission et fusion s’équilibrent afin d’établir un réseau mitochondrial à connectivité optimisée. Le transport des mitochondries permet d’approvisionner les différentes zones de la cellule en produits mitochondriaux, notamment ceux issus de la respiration.
Il est aujourd’hui impossible d’associer de manière dichotomique un phénotype mitochondrial (par exemple, « fractionné » ou « fusionné ») à un niveau de demande énergétique. La fusion mitochondriale permet de mélanger le contenu mitochondrial et génère un réseau mitochondrial étendu à travers la cellule ; en parallèle, la fission permet d’engendrer des mitochondries de petite taille, plus facilement transportées à travers la cellule vers les régions de forte demande énergétique. L’équilibre entre fission et fusion résulte peut-être d’une réponse à la régionalisation de la demande en ATP dans la cellule. Notamment, les mitochondries de petite taille peuvent se relocaliser vers des compartiments à forte demande énergétique dans la migration cellulaire : l’arrière de la cellule (l’uropode), qui se contracte lors de la migration dite amiboïde des lymphocytes T 1, ou encore l’avant en extension de cellules cancéreuses mésenchymateuses 2. Ces exemples, qui révèlent l’importance de la taille et la localisation des mitochondries dans la physiologie cellulaire, contribuent à relier notre connaissance des mécanismes de fission, de fusion et de transport mitochondriaux aux observations des pathologies mitochondriales humaines.
En savoir plus
En plus des références citées dans le texte, voici quelques articles en français et librement accessibles au sujet de la dynamique des mitochondries.
- Castanier, C., and D. Arnoult. 2010. La dynamique mitochondriale au cours de l'apoptose. Med Sci (Paris). 26:830–835. doi:10.1051/medsci/20102610830.
- Lenaers, G., P. Amati-Bonneau, C. Delettre, A. Chevrollier, C. Verny, D. Miléa, V. Procaccio, D. Bonneau, C. Hamel, and P. Reynier. 2010. De la levure aux maladies neurodégénératives. Dix ans d’exploration des pathologies de la dynamique mitochondriale. Med Sci (Paris). 26:836–841.
- Sauvanet, C., L. Arnauné-Pelloquin, C. David, P. Belenguer, and M. Rojo. 2010. Dynamique et morphologie mitochondriales: Acteurs, mécanismes et pertinence fonctionnelle. Med Sci (Paris). 26:823–829. doi:10.1051/medsci/20102610823.