Chez les unicellulaires, la taille des différents individus varie peu au sein d'une espèce donnée. Chez les pluricellulaires, les cellules composant un même tissu présentent également des tailles comparables. Quels mécanismes régulent la taille des cellules, durant le cycle cellulaire ou en réponse à des variations de l'environnement ?
Qu’est-ce qui régule la taille cellulaire?
L’observation minutieuse de différents types cellulaires révèle non seulement la grande diversité de formes qui existent, rattachées à des fonctions physiologiques particulières, mais également que les cellules appartenant à un même type cellulaire présentent une taille similaire pour un environnement nutritif fixé. En effet, pour un type cellulaire donné, la variance de la taille des cellules, qui traduit la dispersion de leurs tailles autour de la valeur moyenne, est relativement faible et stable au cours des générations. Cette observation suggère que les cellules sont capables de contrôler précisément leur volume. Quels sont les mécanismes qui régulent la taille cellulaire et expliquent ainsi la faible variance de taille constatée au sein d’un même type cellulaire ?
La taille d’une cellule en conditions physiologiques est en particulier régie par des facteurs intrinsèques d’origine génétique, qui sont propres à l’organisme et au type cellulaire. Elle dépend également de facteurs environnementaux : son accès aux nutriments, aux facteurs de croissance présents autour. En effet, la croissance cellulaire est extrêmement coûteuse en énergie et repose sur le métabolisme de base de la cellule, c’est-à-dire les besoins énergétiques « incompressibles ». Ces derniers augmentent avec l’augmentation de volume, et la capacité de la cellule à répondre à ces besoins énergétiques va contraindre cette augmentation de volume.
Par ailleurs, la taille et la forme que peut prendre une cellule sont contraintes par des phénomènes physiques. De nombreuses fonctions cellulaires reposent sur la diffusion ou le transport de molécules d’un compartiment à un autre et sont donc dépendantes de la taille de la cellule. La seconde contrainte physique qui pèse sur la taille d’une cellule est la capacité de celle-ci à échanger avec le milieu extérieur. L’intensité de ces échanges est régie par le rapport entre la surface de la membrane plasmique et le volume cellulaire.
Pour répondre à ces contraintes physiques, différents processus, opérant à différentes échelles de temps, permettent de contrôler la taille des cellules. Il s’agit en particulier du contrôle :
- du flux osmotique ;
- du cycle cellulaire ;
- et de l'équilibre entre synthèse et dégradation de composants cellulaires.
La régulation des flux d’eau entre la cellule et le milieu extérieur est importante pour l’homéostasie du volume cellulaire à courte échelle de temps (minutes). Dans des conditions physiologiques fixées, et donc sur des temps longs (plusieurs dizaines d’heures), la taille d’une cellule d’un type cellulaire spécifique peut varier dans deux contextes.
D’une part, dans le cas de la prolifération cellulaire, les cellules se divisent en deux à chaque cycle et il faut un mécanisme qui permette que les cellules petites à la naissance croissent suffisamment avant de se diviser à nouveau. On parle dans ce cas du couplage entre la croissance et la division.
D’autre part, la majorité des cellules, quel que soit leur état (cellule proliférative ou quiescente), synthétisent et dégradent en permanence des macromolécules pour assurer leurs fonctions biologiques. Afin de maintenir leur taille relativement constante, les cellules doivent être capables d’ajuster la balance entre la synthèse et la dégradation des molécules qui les composent. Cette régulation se fait en fonction de leurs besoins ou en réponse à un stimulus, par exemple des facteurs de croissance. Ainsi la croissance cellulaire et la division cellulaire sont deux mécanismes indépendants, qui requièrent leurs propres signaux, mais qui peuvent être couplés.
Régulation de la taille d’une cellule face à des changements de l’environnement
Sur des temps très courts, la cellule peut adapter son volume grâce aux réservoirs de membranes et au transport transmembranaire d’eau et d’ions
Sur des temps très courts (minutes), une cellule peut être exposée à des changements dans son milieu environnant, comme de légers changements de composition. Par exemple, le changement d’osmolarité du milieu (changement de concentrations des espèces chimiques présentes dans le milieu aqueux, appelés osmolytes et ici principalement représentés par les ions) peut entraîner une pression dite osmotique sur la cellule ; ceci va avoir un impact sur sa taille, à travers des entrées ou sorties passives d’eau par ses aquaporines. En effet, si le milieu extérieur est plus concentré que le milieu intracellulaire (choc hypertonique), la cellule va avoir tendance à perdre de l’eau de son volume cellulaire jusqu’à ce que la concentration des solutés non traversants soit similaire au sein et en dehors de la cellule. Au contraire, si le milieu extérieur est plus faiblement concentré que le milieu intracellulaire (choc hypotonique), le volume de la cellule s’accroît. Cette augmentation du volume est limitée par la capacité de la membrane cellulaire à s’étirer. Elle est également contenue grâce au cortex d’actomyosine qui tapisse la face interne de la membrane plasmique et qui permet à la cellule de résister mécaniquement à l’augmentation de la pression intracellulaire. Si la différence de concentrations est trop importante, la cellule peut soit mourir, complètement « recroquevillée » par la diminution de son volume (choc hypertonique), ou simplement éclater car sa membrane va se rompre (choc hypotonique).
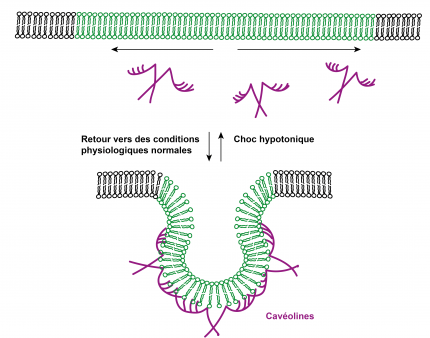
Les cellules animales peuvent résister aux chocs hypotoniques grâce à des réservoirs de membrane, appelés aussi cavéoles. Il s’agit de repliements de la membrane stabilisés entre autres par des protéines, les cavéolines, lorsque la cellule se trouve en conditions physiologiques normales. Lors de l’augmentation de volume de la cellule suite à un choc hypotonique, les cavéolines se désassemblent ce qui permet une augmentation de la surface membranaire et ainsi une adaptation à l’augmentation du volume cellulaire.
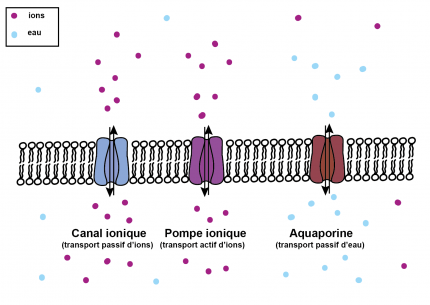
Pour s'adapter à un changement de pression osmotique environnante, la cellule peut importer de l'eau grâce aux aquaporines. Elle peut aussi minimiser un différentiel de pression osmotique sans changer son volume en faisant entrer et sortir des ions grâce à des pompes ioniques.
Au contraire, pour contrer une augmentation de la concentration intracellulaire suite à un choc hypertonique, la cellule possède des canaux et des pompes ioniques qui, de manière respective, peuvent faire passivement et activement entrer ou sortir des ions de la cellule. La concentration intracellulaire se rapproche alors de celle du milieu extérieur, sans qu’il y ait besoin d’un transfert d’eau pour rétablir l’équilibre (c’est-à-dire pour minimiser la pression osmotique). La plupart des cellules de mammifères, après une modification de leur volume initial suite à un choc osmotique, sont capables de retrouver leur volume initial en un temps typique d’une dizaine de minutes.
Ces changements rapides de volume modifient dynamiquement la mécanique des cellules et ont des conséquences sur des fonctions physiologiques cellulaires
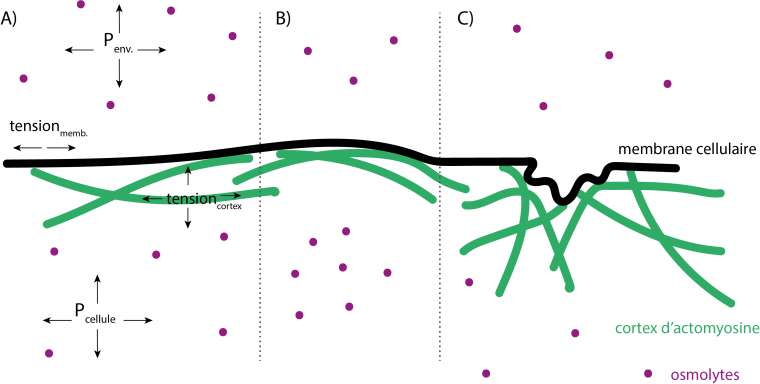
Ces dynamiques de changement de taille se font sur des temps très courts (quelques minutes). Le différentiel de pression osmotique à travers la membrane cellulaire influe donc sur la pression hydrostatique au sein de la cellule (force de tension appliqué par l’eau sur la membrane et le cortex). Cette dernière, relative aux échanges d’eau de la cellule avec son environnement et à ses variations de volume, va avoir un impact majeur sur les propriétés mécaniques de la cellule. En effet, la tension cellulaire dépend à la fois de la tension au niveau de sa membrane (qui peut être modifiée par un choc hyper ou hypo osmotique), et de la tension de son cortex, formé d’un réseau contractile de filaments d’actine ramifiés et non ramifiés et de myosine reliés à la membrane cellulaire. Comme le cortex est lié à la membrane, un changement de pression hydrostatique applique une tension sur la membrane, qui à son tour applique une tension sur le cortex d’actomyosine. Au-delà d’un certain seuil, la capacité du cortex à se contracter et à contrer cette tension est dépassée. En dessous de cette valeur seuil, la pression hydrostatique est suffisamment faible pour permettre au cortex d’actomyosine de se contracter, ce qui permet à la cellule d’adopter des formes spécifiques.
A) La différence de pression (osmotique) à travers la membrane va influencer la pression hydrostatique de la cellule (Pcellule) par les entrées et sorties d'eau. Cette dernière va impacter la tension de la membrane mais également celle du cortex d'actomyosine. (B) Par exemple, une forte différence de pression osmotique peut entraîner une augmentation de la pression hydrostatique au sein de la cellule qui va appliquer une force de tension sur la membrane et le cortex (courbures). (C) Tant que la tension appliquée à la membrane et au cortex est inférieure à un certain seuil, le cortex d'actomyosine est capable de changer la forme de la cellule.
Dynamique de la taille de la cellule au cours du cycle cellulaire
Sur des temps plus longs, la cellule peut augmenter sa taille grâce à la croissance
Il existe également des dynamiques de changement de taille sur une échelle de temps plus longue, celle du cycle cellulaire, avec à la fois des processus de croissance et de division cellulaires.
Pour maintenir une homéostasie de taille au cours des générations, la taille d’une cellule en prolifération double avant qu’elle ne se divise en deux cellules filles, qui posséderont donc la même taille que celle de la cellule mère initiale. Chez les procaryotes, ce processus prend environ 20 minutes alors que chez les Eucaryotes, la gamme de durées est beaucoup plus large selon les espèces et les types cellulaires : entre 1 h 30 et 2 h pour les levures, entre 16 h et 24 h pour des fibroblastes humains.
Avant d’entrer en mitose, le volume de la cellule augmente jusqu’à atteindre le double de sa taille initiale. Or, une cellule est composée principalement d’eau (70 %) mais aussi de masse sèche (30 %) et ce ratio est constant au cours du cycle cellulaire. Le fait que la densité des différents composants cellulaire soit relativement constante au sein de la cellule est permis par le couplage entre augmentation de masse et augmentation de volume, par des mécanismes qui sont encore peu compris. La densité des composants cellulaires est un paramètre qui semble être extrêmement contrôlé, car un léger changement peut perturber les réactions chimiques intracellulaires. En effet, une quantité trop ou pas assez importante de protéines pourrait interférer avec leur diffusion, ce qui pourrait donc modifier les processus chimiques intracellulaires.
Finalement, il existe un continuel équilibre entre la synthèse de protéines, la masse totale de protéines et la quantité d’eau apportée par le flux osmotique dans ces mécanismes de régulation de la croissance et de la taille cellulaires.
Contrôle de la variance de la taille cellulaire : quels sont les mécanismes permettant à la cellule de « sentir » sa taille?
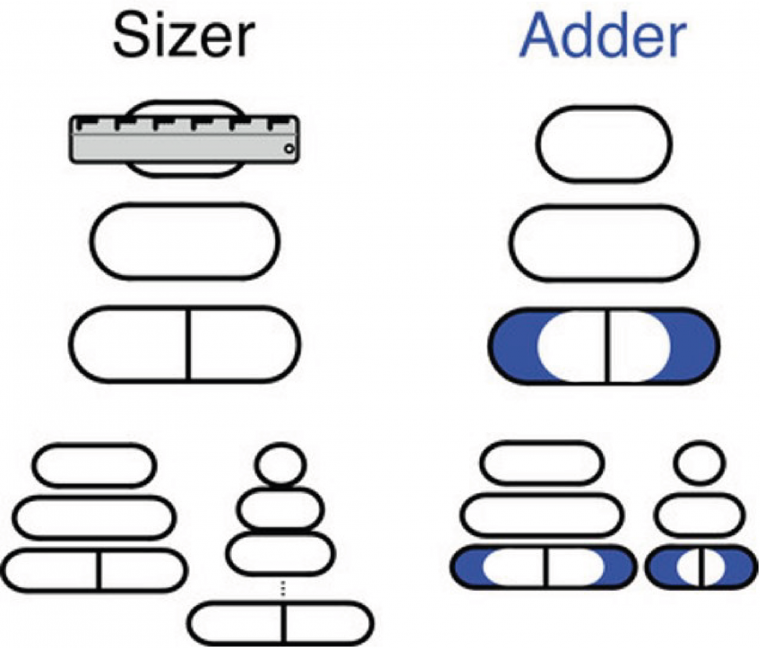
Deux modèles généraux existent pour décrire la régulation de la taille cellulaire
Il existe actuellement deux types de modèles décrivant les mécanismes par lesquels la cellule serait capable de réguler sa taille :
-
Le modèle sizer : il considère que les cellules se divisent à des tailles précises et qu’elles seraient donc capables de réaliser une mesure de leur taille absolue.
-
Le modèle adder : il propose que les cellules se diviseraient après un incrément de taille constant. Ce modèle se différencie du modèle sizer par deux aspects : 1) la taille initiale de la cellule mère va impacter la taille finale des deux cellules filles ; 2) l’augmentation de taille (ici appelé incrément de taille) au cours de la croissance est constante. Ainsi au fur et à mesure des générations et des divisions cellulaires, la cellule converge vers la moyenne de la population. Ce système assure automatiquement l’homéostasie de la taille.
D’après le modèle sizer, les cellules se divisent une fois qu’elles mesurent une certaine longueur (symbolisée par la règle). Dans le modèle adder, les cellules se divisent une fois qu’elles se sont agrandies d’un volume fixé (en bleu), indépendant de leur taille initiale. Les comportements respectifs d’une grande cellule et d’une petite cellule dans chacun des modèles sont présentés dans la partie inférieure du schéma.
Pour réaliser le contrôle de leur taille, les cellules modulent la durée de leur cycle et/ou leur vitesse de croissance
Le cycle cellulaire
Le cycle cellulaire est divisé quatre phases : la phase G1 a lieu immédiatement après la division et est une phase où la cellule croît. À la suite, la cellule duplique son matériel génétique pendant la phase S. Une seconde période de croissance s’ensuit (phase G2) avant que n'intervienne la mitose, ou phase M, où l’ADN condensé est réparti dans deux cellules filles, qui posséderont la même quantité de matériel génétique.
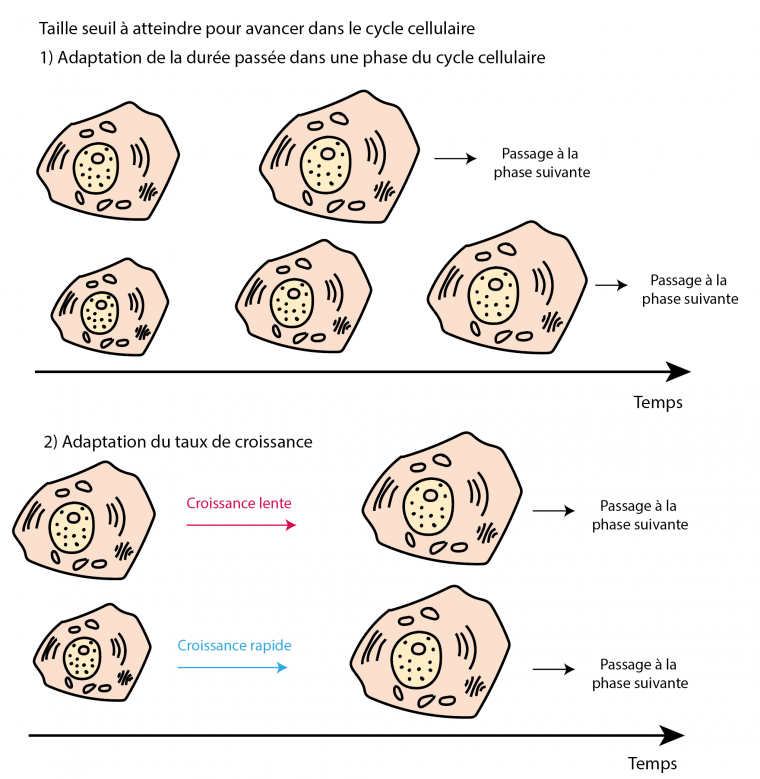
Le contrôle de la taille est compliqué par le fait que la plupart des cellules croissent de manière exponentielle, c’est-à-dire que, en moyenne, plus les cellules sont grandes, plus elles grandissent vite. Dans ce cas, les cellules ont deux manières de réaliser un contrôle de la taille. Une première option est que les petites cellules grandissent plus longtemps que les grandes afin d’atteindre leur taille critique (modèle sizer) ou un incrément de taille constant (modèle adder) : il y a modulation de la durée du cycle. Une seconde option est que les petites cellules grandissent plus vite que les grandes cellules (à un taux exponentiel plus élevé que les grandes) : il y a modulation de la vitesse de croissance (Figure 5).
Les résultats expérimentaux suggèrent que les cellules de levures et de mammifères possèdent un mécanisme de contrôle de type sizer en phase G1 pour ensuite entrer en phase S. De nombreux résultats chez les cellules animales et les levures ont montré que ce sizer est obtenu par une modulation de la durée de la phase G1 en fonction de la taille des cellules, alors que la régulation de la vitesse de croissance est une hypothèse sur laquelle les chercheurs et chercheuses travaillent encore. Cet exemple de maîtrise du cycle cellulaire peut être rattaché à un modèle de sizer ou d’adder selon les types cellulaires.
Une taille précise peut être obtenue soit par la modification de la durée des phases du cycle cellulaire, soit par la modification du taux de croissance au cours du cycle cellulaire.
Cette régulation active la progression des cellules dans leur cycle cellulaire (maîtrise du temps de résidence dans une phase en particulier), nécessite que les cellules possèdent un moyen de « mesurer », de « sentir » leur taille de manière précise. Certains de ces mécanismes seront introduits et illustrés dans la partie qui suit.
Exemples de mécanismes moléculaires permettant aux cellules de maîtriser leur cycle cellulaire
Selon les espèces, différents mécanismes peuvent être impliqués et les exemples suivants ne sont pas exhaustifs.
Premièrement, certains types cellulaires utilisent la titration de la concentration d’une protéine, le plus souvent un inhibiteur du cycle cellulaire, dont la quantité totale reste constante au cours de la croissance cellulaire. Cette protéine est donc présente à une quantité fixe dès la formation de la cellule suite à une mitose mais, comme sa quantité ne change pas au cours de la croissance cellulaire, sa concentration diminue au cours de celle-ci. Une fois une certaine concentration seuil atteinte, la quantité de la protéine inhibitrice n’est plus suffisante pour permettre le blocage du cycle cellulaire. Ce mécanisme semble être employé chez les cellules de levure et d’épiderme de mammifères où la protéine Whi5, respectivement Rb, inhibant le cycle cellulaire, serait produite initialement en haute quantité en phase S-G2, indépendamment de la taille de la cellule. Les cellules les plus petites vont donc rester plus longtemps en G1, le temps que la concentration de Whi5 / Rb décroisse suffisamment pour atteindre une valeur seuil à partir de laquelle son effet est levé par son inhibiteur Cln3 / p107. Dès lors, ce dernier serait capable de l’inhiber complètement et d’initier cette transition dans le cycle cellulaire.
Secondement, d’autres stratégies peuvent être adoptées comme l’établissement de gradients moléculaires au sein des cellules. En effet, chez les bactéries en forme de bâtonnet, la régulation de la taille cellulaire pourrait impliquer une mesure de la longueur de la cellule, grâce à des gradients intracellulaires des protéines régulatrices du cycle cellulaire. Dans ce cas, ces protéines régulatrices seraient produites depuis un emplacement subcellulaire précis et diffuseraient dans la cellule. En dessous d’une certaine concentration, la cellule détecterait que la source émettrice de ces protéines est suffisamment loin (longueur caractéristique) pour que ces protéines ne soient suffisamment concentrées pour être détectées, initiant ainsi la division cellulaire.
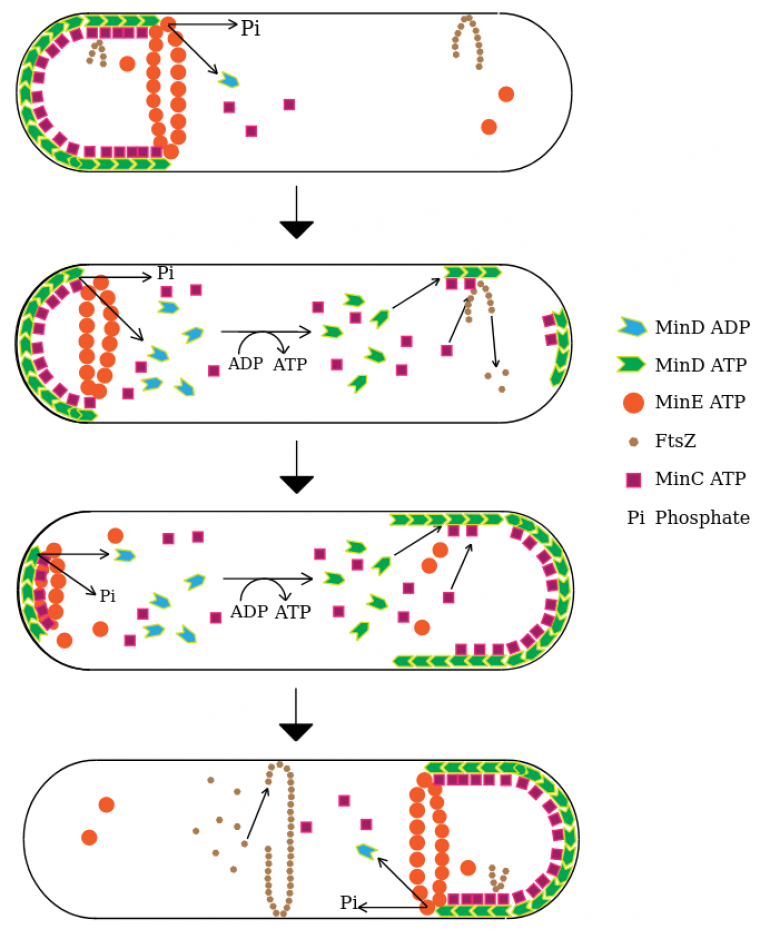
Ce mécanisme est illustré dans la régulation de la taille chez la bactérie Escherichia coli par le trio de protéines Min D, Min C et Min E qui, par leur interaction, vont confiner le divisome au centre de la cellule. Le divisome est composé principalement de protéines FtsZ, homologues structurels de la tubuline, qui vont grâce au GTP s’autoassembler en polymères sous forme d’anneau (anneau Z). Ceci va permettre la formation du septum, la paroi transversale formée au cours de la division cellulaire, entraînant ainsi la cytokinèse de la cellule en deux cellules filles.
Le système MinCDE agirait de la manière suivante pour réguler spatialement la taille cellulaire. MinD, lorsqu’il est lié à l’ADP, est sous forme de monomère soluble. Il possède la capacité de se dimériser en échangeant l'ADP pour de l’ATP, ce qui lui permet alors de se lier à la membrane dans des régions spécifiques, des microdomaines composés de cardiolipides. Ces microdomaines seraient présents dans la membrane à des régions où elle est courbée, ainsi MinD serait préférentiellement recruté aux pôles de la cellule.
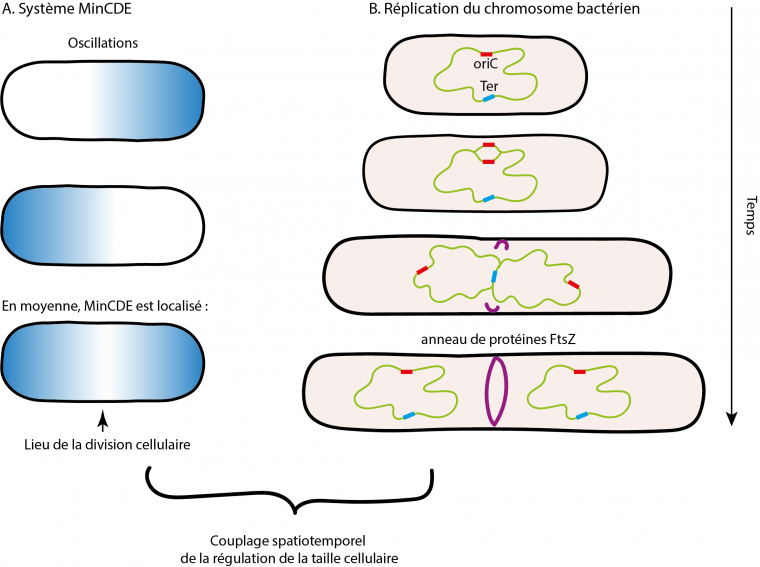
MinE, sous forme de dimère en conformation fermée, diffuserait également librement dans le cytoplasme, jusqu’à rencontrer un dimère MinD lié à l’ATP et à la membrane. Cette interaction va changer sa conformation vers une position ouverte, formant alors deux dimères asymétriques MinDE. Cette liaison déclencherait l’hydrolyse de l’ATP lié à MinD, induisant sa monomérisation et son détachement de la membrane ; il diffuserait alors, et pourrait être recruté au pôle opposé. MinE pourrait se réassocier avec d’autres dimères MinD environnants ou se détacher de la membrane et à son tour diffuser en conformation fermée. Ce mécanisme assurerait l’accumulation de MinE dans les régions où MinD est fortement concentré et donc le détachement de MinD. Ainsi, cette dynamique moléculaire pourrait expliquer que l’on observe une expression oscillante de MinD au niveau des deux pôles (extrémités) de la bactérie E. coli. La robustesse de cette oscillation aux pôles pourrait reposer sur différents mécanismes : la présence de signaux spécifiques aux pôles (composition lipidique) ou la courbure de la membrane.
Or la protéine MinD recrute également à son emplacement la protéine MinC. De fait, MinC n’est pas nécessaire à la génération de ce motif oscillant mais il est important car il inhibe la formation du divisome (l’anneau de FtsZ). Ainsi, chaque pôle accumulerait une concentration d’inhibiteur qui est périodiquement démantelée et au cours de la croissance cellulaire, et la concentration de MinC serait en moyenne de plus en plus basse au centre de la bactérie. Passé une longueur caractéristique, la concentration de MinC au centre de la cellule serait trop faible pour inhiber la mise en place de l’anneau FtsZ au niveau du centre, entraînant ainsi la septation puis la cytokinèse de la bactérie à une longueur précise. Ce système dynamique est un système de réaction-diffusion et reflète une instabilité dite de Turing, où MinD est autocatalytique et recrute son propre inhibiteur MinE. La petite taille des bactéries permet en effet l’exploration efficace de l’espace intracellulaire par diffusion, ce qui en fait de bons candidats pour utiliser les systèmes de réaction-diffusion de ce type pour réguler leur taille cellulaire.
Ce mécanisme de régulation spatiale de la taille cellulaire semble être également couplé à une régulation temporelle. Pour la comprendre, il est nécessaire de rappeler que la réplication du chromosome bactérien se fait depuis une seule origine chromosomique de réplication (oriC) vers un site de terminaison (Ter). Au fur et à mesure de la réplication, les deux chromosomes ségrègent chacun d’un côté de la cellule en laissant en son centre la région Ter (Figure 5).
La régulation temporelle de la taille cellulaire chez les bactéries est permise par des protéines, appelées facteurs d’occlusion du nucléoïde, qui se lient à des sites de liaison spécifiques répartis tout le long du chromosome bactérien, à l’exception de la région Ter. Ces protéines (nommées SlmA chez E.coli et noc chez B. subtilis) empêchent l’assemblage de l’anneau FtsZ jusqu’à ce que les fourches de réplication atteignent la région Ter. Ce mécanisme permettrait d’assurer la ségrégation des chromosomes avant la division de la cellule. Expérimentalement, lorsque des sites de liaison aux facteurs d’occlusion du nucléoïde sont ajoutés à la région Ter, la division cellulaire est retardée et les cellules sont alors plus grandes.
Conclusion
La taille cellulaire est variable selon les types cellulaires mais peu de variation existe au sein d’un même type cellulaire. En réponse à des contraintes physiques et afin de réaliser leurs fonctions physiologiques, les cellules sont capables d’ajuster leur taille via des mécanismes opérant sur des temps courts et des temps longs.
En effet, face aux changements rapides de l’environnement, les cellules sont capables de maintenir leur homéostasie de volume grâce à des réservoirs de membrane et en régulant les flux d’eau et d’ions au niveau de leur membrane. Nous avons vu que ces mécanismes pouvaient être actifs ou passifs, et avaient une influence sur les forces s’exerçant au niveau des cellules, forces qui conditionnent leurs formes. Sur des temps longs, la taille d’une cellule d’un type cellulaire spécifique variera principalement dans le contexte du couplage entre la croissance cellulaire, reposant d’une part sur la synthèse de masse sèche et d’autre part sur l’augmentation du volume, et la division cellulaire, au cours du cycle cellulaire.
Dans une seconde partie, nous avons vu que différents modèles pouvaient décrire la minimisation de la variance de taille pour un type cellulaire donné et nous avons essayé de voir plus en détail des résultats expérimentaux illustrant la régulation du cycle cellulaire pour atteindre une taille donnée, et les mécanismes moléculaires (titration d’une concentration, gradients intracellulaires) permettant aux cellules d’évaluer leur taille.
Références
- Amodeo, A.A., Skotheim, J.M., 2016. Cell-Size Control. Cold Spring Harb Perspect Biol 8. https://doi.org/10.1101/cshperspect.a019083
- Cadart, C., Venkova, L., Recho, P., Lagomarsino, M.C., Piel, M., 2019. The physics of cell-size regulation across timescales. Nat. Phys. 15, 993–1004. https://doi.org/10.1038/s41567-019-0629-y
- Lecuit, T., Cours 2020 «Taille, croissance et organisation cellulaires», Collège de France https://www.college-de-france.fr/site/thomas-lecuit/course-2020-2021.htm
- Lloyd, A.C., 2013. The Regulation of Cell Size. Cell 154, 1194–1205. https://doi.org/10.1016/j.cell.2013.08.053
- Ramm, B., Heermann, T., Schwille, P., 2019. The E. coli MinCDE system in the regulation of protein patterns and gradients. Cell Mol Life Sci 76, 4245–4273. https://doi.org/10.1007/s00018-019-03218-x
- Son, S., Tzur, A., Weng, Y., Jorgensen, P., Kim, J., Kirschner, M.W., Manalis, S.R., 2012. Direct observation of mammalian cell growth and size regulation. Nat Methods 9, 910–912. https://doi.org/10.1038/nmeth.2133
- Wu, L.J., Errington, J., 2012. Nucleoid occlusion and bacterial cell division. Nature Reviews Microbiology 10, 8–12. https://doi.org/10.1038/nrmicro2671