L’endosymbiose est un type particulier de symbiose1, c’est-à-dire d’association durable à bénéfices réciproques entre deux êtres vivants, où l’un est situé à l’intérieur des cellules de l’autre. Selon la théorie endosymbiotique, la cellule eucaryote serait issue de différents événements d’endosymbiose. De nombreuses associations endosymbiotiques peuvent être observées entre organismes de différents taxons et jouent un rôle important dans le fonctionnement des écosystèmes. Leur étude peut apporter un éclairage sur les grandes étapes ayant conduit à la mise en place de la cellule eucaryote.
Les arguments en faveur d’une origine endosymbiotique des organites
Différentes comparaisons effectuées entre mitochondries, plastes et procaryotes montrent que les mitochondries et les plastes dérivent de bactéries internalisées dans une cellule eucaryote primitive.
Des ressemblances structurales
Plusieurs ressemblances structurales plaident en faveur d’une origine bactérienne des plastes et mitochondries :
- La taille des plastes et des mitochondries, de l’ordre du micromètre, est comparable à celle de nombreuses bactéries.
- Ces organites sont généralement entourés de deux membranes, comme leurs ancêtres bactériens.
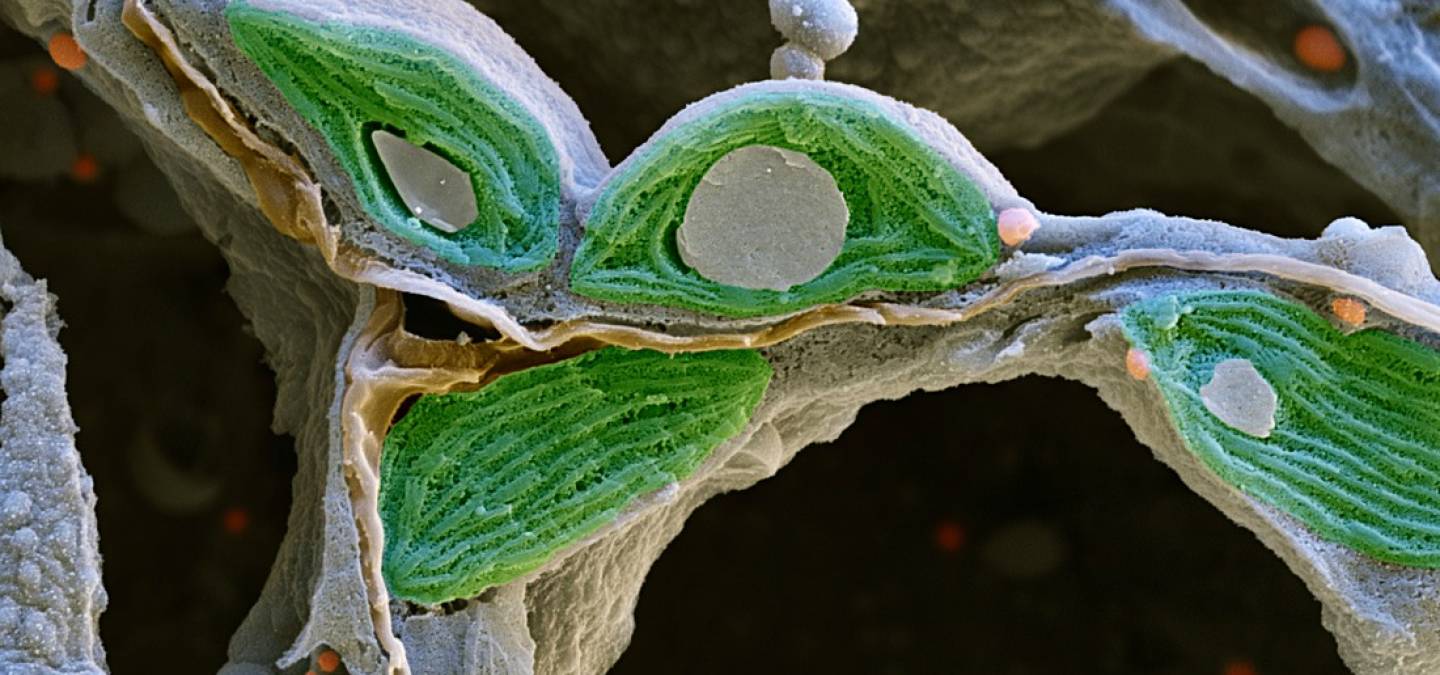
- La comparaison entre une cyanobactérie et un chloroplaste montre plusieurs points communs : présence de thylakoïdes, de ribosomes, d’ADN… (Figure 1)
Par ailleurs, les analyses de phylogénie moléculaire basées sur le gène COX1, présent aussi bien chez les plastes que chez les mitochondries, ont permis de démontrer que les premiers provenaient de cyanobactéries tandis que les secondes étaient issues d’alphaprotéobactéries 1.
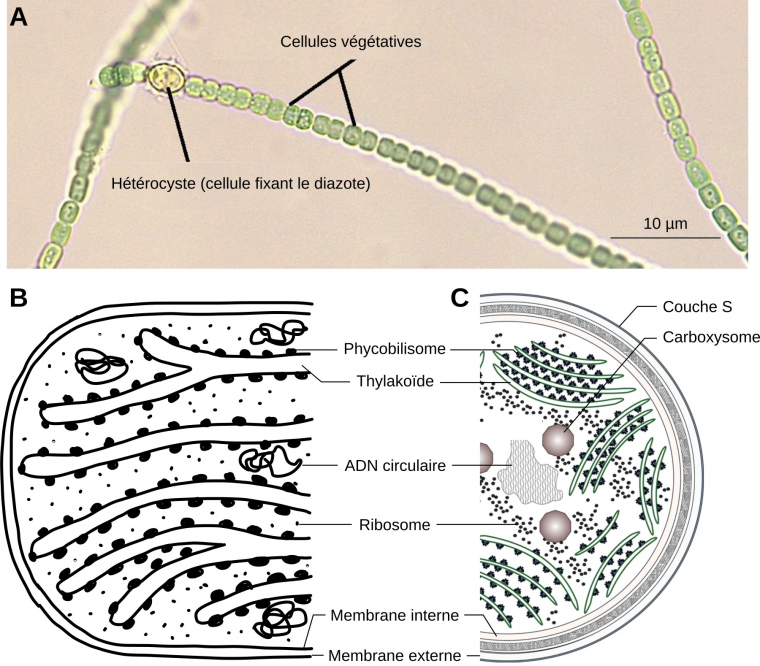
A. Filament de cyanobactéries du genre Anabaena. Les hétérocystes sont des cellules spécialisées dans la fixation du diazote N2. Elles sont plus grandes que les cellules végétatives qui, elles, réalisent la photosynthèse.
B. Détail d’un plaste d’algue rouge.
C. Détail d’une cellule végétative de cyanobactérie.
NB : Sur la figure B, les membranes interne et externe sont représentées avec un seul trait, tandis qu’elles sont délimitées par deux traits sur la figure C.
Source des images : A. Modifié d’après Melissa Ha, ASCCC OERI, CC-BY-NC, Flickr ; B. Jean-François Bonello, CC-BY ; C. Modifié d’après Mills et coll., 2020, CC-BY, Bioscience Reports.
Les bactéries Rhizobium : comme des organites à double membrane au sein des nodosités
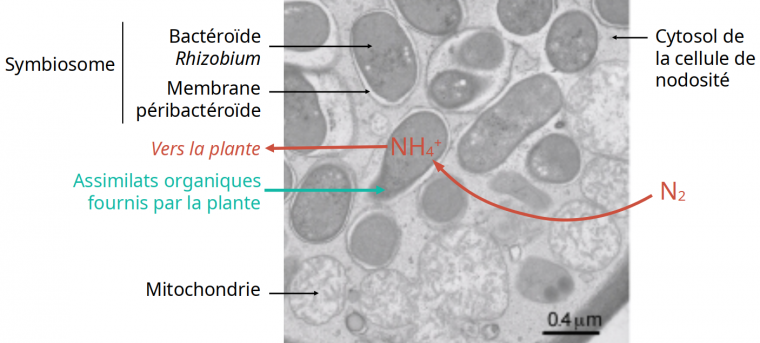
La structure des organites à double membrane, rappelle celle rencontrée dans les cellules de nodosités de Fabacées, où le bactéroïde, issu d’une bactérie symbiotique de la famille des Rhizobiacées, est entouré d’une membrane d’endocytose (Figure 2) 1. Il y a eu ici un phénomène d’endocytobiose (un partenaire est à l’intérieur des cellules de l’autre, entouré d’une membrane d’endocytose) conduisant à une endosymbiose.
La bactérie, grâce à la présence de nitrogénase, fixe le diazote atmosphérique N2 et le réduit en ammonium NH4+ qui est transmis à la plante. La plante fournit quant à elle des composés organiques à Rhizobium.
Les bactéries sont incluses, sous forme de bactéroïdes, dans la membrane péribactéroïde, d’origine végétale. L’ensemble se comporte comme un organite, le symbiosome, spécialisé dans la fixation du diazote venant de l’atmosphère. Selon les espèces hôtes, chaque symbiosome peut contenir une seule ou plusieurs bactéries, soit par fusion de plusieurs symbiosomes, soit par division bactérienne 1.
Des compositions membranaires similaires
Un autre argument en faveur de la théorie endosymbiotique vient du fait que certains lipides de la membrane interne de la mitochondrie ou des chloroplastes sont retrouvés chez certains taxons bactériens, mais pas ailleurs dans la cellule eucaryote. Par exemple, les cardiolipides de la membrane interne mitochondriale sont particulièrement abondants dans la membrane interne des bactéries à Gram négatif.
Enfin, le taux de protéines de la membrane interne des plastes et des mitochondries est élevé, comme celui des membranes bactériennes. En effet, le ratio de la masse des protéines sur la masse des lipides est de l’ordre de 3 pour ces organites, alors qu’il est de l’ordre de 1 pour les membranes plasmiques des cellules eucaryotes.
Une même organisation fonctionnelle du génome
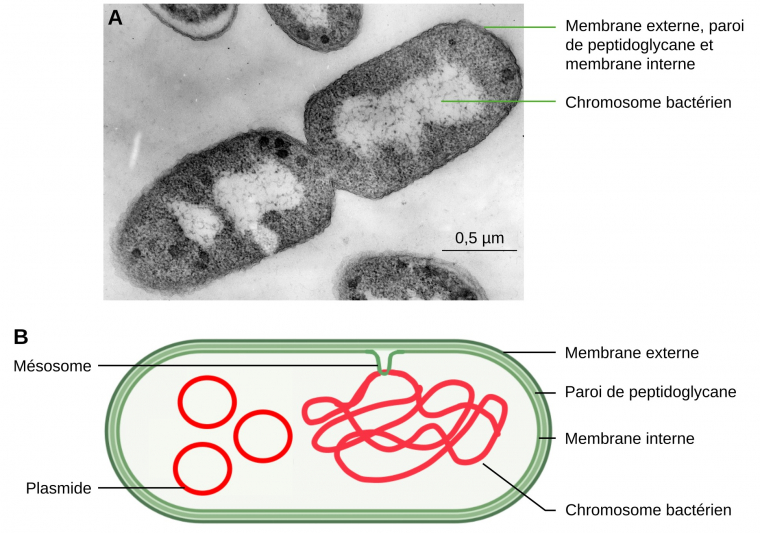
L’argument majeur pour l’origine endosymbiotique des mitochondries et des plastes a été la mise en évidence d’un génome dans ces organites 12. Il s’agit, comme chez les Bactéries, d’une molécule d’ADN circulaire dépourvue d’histones. Cette molécule est présente en plusieurs copies identiques.
De plus, chez les Bactéries, l’ADN est associé à des replis de la membrane interne, appelés mésosomes (Figure 3). De même, l’ADN mitochondrial est associé aux replis de la membrane interne.
Par ailleurs, l’ADN des mitochondries et des plastes est dupliqué et transmis à l’identique lors de la division de l’organite qui s’effectue par bipartition, selon un mécanisme comparable à celui observé chez les Bactéries.
Les génomes des mitochondries et des plastes présentent des points communs avec ceux des Bactéries, comme l’organisation de certains gènes en opérons, où une même région promotrice initie la transcription de plusieurs gènes.
Enfin, les mitochondries et les plastes possèdent des ribosomes qui ont une composition similaire à celle des ribosomes bactériens. Ils ont une constante de sédimentation de 70S, et sont constitués entre autres d’un ARNr 16S dont la séquence est fortement conservée au sein des mitochondries, plastes et bactéries.
A. Bactérie Escherichia coli, en phase de division cellulaire, observée en microscopie électronique à transmission.
B. Schéma d’une bactérie à Gram négatif.
Crédits : A. James D. Jamieson, CC-BY-NC-SA, Cell Image Library ; B. Jean-François Bonello, CC-BY.
C’est sur la base de la présence d’ADN dans les mitochondries et les plastes que Lynn Margulis soumet un article sur l’origine des cellules eucaryotes, d’abord refusé par une quinzaine de revues scientifiques, avant d’être finalement publié en mars 1967 dans le Journal of Theoretical Biology sous son nom de jeune fille Lynn Sagan 1. Elle y explique que les mitochondries proviendraient de l’endocytose de bactéries par un phagocyte primitif et insiste sur les phénomènes de fusion/absorption de cellules au cours de l’évolution. Elle peaufine sa théorie et publie en 1970 un livre qui pose les bases de la théorie endosymbiotique : Origin of eukaryotic cells 2.
Les évènements d’endosymbiose conduisant à la formation des cellules eucaryotes
Pour comprendre les évènements d’endosymbiose, il est nécessaire de bien distinguer les termes d'endocytose, de phagocytose, d’endocytobiose et d’endosymbiose. L’endocytose correspond à un mécanisme actif d’internalisation d’éléments extracellulaires (molécules, virus, cellules ou débris cellulaires) faisant intervenir un transport vésiculaire. Lorsque ces éléments extracellulaires font plus de 0,5 µm on parle de phagocytose et, dans le cas où ces éléments sont des cellules, d’endocytobiose. Lorsque l’endocytobiose conduit à l’établissement d’une relation permanente à bénéfice réciproque entre la cellule hôte et la cellule endocytée, on parle d’endosymbiose.
L’origine des cellules eucaryotes, hôtes de bactéries endosymbiotiques
Lorsque l’on compare les gènes dont les produits sont liés à l’entretien et à l’expression du génome, les plus proches parents des Eucaryotes semblent être les Archées. En revanche, lorsqu’on utilise des gènes du métabolisme, ce sont les Bactéries qui semblent être les plus proches parentes des Eucaryotes. Ainsi, les comparaisons des protéines ayant les mêmes fonctions (protéines orthologues) dans les trois domaines du vivant montrent que les génomes des Eucaryotes contiennent une mosaïque de gènes, certains issus de Bactéries, d’autres d’Archées.
Deux scénarios principaux sont proposés pour la formation des cellules eucaryotes 34. Ils postulent que des procaryotes aient été unis par une relation de syntrophie, c’est-à-dire par une association trophique entre deux partenaires, dont l’un se nourrit des déchets produits par l’autre. De telles associations sont fréquentes au sein de tapis microbiens.
Une syntrophie entre deux types de procaryotes
Plusieurs modèles sont basés sur une syntrophie entre un hôte archéen et un endosymbiote de type alphaprotéobactérien (à l’origine de la mitochondrie). Ces modèles n’expliquent pas facilement l’origine du noyau et ne permettant pas de comprendre pourquoi les membranes plasmiques eucaryotes sont proches des membranes bactériennes et non pas archéennes.
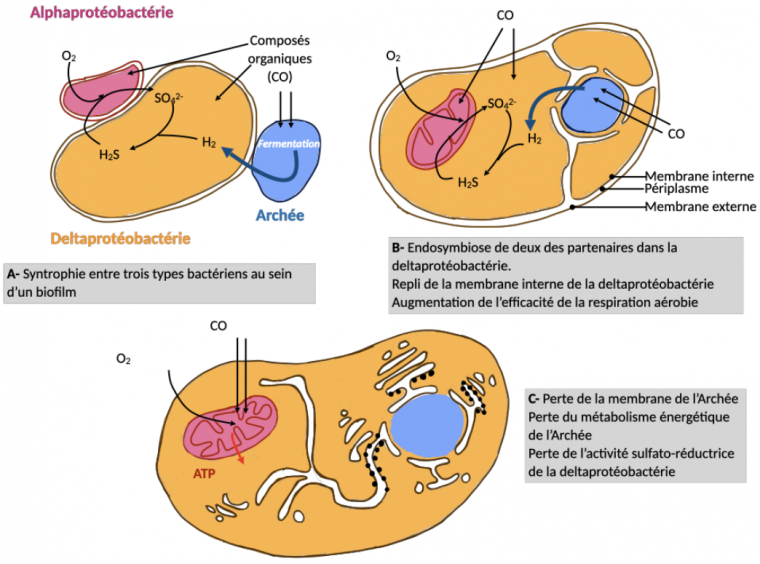
Une syntrophie entre trois types de procaryotes
Un autre modèle propose que la cellule eucaryote ait été formée par syntrophie entre deux types de bactéries et une archée, réunies au sein d’un biofilm (Figure 4) 5.
Dans ce modèle, la matière organique serait produite par photosynthèse en surface du biofilm bactérien par différents types de bactéries dont les cyanobactéries. Une archée dégraderait la matière organique par fermentation et libérerait du dihydrogène H2. Le H2 produit serait recyclé par une deltaprotéobactérie formant du sulfure d’hydrogène H2S à partir du H2 et de sulfates SO42−. Enfin, une alphaprotéobactérie réoxyderait le H2S et fournirait ainsi le SO42− nécessaire à la deltaprotéobactérie.
Au cours du temps, cette syntrophie tripartite serait devenue une symbiose obligatoire entre les trois partenaires et aurait conduit à une endosymbiose de l’archée et de l’alphaprotéobactérie dans la deltaprotéobactérie. L’archée constituerait le futur noyau, l’alphaprotéobactérie la future mitochondrie et la deltaprotéobactérie le futur cytoplasme de la cellule eucaryote.
Le modèle proposé ici vise à expliquer l'émergence de la cellule eucaryote à partir de l'association entre trois types de micro-organismes : une alphaprotéobactérie, une deltaprotéobactérie et une archée. Ces trois types de micro-organismes auraient été unis par une relation de syntrophie, c’est-à-dire par une association trophique dans laquelle les partenaires se nourrissent des déchets les uns des autres. Dans ce modèle, la matière organique serait produite par photosynthèse en surface du biofilm bactérien par différents types de bactéries dont les cyanobactéries. L'archée dégraderait la matière organique par fermentation et libérerait du dihydrogène H2. Celui-ci serait recyclé par une deltaprotéobactérie formant du sulfure d’hydrogène H2S à partir du H2 et de sulfates SO42−. Enfin, une alphaprotéobactérie réoxyderait le H2S et fournirait ainsi le SO42− nécessaire à la deltaprotéobactérie. Au cours du temps, cette syntrophie tripartite serait devenue une symbiose obligatoire entre les trois partenaires et aurait conduit à une endosymbiose de l’archée et de l’alphaprotéobactérie dans la deltaprotéobactérie. Ainsi, le noyau de la cellule eucaryote correspondrait à l’archée, la mitochondrie à l'alphaprotéobactérie et le cytoplasme à la deltaprotéobactérie.
Ce modèle syntrophique pourrait expliquer les différentes signatures génomiques trouvées dans le génome eucaryote 1. En effet, les comparaisons des protéines ayant les mêmes fonctions dans les trois domaines du vivant montrent que les génomes des Eucaryotes contiennent une mosaïque de gènes : certains codent des protéines plus apparentées à des protéines de Bactéries, d’autres à des protéines d’Archées et le reste à des protéines qui semblent spécifiques des Eucaryotes.
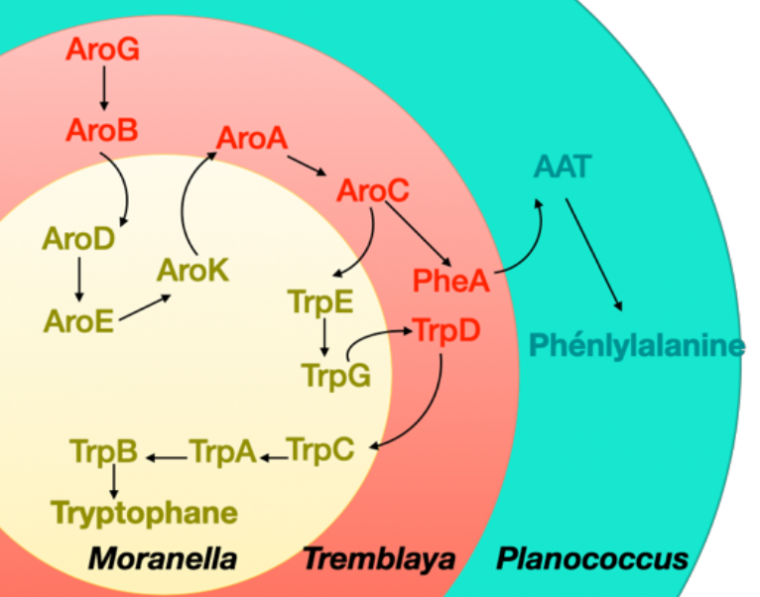
La syntrophie chez la cochenille farineuse du citronnier : un ménage à trois
Des syntrophies tripartites peuvent être observées actuellement, comme celle unissant la cochenille farineuse du citronnier (Planococcus citri) à deux espèces bactériennes. Cette cochenille est un insecte piqueur-suceur qui cause des dommages notamment aux citronniers, aux bananiers et aux orchidées. Elle affaiblit la plante en prélevant sa sève élaborée et produit un miellat qui favorise le développement de champignons. La cochenille abrite non seulement la bactérie intracellulaire Candidatus Tremblaya princeps, mais aussi Candidatus Moranella endobia qui vit dans le cytoplasme de la première. Il y a donc une structure en poupées russes avec trois partenaires imbriqués l’un dans l’autre. Ces partenaires vivent en syntrophie car chacun possède une partie des enzymes nécessaires à la synthèse de deux acides aminés essentiels pour l’insecte : la phénylalanine et le tryptophane (Figure 5) 1.
Les intermédiaires des voies de biosynthèse sont indiqués par leurs initiales à 3 lettres.
L’origine des mitochondries
Les comparaisons de séquences de gènes mitochondriaux de différentes espèces montrent que les mitochondries forment un groupe très homogène. Elles seraient donc issues d’un seul événement d’endosymbiose.
Par ailleurs, la comparaison de ces séquences avec les génomes bactériens révèle que les mitochondries se rapprochent le plus d’un groupe de bactéries à Gram négatif : les alphaprotéobactéries. Alors que des études ont longtemps permis de penser que les mitochondries se rapprochaient le plus des Rickettsiales, des bactéries parasites ou symbiotes obligatoires de cellules eucaryotes, des travaux récents employant des méthodes phylogénétiques plus poussées montrent que les mitochondries ne sont finalement proches d’aucune lignée connue d’alphaprotéobactéries 1.
L’acquisition des mitochondries aurait permis dans un premier temps de lutter contre les effets néfastes du dioxygène, les mitochondries consommant cette molécule lors des réactions de la respiration. En effet, le dioxygène produit des dérivés toxiques tels que les ions superoxyde O2− et l’eau oxygénée, ou peroxyde d’hydrogène, H2O2. De plus, la respiration aérobie permet de produire de grandes quantités d’ATP. L’acquisition des mitochondries aurait donc été sélectionnée favorablement au cours de l’évolution après l’oxygénation des océans et de l’atmosphère qui a débuté il y a 2,4 Ga. Le dioxygène a donc exercé une forte pression de sélection qui a dû stabiliser l’association symbiotique entre des cellules et des bactéries capables de respirer et de convertir l’O2 en eau. On estime ainsi que les mitochondries sont apparues il y a 2 Ga. Selon le modèle de syntrophie, cette date correspondrait à l’apparition des cellules eucaryotes, formées par syntrophie entre des Archées et des Bactéries.
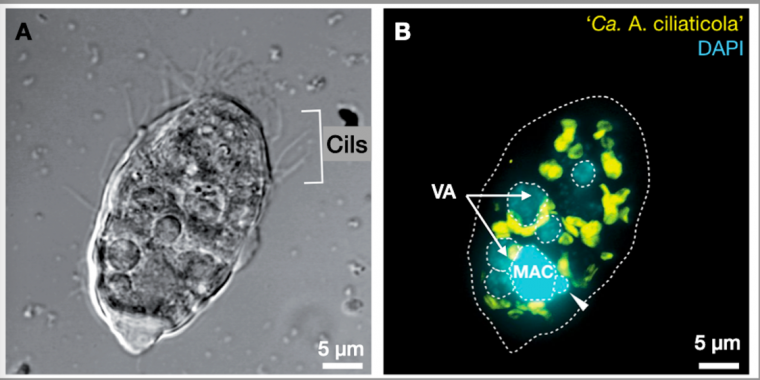
Certains Ciliés possèdent des endosymbiotes agissant comme des substituts de mitochondries en réalisant une respiration anaérobie
Certains Ciliés ne peuvent vivre que dans des conditions anaérobies. Leurs mitochondries ont évolué en hydrogénosomes qui réalisent la fermentation des composés organiques et produisent du dihydrogène H2 et un peu d’ATP.
En plus des hydrogénosomes, ces Ciliés hébergent dans leur cytoplasme des gammaprotéobactéries Candidatus Azoamicus ciliaticola (Figure 6). Ces bactéries endocytées sont capables de réaliser la respiration en utilisant comme source d’électrons le H2 produit par l’hydrogénosome et comme accepteur final d’électrons, les nitrates NO3− qu’elles réduisent en diazote N2. Elles réalisent ainsi un processus de dénitrification. Le transfert d’électrons est associé à une production importante d’ATP comme dans une chaîne respiratoire classique. Une partie de l’ATP produit est fourni à l’hôte et complète ainsi la production d’ATP par l’hydrogénosome.
C’est le seul endosymbiote connu qui assure la production d’ATP comme une mitochondrie, mais en réalisant une dénitrification.
A. Observation au microscope à contraste de phase
B. Observation au microscope confocal après hybridation à l’aide d’une sonde spécifique d’un gène de la bactérie (en jaune) et marquage de l’ADN au DAPI (en cyan).
MAC : macronoyau, flèche blanche : micronoyau, VA : Vacuoles digestives. La bactérie endosymbiotique est colorée en jaune.
L’origine des plastes
Origine des plastes à deux membranes
L’acquisition des plastes s’est produite plus tardivement que celle des mitochondries, comme en témoigne leur moins large répartition au sein des Eucaryotes. Elle se serait effectuée entre 1,2 et 2 Ga.
Le premier événement d’endosymbiose à l’origine de plastes (endosymbiose primaire) s’est produit chez les Archéoplastidés (Figure 8). Les plastes des membres de ce taxon résultent de l’endocytose d’une cyanobactérie par une cellule eucaryote, comme en témoigne la présence de phycobilisomes chez les Glaucophytes et les Rhodophytes (« algues rouges ») 12.
Des études phylogénétiques montrent que les chloroplastes dérivent d’une lignée proche d’un ordre nouvellement décrit de cyanobactéries : les Gloemargaritales. Ainsi, l’apomorphie principale des Archéoplastidés est la présence de plastes à deux membranes contenant de la chlorophylle a.
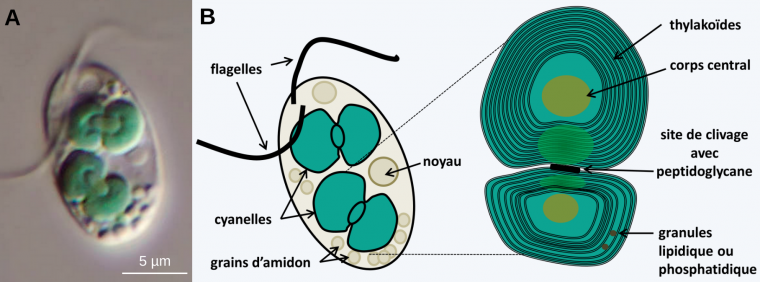
Des observations réalisées chez les Glaucophytes montrent que les deux membranes des plastes des Archéoplastidés sont d’origine bactérienne 3. En effet, chez ces algues unicellulaires d’eau douce, les plastes, appelés cyanelles, présentent une enveloppe qui ressemble beaucoup à celle des cyanobactéries, avec en particulier la présence de peptidoglycane entre les deux membranes, clairement visible au niveau du site de clivage du plaste (Figure 7). Dans ce cas, la membrane d’endocytose aurait disparu.
Chez les Glaucophytes, les chloroplastes sont appelés cyanelles. La présence de peptidoglycane atteste de l'origine bactérienne des chloroplastes.
Source des images : A. Wolfgang Bettighofer, CC-BY-NC-SA, Protisten.de. B. : Philippe Silar, CC-BY-NC-SA, Protistes Eucaryotes, 2016.
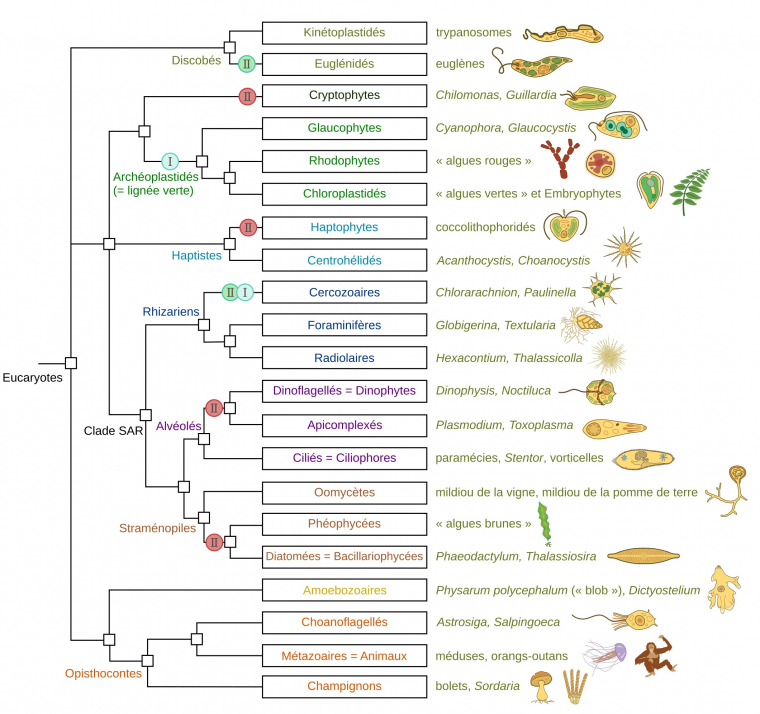
L’arbre montre les principaux groupes d’Eucaryotes (en termes de nombre d’espèces, d’importance écologique ou sanitaire). Les relations de parenté sont données d’après Keeling et Burki, 2019 1. Des exemples ainsi que des illustrations de membres des différents taxons sont donnés à droite.
Les évènements d’endosymbiose sont indiqués sur l’arbre sous forme de ronds contenant un I pour les endosymbioses primaires et un II pour les endosymbioses secondaires. La couleur du rond traduit le type d’organisme endocyté : cyan pour une cyanobactérie, vert pour un membre des Chloroplastidés (« algues vertes »), rouge pour un membre des Rhodophytes (« algues rouges »). Chez les Cercozoaires, les plastes des Chlorarachniophytes sont issus d’une endosymbiose secondaire avec un Chloroplastidé tandis que ceux de Paulinella chromatophora sont issus d’une endosymbiose primaire avec une cyanobactérie.
Les miniatures sont issues de Keeling et Eglit, 2023 2.
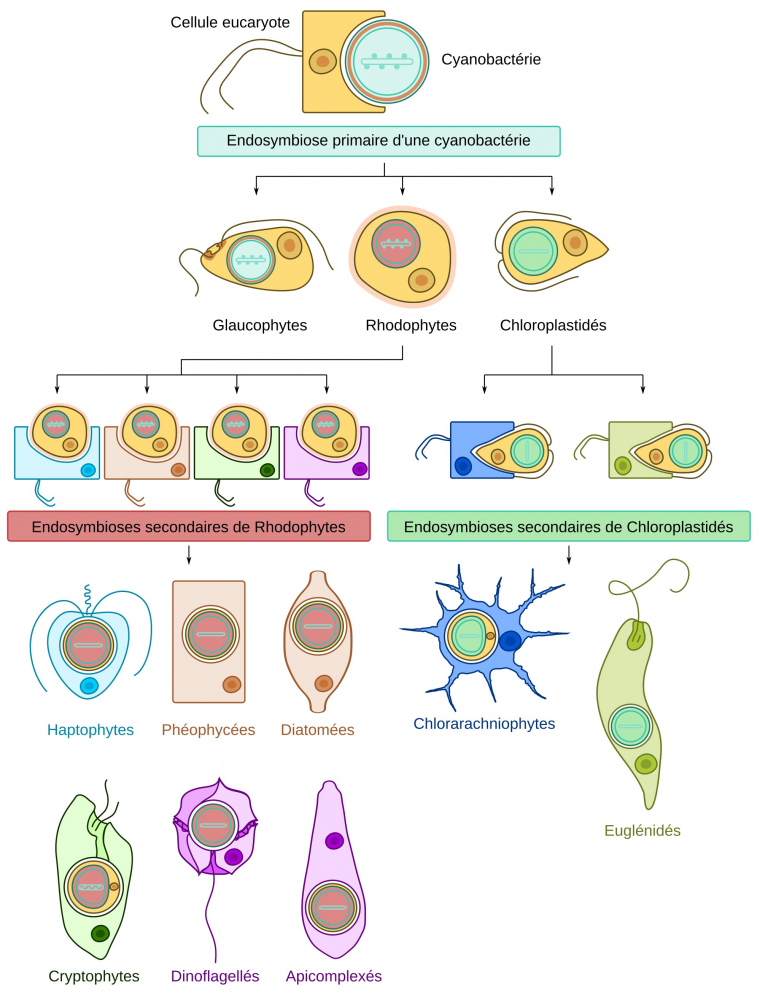
Les plastes des Eucaryotes trouvent leur origine dans l’endosymbiose primaire d’une cyanobactérie par l’ancêtre des Archéoplastidés. La cyanobactérie contenait des thylakoïdes (bleu clair) associés à des phycobilisomes (points bleu clair). Elle était délimité par une membrane plasmique (turquoise) entourée par une paroi de peptidoglycane (marron) et une membrane externe (vert bouteille).
Cette endosymbiose primaire a donné les plastes à deux membranes des Glaucophytes (qui ont conservé la paroi et les phycobilisomes), aux Rhodophytes (qui ont conservé les phycobilisomes) et aux Chloroplastidés. Notez que la membrane d’endocytose n’a pas persisté.
Des endosymbioses secondaires, soit de Rhodophytes, soit de Chloroplastidés, ont ensuite eu lieu dans différentes lignées d’Eucaryotes, représentées par des couleurs de cytoplasme et de membrane plasmique différentes. Ces événements d’endosymbiose secondaire ont logiquement conduit à des plastes à quatre membranes, les deux membranes les plus externes correspondant à la membrane d’endocytose ainsi qu’à la membrane de la cellule endocytée. Dans certains cas, le noyau de la cellule endocytée persiste sous forme de nucléomorphe (Cryptophytes et Chlorarachniophytes). Chez les Dinoflagellés et les Euglénidés, les plastes n’ont que trois membranes, ce qui pourrait s’expliquer par une perte de la membrane de la cellule endocytée. Par ailleurs, chez les Dinoflagellés, le plaste à trois membranes a été remplacé dans plusieurs lignées suite à d’autres événements d’endosymbiose secondaire, voire tertiaire, non représentés ici. Chez les Cryptophytes, les phycobilisomes ne se situent pas du côté du stroma, mais du côté du lumen des thylakoïdes. Chez les Apicomplexés, le plaste n’est pas photosynthétique. Dénommé apicoplaste, il est impliqué dans certaines biosynthèses.
Les proportions du plaste et du noyau par rapport au reste de la cellule ne sont pas respectées.
Les schémas de cellules sont adaptés de Keeling et Eglit, 2023 1.
Origine des plastes à quatre membranes
Les plastes à quatre membranes sont issus d’événement d’endosymbioses secondaires (Figures 8 et 9). Chacun a impliqué l’endocytose, par une cellule eucaryote, d’une autre cellule eucaryote possédant déjà des plastes à deux membranes. Ainsi, les plastes à quatre membranes sont formés, de l’extérieur vers l’intérieur (Figure 10) :
- de la membrane d’endocytose ;
- de la membrane plasmique de la cellule endocytée ;
- des deux membranes correspondant à celles du plaste de la cellule endocytée.
Les plastes à quatre membranes sont présents chez les Phéophycées (« algues brunes »), les Diatomées, les Cryptophytes, les Haptophytes, les Apicomplexés et les Chlorarachniophytes. Chez les Cryptophytes et les Chlorarachniophytes, l’espace située entre la deuxième et la troisième membrane est semblable à un espace cytoplasmique et présente un organite évoquant un noyau réduit, appelé nucléomorphe (Figure 11).
Les plastes à quatre membranes ont été acquis plusieurs fois indépendamment au cours de l’histoire des Eucaryotes. Chez les Cryptophytes, les Haptophytes et les Apicomplexés, ainsi que dans le clade réunissant les Phéophycées et les Diatomées, ils résultent d’endosymbioses secondaires de cellules de Rhodophytes (« algues rouges ») tandis chez les Chlorarachniophytes, les plastes à quatre membranes proviennent de l’endocytose d’un membre des Chloroplastidés (« algues vertes »).
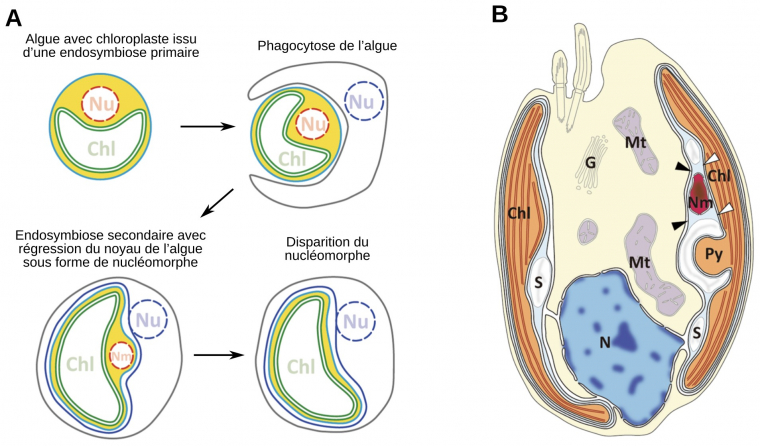
A. Les chloroplastes acquis suite à une endosymbiose secondaire sont issus des chloroplastes d’une algue en possédant suite à une endosymbiose primaire. De tels plastes sont donc entourés de quatre membranes. De l’extérieur vers l’intérieur se trouvent la membrane d’endocytose (bleu foncé), la membrane plasmique de l’algue endocytée, appelée membrane périplastidienne (bleu clair), et les deux membranes du chloroplaste primaire (vert). L’espace en jaune, correspondant au cytoplasme de l’algue endocytée, est appelé espace périplastidien. Un nucléomorphe (Nm), correspondant au noyau (Nu) de l’algue endocytée peut persister (Cryptophytes et Chlorarachniophytes) ou non (Phéophycées, Diatomées, Haptophytes et Apicomplexés).
B. Schéma de l’ultrastructure de la cryptophyte Guillarda theta.
Chl : chloroplaste, G : appareil de Golgi, Mt : mitochondrie, N : noyau, Nm : nucléomorphe, Py, pyrénoïde (structure intraplastidiale permettant de concentrer le CO2 au voisinage de la Rubisco), S : grain d’amidon. Le nucléomorphe est situé entre la membrane externe du chloroplaste (têtes de flèche blanches) et la membrane périplastidienne (têtes de flèche noires)
Les Chlorarachniophytes sont des algues marines unicellulaires. Elles possèdent des chloroplastes acquis par endosymbiose secondaire.
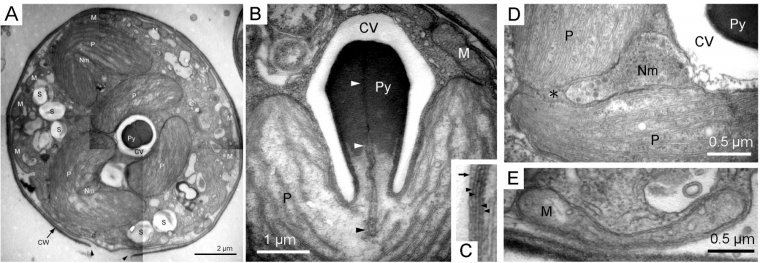
A. Ultrastructure de la cellule entière. Cette cellule contient trois chloroplastes bilobés et de nombreuses mitochondries à proximité de la paroi. Les têtes de flèche indiquent un pore dans la paroi.
B. Coupe longitudinale du pyrénoïde (structure intraplastidiale permettant de concentrer le CO2 au voisinage de la Rubisco) montrant l’invagination des deux membranes les plus internes du chloroplaste dans la matrice du pyrénoïde (têtes de flèche).
C. Détail des membranes du plaste. La flèche indique la membrane d’une vésicule qui coiffe le pyrénoïde. Les têtes de flèche pointent les quatre membranes qui constituent le chloroplaste.
D. Détail du compartiment périplastidien et du nucléomorphe, correspondant respectivement au cytoplasme et au noyau de l’algue endocyté.
E. Mitochondrie tubulaire
CV : vésicule coiffant le pyrénoïde ; CW : paroi ; M : mitochondrie ; Nm : nucléomorphe ; P : plaste ; Py : pyrénoïde ; S : vésicule de stockage de métabolites.
Un cas original : l’endosymbiose d’une algue par un champignon
Il existe des algues eucaryotes vivant en endosymbiose, comme les chlorelles et les xanthelles des Cnidaires ou certaines algues rouges chez les Foraminifères.
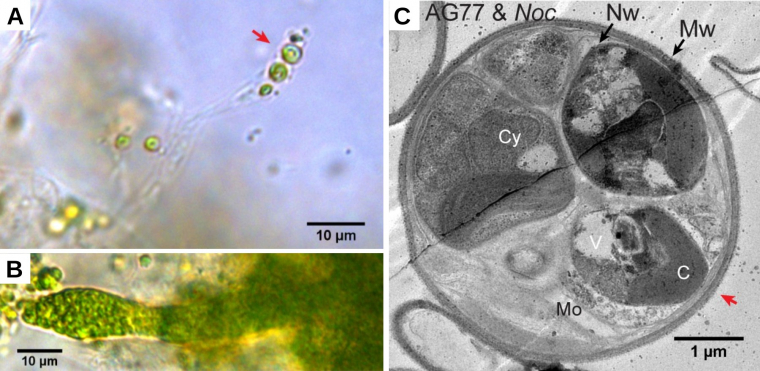
Le champignon Mortierella elongata (champignon à hyphes non cloisonnés) et l’algue marine unicellulaire Nannochloropsis oceanica (Straménopiles), établissent rapidement une association symbiotique lorsqu’ils sont cultivés tous les deux en milieu liquide et sous éclairage continu (Figure 12). L’algue transfère au champignon une partie de la matière organique produite par photosynthèse. Le champignon fournit à l’algue des nitrates NO3−. Au bout d’un mois de culture commune, des algues sont retrouvées à l’intérieur des cellules du champignon. Elles se reproduisent par divisions cellulaires à l’intérieur des cellules du champignon. C’est la seule endosymbiose connue pour le moment, entre un hôte champignon et une algue. En effet, dans les lichens, associations symbiotiques entre champignons et algues, ces dernières restent à l’extérieur des hyphes.
A. Après un mois de coculture, des algues Nannochloropsis oceanica sont visibles à l’intérieur d’un hyphe du champignon Mortierella elongata.
B. Après deux mois de coculture, l’hyphe du champignon est riche en algues.
C. Observation en microscopie électronique à transmission d’une section transversale d’hyphe après un mois de coculture entre le champignon et l’algue. Mo : organites du champignon, Mw : paroi du champignon, Nw : paroi de l’algue, Cy, V et C : cytoplasme, vacuole et chloroplaste de l’algue.
La flèche rouge indique la même position sur les images A et C.
Origine des plastes à trois membranes
Les Euglénidés et certains Dinoflagellés présentent des plastes à trois membranes. Leur origine est encore mal comprise et deux hypothèses sont émises.
La première consiste à considérer que ces plastes à trois membranes, comme les plastes à quatre membranes, proviendraient d’endosymbioses secondaires, qui auraient été suivies d’une régression de l’eucaryote internalisé, aboutissant à la perte de la membrane plasmique et de son cytoplasme. Il resterait alors les deux membranes du plaste, entourées par la membrane d’endocytose.
La seconde hypothèse postule que les plastes à trois membranes proviendraient de la capture d’un plaste à deux membranes par une cellule eucaryote. Cette hypothèse de kleptoplastie (du grec kleptes : voler) est basée sur l’observation de certains organismes aquatiques, qui se nourrissent d’algues et laissent photosynthétiser les plastes ingérés, avant de les digérer. Ces plastes, qui sont entourés d’une membrane d’endocytose, sont appelés kleptoplastes.
La limace de mer : une voleuse de plastes
La limace de mer Elysia chlorotica naît sans plaste et la larve doit, pour en acquérir, consommer des algues du genre Vaucheria (Straménopiles) (Figure 13). Les plastes des algues ingérés ne sont pas digérés, mais au contraire stockés à l’intérieur de vésicules d’endocytose, dans des cellules autour du tube digestif. Ils assurent une partie de la nutrition carbonée, pendant les 10 mois de la vie de cet organisme.
A. L’élysie émeraude (Elysia chlorotica) doit sa couleur verte aux plastes des algues Vaucheria sp.
B. Algue filamenteuse Vaucheria sp. Les plastes verts sont bien visibles à l’intérieur des filaments. Au centre de la photo, on observe deux structures reproductrices de l’algue.
Source des images : A: Patrick Krug, CC-BY, Flickr. B: Carolina Biological Supply Company, CC BY-NC-ND, Flickr.
La transmission des endosymbiotes au cours des générations
La transmission verticale correspond à la transmission des endosymbiotes, des parents vers les descendants de l’hôte au cours de la reproduction. Dans le cas des mitochondries et des plastes cette transmission peut être uniparentale ou biparentale. Par exemple, les mitochondries animales sont transmises par l’ovule (hérédité uniparentale maternelle). Les plastes peuvent présenter une hérédité uniparentale maternelle ou paternelle suivant les taxons considérés. Dans la transmission uniparentale, il arrive que le symbiote manipule la sexualité de l’hôte pour maximiser sa propre reproduction (voir l’article Wolbachia : la bactérie symbiotique qui change les cloportes mâles en femelles).
L’établissement de la symbiose peut être effectué de novo à chaque génération. L’hôte prélève ainsi à chaque génération les symbiotes dans son milieu (ex : symbiose entre Rhizobium et Fabacée, kleptoplastie de la limace de mer). Il y a alors souvent établissement d’un dialogue moléculaire entre l’hôte et son symbiote, permettant une reconnaissance spécifique entre les deux partenaires (ex : production de flavonoïdes par les racines de Fabacées, qui induisent la production de facteurs NOD par Rhizobium).
La coévolution de la cellule eucaryote et des organites d’origine endosymbiotique
Mise en évidence d’une réduction du génome des organites et d’un transfert de gènes de l’organite au noyau
Plusieurs exemples permettent de mettre en évidence que les phénomènes d’endosymbiose s’accompagnent généralement d’une diminution de la taille du génome de l’organisme endocyté, qui peut en partie s’expliquer par un transfert des gènes du symbiote vers le génome nucléaire.
Par exemple, l’étude du génome du plaste du Cercozoaire Paulinella chromatophora, appelé chromatophore, a montré que celui-ci viendrait d’une endosymbiose primaire d’une cyanobactérie, indépendante de l’événement d’endosymbiose primaire à l’origine des plastes des Chloroplastidés. Le génome du plaste de Paulinella chromatophora présente cependant une taille plus faible que le génome des cyanobactéries (1.106 pb contre une moyenne de 5.106 pb pour les génomes de cyanobactéries). Il ne code que 867 protéines, 42 ARNt et les ARN ribosomaux 1.
Un autre exemple de transfert de gènes est apporté par la Rubisco. Cette enzyme, qui fixe le CO2 dans le cycle de Calvin, est constituée de huit grandes sous-unités et de huit petites sous-unités. Chacun de ces deux types de sous-unités est codé par le chromosome bactérien chez les cyanobactéries et par le génome des plastes chez les Rhodophytes et chez les Phéophycées. Par contre, chez les Chloroplastidés, la petite sous-unité de la Rubisco est codée dans le noyau, ce qui signifie que le gène correspondant a été transféré du génome chloroplastique au génome nucléaire au cours de l’évolution.
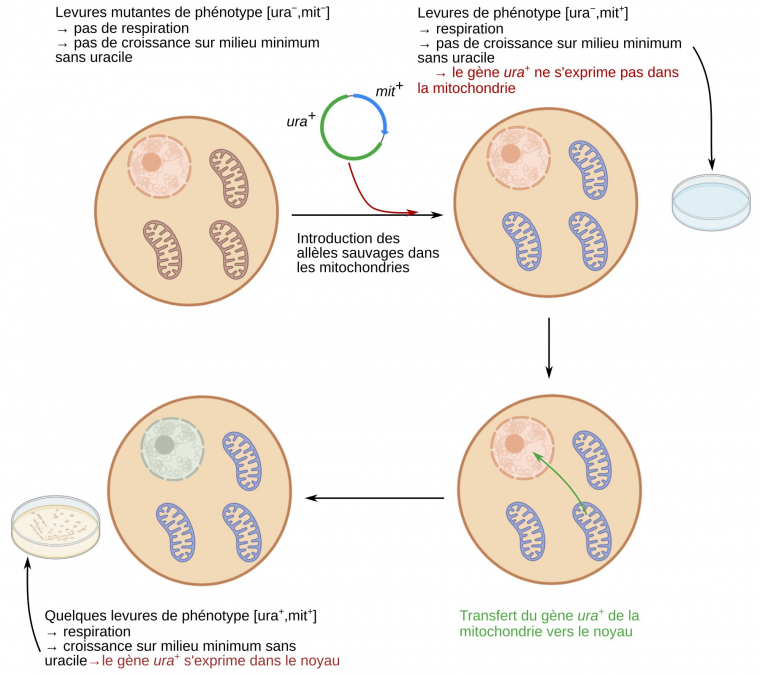
Enfin, de tels transferts horizontaux de gènes peuvent être mis en évidence expérimentalement chez la levure Saccharomyces cerevisiae (Figure 14). La démonstration en a été faite en utilisant une souche incapable de synthétiser l’uracile (car possédant la mutation nucléaire ura−) et incapables de respirer (car possédant la mutation mitochondriale mit−). À l’intérieur des mitochondries de ces levures, on introduit alors les séquences des allèles sauvages fonctionnels ura+ et mit+. Les levures transformantes sont capables de respirer, car l’allèle mit+ a été ajouté dans les mitochondries, là où il est normalement exprimé, mais la plupart d’entre elles ne produisent pas d’uracile, car l’allèle sauvage a été introduit dans les mitochondries alors que la production d’uracile nécessite que cet allèle soit exprimé dans le noyau. Cependant, en cultivant un grand nombre de levures de génotype (ura+, mit+) sur un milieu sans uracile, il est tout de même possible d’observer le développement de quelques colonies, qui sont donc de phénotype [ura+]. Chez la plupart de ces levures, la séquence ura+, introduite initialement dans les mitochondries, a été retrouvée au niveau du génome nucléaire où elle s’exprime. Ces expériences démontrent l’existence d’un transfert de gène, des mitochondries vers le noyau. De tels transferts sont fréquents, car les colonies [ura+] apparaissent avec une fréquence élevée, de l’ordre de 2.10-5 par génération.
Les trois exemples développés permettent d’illustrer un phénomène général : plus de 90 % des protéines des organites sont codées par des gènes nucléaires. La plupart du temps, les gènes d’organites ont été transférés dans le noyau au cours de l’évolution.
Par ailleurs, dans les cas où un gène nucléaire possède une fonction similaire à un gène d’organite, la pression de sélection sur ces gènes s’affaiblit et peut mener à la disparition de l’un des deux, ce qui constitue un autre mécanisme pouvant également contribuer à la réduction du génome des organites.
|
Cas de la levure |
Génome mitochondrial |
Génome nucléaire |
|
ATPase |
3 sous-unités |
5 sous-unités |
|
Cytochrome c oxydase |
3 sous-unités |
4 sous-unités |
|
Complexe bc1 |
Apoprotéine du cytochrome b |
6 sous-unités |
|
Cas d’Arabidopsis thaliana |
Génome chloroplastique |
Génome nucléaire |
|
Antennes collectrices des photosystèmes I et II |
|
3 sous-unités |
|
Centres réactionnels des photosystèmes I et II Cytochrome b6f |
Entièrement codés par le génome chloroplastique |
|
|
ATPase |
6 sous-unités |
3 sous-unités |
Mécanismes de transfert génétique entre organites et noyau
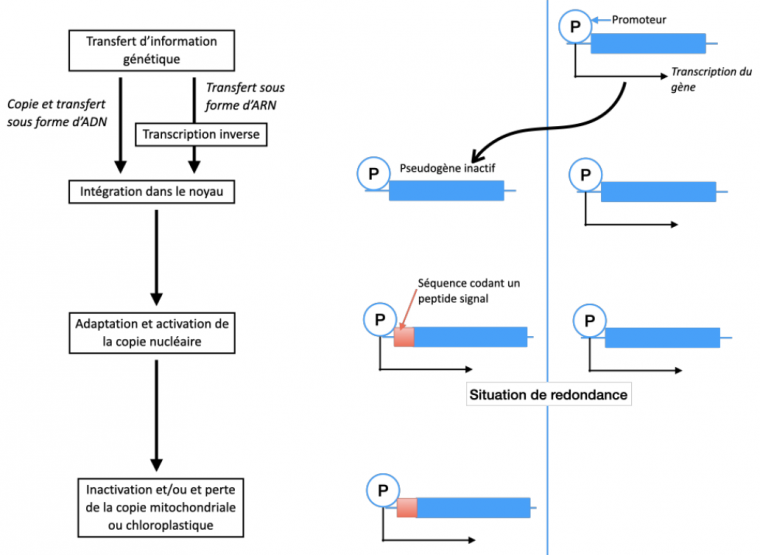
Les mécanismes de transfert génétique entre organites et noyau restent encore mal connus. Le modèle proposé par Marc-André Selosse implique plusieurs étapes : le passage de l’information génétique vers le noyau, la mise en fonctionnement de l’information génétique transférée et la réduction de l’information génétique de l’organite (Figure 15) 1.
Passage d’information génétique vers le noyau
Deux mécanismes sont possibles pour expliquer le passage de l’information génétique des organites vers le noyau :
- L’information génétique sortirait de l’organite sous forme d’ARN. L’ARN serait ensuite rétrotranscrit en ADN par une transcriptase inverse. L’ADN obtenu pourrait alors s’insérer dans le génome nucléaire.
- L’information génétique pourrait également être directement transférée sous forme d’ADN, de l’organite vers le noyau. Les mécanismes de transfert sont mal compris.
Mise en fonctionnement de l’information génétique transférée
L’information génétique transférée peut être directement codante ou nécessiter quelques mutations pour le devenir. En effet, le code génétique des plastes et des mitochondries est légèrement différent du code génétique nucléaire.
Pour être exprimée, l’information génétique transférée dans le noyau doit posséder un promoteur permettant sa transcription. Cette séquence, ainsi que d’éventuelles séquences régulatrices, peuvent être transférées en même temps que la séquence codante. Un autre mécanisme peut consister en l’intégration de la séquence codante en provenance de l’organite directement à proximité de séquences contrôlant la transcription.
Par ailleurs pour que la protéine codée soit ensuite transférée dans l’organite, il faut qu’elle possède une séquence d’adressage vers les organites (peptide de transit). L’information génétique transférée doit donc évoluer de manière à présenter une séquence codant un peptide de transit.
Réduction de l’information génétique de l’organite
Dans l’organite, la copie initiale du gène devient redondante. Elle peut alors, du fait d’une baisse de la pression de sélection qui s’exerce sur elle, accumuler des mutations et devenir non fonctionnelle. Le gène peut également disparaître par délétion.
La réduction du génome des organites résulte donc surtout d’un flux de gènes vers le noyau. Ce flux de gènes aboutit à une dépendance des organites, qui ne peuvent pas survivre en dehors de la cellule hôte. Cette dépendance génétique marque la différence entre un organite et un endosymbiote. Un organite possède un système d’import de protéines nucléaires de l’hôte, ce qui n’est pas le cas d’un endosymbiote 2.
Conclusion
L’établissement d’une endosymbiose implique différentes étapes :
- la vie à proximité de deux (ou trois partenaires), avec éventuellement des phénomènes de syntrophie ;
- l’endocytose d’un ou de plusieurs partenaires à l’intérieur d’un autre, qualifié d’hôte ;
- l’endosymbiose peut ensuite conduire à des transferts horizontaux de gènes et une perte d’indépendance des partenaires, qui rend l’endosymbiose obligatoire et permanente.
Les endosymbioses peuvent être maintenues d’une génération à une autre au cours des processus de divisions cellulaires et de reproduction (ex. transmission des mitochondries et des plastes). Elles peuvent aussi être renouvelées à chaque génération par prélèvement de l’endosymbiote dans le milieu par l’hôte (ex. mise en place des symbioses fixatrices d’azote).
Les endosymbioses ont des rôles écologique et évolutif prépondérants. L’endosymbiose à l’origine des mitochondries a accompagné l’évolution des Eucaryotes dans un milieu riche en dioxygène, en limitant la production de dérivés toxiques du dioxygène.
L’endosymbiose cyanobactérienne à l’origine des plastes a eu des conséquences évolutives et écologiques majeures, puisqu’elle a conduit à l’évolution des Eucaryotes photosynthétiques. L’événement d’endosymbiose primaire d’une cyanobactérie a donné naissance aux Archéoplastidés, qui englobent les Glaucophytes, les Rhodophytes (« algues rouges ») et les Chloroplastidés (« algues vertes » et plantes terrestres). Par la suite, des endosymbioses secondaires (et même tertiaires) d’algues rouges ou vertes au sein de différents taxons ont donné naissance à des lignées supplémentaires d’eucaryotes photosynthétiques.
Les endosymbioses se sont mises en place à différents moments de l’histoire évolutive des Eucaryotes : vers 2 Ga pour les symbioses à l’origine des mitochondries, entre 2 et 1,2 Ga pour celles à l’origine des plastes. Les endosymbioses fixatrices d’azote se sont mises en place plus récemment, vers 65 millions d’années.