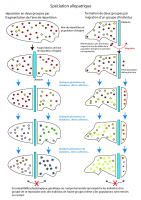
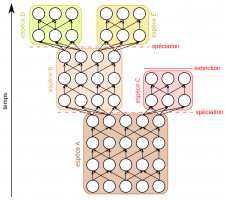
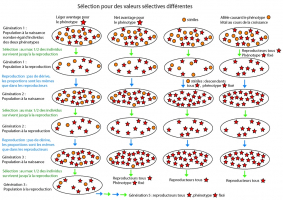
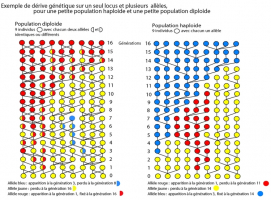
Médiathèque

Médiathèque
2455 médias

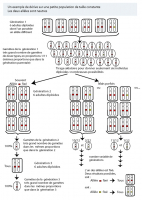
(A) et (B) Patrons d'expression de dix gènes Hox chez les Centipèdes (Arthropodes Myriapodes) présenté sur un schéma d'embryon (A) et sous forme de diagramme (B). (C) Patron d'expression de dix gènes Hox chez différents sous-embranchements d'Arthropodes. Les différentes espèces d'Arthropodes ont sou...
Licence : Reproduction autorisée dans un contexte éducatif et non commercial (Development)
L'expression des gènes Hox chez les Arthropodes