Médiathèque

Médiathèque
2450 médias
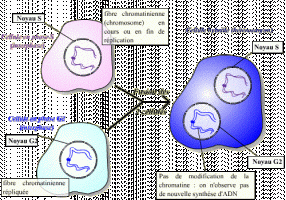
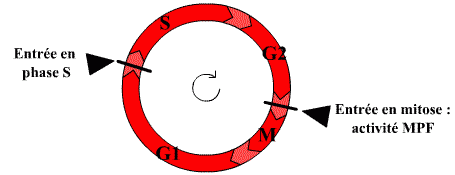
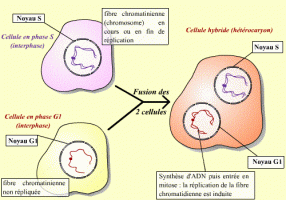
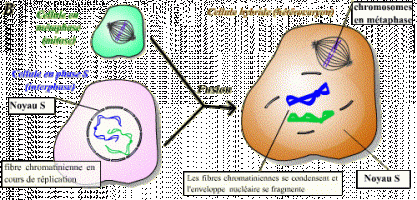
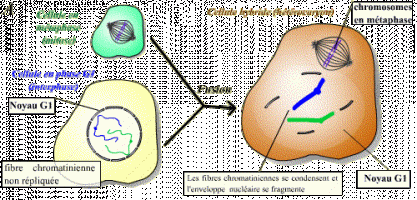
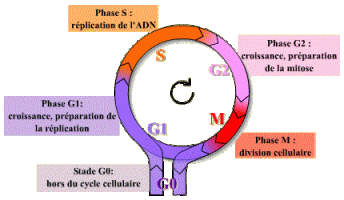
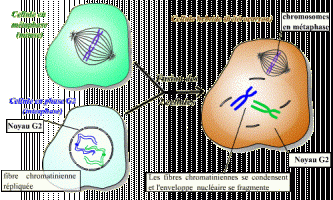
Le facteur contenu dans le cytoplasme de la cellule en phase S n'agit pas sur les fibres chromatiniennes déjà répliquées : ce facteur n'est pas actif sur des cellules ayant déjà répliqué leur ADN. Il existe donc un mécanisme qui bloque toute nouvelle réplication tant que la mitose n'a pas eu lieu.
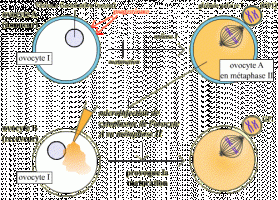
L'injection du cytoplasme prélevé dans un ovocyte II maturé (bloqué en métaphase II) dans un ovocyte I, induit l'entrée en méiose de ce dernier. Cette expérience montre que le cytoplasme de l'ovocyte A contient un composé, présent en méiose, et suffisant pour induire le passage en méiose.
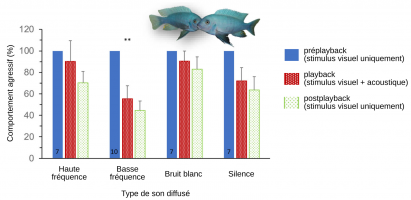
Réaction agressive des poissons mâles face à des signaux acoustique et visuel incongrus de l’adversaire. Chaque poisson testé est, durant les trois périodes de l'expérience (préplayback, playback et postplayback) en contact visuel avec un autre poisson mâle. Pendant le playback, les poissons testés ...
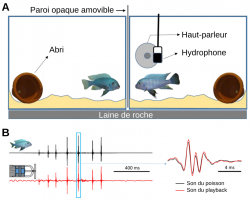
A. Deux mâles de M. zebra de même taille ont été placés dans chaque aquarium 24 h avant les essais. Les essais démarrent en supprimant la paroi opaque pour permettre des interactions agonistiques et consistent en trois périodes de 5 min : préplayback, playback (présentation des stimuli acoustiques) ...