Les médicaments de thérapie innovante représentent un potentiel considérable pour des patients atteints de pathologies pour lesquelles il n’existe pas de traitement efficace ou pour lesquelles l’arsenal thérapeutique a précédemment échoué. Ces thérapies innovantes basées sur le concept de médecine personnalisée de précision génèrent de grands espoirs. Cet article vise à donner un aperçu de leurs modes de fonctionnement, de leur réglementation et en présente quelques exemples.
Introduction et définition
Les premières thérapies cellulaires correspondent aux transfusions sanguines, réalisées avec succès au début du xxe siècle, notamment grâce à la découverte des groupes sanguins ABO par Karl Landsteiner. Plus récemment, le développement de la greffe de moelle osseuse, aussi appelée greffe de cellules souches hématopoïétiques, offre des perspectives intéressantes dans le traitement de certaines hémopathies malignes. De nouvelles avancées liées à des découvertes scientifiques majeures telles que les méthodes d’isolement de cellules souches embryonnaires, la reprogrammation de cellules adultes en cellules souches ou les avancées en thérapie génique entraînent de nouvelles possibilités thérapeutiques.
Les médicaments de thérapie innovante se distinguent des médicaments conventionnels par plusieurs aspects. Par leur composition, les médicaments conventionnels sont généralement constitués de composés chimiques appelés principes actifs, tandis qu’en thérapie cellulaire (ou tissulaire), ce sont les cellules (ou tissus) qui permettent l’effet thérapeutique. De nombreux médicaments de thérapie innovante sont développés sur mesure pour chaque patient dans le cadre de la médecine personnalisée de précision.
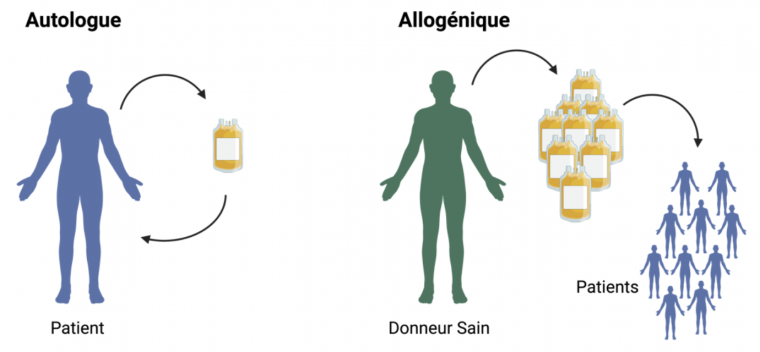
Lorsqu’ils mettent en jeu des cellules ou des tissus, les médicaments de thérapie innovante peuvent être autologues si les cellules ou tissus utilisés proviennent du patient lui-même ou allogéniques sinon (Figure 1). Les traitements allogéniques présentent le problème de la compatibilité immunologique entre le donneur et le receveur, qui peut être à l’origine de complications comme le rejet de greffe. Ce risque peut toutefois être diminué par un traitement immunosuppresseur. L’avantage de la thérapie allogénique est que dans certains cas, un même donneur peut être la source de cellules ou de tissus pour plusieurs patients.
Schéma réalisé à l'aide de BioRender.com.
Cadre réglementaire
La thérapie cellulaire et génique au sens large regroupe plusieurs catégories de produits. Tout d’abord, il faut distinguer les médicaments de thérapie innovante des produits de thérapie cellulaire.
Le terme de médicament de thérapie innovante a été introduit en 2007 dans l’article 2 du règlement 1394/2007/CE du Parlement européen et du Conseil 1. Il existe quatre classes de médicaments de thérapie innovante :
- les médicaments de thérapie génique ;
- les médicaments de thérapie cellulaire somatique ;
- les médicaments issus de l’ingénierie tissulaire ;
- les médicaments combinés de thérapie innovante.
Les produits de thérapie cellulaire, eux, ne sont pas considérés au sens légal du terme comme médicament. Ils relèvent de la réglementation européenne Directive 2004/23/CE 2. Contrairement aux médicaments de thérapie innovante, leur procédé de production n’implique pas de modifications substantielles des cellules et la fonction de celles-ci est la même chez le donneur et le receveur. Les produits de thérapie cellulaire incluent par exemple les cellules souches hématopoïétiques utilisées dans le traitement d’hémopathies malignes ainsi que les îlots de Langerhans greffés pour le traitement du diabète de type 1.
Les produits sanguins labiles (concentrés de globules rouges, plaquettes et plasmas thérapeutiques) qui sont issus d’un don de sang et destinés à être transfusés à un patient sont également exclus de la catégorie des médicaments de thérapie innovante et font partie d’une catégorie à part entière 3.
L’Agence européenne de médecine a créé un comité spécial, le Committee for Advanced Therapies, qui est chargé de la classification de ces nouveaux produits. Cependant, il n’est pas toujours évident de définir le caractère substantiel ou non d’une modification. Les précédents rapports de classification de ce comité et l’annexe 1 du règlement 1394/2007 citent cependant de manière non exhaustive des modifications substantielles telles que la culture cellulaire ex vivo ou in vitro, l’expansion ou l’activation ex vivo ou in vitro, l’altération du phénotype cellulaire et la manipulation génétique incluant le transfert de gènes ou la modification du génome.
Les médicaments de thérapie génique
Un médicament de thérapie génique contient un acide nucléique recombinant administré à des personnes en vue de réguler, de réparer, de remplacer, d’ajouter ou de supprimer une séquence génétique 4. L’effet thérapeutique, prophylactique ou diagnostique dépend directement de la séquence d’acide nucléique recombinant ou du produit de l’expression génétique de cette séquence.
Deux exemples de thérapie géniques sont présentés : celui du Luxturna, un médicament utilisé pour traiter les dystrophies rétiniennes héréditaires dues à une mutation du gène RPE65, et celui des cellules CAR-T, utilisées en immunothérapie.
Le Luxturna
Le Luxturna est un médicament de thérapie génique indiqué dans le traitement des adultes et des enfants atteints de déficiences visuelles dues à des dystrophies rétiniennes héréditaires liées à des mutations du gène RPE65. Ce médicament commercialisé par Novartis a pour substance active le voretigène néparvovec. Il s’agit d’un vecteur viral adéno-associé recombinant, contenant une copie fonctionnelle du gène RPE65. Injecté sous la rétine, le vecteur viral permet d’introduire le gène RPE65 dans les cellules rétiniennes. En 2017, Russel et ses collaborateurs ont publié les résultats d’un essai clinique de phase III chez vingt patients 1. Ceux-ci ont présenté, à un mois, une amélioration modérée, mais significative, du test de mobilité par rapport aux neuf patients du groupe témoin. Depuis, le Luxturna est autorisé en France et pris en charge par l’Assurance maladie. Aux États-Unis, il est commercialisé au prix de 850 000 dollars pour les deux yeux.
Les cellules CAR-T
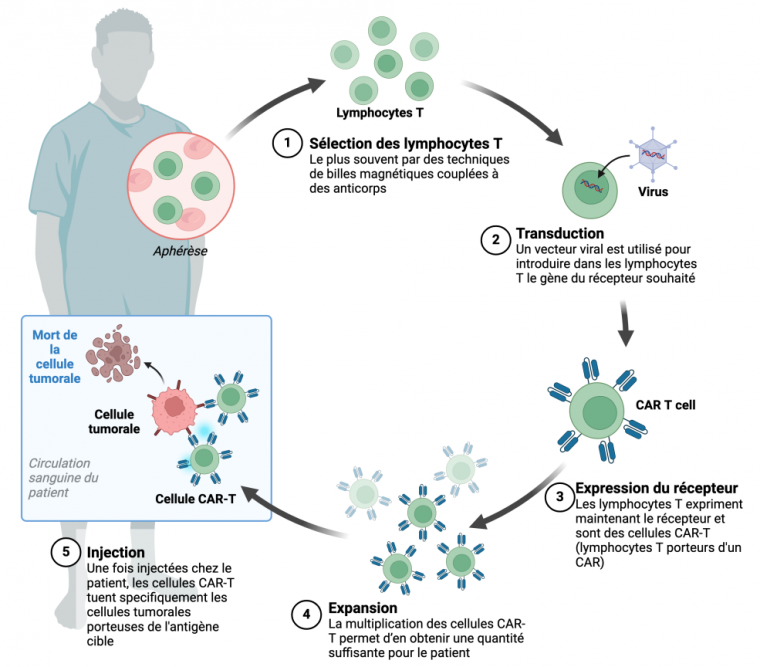
Les cellules CAR-T (pour chimeric antigenic receptor, ou « récepteur antigénique chimérique » en français) sont produites à partir de lymphocytes T issus du patient lui-même ou d’un donneur sain. Ces cellules sont ensuite modifiées génétiquement in vitro pour exprimer un récepteur spécifique des cellules tumorales du patient et ainsi les éliminer. En effet, un des rôles importants des lymphocytes T est leur capacité à reconnaître et détruire les agents pathogènes, qu'il s'agisse de bactéries ou de cellules cancéreuses. Cependant, lors du développement de certains cancers, cette capacité de défense immunitaire peut être inactivée par différents mécanismes.
La production de cellules CAR T (Figure 2) commence par le prélèvement des cellules sanguines, suivie par une étape de sélection des lymphocytes T. Ces cellules sont ensuite génétiquement modifiées par l’insertion d’un gène codant un récepteur ciblant spécifiquement les cellules tumorales que l’on appelle CAR (chimeric antigenic receptor, ou récepteur antigénique chimérique en français). Les cellules sont ensuite amplifiées afin d’en avoir un nombre suffisant avant injection au patient. Grace à ce récepteur, les cellules CAR-T produites pourront spécifiquement cibler, reconnaître et détruire les cellules tumorales.
Plusieurs types de cellules CAR-T sont utilisées ou en cours d’essais cliniques en Europe et dans le monde dans le traitement d’hémopathies malignes telles que les lymphomes ou les leucémies, mais également, plus récemment, dans le traitement des tumeurs solides.
Parmi ces traitements, plusieurs sont aujourd’hui remboursés en France et en Europe, les deux premiers étant en 2018 le Yescarta® (molécule thérapeutique : axicabtagene ciloleucel 2) et le Kymriah (molécule thérapeutique : tisagenlecleucel 3) qui ont montré des résultats révolutionnaires chez des patients en impasse thérapeutique. De nombreux essais cliniques sont en cours dans le traitement de maladies hématologiques, de cancers solides mais également de maladies auto-immunes.
Schéma réalisé avec BioRender.com.
Les médicaments de thérapie cellulaire
Un médicament de thérapie cellulaire contient ou consiste en des cellules ou des tissus qui ont fait l’objet d’une manipulation substantielle de façon à modifier leurs caractéristiques biologiques, leurs fonctions physiologiques ou leurs propriétés structurelles par rapport à l’usage clinique prévu. Il peut également s’agir de cellules ou de tissus qui ne sont pas destinés à être utilisés pour la ou les mêmes fonctions essentielles chez le receveur et le donneur. Un médicament de thérapie cellulaire possède des propriétés permettant de traiter, de prévenir ou de diagnostiquer une maladie à travers son action métabolique, immunologique ou pharmacologique.
Deux exemples de médicaments de thérapie cellulaire sont présentés : l’Alofisel, utilisé dans le traitement des fistules de la maladie de Crohn, et le VX-880, faisant l’objet d’un essai clinique dans le cadre du traitement du diabète de type 1.
L’Alofisel
L’Alofisel (substance active : darvadstrocel) est un traitement utilisant des cellules stromales mésenchymateuses isolées à partir de tissu adipeux. Les cellules stromales mésenchymateuses sont des cellules souches non hématopoïétiques, présentes dans de nombreux organes. Elles peuvent se différencier en cellules de la voie mésodermique et, après administration, migrent préférentiellement vers les tissus endommagés 1. Dans le cas de l’Alofisel, les cellules sont prélevées à partir du tissu adipeux d’un donneur sain, tissu qui est obtenu le plus souvent par liposuccion chirurgicale. Ce tissu est ensuite digéré à l’aide d’enzymes et subit une centrifugation pour séparer les différents types cellulaires et ne garder que les cellules stromales mésenchymateuses. Ces cellules sont alors utilisées dans le traitement des fistules périanales2 complexes dues à une maladie de Crohn. Dans ce cas, les cellules stromales mésenchymateuses inhibent la réponse immunitaire et les phénomènes inflammatoires par la sécrétion de cytokines anti-inflammatoires, ce qui permet la cicatrisation du tissu. Les résultats de l’étude de phase 3 du laboratoire Takeda ont été publiés en octobre 2023 : l’Alofisel est bien toléré par les patients, mais ceux-ci ne présentent pas de rémission à 24 mois 3.
Le VX-880
VX-880 est une thérapie allogénique constituée de cellules souches différenciées en cellules pancréatiques endocrines pour sécréter de l’insuline et du glucagon et ainsi maintenir la glycémie des patients atteints de diabète de type 1 dans des valeurs normales. L’infusion4 des cellules se fait via la veine porte hépatique et cette thérapie nécessite un traitement immunosuppresseur pour prévenir les rejets. Les premiers résultats de l’essai clinique de Vertex Pharmaceuticals, présentés en octobre 2023, montrent que les 14 patients traités par VX-880 présentent une production endogène d’insuline et un meilleur contrôle glycémique. Les deux patients transplantés depuis plus de 12 mois n’ont pas présenté d’hypoglycémie sévère (complication redoutée du diabète de type 1) et n’ont presque plus ou pas besoin d’injection quotidienne d’insuline. Cependant, en janvier 2024, Vertex Pharmaceuticals a décidé de mettre en pause cet essai clinique à la suite du décès de deux patients, dans l’attente de l’étude des données par un comité de surveillance indépendant et par les différentes autorités de réglementation au niveau international 5.
Les médicaments issus de l’ingénierie tissulaire et cellulaire
Un médicament issu de l’ingénierie tissulaire ou cellulaire possède des propriétés lui permettant de régénérer, réparer ou remplacer un tissu humain. Il s’agit de cellules ou tissus qui sont soumis à des manipulations substantielles ou qui ne sont pas destinés à être utilisés pour la ou les mêmes fonctions chez le receveur et le donneur et spécialement administrés pour régénérer, réparer ou remplacer des tissus humains existants.
L’Holoclar
L'Holoclar est composé de cellules souches limbiques, c’est-à-dire issues du limbe de l’œil, qui correspond à la frontière entre la cornée, transparente, et la sclérotique, opaque. Dans ce traitement, les cellules souches du patient sont amplifiées in vitro jusqu’à atteindre 79 000 à 310 000 cellules/cm2. Cette thérapie est indiquée dans le traitement des déficits en cellules souches limbiques causés par des brûlures oculaires chimiques ou physiques. Une fois implantées les cellules souches limbiques permettent de remplacer la surface cornéenne par du tissu sain 6.
Les médicaments combinés de thérapie innovante
Les médicaments combinés de thérapie innovante incorporent un ou plusieurs dispositifs médicaux couplés à une partie cellulaire ou tissulaire qui contient des cellules ou tissus dont l’action est considérée comme essentielle par rapport à celle du ou des dispositifs médicaux seuls.
Deux exemples sont présentés : le MACI, un traitement des lésions du cartilage du genou, ainsi que l’iRPE-patch, qui fait l’objet d’un essai clinique dans le cas de la dégénérescence maculaire liée à l’âge.
Le MACI
Le MACI est un médicament combiné de thérapie innovante alliant des chondrocytes (cellules du cartilage) autologues amplifiés in vitro à une membrane de collagène d’origine porcine marquée CE7. Ce produit une fois implanté a pour objectif de réparer les lésions du cartilage du genou. Il a été classé par le Committee for Advanced Therapies comme médicament combiné de thérapie innovante car il est constitué à la fois de cellules et d’une matrice marquée CE. Le MACI est à ce jour le seul médicament combiné à avoir obtenu une autorisation de mise sur le marché par l’Agence européenne du médicament 8.
L’iRPE-patch
L’iRPE-patch est une thérapie autologue utilisée dans le traitement de la dégénérescence maculaire liée à l’âge. L’objectif de cette thérapie est de restaurer les cellules de l’épithélium pigmentaire rétinien à partir de cellules souches pluripotentes induites (induced pluripotent stem cells ou iPSC). Décrites en 2006 par le professeur Yamanaka et récompensées par le prix Nobel en 2012 9, ces cellules sont produites à partir de cellules adultes qui sont dédifférenciées, in vitro, pour revenir à un état pluripotent. Les cellules iPSC ainsi obtenues peuvent ensuite être à nouveau différenciées en différents types cellulaires. Dans le cas de l’iRPE-patch, les cellules iPSC sont obtenues à partir de cellules sanguines puis sont ensuite différenciées en cellules de l’épithélium pigmentaire rétinien. Elles sont alors placées sur un matériau biodégradable avant d’être transplantées dans la rétine des patients au bloc opératoire. Il s’agit d’un essai clinique qui a reçu en 2020 l’accord de la FDA, l'agence américaine de l'alimentation et du médicament, mais aucun résultat n'a été publié pour le moment 10.
Les produits de thérapie cellulaire
Les produits de thérapie cellulaire sont des cellules humaines, autologues ou allogéniques, utilisées à des fins thérapeutiques, dont le procédé de production ne requiert pas de modification substantielle, et dont la fonction est la même chez le donneur et le receveur. Les produits de thérapie cellulaire sont administrés au patient afin de « réparer » un tissu ou un organe malade ou de mobiliser les défenses de l’organisme contre un virus ou des cellules cancéreuses.
Les cellules souches hématopoïétiques
La greffe de cellules souches hématopoïétiques ou greffe de moelle osseuse est pratiquée depuis plus de 50 ans en hématologie pour le traitement d’hémopathies malignes telles que les leucémies. Il peut s’agir d’autogreffe ou d’allogreffe et les cellules peuvent être prélevées à partir de différentes sources : la moelle osseuse, le sang périphérique après stimulation ou à partir du sang de cordon ombilical. Les cellules sont ensuite transplantées chez le receveur pour restaurer l’hématopoïèse, c’est-à-dire la production des différentes cellules du sang.
Les îlots de Langerhans
Depuis 2022, la transplantation d’îlots de Langerhans est remboursée par l’Assurance maladie dans le traitement du diabète de type 1 lorsque celui-ci n’est plus équilibré par des injections quotidiennes d’insuline et que les risques d’hypoglycémie sont importants. L’isolement des îlots de Langerhans se fait à partir de pancréas obtenus lors de dons d’organes. Les plateformes de biothérapies isolent ensuite, par des techniques de digestion et de purification, les îlots du reste du pancréas. Ceux-ci sont ensuite injectés, au bloc opératoire, aux patients diabétiques via la veine porte hépatique. Il s’agit d’une thérapie cellulaire allogénique, et un même patient peut recevoir des îlots provenant de différents donneurs.
Conclusion
La thérapie cellulaire et génique ouvre de nouvelles perspectives passionnantes dans le domaine de la médecine, offrant des solutions potentielles pour des maladies incurables ou difficiles à traiter. En effet, le rapport de l’Alliance pour la médecine régénérative de 2021 a recensé 2406 essais cliniques en cours dans le monde dans le domaine des thérapies innovantes, dont 360 en Europe. Cependant, le chemin vers l’application clinique généralisée de ces thérapies n’est pas sans obstacles. Les défis liés à la sécurité, à l’immunogénicité, à l’éthique, au coût et à la complexité technique nécessitent une approche réfléchie et des recherches continues.