Chez les patients souffrant de formes sévères de diabète de type 1, le traitement par insulinothérapie peut ne pas être suffisant. Chez ces personnes, la greffe d'îlots de Langerhans provenant de donneurs en état de mort cérébrale peut permettre de restaurer, sur le long terme, un état d'insulino-indépendance ou, a minima, de limiter le développement des pathologies liées au diabète.
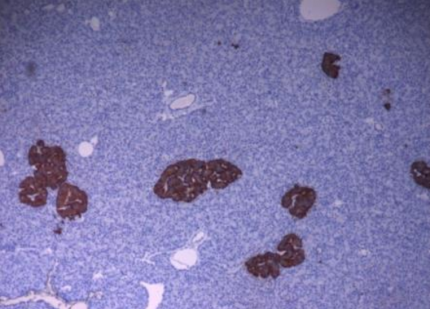
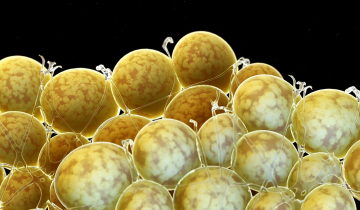
Les îlots de Langerhans ont été mis en évidence par immunohistochimie, à l'aide d'anticorps anti-insuline. Ils apparaissent en marron (coloration à la diaminobenzidine) tandis que les noyaux des cellules exocrines sont contrecolorés à l’hématoxyline (coloration bleue) (×100).
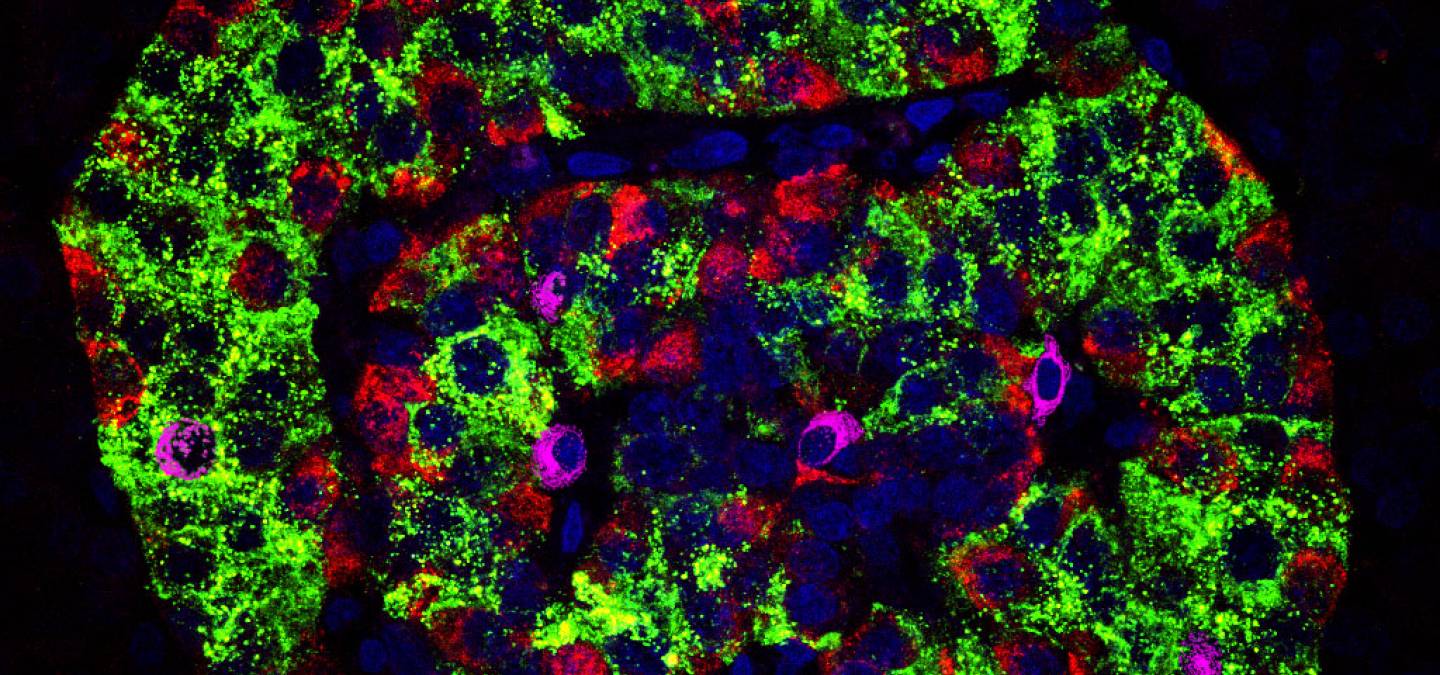
Aujourd’hui, le diabète affecte plus de 420 millions de personnes dans le monde et ce nombre est en constante progression 12. Cette maladie métabolique se caractérise par une hyperglycémie, c’est-à-dire par un taux de sucre dans le sang supérieur à 1,26 g/L à jeun et regroupe plusieurs types de diabète. Les plus connus sont le diabète de type 1 (DT1) ou diabète insulinodépendant et le diabète de type 2 (DT2), anciennement appelé diabète gras. Le diabète de type 1 représente 10 % des cas de diabète et se caractérise par la perte des cellules β qui sécrètent l’insuline, une hormone hypoglycémiante. Ces cellules sont présentes au sein d’amas cellulaires pancréatiques appelés îlots de Langerhans et disséminés dans le tissu exocrine (Figure 1).
La plupart des patients diabétiques parviennent à équilibrer leur diabète tout au long de la vie. Mais chez certains malades, sans que l’on sache pourquoi, le diabète devient instable et imprévisible après quelques années de traitement. Ces patients risquent notamment de faire des hypoglycémies sévères (baisse brutale de la glycémie), allant jusqu’au coma.
Diabète et hypoglycémie
Bien que le diabète se caractérise par une situation d’hyperglycémie chronique, la prise d’insuline ou d’un médicament stimulant la production d’insuline par un patient diabétique peut conduire à des épisodes d’hypoglycémie. Celle-ci peut être légère ou modérée ou, plus rarement, sévère. Dans ce cas, la personne n’est plus en mesure d’ingérer elle-même des sucres rapides et quelqu’un d’autre doit intervenir. La glycémie est alors inférieure à 2,8 mmol/L (soit 0,5 g/L) ce qui peut entraîner une perte de connaissance ou des convulsions, et peut dans de rares cas mettre la vie en danger.
Le plus souvent, l’origine de ces hypoglycémies est directement imputable à l’insuline injectée. Dans ces cas sévères de diabète de type 1, en dehors d’une insulinothérapie lourde, la thérapie cellulaire est la seule stratégie thérapeutique permettant la restauration d’un bon équilibre glycémique. En 2000, la publication des résultats cliniques d’une équipe d’Edmonton (Canada) portant sur 7 patients a planté un jalon important pour le traitement du diabète de type 1 1. Cette équipe a démontré que le remplacement des cellules β par une greffe allogénique2 d’îlots de Langerhans pouvait restaurer la sécrétion d’insuline endogène et l’homéostasie du glucose à une situation proche de la normale. Depuis, la transplantation d’îlots de Langerhans a été proposée dans le monde à plus 1 000 patients atteints de diabète de type 1 sévère.
Bien que la transplantation d’îlots améliore la qualité de vie et diminue les complications chroniques du diabète, cette thérapie innovante reste destinée en priorité aux diabétiques faisant des hypoglycémies sévères affectant leur survie. En effet, comme pour toutes les greffes allogéniques, une immunosuppression chronique doit être mise en place afin d’assurer la survie et la fonction du greffon.
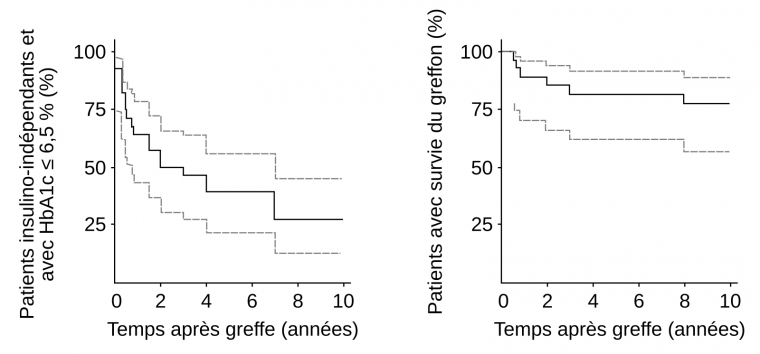
Par ailleurs, les effets de ces greffes à long terme étaient jusqu’ici peu connus. Grâce à une étude fondée sur 28 patients greffés dix ans auparavant, nous avons montré très récemment, pour la première fois, que la transplantation d’îlots utilisant le protocole d’Edmonton permettait un contrôle métabolique nettement amélioré par rapport à l’état de ces patients avant greffe 3. Notre étude a montré que ces patients n’avaient pas présenté d’événements hypoglycémiques graves, qu’une insulino-indépendance (HbA1c < 6,5 % [48 mmol/mol d’hémoglobine]) était maintenue pour 39 % des patients greffés à 5 ans et que cette rémission du diabète perdurait chez 28 % des patients à 10 ans (Figure 2). De plus, le taux de survie du greffon était de 82 % cinq ans après la greffe et de 78 % dix ans postgreffe. Cette survie du greffon permet une sécrétion endogène d’insuline et même si celle-ci n’est pas suffisante pour guérir l’ensemble des patients diabétiques (c’est-à-dire pour atteindre un état d’insulino-indépendance), elle permet de limiter les pathologies liées aux diabètes (atteintes rénales, vasculaires, etc.).
Estimations sur dix ans de l'indépendance à l'insuline avec une hémoglobine glyquée (HbA1C) < 6,5 % (< 48 mmol/mol d’hémoglobine) (à gauche) et de la survie du greffon (à droite). Les pointillés gris bornent l’intervalle de confiance à 95 %. Le fait que l’indépendance à l’insuline soit progressivement perdue pourrait provenir d’une disparition des îlots greffés chez les patients. La variabilité de la réponse des patients au traitement (certains ayant une glycémie efficacement contrôlée pendant 10 ans tandis que chez d’autres les effets de la greffe durent moins d’un an), s’expliquerait par une variabilité dans le rejet des îlots greffés, dépendant de facteurs non identifiés mais qui pourraient provenir d’une réponse immunitaire variable de l’hôte face au greffon. n = 28 patients.
Hémoglobine glyquée
Alors que la mesure de la glycémie ne donne qu’un instantané de l’état glycémique, le dosage sanguin de l’hémoglobine glyquée (ou HbA1c) est le reflet de la glycémie sur une longue période (environ deux à trois mois, ce qui correspond à la durée de vie d’un globule rouge et donc de l’hémoglobine qu’il contient). Généralement, un diabète est considéré comme équilibré si le taux d’HbA1c est inférieur ou égal à 6,5 %. Au-delà, le risque de développer des complications à long terme augmente.
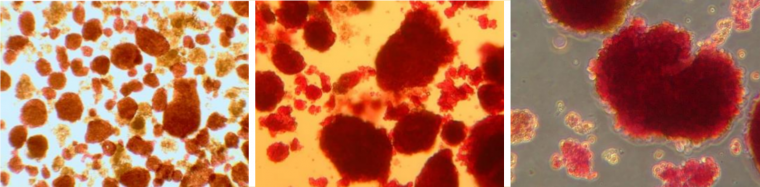
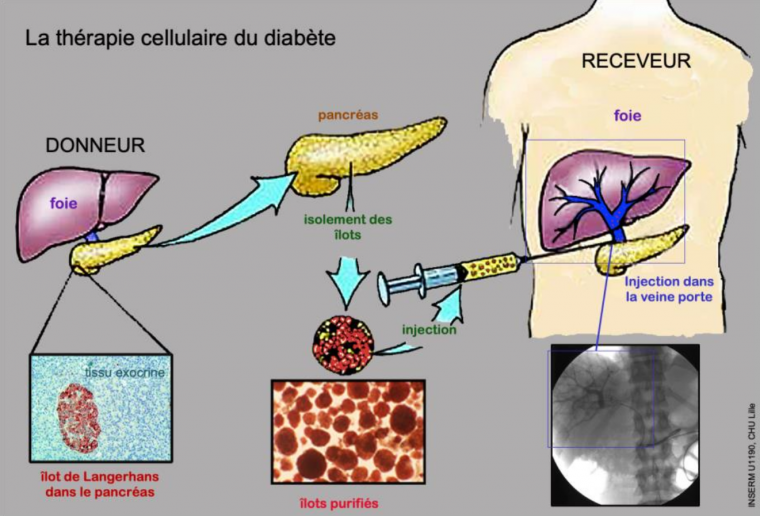
La thérapie cellulaire du diabète consiste à greffer des îlots de Langerhans purifiés, isolés à partir de pancréas humains provenant de donneurs en état de mort cérébrale dans le cadre d’un don d’organes (Figure 3). Les îlots, qui représentent 1 % de la masse pancréatique, sont libérés du parenchyme exocrine par une digestion enzymatique et une action mécanique, puis sont purifiés dans un gradient de Ficoll1 2.
Les îlots sont colorés à la dithizone (chélateur du zinc colorant en rouge la molécule d’insuline). Les îlots de Langerhans sont des amas formés de quelques dizaines à plusieurs milliers de cellules endocrines, dont les cellules β productrices d’insuline (de gauche à droite : ×100, ×200 et ×500).
Les îlots sont ensuite injectés dans le foie du patient diabétique pour permettre au greffon de s’implanter. En effet, cet organe volumineux et fortement vascularisé peut accueillir plusieurs millilitres de culot cellulaire ce qui en fait un site de choix pour la transplantation des îlots de Langerhans. Cette injection tissulaire est réalisée par voie chirurgicale à l’aide d’un cathéter qui remonte de long de la veine porte (Figure 4).
Le pancréas est prélevé sur un donneur en état de mort cérébrale. Puis le pancréas est digéré pour libérer les îlots de Langerhans du tissu exocrine. Après purification, les îlots sont injectés dans la veine porte pour permettre leur implantation dans le foie du receveur.
À la fin de ce processus d’isolement et avant chaque greffe, des études in vitro sont réalisées sur une petite fraction de la préparation finale afin de vérifier l’absence de contamination microbiologique de celle-ci ainsi que la viabilité cellulaire et la capacité de sécrétion de l’insuline des cellules endocrines après une stimulation par le glucose. Il est important de réaliser ces tests afin de connaître la qualité des cellules greffées, qui conditionne l’efficacité de la thérapie cellulaire. En effet, nous avons montré que la capacité de sécrétion d’une préparation cellulaire était directement corrélée au bon fonctionnement d’une greffe 1.
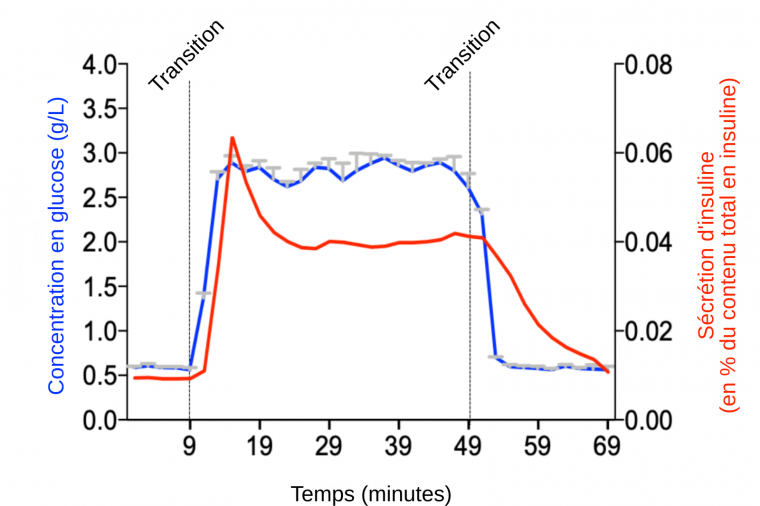
Pour tester la capacité de sécrétion des îlots purifiés, nous avons mis au point un protocole in vitro de stimulation dynamique par le glucose, premier sécrétagogue2 insulinique des cellules β pancréatiques. Pour cela, nous plaçons les îlots destinés à la greffe dans une chambre de périfusion3 thermostatée à 37 °C, sous oxygène et baignée par un flux constant (1 mL/min) d’une solution tampon en bas glucose à 3 mM (0,54 g/L), ou en haut glucose à 15 mM (2,72 g/L). Toutes les deux minutes, l’éluat est récupéré pour permettre un dosage de l’insuline sécrété. À la fin de la stimulation, tous les îlots présents dans la chambre sont récupérés puis lysés pour permettre de mesurer la quantité d’insuline intracellulaire résiduelle. Au final, les résultats sont exprimés en pourcentage d’insuline sécrétée par rapport au contenu total en insuline des îlots, ce qui permet de comparer les résultats obtenus entre différentes préparations d’îlots (en effet, le pourcentage de cellules β contenues dans un îlot est très variable, allant de 10 à 90 % des cellules). La figure 5 montre que l’augmentation de la concentration en glucose de 0,54 à 2,72 g/L (courbe bleue) entraîne une sécrétion d’insuline (courbe rouge) en 3 phases. En effet, lors du passage à la condition haut glucose, on observe un pic de sécrétion rapide et intense suivi d’une baisse de la sécrétion jusqu’à atteindre un plateau qui dure tout au long de la stimulation. Lorsque l’on revient en bas glucose, le niveau initial d’insuline est rétabli après 20 minutes.
La courbe bleue représente l’évolution de la concentration de glucose utilisée pour stimuler les îlots de Langerhans (moyenne de n = 3 séries de mesures). La courbe rouge représente la quantité d’insuline sécrétée par rapport au contenu total en insuline des cellules en réponse au glucose (moyenne de n = 61 préparations d’îlots de Langerhans).
En France, après plus de 25 ans de recherche clinique, la greffe d’îlots de Langerhans pour le traitement du diabète sévère devient une réalité avec sa reconnaissance en 2020, par la Haute autorité de santé, comme une nouvelle thérapie pour les patients diabétiques de type 1. La greffe d’îlots pourra donc, au cours de cette année 2021 être prescrite par les médecins pour guérir les diabétiques de type 1 instables, au même titre qu’une prescription pour la greffe d’un organe.
En parallèle des travaux sur les greffes allogéniques, de nombreux laboratoires dans le monde envisagent le traitement du diabète de type 1 à partir de cellules souches pluripotentes, qu’il s’agisse de cellules souches embryonnaires (ESC, embryonic stem cells) ou de cellules pluripotentes induites (iPSC, induced pluripotent stem cells). Le défi à relever est de réussir à trouver les conditions de différenciation in vitro permettant d’aboutir à de véritables îlots de Langerhans fonctionnels 1.