La tuberculose est une maladie humaine causée par la bactérie Mycobacterium tuberculosis et qui est responsable chaque année de plus d’un million et demi de décès dans le monde. Le vaccin traditionnellement utilisé, le BCG, peine à conférer une protection suffisante contre la tuberculose pulmonaire, à cause de son immunogénicité peu adaptée. Les auteurs présentent ici une nouvelle souche de BCG recombinante, baptisée BCG::ESX-1Mmar, qui possède une région génomique permettant l’expression et la sécrétion de certains facteurs dont le BCG conventionnel est dépourvu. Ces facteurs accèdent au cytosol de la cellule hôte et constituent des cibles antigéniques privilégiées pour le système immunitaire et par conséquent améliorent l’immunité innée et adaptative contre M. tuberculosis, faisant de BCG::ESX-1Mmar un candidat vaccin prometteur.
Introduction
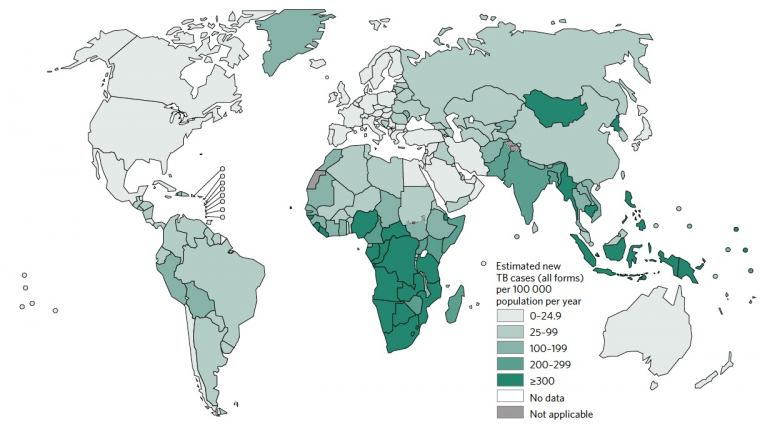
Mycobacterium tuberculosis, le bacille intracellulaire découvert par Robert Koch en 1882, est l’agent étiologique de la tuberculose humaine, une maladie contagieuse et chronique qui affecte essentiellement les poumons. Au niveau mondial, la tuberculose compte parmi les dix premières causes de mortalité. Elle constitue, avec le sida et le paludisme, les trois premières pathologies infectieuses qui menacent encore l’humanité. En effet, on estime que le tiers de la population mondiale porte cette bactérie de façon latente, d’où la déclaration en 1993 de la tuberculose comme une urgence mondiale par l’Organisation Mondiale de la Santé (OMS). Dans plus de 90 % des cas, l’immunité naturelle mise en place protège les individus de la conversion de l’infection latente vers une maladie active. Cependant, lors de l’affaiblissement du système immunitaire, lié à des facteurs tels que la malnutrition, l’âge, le diabète et surtout l’immunodéficience, génétique ou acquise, le risque d’évolution vers une tuberculose active s’accroît considérablement. À l’heure actuelle, 15 millions de personnes sont co-infectées par le VIH et M. tuberculosis dans le monde. La séro-conversion pour le VIH et l’immunodéficience subséquente augmentent de 30 fois le risque de développer une tuberculose active. L’ensemble de ces paramètres a conduit, en 2015, à la survenue de plus de 10 millions de nouveaux cas de tuberculose active et 1,8 millions de décès à travers le monde (1) (Figure 1).
Pour lutter contre la tuberculose, des moyens considérables sont mis en place, mais ces efforts sont souvent insuffisants et compliqués par la nature persistante du bacille. Pour traiter des cas de tuberculose active, un cocktail de quatre médicaments antituberculeux de première ligne (rifampicine, isoniazide, pyrazinamide et éthambutol) doit être pris pendant six mois, ce qui représente un traitement contraignant et coûteux. De plus, lors d’un traitement antirétroviral simultané avec des antituberculeux, des interactions médicamenteuses peuvent activer ou inhiber l’activité des enzymes hépatiques. Dans le cas des souches multi-résistantes (MDR - résistance à l’isoniazide et à la rifampicine, au moins), voire ultra-résistantes (XDR - multirésistance à laquelle s’ajoute une résistance à n’importe quelle fluoroquinolone et à au moins un des trois antituberculeux injectables de deuxième intention – capréomycine, kanamycine et amikacine), des antibiotiques de seconde ligne doivent être ajoutés et la durée du traitement doit se prolonger à au moins deux ans, avec un pronostic de guérison diminué (2). En vue du contrôle de la tuberculose, les objectifs prioritaires définis par l’OMS incluent : (i) acheminement des médicaments dans les zones endémiques les plus reculées, (ii) prise en charge de la co-infection M. tuberculosis-VIH, (iii) élimination de la pharmaco-résistance, (iv) recherche de nouveaux outils de diagnostic, (v) découverte de nouveaux antibiotiques, et (vi) mise au point de nouveaux vaccins à visée prophylactique ou thérapeutique (3).
Quelques données sur la physiopathologie de la tuberculose
Les symptômes caractéristiques de la tuberculose pulmonaire active englobent fièvre, sueurs nocturnes, perte de poids, fatigue, toux, présence de sang dans les crachats et douleurs thoraciques. À ce stade avancé de la maladie, un patient peut transmettre les bacilles tuberculeux par l’intermédiaire de gouttelettes générées par la toux, qui s’acheminent vers les voies respiratoires d’autres individus. Cette transmission par aérosols suite à l’induction des lésions pulmonaires est une étape clef dans le cycle de propagation de M. tuberculosis, qui est un micro-organisme pathogène obligatoire.
La première ligne de défense de l’hôte contre M. tuberculosis est constituée de macrophages de l’espace alvéolaire pulmonaire qui phagocytent les bacilles inhalés et qui migrent ensuite vers le parenchyme pulmonaire. Ces macrophages infectés sont alors fortement activés. En effet, les mycobactéries sont très riches en motifs bactériens constitués de lipides, glycolipides et lipoprotéines reconnus par une pléthore de récepteurs de l’immunité innée présents non seulement à la surface cellulaire, mais également dans le cytosol et dans les compartiments endocytiques des cellules phagocytaires de l’hôte.
De nombreuses études ont été consacrées à analyser le devenir de M. tuberculosis dans les macrophages. Pendant des années, il était largement admis qu’une fois phagocyté, M. tuberculosis restait enfermé dans les vacuoles/phagosomes de la cellule hôte et continuait à se multiplier en bloquant la maturation du phagosome (4). Cependant, des études récentes ont montré que M. tuberculosis possédait aussi la capacité de perforer la membrane du phagosome, et d’établir ainsi un contact direct avec le cytosol du macrophage. Ce pouvoir du bacille tuberculeux d’endommager la membrane phagosomale nécessite l’action de plusieurs facteurs de virulence de M. tuberculosis, tels que le système de sécrétion de type VII nommé «ESX-1» (Figure 2) et les lipides mycobactériens présents au niveau de la membrane externe des mycobactéries pathogènes, nommés phtiocérol dimycocérosate (PDIM ou DIM) (5-8). Longtemps considéré comme relativement passif, il est clair de nos jours que M. tuberculosis est capable de contourner activement les mécanismes bactéricides mis en place par la cellule hôte. Les facteurs bactériens qui contribuent à la survie de M. tuberculosis dans les cellules hôtes incluent des protéines et des lipides. Ainsi des souches dépourvues de ces éléments sont atténuées et seront éliminées par la réponse immunitaire.
Les interactions moléculaires entre les mycobactéries et la cellule hôte activent de nombreux axes de signalisation intracellulaires, ce qui aboutit à la maturation phénotypique et fonctionnelle des cellules de l’immunité innée. Celle-ci repose essentiellement sur l’expression des molécules de co-stimulation à la surface cellulaire et par la sécrétion d’une multitude de chimio-attractants et des cytokines inflammatoires. Ces événements aboutissent au recrutement progressif d’autres cellules de l’immunité innée (neutrophiles, macrophages, cellules dendritiques, monocytes inflammatoires, natural killers (NK), macrophages polynucléés), et dans un second temps, le recrutement de cellules de l’immunité adaptative (lymphocytes B, T CD4+, T CD8+, T à TCRγδ), ce qui aboutit ultimement à la formation d’un foyer multi-cellulaire sophistiqué, appelé « granulome » (9). Ces tubercules sont à l’origine du nom de la maladie.
Macrophages polynucléées et lymphocytes T à TCRγδ
Suite à l’infection pulmonaire par M. tuberculosis, au cours du développement d’un site inflammatoire, des macrophages peuvent se différencier en différents types parmi lesquels on compte des cellules géantes polynucléées. Cette modification serait initiée par un des glycolipides de M. tuberculosis, le lipomannane. Cet exemple indique comment les mycobactéries peuvent moduler la nature des cellules de l’hôte. Le rôle exact des macrophages polynucléés n’est pas encore élucidé.
Les lymphocytes T à TCRγδ, par opposition aux lymphocytes T à TCRαβ, représentent seulement 1 à 5% des lymphocytes du sang. Ces cellules sont surtout retrouvées dans les muqueuses digestives et respiratoires. Leur nombre augmente très significativement dans les poumons lors de l’infection mycobactérienne. Ces cellules peuvent produire du TNF-α mais sont surtout une source abondante d’interleukine-17 lors de l’infection par M. tuberculosis.
Le granulome est un édifice immunologique largement organisé et fonctionnel qui peut isoler et contenir, voire éradiquer l’infection primaire. Néanmoins, si le granulome est défaillant ou la mycobactérie hyper-virulente, l’équilibre peut basculer en faveur du bacille. Celui-ci se propageant, il entraîne une exacerbation inappropriée de la réponse inflammatoire qui endommage localement le parenchyme pulmonaire. Au centre du granulome défaillant, une nécrose caséeuse (dont l’aspect rappelle le fromage) se forme d’où les bacilles, devenus extracellulaires, disséminent. Ils formeront bientôt des foyers secondaires d’infection dans le poumon; c’est la survenue d’une tuberculose active (10). De nombreuses données cliniques ou expérimentales montrent que les réponses immunitaires innées conduisant à la mise en place des réponses lymphocytaires T CD4+ de type Th1, ainsi que des réponses T CD8+, constituent les meilleurs corrélats de protection identifiés jusqu’ici.
Lymphocytes auxiliaires Th1 et Th2
Les lymphocytes auxiliaires de type Th1 (« T helper 1 ») sont essentiellement producteurs des cytokines IL-2, IFN-γ et TNF-α, par opposition aux lymphocytes Th2, qui produisent préférentiellement de l’IL-4, IL-5 et IL-13. Les lymphocytes Th1 sont efficaces dans la lutte contre les infections intracellulaires, alors que les lymphocytes Th2 sont davantage impliqués dans les réactions allergiques.
On sait cependant, que le contrôle immunitaire du bacille tuberculeux met en jeu des mécanismes multi-factoriels, avec des caractéristiques spatio-temporelles fines et complexes qui restent encore largement à explorer. Au sein de la population T CD4+ Th1, de nombreuses sous-populations fonctionnelles sont présentes avec différentes spécificités antigéniques et différents profils concernant leur fonction et leur état d’activation, de différenciation, de mémoire et de migration et qui peuvent contribuer au contrôle de la croissance in vivo du bacille, ou au contraire être destructeurs pour le parenchyme pulmonaire. L’induction des réponses adaptatives immunitaires appropriées est donc primordial lors de la vaccination.
Le vaccin actuellement disponible : son histoire, le pour et le contre
Le seul vaccin antituberculeux actuellement en utilisation est celui qui a été élaboré par Albert Calmette et Camille Guérin au début du XXe siècle. Calmette, alors directeur de l’Institut Pasteur de Lille, et Guérin, vétérinaire, s’intéressèrent aux mécanismes de l’infection par le bacille tuberculeux et à l’immunité anti-mycobactérienne. Ils cultivèrent notamment un isolat de Mycobacterium bovis, fourni par Edmond Nocard, sur des tranches de pommes de terre traitées à la bile de bœuf. C’est à la suite de passages successifs en culture que Calmette et Guérin observèrent l’atténuation de la virulence et de la capacité pathogénique dans divers modèles animaux. Après 230 passages, la souche considérée comme complètement atténuée, a été appelée « bacille bilié de Calmette et Guérin » (BCG). Cette souche a été utilisée d’abord dans des essais de vaccination de jeunes bovins et des singes, avec un certain succès. À la fin de la première guerre mondiale, Calmette mît en place, à l’Institut Pasteur de Paris, une équipe de recherche sur la tuberculose et pour la préparation du BCG à usage vaccinal. Suite à ces travaux précurseurs et à l’envoi du BCG à de nombreuses destinations à travers le monde, depuis 1921 plus de 4 milliards de doses de BCG ont été administrées chez l’homme, ce qui fait du BCG le vaccin à la couverture vaccinale la plus vaste au niveau mondial, avec une très bonne innocuité.
Bien que le BCG soit efficace jusqu’à 80 % dans les pays les plus septentrionaux de l’hémisphère nord et notamment contre les formes disséminées des infections mycobactériennes chez l’enfant, il présente une efficacité très limitée, voire inexistante dans certaines zones pandémiques contre la tuberculose pulmonaire d’adulte qui est la forme la plus contagieuse. Un des défauts de ce vaccin est que non seulement l’immunité protectrice qu’il confère est d’une durée limitée (environ 10 ans), mais aussi qu’une vaccination de rappel par le même vaccin (« boost » homologue) n’améliore pas la protection (11). Vue l’incidence alarmante de la tuberculose dans les zones endémiques de l’Asie du sud-est et de l’Afrique sub-saharienne et dans certaines régions de l’ex-Union Soviétique, ainsi que la réémergence de la tuberculose dans des régions du Proche Orient frappées par la guerre (Figure 1), l’élaboration et l’administration d’un vaccin efficace de nouvelle génération est une nécessité de santé publique.
Une approche génétique pour améliorer le BCG
On identifie deux axes majeurs de développement de nouveaux candidats vaccins antituberculeux : (i) les vaccins vivants atténués, qui consistent en M. bovis BCG génétiquement amélioré ou des mutants atténués de M. tuberculosis, et (ii) les vaccins sous-unitaires, qui consistent en un nombre restreint d’antigènes, vectorisés et/ou formulés dans des adjuvants appropriés. La primo-vaccination par un vaccin vivant atténué, suivie d’une vaccination de rappel (« boost ») par un vaccin sous-unitaire, semble constituer un consensus vers lequel tendent les stratégies mises en place par la communauté d’experts. Dans notre unité de recherche à l’Institut Pasteur, nous travaillons essentiellement sur le développement de candidats vaccins vivants atténués.
Les connaissances en génétique, microbiologie et immunologie ont considérablement progressé grâce à l’analyse de la séquence du génome complet de M. tuberculosis (12) et de celui du BCG (13). L’événement génétique principal à l’origine de l’atténuation de la virulence du BCG est la délétion d’une région génomique d’environ 10 kb, chez le BCG, nommée région de différence 1 (RD1) (14). Cette région comporte les gènes codant pour les éléments d’une machinerie de sécrétion très sophistiquée et spécialisée, dite « système de sécrétion de type VII » ou « ESX-1 ». Cette machinerie, logée dans la membrane cellulaire des mycobactéries, est à l’origine de l’export et de la sécrétion des protéines Esx de faible poids moléculaire vers le milieu extérieur de la bactérie au travers d’une paroi très dense et hydrophobe (15, 16). Certaines de ces protéines secrétées représentent des facteurs de virulence.
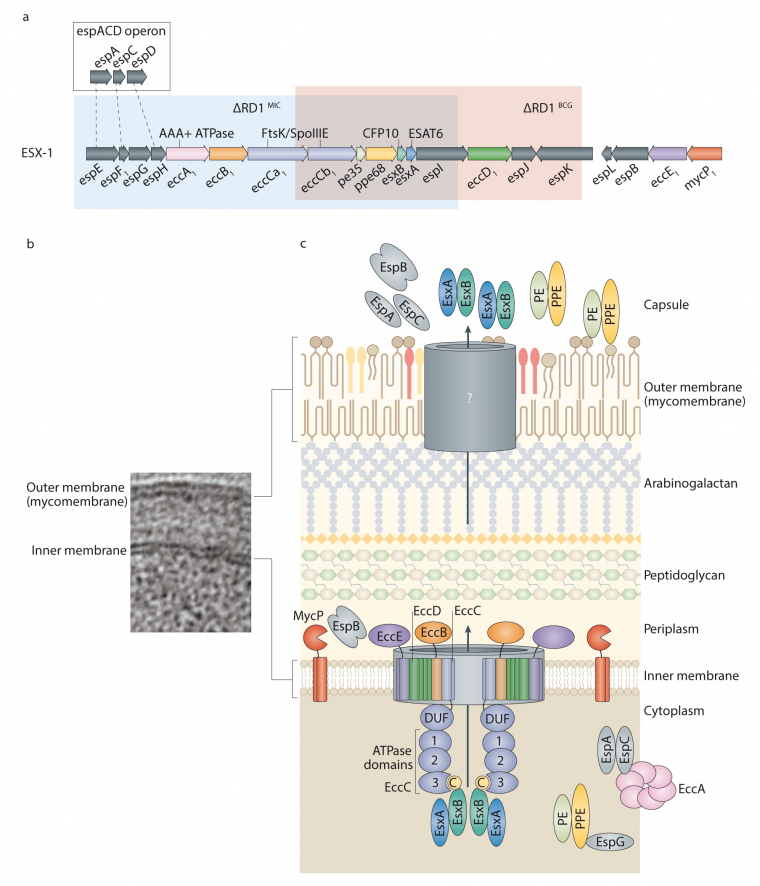
a. L’organisation de la région génomique codant pour les protéines du système de sécrétion ESX-1, de M. tuberculosis et de l’opéron « espACD » en amont de cette région. La région ESX-1 comprend les gènes codant pour l’antigène EsxA (aussi appelé ESAT-6) et sa chaperonne EsxB (également connue sous le nom de CFP-10), d’autres substrats nommés « Esp » (voir ci-dessous), mais aussi pour des protéines nommées « Ecc ». Ces dernières sont des composantes structurales de la machinerie de sécrétion ESX-1. Noter les segments « ΔRD1 » surlignés en rouge ou en bleu qui correspondent respectivement aux parties délétées chez M. bovis BCG ou chez une mycobactérie naturellement atténuée appelée Mycobacterium microti. b. Une image de microscopie électronique montrant les membranes interne et externe (dite aussi mycomembrane) de mycobactérie. La partie externe est composée d’une structure très dense et hydrophobe, riche en lipoprotéines, glycoprotéines et glycolipides, nécessitant divers appareils de sécrétion tels que ESX-1 en vue de l’export et la sécrétion de différents composés de mycobactéries, y compris les facteurs de virulence, vers le milieu extérieur. c. Schéma de l’appareil de sécrétion ESX (selon les données très récemment obtenues par analyses de particules(17) et des substrats sécrétés par la machinerie ESX-1. La plupart des composants identifiés jusqu’ici se localisent dans la membrane interne. Les composantes de la machinerie ESX-1 qui seraient localisées dans la mycomembrane restent encore à identifier. En plus des substrats EsxA et EsxB, on note la sécrétion des protéines : (i) « PE » et « PPE », ainsi appelées car elles comportent des motifs conservés Pro-Glu (PE) ou Pro-Pro-Glu (PPE) à leur extrémité N-terminale, et (ii) une famille dite « Esp » pour « Esx-1 secreted proteins ».
Une hypothèse a été émise selon laquelle l’inefficacité du vaccin BCG proviendrait de sa sur-atténuation, liée à la perte de la région RD1, d’où sa persistance trop écourtée chez l’hôte pour induire efficacement des réponses protectrices. De même, cette délétion entraîne l’absence d’expression de nombreux antigènes à capacité protectrice qui sont codés dans la région RD1 et sécrétés par le système ESX-1. L’idée de la complémentation génétique du BCG par la région RD1 de M. tuberculosis a donc rapidement émergée. L’évolution des outils de génomique, depuis le début des années 2000, a rendu possible la complémentation du génome des mycobactéries au moyen des cosmides intégratifs, permettant d’y insérer stablement de larges fragments chromosomiques. La complémentation génétique du BCG par RD1 de M. tuberculosis a donc donné lieu à « BCG::ESX-1Mtb » qui a non seulement ouvert des perspectives enthousiasmantes pour améliorer le BCG en tant que vaccin vivant atténué de seconde génération, mais a aussi permis de mettre en évidence la contribution de différents constituants de la machinerie ESX-1 dans le processus de sécrétion de nombreuses protéines de mycobactéries à rôles déterminants (14, 18-21)
Le système ESX-1, pierre angulaire de l’immunogénicité mais aussi de la pathogenèse de M. tuberculosis
L’appareil de sécrétion ESX-1 (Figure 2) est responsable de l’export et la sécrétion de toute une batterie de protéines (ou « substrats ») de faibles poids moléculaires : EsxA, EsxB, EspA, EspC… (15, 16). Probablement grâce à leurs petites tailles, mais aussi à leur sécrétion abondante et active, ces protéines gagnent facilement accès aux machineries de présentation antigénique par les molécules du complexe majeur d’histo-compatibilité (CMH) de classe I et II situés respectivement dans le cytosol et le système endosomal/phagosomal de l’hôte. Ces protéines constituent donc des immunogènes puissants pour l’hôte. Par ailleurs, ces protéines sont aussi des facteurs de virulence, car elles interviennent activement dans le processus que la mycobactérie déclenche pour ne pas être éliminée par la cellule hôte. Or, il est admis que l’immunité adaptative contre les facteurs de virulence a plus de chance d’être protectrice.
Immunogènes et facteurs de virulence
Un immunogène est une molécule reconnue par le système immunitaire de l’hôte comme un corps étranger et contre lequel il met en place une réponse immunitaire spécifique.
Les facteurs de virulence sont des composés produits par des agents pathogènes qui leur permettent d’attaquer les cellules ou les tissus de l’hôte, de coloniser l’hôte, voire de contourner les différents mécanismes de défense et les réponses immunitaires mis en place par l’hôte. Ces composés permettent donc aux agents pathogènes de se multiplier ou de persister chez l’hôte afin d’exercer leur pouvoir pathogénique.
Comparé au BCG parental, le BCG::ESX-1Mtb persistait plus longtemps chez l’hôte vacciné, provoquait des recrutements des cellules immunitaires innées de façon plus robuste avec des inflammations plus marquées, comme observés dans le modèle préclinique de souris. Par ailleurs, le BCG::ESX-1Mtb induisait des réponses immunitaires adaptatives de type proliférative et Th1 spécifiques des antigènes codés par RD1. Lorsqu’utilisé comme candidat vaccin, le BCG::ESX-1Mtb protégeait mieux les souris ou les cobayes contre une souche virulente de M. tuberculosis (21). Cependant, le BCG::ESX-1Mtb manifestait un regain assez important de virulence, ce qui a empêché son utilisation comme vaccin à innocuité acceptable. De nombreuses manipulations génétiques ont été depuis réalisées sur la région RD1 du BCG::ESX-1Mtb pour tenter de préserver son immunogénicité avantageuse tout en s’affranchissant de l’augmentation de sa virulence, sans toutefois atteindre cet optimum. En effet, l’immunogénicité des antigènes de RD1 et la virulence des mycobactéries allaient toujours de pair…
Nouveau détour vers les avancées les plus récentes
La comparaison du BCG parental avec le BCG::ESX-1Mtb d’une part (21) et la délétion génomique de la région RD1 chez M. tuberculosis d’autre part (22) ont ouvert la voie à la découverte d’innombrables impacts de l’appareil de sécrétion ESX-1 dans l’interaction des mycobactéries avec le système immunitaire de l’hôte et les mécanismes de pathogenèse mis en jeu par les mycobactéries. L’appareil de sécrétion ESX-1 et les facteurs de virulence qu’il sécrète conditionnent en effet la persistance intracellulaire du bacille, son interférence avec la présentation antigénique et la subversion de l’arsenal immunitaire et bactéricide déployé par l’hôte.
M. tuberculosis est un bacille immobile et intracellulaire, de croissance très lente, qui une fois internalisé par les macrophages ou les cellules dendritiques, se loge dans le phagosome. Afin de survivre dans cet organite, M. tuberculosis inhibe la fusion des phagosomes avec les lysosomes, empêchant ainsi sa digestion par les enzymes lysosomales et persistant dans les cellules de façon chronique. Depuis leur habitat de prédilection remodelé, les mycobactéries pourvues du système de sécrétion ESX-1 et des lipides de virulence (PDIM/DIM) parviennent à endommager la membrane délimitant les phagosomes et à établir un certain contact entre le phagosome et le cytosol, et ce dès quelques heures après la phagocytose (5-7).
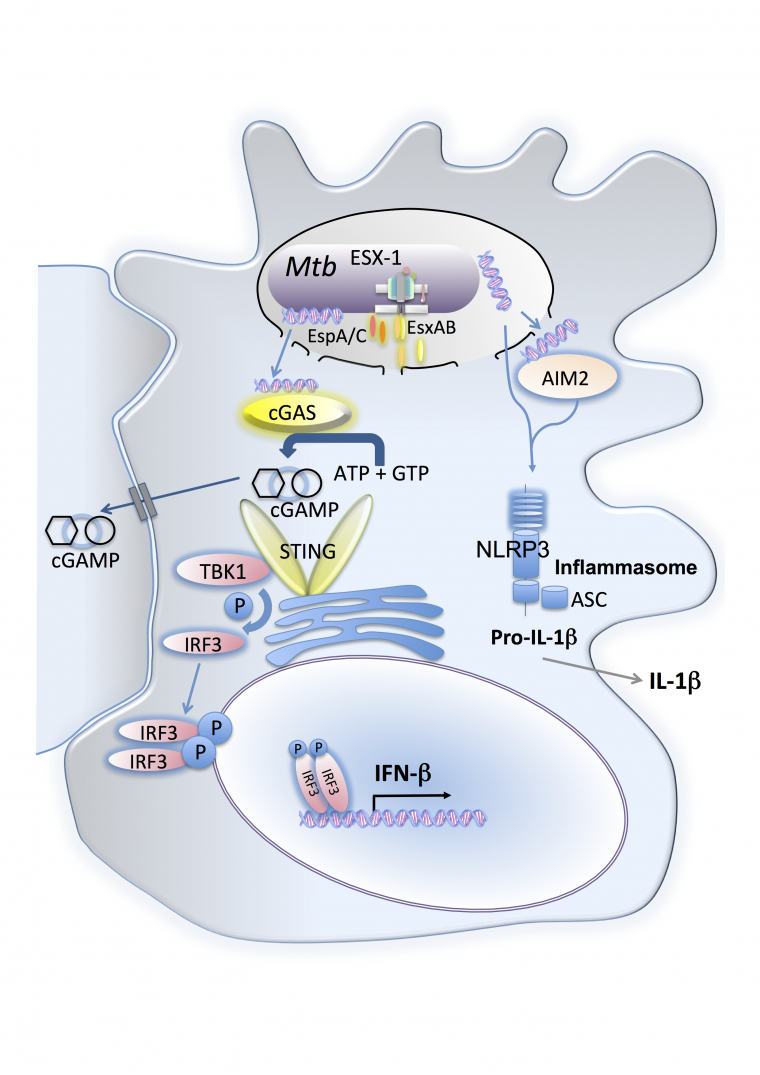
Il est aujourd’hui admis que, grâce à cette communication entre le phagosome et le cytosol, l’ADN de la mycobactérie peut accéder aux récepteurs cytosoliques du système immunitaire inné et notamment l’enzyme cGas (cyclic GMP–AMP synthase) qui va alors synthétiser des GMP et AMP cycliques (Figure 3). Ces derniers messagers sont reconnus à leur tour par le récepteur STING (stimulator of interferon genes), ce qui activera un axe de stimulation intracellulaire menant à la transcription des gènes codant des interférons de type I (IFN-I), des médiateurs inflammatoires très pléïotropiques (23-25). Par ailleurs, cette communication entre le phagosome et le cytosol donne lieu à la détection des composants des mycobactéries par des éléments de l’inflammasome localisés dans le cytosol. L’inflammasome est un imposant complexe moléculaire, capable de détecter des motifs bactériens et de cliver rapidement des pro-cytokines comme pro-IL-1β et pro-IL18 en cytokines actives, sans nécessiter de mécanismes transcriptionnels laborieux (Figure 3).
Un des principaux facteurs de virulence de M. tuberculosis (Mtb), EsxA, sécrété avec d’autres composés par le système ESX-1, induit des ruptures dans la membrane du phagosome à l’intérieur du macrophage infecté. Il est admis que cet événement déclenche la translocation cytosolique des composants de mycobactérie comme l’ADN double brin. (i) Ce dernier est détecté par le cGAS, qui synthétise le second messager cGAMP. Ce dernier active le STING associé au réticulum endoplasmique et la voie de signalisation qui induit la transcription des IFN de type I. cGAMP peut également se transmettre à des macrophages avoisinants non-infectés et les activer. (ii) L’ADN mycobactérien cytosolique peut également être détecté par AIM-2, un détecteur lié à l’inflammasome, ce qui renforce l’activation de cette voie et augmente la production et la sécrétion rapide de l'IL-1β active à partir du pro-IL-1β.
Comment trouver une nouvelle approche qui permette d’exploiter ces propriétés attrayantes, toutes liées au fonctionnement de la machinerie d’ESX-1, en vue de l’amélioration génétique du BCG ?
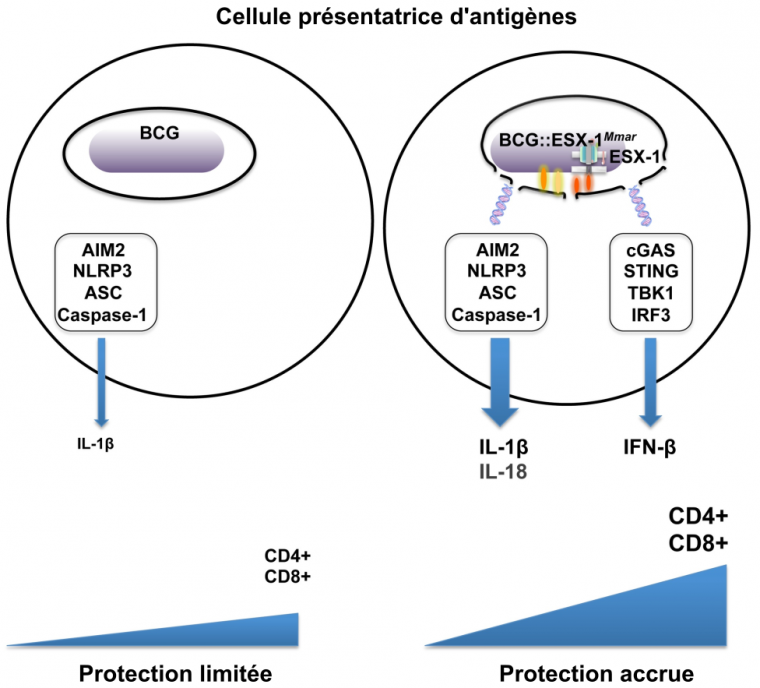
BCG::ESX-1Mmar :un candidat vaccin prometteur de troisième génération
À l’instar de M. tuberculosis, Mycobacterium marinum, un pathogène des organismes aquatiques, possède un système de sécrétion ESX-1. Notre raisonnement a été de complémenter le BCG, non pas par l’ESX-1 de M. tuberculosis mais par l’appareil homologue provenant de M. marinum (26). Le BCG::ESX-1Mmar ainsi génétiquement élaboré secrète très efficacement les homologues d’EsxA et EsxB provenant de M. marinum. Ces protéines présentent suffisamment d’homologies de séquences en acides aminés avec leurs homologues dérivés de M. tuberculosis pour induire des réponses immunitaires T qui reconnaîtront les antigènes d’ESX-1 de M. tuberculosis. Cependant, à l’évidence, les quelques substitutions en acides aminés entre les éléments des deux systèmes ESX-1 empêchent le regain des fonctions impliquées dans la virulence. En effet, le BCG::ESX-1Mmar est à peine plus virulent que le BCG parental et nettement moins que le BCG::ESX-1Mtb chez des souris immuno-déficientes.
Une des propriétés de la souche BCG::ESX-1Mmar, comme le BCG::ESX-1Mtb, est sa capacité à activer le système immunitaire inné de l’hôte de façon plus robuste que le BCG. Dans les conditions intraphagosomales, le système ESX-1 reconstitué de BCG::ESX-1Mmar semble alors capable d’endommager la membrane des phagosomes des cellules dendritiques ou des macrophages et d’établir un contact cytosolique. Il en résulte l’activation de la production des IFN-I et l’augmentation de la production d’IL-1β, comme développées ci-dessus. Ces propriétés de l’immunité innée sont accompagnées des réponses adaptatives améliorées induites par cette souche. En effet, le BCG::ESX-1Mmar possède comme le BCG::ESX-1Mtb un répertoire antigénique plus large que le BCG puisque tous les antigènes de RD1 que nous avons pu étudier sont sécrétés par cette souche et induisent chez l’hôte vacciné des lymphocytes T CD4+ de type Th1 et polyfonctionnels spécifiques de ces antigènes. Un autre avantage du BCG::ESX-1Mmar est sa capacité à mettre en place des réponses T CD8+ spécifiques des antigènes partagés par le BCG parental, mais à des fréquences jusqu’à 5 à 7 fois supérieures (26).
Lorsqu’utilisé comme candidat vaccin dans le modèle préclinique de souris, le BCG::ESX-1Mmar confère une protection plus significative que le BCG parental, comparable à celle induite par le BCG::ESX-1Mtb mais avec l’avantage d’être dépourvue de virulence notable. Dans le modèle de souris, le BCG::ESX-1Mmar non seulement protège efficacement contre la souche de M. tuberculosis de laboratoire mais également contre des souches hyper virulentes des familles Beijing ou Harlem (26). Le mode de fonctionnement du candidat vaccin BCG::ESX-1Mmar peut se résumer comme dans la Figure 4.
L’activation renforcée de l’immunité innée par l’appareil de sécrétion ESX-1 a pour conséquence l’amélioration des réponses T CD4+ et T CD8+ induites par BCG::ESX-1Mmar, ce qui est corrélé avec une protection améliorée lors d’une infection par M. tuberculosis virulent dans le modèle préclinique de souris.
Conclusions
Les résultats présentés dans cette revue montrent clairement que les réponses immunitaires induites par un vaccin antituberculeux qui a la capacité d’établir le contact avec le cytosol de la cellule hôte sont qualitativement et quantitativement plus protectrices. Par conséquent, ces données ouvrent de nouvelles perspectives en vue de la mise au point d’un vaccin plus efficace contre les différentes pathologies provoquées par M. tuberculosis. Ce concept basé sur la recherche en biologie cellulaire et immunologie est donc prometteur pour développer des vaccins de nouvelle génération.
Financements
Les auteurs remercient le soutien financier de l’Union Européenne (consortium TBVAC2020, No. 643381), de la Fondation pour la Recherche Médicale (FRM) DEQ20130326471, le LabEx IBEID (Laboratoire d’Excellence Biologie Intégrative des maladies infectieuses émergentes) et du Programme Transversal de Recherche PTR No 441 de l’Institut Pasteur.
Références
- WHO. 2015. World Health Organization, Global Tuberculosis Report 2015, Geneva, Switzerland. http://wwwwhoint/tb/publications/global_report/en/.
- Boritsch EC, Brosch R. 2016. Evolution of Mycobacterium tuberculosis: New Insights into Pathogenicity and Drug Resistance. Microbiol Spectr 4.
- WHO. 2015. http://www.who.int/tb/strategy/stop_tb_strategy/fr/.
- Russell DG. 2003. Phagosomes, fatty acids and tuberculosis. Nat Cell Biol 5:776-778.
- Augenstreich J, Arbues A, Simeone R, Haanappel E, Wegener A, Sayes F, Le Chevalier F, Chalut C, Malaga W, Guilhot C, Brosch R, Astarie-Dequeker C. 2017. ESX-1 and phthiocerol dimycocerosates of Mycobacterium tuberculosis act in concert to cause phagosomal rupture and host cell apoptosis. Cell Microbiol doi:10.1111/cmi.12726.
- Simeone R, Bobard A, Lippmann J, Bitter W, Majlessi L, Brosch R, Enninga J. 2012. Phagosomal rupture by Mycobacterium tuberculosis results in toxicity and host cell death. PLoS Pathog 8:e1002507.
- Simeone R, Sayes F, Song O, Groschel MI, Brodin P, Brosch R, Majlessi L. 2015. Cytosolic Access of Mycobacterium tuberculosis: Critical Impact of Phagosomal Acidification Control and Demonstration of Occurrence In Vivo. PLoS Pathog 11:e1004650.
- Van der Wel N, Hava D, Houben D, Fluitsma D, van Zon M, Pierson J, Brenner M, Peters PJ. 2007. M. tuberculosis and M. leprae translocate from the phagolysosome to the cytosol in myeloid cells. Cell 129:1287-1298.
- Ramakrishnan L. 2012. Revisiting the role of the granuloma in tuberculosis. Nat Rev Immunol 12:352-366.
- Pai M, Behr MA, Dowdy D, Dheda K, Divangahi M, Boehme CC, Ginsberg A, Swaminathan S, Spigelman M, Getahun H, Menzies D, Raviglione M. 2016. Tuberculosis. Nat Rev Dis Primers 2:16076.
- Levy-Bruhl D, Barrault Y, Decludt B, Schwoebel V, group du travail du Comite technique des vaccinations sur la revaccination BCG. 2003. [BCG and tuberculin tests: evolutions of French vaccinal policy]. Arch Pediatr 10:482-486.
- Cole ST, Brosch R, Parkhill J, Garnier T, Churcher C, Harris D, Gordon SV, Eiglmeier K, Gas S, Barry CE, 3rd, Tekaia F, Badcock K, Basham D, Brown D, Chillingworth T, Connor R, Davies R, Devlin K, Feltwell T, Gentles S, Hamlin N, Holroyd S, Hornsby T, Jagels K, Krogh A, McLean J, Moule S, Murphy L, Oliver K, Osborne J, Quail MA, Rajandream MA, Rogers J, Rutter S, Seeger K, Skelton J, Squares R, Squares S, Sulston JE, Taylor K, Whitehead S, Barrell BG. 1998. Deciphering the biology of Mycobacterium tuberculosis from the complete genome sequence. Nature 393:537-544.
- Brosch R, Gordon SV, Garnier T, Eiglmeier K, Frigui W, Valenti P, Dos Santos S, Duthoy S, Lacroix C, Garcia-Pelayo C, Inwald JK, Golby P, Garcia JN, Hewinson RG, Behr MA, Quail MA, Churcher C, Barrell BG, Parkhill J, Cole ST. 2007. Genome plasticity of BCG and impact on vaccine efficacy. Proc Natl Acad Sci U S A 104:5596-5601.
- Pym AS, Brodin P, Brosch R, Huerre M, Cole ST. 2002. Loss of RD1 contributed to the attenuation of the live tuberculosis vaccines Mycobacterium bovis BCG and Mycobacterium microti. Mol Microbiol 46:709-717.
- Groschel MI, Sayes F, Simeone R, Majlessi L, Brosch R. 2016. ESX secretion systems: mycobacterial evolution to counter host immunity. Nat Rev Microbiol 14:677-691.
- Majlessi L, Prados-Rosales R, Casadevall A, Brosch R. 2015. Release of mycobacterial antigens. Immunol Rev 264:25-45.
- Beckham K, Ciccarelli L, Bunduc C, HD. M, Ummels R, Lugmayr W, Mayr J, Rettel M, Savitski M, Svergun D, Bitter W, Wilmanns M, Marlovits T, Parret A, Houben E. 2017. Structure of the mycobacterial ESX-5 type VII secretion system membrane complex by single-particle analysis. Nat Microbiol Apr 10;2:17047. .
- Brodin P, de Jonge MI, Majlessi L, Leclerc C, Nilges M, Cole ST, Brosch R. 2005. Functional analysis of early secreted antigenic target-6, the dominant T-cell antigen of Mycobacterium tuberculosis, reveals key residues involved in secretion, complex formation, virulence, and immunogenicity. J Biol Chem 280:33953-33959.
- Brodin P, Majlessi L, Marsollier L, de Jonge MI, Bottai D, Demangel C, Hinds J, Neyrolles O, Butcher PD, Leclerc C, Cole ST, Brosch R. 2006. Dissection of ESAT-6 system 1 of Mycobacterium tuberculosis and impact on immunogenicity and virulence. Infect Immun 74:88-98.
- Majlessi L, Brodin P, Brosch R, Rojas MJ, Khun H, Huerre M, Cole ST, Leclerc C. 2005. Influence of ESAT-6 secretion system 1 (RD1) of Mycobacterium tuberculosis on the interaction between mycobacteria and the host immune system. J Immunol 174:3570-3579.
- Pym AS, Brodin P, Majlessi L, Brosch R, Demangel C, Williams A, Griffiths KE, Marchal G, Leclerc C, Cole ST. 2003. Recombinant BCG exporting ESAT-6 confers enhanced protection against tuberculosis. Nat Med 9:533-539.
- Hsu T, Hingley-Wilson SM, Chen B, Chen M, Dai AZ, Morin PM, Marks CB, Padiyar J, Goulding C, Gingery M, Eisenberg D, Russell RG, Derrick SC, Collins FM, Morris SL, King CH, Jacobs WR, Jr. 2003. The primary mechanism of attenuation of bacillus Calmette-Guerin is a loss of secreted lytic function required for invasion of lung interstitial tissue. Proc Natl Acad Sci U S A 100:12420-12425.
- Collins AC, Cai H, Li T, Franco LH, Li XD, Nair VR, Scharn CR, Stamm CE, Levine B, Chen ZJ, Shiloh MU. 2015. Cyclic GMP-AMP Synthase Is an Innate Immune DNA Sensor for Mycobacterium tuberculosis. Cell Host Microbe 17:820-828.
- Wassermann R, Gulen MF, Sala C, Perin SG, Lou Y, Rybniker J, Schmid-Burgk JL, Schmidt T, Hornung V, Cole ST, Ablasser A. 2015. Mycobacterium tuberculosis Differentially Activates cGAS- and Inflammasome-Dependent Intracellular Immune Responses through ESX-1. Cell Host Microbe 17:799-810.
- Watson RO, Bell SL, MacDuff DA, Kimmey JM, Diner EJ, Olivas J, Vance RE, Stallings CL, Virgin HW, Cox JS. 2015. The Cytosolic Sensor cGAS Detects Mycobacterium tuberculosis DNA to Induce Type I Interferons and Activate Autophagy. Cell Host Microbe 17:811-819.
- Groschel MI, Sayes F, Shin SJ, Frigui W, Pawlik A, Orgeur M, Canetti R, Honore N, Simeone R, van der Werf TS, Bitter W, Cho SN, Majlessi L, Brosch R. 2017. Recombinant BCG Expressing ESX-1 of Mycobacterium marinum Combines Low Virulence with Cytosolic Immune Signaling and Improved TB Protection. Cell Rep 18:2752-2765.