Le diabète de type 1 est une maladie auto-immune, d’origine multifactorielle, qui se caractérise par une hyperglycémie chronique liée à la destruction des cellules β des îlots de Langerhans du pancréas par des lymphocytes T cytotoxiques auto-immuns. Le traitement de référence consiste en une administration d’insuline exogène pour restaurer l’équilibre glycémique. En parallèle, différents types de thérapies ont été développées ces dernières années : moléculaires, cellulaires, pancréas artificiels…
Le diabète de type 1 apparaît majoritairement avant l’âge de 20 ans, mais également plus tardivement (30 % des nouveaux diagnostiqués ont plus de 30 ans). Cependant, la maladie est souvent plus agressive chez l’enfant. Le nombre de nouveaux cas détectés a doublé au cours des 25 dernières années et l’incidence de cette maladie ne cesse d’augmenter (entre 3 et 4 % par an). Le diabète de type 1 concerne 10 % des cas de diabète en France, soit environ 300 000 personnes 1.
Chez une personne atteinte de diabète de type 1, la destruction des cellules β des îlots de Langerhans est à l'origine d'un déficit de production d'insuline. Comprendre cette maladie nécessite donc de rappeler le rôle joué par l'insuline dans la régulation de la glycémie.
Rôle de l’insuline dans la régulation de la glycémie
Malgré l’irrégularité des apports alimentaires, chez un individu sain à jeun, la glycémie, c'est-à-dire le taux de glucose sanguin, est maintenue à peu près constante, dans une fourchette comprise entre 0,7 et 1,1 g/L (4 à 6 mmol/L, Figure 1). Le glucose étant l’un des substrats énergétiques majeurs d’un certain nombre de tissus, il est essentiel que cette molécule puisse être libérée ou stockée en fonction des besoins. Ce contrôle de la glycémie est assuré par des hormones agissant directement sur celle-ci, qu'elles soient hypoglycémiantes (telle que l’insuline) ou hyperglycémiantes (telles que le glucagon, l’adrénaline ou, à plus long terme, le cortisol), mais également par des molécules régulant la libération de ces hormones. À titre d'exemples, les incrétines stimulent la libération d'insuline et inhibent celle du glucagon, tandis que la somatostatine inhibe la sécrétion d'insuline et de glucagon.
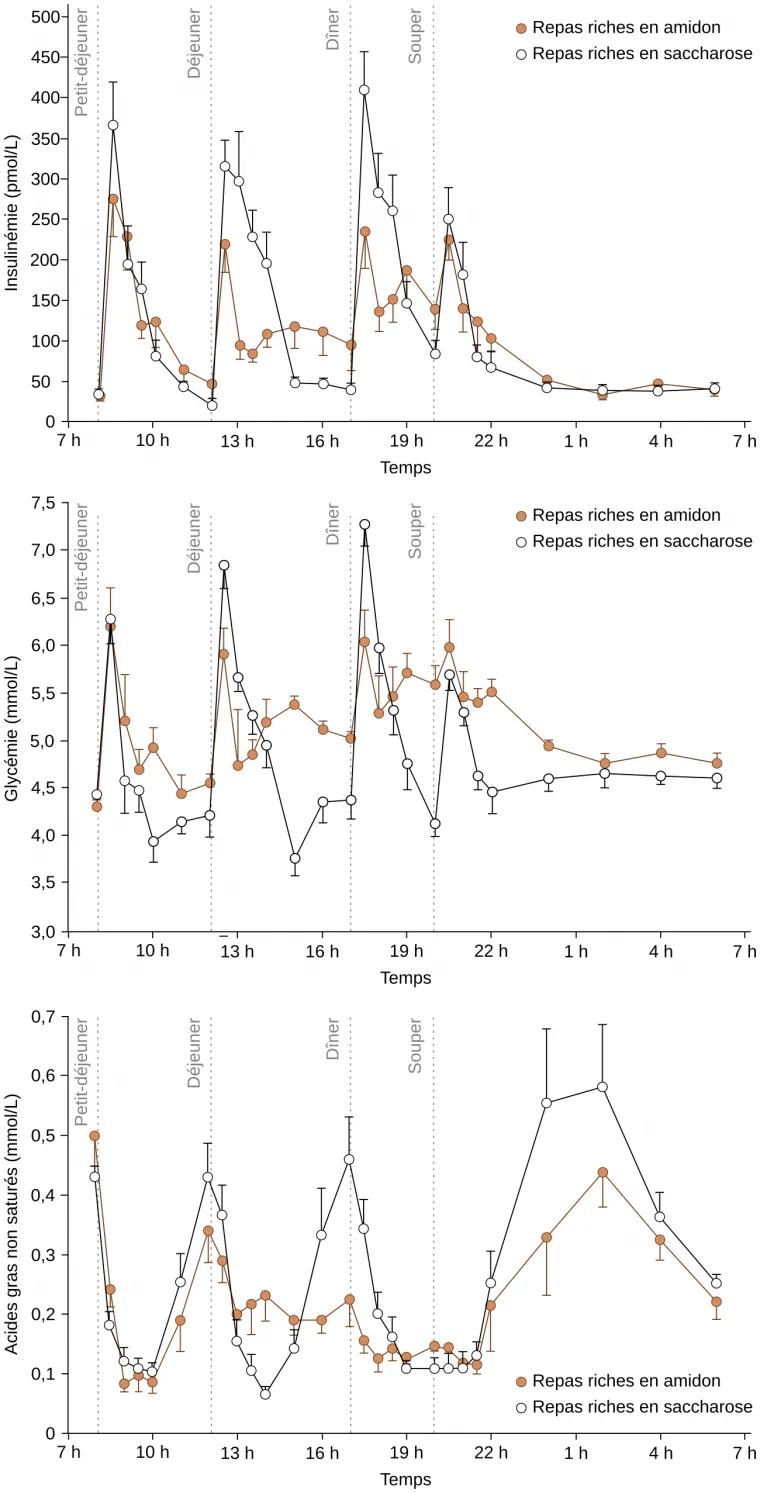
Les glycémies et insulinémies de huit personnes (quatre femmes, quatre hommes) en bonne santé (en particulier, non atteints de diabète) ont été mesurées régulièrement pendant 24 heures. Durant la journée de mesures, les personnes reçoivent 50 % de leurs apports énergétiques soit sous forme de saccharose (fraises, meringues, sucre, tomates…), soit sous forme d’amidon (riz soufflé, pain, pommes de terre…). Chaque point représente la valeur moyenne pour les huit individus ; la barre associée à chaque point correspond à l’erreur type de la moyenne. L'étude a été réalisée à l'université de Newcastle (Angleterre), ce qui explique l'organisation des repas, différente de celle habituellement constatée en France. Les données sont issues de Daly et coll., 1998 1, article dans lequel la composition précise de chaque repas est détaillée.
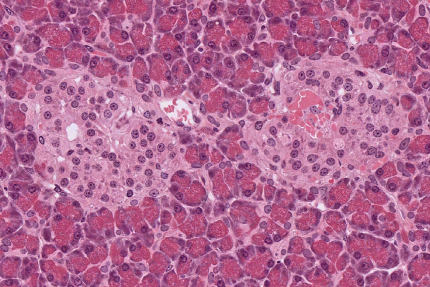
Le pancréas est constitué de cellules acineuses pancréatiques, qui apparaissent foncées. Elles sont impliquées dans la fonction exocrine du pancréas : la sécrétion d'enzymes digestives. Au centre de l'image, deux îlots de Langerhans apparaissent plus clairs. Ces îlots remplissent la fonction endocrine du pancréas avec notamment la sécrétion d'insuline par les cellules β et de glucagon par les cellules α. Observation en microscopie optique, coloration hématoxyline-éosine. Source : collection de l'université du Mississippi.
L’insuline est sécrétée par les cellules β des îlots de Langerhans du pancréas (Figure 2). Elle a un rôle majeur dans le maintien de l’homéostasie glucidique par ses actions qui facilitent, d’une part, l’utilisation et le stockage du glucose, et d’autre part l’inhibition des mécanismes susceptibles de faire augmenter sa concentration plasmatique.
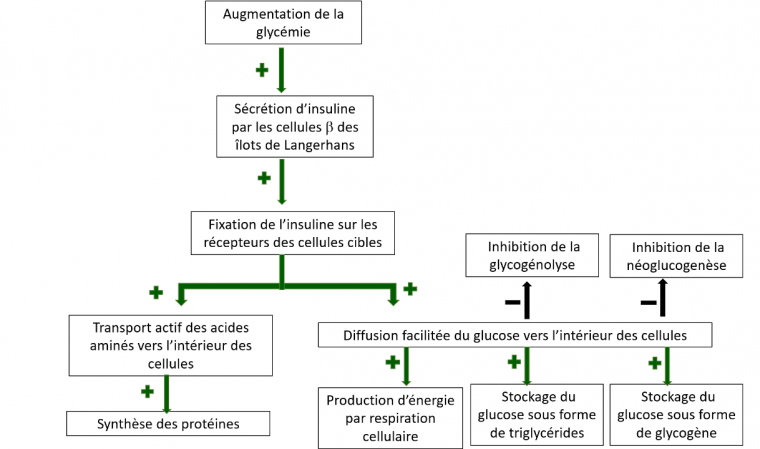
Ainsi, après un repas riche en glucides, l’élévation du taux de glucose sanguin déclenche la sécrétion d’insuline (Figure 3). Suite à son transport par le sang, cette hormone se lie aux récepteurs membranaires présents à la surface des cellules des organes cibles (foie, tissu adipeux et muscles squelettiques) et y exerce de nombreux effets. Parmi ceux-ci, l’insuline permet notamment la diffusion facilitée du glucose dans ces cellules, en provoquant une augmentation du nombre de transporteurs au glucose au niveau de la membrane plasmique. L’insuline stimule également le transport actif des acides aminés vers l’intérieur des cellules et facilite la synthèse protéique. Au sein des cellules hépatiques et musculaires, la glycogenèse, c’est-à-dire la mise en réserve du glucose sous forme de glycogène, est stimulée. Si les capacités de stockage en glycogène sont saturées, le glucose est converti en acides gras qui sont alors stockés sous forme de triglycérides dans les adipocytes. L’insuline sécrétée au moment du repas inhibe la glycogénolyse et la néoglucogenèse, évitant ainsi un apport simultané endogène et exogène de glucose et l’hyperglycémie qui pourrait en résulter.
Entre les repas, le foie libère du glucose à partir du glycogène (glycogénolyse), puis si la période de jeûne se prolonge (quelques heures), la néoglucogenèse est activée dans les cellules hépatiques. Cette voie métabolique correspond à la synthèse de novo de glucose à partir de précurseurs non glucidiques (tels que le pyruvate, le lactate, le glycérol et les acides aminés).
Chez les patients atteints de diabète de type 1, la production d’insuline est insuffisante à cause de la destruction des cellules β des îlots de Langerhans du pancréas par les lymphocytes T CD8+ cytotoxiques autoimmuns. Si de tels lymphocytes T sont également détectés dans le sang circulant de tout individu, malade ou non, ils ne sont présents en grand nombre que dans le pancréas des patients diabétiques de type 1. Ainsi, 60 à 70 % des patients atteints du diabète de type 1 présentent des lymphocytes T CD8+ autoréactifs infiltrant le pancréas et dirigés contre des antigènes de la préproinsuline. Ces lymphocytes ont la capacité de détruire des cellules β humaines in vitro 1. Les lymphocytes T cytotoxiques auto-immuns peuvent également être dirigés contre d’autres autoantigènes des cellules β.
Le diabète de type 1 qui, du fait de cette carence en insuline, est également appelé diabète insulino-dépendant, se traduit donc, en l’absence de traitement, par une glycémie élevée, supérieure à 1 g/L et pouvant atteindre plusieurs fois cette valeur. Cette situation d’hyperglycémie chronique est à l’origine de différents signes cliniques.
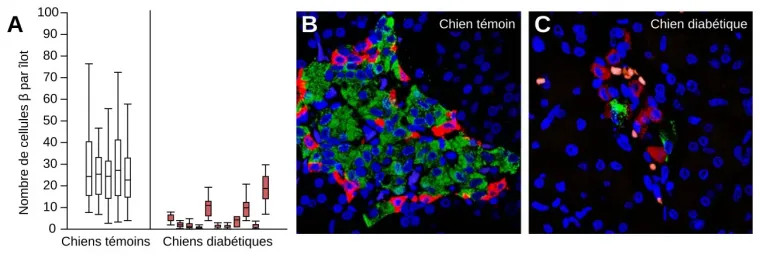
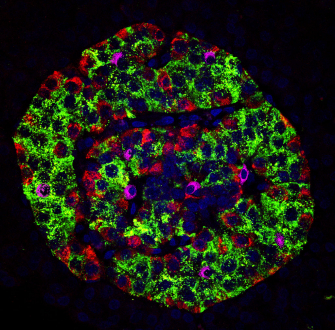
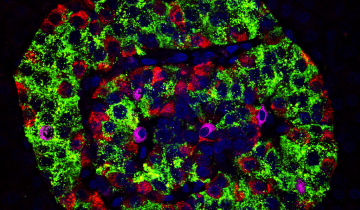
Les résultats présentés ici ont été obtenus chez des chiens témoins et chez des chiens atteints de diabète. Chez les chiens, le diabète est associé à une diminution du nombre de cellules β des îlots de Langerhans du pancréas, comme pour le diabète de type 1 de l’être humain.
A. Nombre de cellules β par îlot chez des chiens témoins (n = 5) et chez des chiens diabétiques (n = 11). Pour chaque chien, le rectangle représente la moyenne ± un écart-type, le trait horizontal la médiane et les traits verticaux l’étendue des valeurs.
B et C. Images en microscopie confocale d’un îlot de Langerhans de chien témoin (B) et de chien diabétique (C). Des anticorps anti-insuline et anti-glucagon, ainsi que du DAPI marquent respectivement les cellules β (vert), les cellules α (rouge) et les noyaux des cellules du pancréas (bleu).
Signes cliniques et diagnostic de la maladie
Le diabète de type 1 est caractérisé par les signes cliniques suivants : amaigrissement, sensation de faim et de soif, production importante d’urine, fatigue excessive, sensibilité accrue à différentes infections (peau, vessie, etc.), engourdissement ou fourmillement dans les mains et les pieds.
Quatre stades de la maladie peuvent être distingués :
- Au pré-stade 1, la présence d’un seul autoanticorps anti-îlot ne présage pas de l’évolution vers un diabète de type 1.
- Au stade 1, le patient est asymptomatique car la plupart des cellules β productrices d’insuline sont encore présentes et fonctionnelles. Cependant, l’autoimmunité anti-îlot est déjà en cours puisque ce stade est défini par la présence d’au moins deux autoanticorps anti-îlots et un début de destruction des cellules β.
- Au stade 2, le patient est toujours asymptomatique mais des tests métaboliques fins peuvent révéler une altération de la fonction pancréatique (un retard de sécrétion d’insuline à l’origine d’hyperglycémies transitoires) associé aux marqueurs d’autoimmunité. L’évolution vers un stade 3 est inéluctable.
- Au stade 3, l’insulinopénie profonde associée aux symptômes d’hyperglycémie aussi bien à jeun qu'en période postprandiale amènent le patient à consulter.
Le diagnostic est classiquement réalisé par des analyses biologiques. Chez les patients diabétiques, la glycémie à jeun est supérieure ou égale à 1,26 g/L, ce qui peut être confirmé par un test oral de tolérance au glucose. Ce test consiste à doser le glucose sanguin avant puis après la prise orale de 75 g de glucose, toutes les trente minutes pendant deux heures. Chez un individu sain, la glycémie retourne à sa valeur basale, tandis que chez les patients diabétiques, elle dépasse toujours la valeur de 1,98 g/L à la fin du test.
Les patients atteints du diabète de type 1 présentent également un taux d’hémoglobine glyquée (hémoglobine liée à une ou plusieurs molécules de glucose) supérieur 6 %, et la présence dans le sang d’anticorps dirigés contre les îlots de Langerhans.
Conséquences de la résistance à l’insuline et de l’hyperglycémie
Malgré l’hyperglycémie qui caractérise un sujet diabétique, la diminution drastique de la quantité d’insuline empêche l’organisme de mettre en place les mécanismes permettant la diminution du glucose dans le sang. Cet organisme ne pouvant utiliser le glucose présent en excès dans le sang, se comporte comme dans une situation de jeûne. Il s’ensuit une activation des mécanismes permettant de mettre en circulation le glucose : glycogénolyse, lipolyse (dégradation des lipides) et néoglucogenèse. Par conséquent, la quantité de glucose dans le sang augmente encore davantage, ce qui entraîne, au niveau des reins, le passage du glucose en excès dans l’urine (glycosurie). À cause de son pouvoir osmotique, ce surplus de glucose est responsable de la production d’un volume d’urine important (polyurie). Cela provoque également la diminution du volume sanguin et donc une déshydratation responsable d’une soif intense (polydipsie).
L’excès de glucose dans le sang augmente la viscosité de ce dernier, ce qui pose d’autres problèmes, dont les plus fréquents sont des atteintes du cristallin, des complications dégénératives de la rétine et des nerfs périphériques, des néphropathies, des lésions vasculaires périphériques ainsi que des infections cutanées fréquentes.
Lorsque le glucose ne peut servir de combustible cellulaire, l’organisme mobilise une quantité accrue d’acides gras qui passent dans le sang. Ce puisement dans les réserves est à l’origine de l’exagération de l’appétit et donc de la consommation d’aliments (la polyphagie). Dans les cas graves, la mobilisation accrue des triglycérides entraîne une forte augmentation des taux sanguins des acides gras et de leurs métabolites acides : les corps cétoniques. Leur accumulation est responsable d’une chute du pH sanguin, c’est l’acidocétose. Les corps cétoniques chargés négativement sont alors excrétés dans l’urine (cétonurie) entraînant avec eux des ions chargés positivement. Au départ, ce déséquilibre électrolytique cause des douleurs abdominales, des nausées et des vomissements. Afin de compenser l’acidose, les cellules tubulaires rénales sécrètent davantage d’ions H+ dans l’urine et réabsorbent plus de bicarbonate au niveau des tubules proximaux, permettant ainsi de tamponner l’acidité sanguine. Le système nerveux y réagit en instaurant une respiration rapide et profonde. Ceci permet une évacuation du dioxyde de carbone du sang et, l’élimination des ions H+ qui en découle, produit une augmentation du pH sanguin. Cependant, laissée sans traitement, cette acidocétose perturbe l’activité cardiaque et le transport du dioxygène, tandis que l’affaiblissement de l’activité nerveuse peut entraîner un coma voire la mort.
Le rôle des lymphocytes dans le diabète de type 1
Le diabète de type 1 est le résultat d’une destruction auto-immune des cellules β des îlots de Langerhans du pancréas par les lymphocytes T CD8+ cytotoxiques autoimmuns. La maladie se caractérise également par la présence de lymphocytes B réactifs aux antigènes des îlots de Langerhans donnant naissance à des cellules sécrétrices d’auto-anticorps. Cependant, ces anticorps ne jouent pas de rôle dans la destruction des cellules β. La contribution la plus importante des lymphocytes B autoréactifs à la pathologie semble être la présentation d’auto-antigènes aux cellules T 1 et les auto-anticorps ne sont qu’un biomarqueur diagnostique de la maladie.
Le rôle des lymphocytes T cytotoxiques autoréactifs
De nombreuses données expérimentales, issues de recherches menées aussi bien chez l’être humain que chez des modèles murins, ont mis en évidence le rôle majeur des lymphocytes T CD8⁺ dans la destruction des cellules β du pancréas, étape clé dans le déclenchement du diabète de type 1.
Le processus auto-immun peut commencer dès l’enfance et le taux de destruction auto-immune des cellules β varie considérablement d’un individu à l’autre. Par conséquent, l’âge auquel apparaissent les premiers symptômes est variable selon les patients (le plus souvent entre 5 et 20 ans, mais le déclenchement de la maladie peut-être plus tardif).
Chez l’être humain, des lymphocytes T CD8+ autoréactifs spécifiques de peptides d’îlots sont présents à des fréquences similaires dans le sang circulant d’individus sains et diabétiques de type 1. Ces lymphocytes sont majoritairement naïfs, ce qui suggère qu’ils ne sont pas directement impliqués dans le processus auto-immun 234. Seule une faible proportion de ces cellules adopte un phénotype mémoire effecteur (CD45RO+, CD57+, GrzB+) chez les patients diabétiques 56.
La situation est bien différente au niveau du pancréas : alors que les lymphocytes T autoréactifs sont absents de cet organe chez les individus non diabétiques, ils sont au contraire présents chez les patients atteints de diabète de type 1, apportant une preuve directe de leur implication dans le processus auto-immun 7. Chez les individus diabétiques, les lymphocytes T CD8+ qui infiltrent le pancréas sont dirigés contre divers antigènes des îlots, comme des peptides dérivés de la préproinsuline, de la glutamate décarboxylase 65 (GAD65) et de l’IGRP (islet-specific glucose-6-phosphatase catalytic subunit-related protein). Au début de la maladie, ces lymphocytes présentent un phénotype caractérisé par une diminution des marqueurs de l’état naïf (comme CD27 et CCR7), une augmentation de ceux liés à l’activation ou à la cytotoxicité (CD57, CD95, HLA-DR), et l’expression de molécules létales comme la perforine et les granzymes. Cela traduit leur capacité à détruire les cellules β, par des mécanismes reposant sur la reconnaissance spécifique de peptides présentés par le complexe majeur d’histocompatibilité (CMH).
Ces conclusions sont renforcées par l’étude des modèles murins, notamment les souris NOD (non obese diabetic). Dans ce modèle, les lymphocytes T CD8⁺ apparaissent dans les îlots bien avant les signes cliniques, et leur nombre augmente jusqu’à la destruction quasi complète des cellules β des îlots de Langerhans du pancréas. Par ailleurs, des transferts de clones T CD8⁺ spécifiques d’antigènes des cellules β permettent de déclencher la maladie chez des souris naïves ou immunodéprimées. À l’inverse, leur déplétion ou l’inhibition de leurs armes cytotoxiques (par exemple via la suppression du gène de la perforine) réduit nettement l’incidence du diabète 8.
Le rôle des lymphocytes T régulateurs
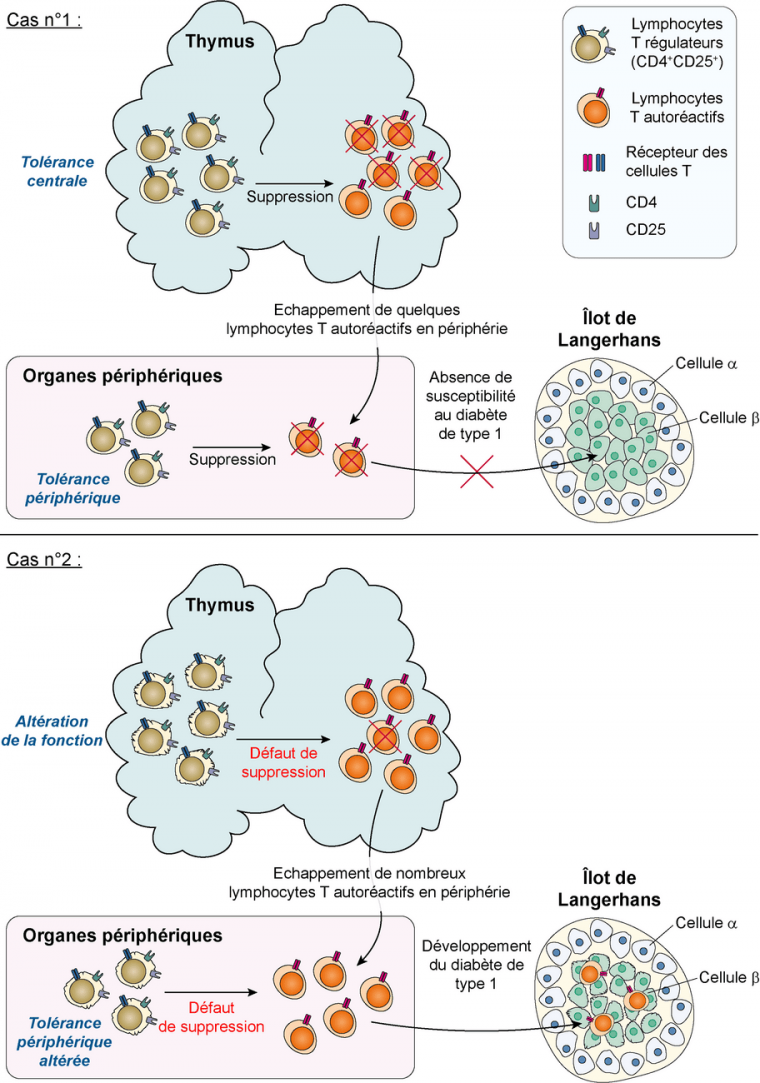
Chez les individus sains, un sous-type de lymphocytes T appelés lymphocytes T régulateurs (Treg) exprimant les molécules CD4 et CD25 (CD25 étant la sous-unité α du récepteur à l’IL2) modulent la réponse immunitaire ce qui permet d’éviter une attaque de l’organisme par lui-même (réaction autoimmune). Ils interviennent principalement lors des étapes de maturation des lymphocytes dans la moelle osseuse ou le thymus par suppression des lymphocytes potentiellement autoréactifs, c’est-à-dire qui reconnaîtraient avec une trop forte affinité des antigènes du soi et pourraient déclencher des processus auto-immuns.
Plusieurs équipes de chercheurs ont montré expérimentalement que le déclenchement du diabète de type 1 pourrait être lié au moins en partie aux lymphocytes T régulateurs, dont le dysfonctionnement aboutirait à la présence de lymphocytes autoréactifs en périphérie, provoquant la destruction des cellules β. La fréquence de ces cellules T régulatrices ne montre pas de différences entre les individus sains et les patients atteints de diabète de type 1, par contre leur fonction est altérée 91011.
De plus, des travaux chez la souris montrent qu’une absence de ces lymphocytes T régulateurs provoque l’apparition rapide d’un diabète de type 1, tandis que la reconstitution de cette population cellulaire permet de prévenir l’apparition de la maladie. L’ensemble de ces résultats traduit le rôle prépondérant de cette population de lymphocytes T dans la survenue de la maladie 1213.
Les cellules T régulatrices semblent jouer un rôle important dans le maintien de l’auto-tolérance par deux actions : d’une part en intervenant dans l’élimination des lymphocytes T autoréactifs dans le thymus et en périphérie, et d’autre part en modifiant les propriétés fonctionnelles d’autres cellules immunitaires dont les lymphocytes T CD4+ et CD8+ et les lymphocytes B. Les lymphocytes T régulateurs sont ainsi également capables de produire des cytokines qui suppriment la réponse immunitaire (par exemple les interleukine 10 et 35, ainsi que le TGF-β) 141516.
Dans le cas n°1 (individu sain), les lymphocytes T régulateurs orchestrent les mécanismes de suppression des lymphocytes T autoréactifs au niveau du thymus et en périphérie.
Dans le cas n°2 (individu diabétique), une altération de la fonction des lymphocytes T régulateurs induit l’échappement d’un grand nombre de lymphocytes T autoréactifs en périphérie, dirigés contre des antigènes des cellules β. Cela entraîne la destruction de ces cellules et l’apparition d’un diabète de type 1.
Une origine multifactorielle
Le diabète de type 1 possède une origine multifactorielle, mêlant susceptibilité génétique et facteurs environnementaux, ces derniers jouant un rôle particulièrement important au début de la vie 1.
Une origine génétique avec plusieurs gènes candidats
Bien qu’il n’existe pas un patron clair d’hérédité du diabète de type 1, de nombreuses études ont rapporté que la prédisposition génétique pouvait expliquer jusqu’à 50 % des risques. Il peut s’agir notamment d’antécédents familiaux 2.
Les gènes du complexe majeur d’histocompatibilité
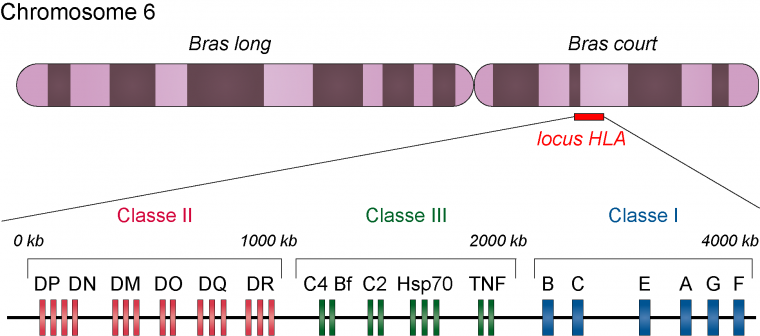
Les premiers loci liés au diabète de type 1 et constituant les facteurs de susceptibilité les plus importants sont les gènes du complexe majeur d’histocompatibilité (CMH) et plus particulièrement ceux du CMH de classe II. Chez l’être humain, le complexe majeur d’histocompatibilité est également appelé HLA (Human Leucocyte Antigens) et les gènes qui le compose sont situés dans une région qui s’étend sur environ 4 Mb sur le chromosome 6.
Les gènes du complexe majeur d’histocompatibilité (également appelé HLA chez l’être humain) sont situés sur le bras court du chromosome 6. Le CMH de classe I et celui de classe II sont impliqués dans la présentation des antigènes aux lymphocytes T. Les gènes de classe III codent diverses protéines qui jouent des rôles différents dans la réponse immunitaire, mais qui ne sont pas directement impliquées dans la présentation des antigènes.
Les gènes du CMH II codent un ensemble de glycoprotéines dimériques αβ situées à la surface des cellules présentatrices de l’antigène (cellules dendritiques, macrophages et lymphocytes B). C’est par le biais du CMH II que ces cellules présentent les antigènes aux lymphocytes T CD4. Il existe dans la population, de très nombreux allèles pour chacune des sous-unités α et β et les liens entre certains allèles CMH de classe II et des maladies auto-immunes telles que le diabète de type 1, l’arthrite rhumatoïde, la sclérose multiple sont largement documentés. Ainsi les individus présentant les allèles HLA-DR3-DQ2 et/ou HLA-DR4-DQ8 présentent le plus fort risque de développement du diabète de type 1.
Les mécanismes exacts par lesquels certains allèles des molécules du CMH de classe II confèrent une susceptibilité au diabète de type 1 ne sont pas encore entièrement connus. Un mécanisme impliqué pourrait être la perte de tolérance à des peptides clés de certains auto-antigènes, comme la préproinsuline, précurseur de l’insuline. Cette perte de tolérance serait liée à ces allèles particuliers du CMH de classe II et entraînerait la destruction auto-immune des cellules β 1.
L’association d’allèles du CMH de classe I avec le diabète de type 1 est bien moins importante que celle des allèles du CMH de classe II. Les deux allèles majeurs impliqués sont HLA-A*24 et HLA-B*39 23.
Le locus INS_VNTR
L’insuline est un auto-antigène majeur, cible des lymphocytes autoréactifs du diabète de type 1, tant dans les modèles murins que chez l’être humain 4. Chez ce dernier, les niveaux d’expression de l’insuline sont en partie contrôlés par une région de l’ADN située en amont du gène de l’insuline et contenant des courtes séquences répétées en tandem en nombre variable (INS_VNTR).
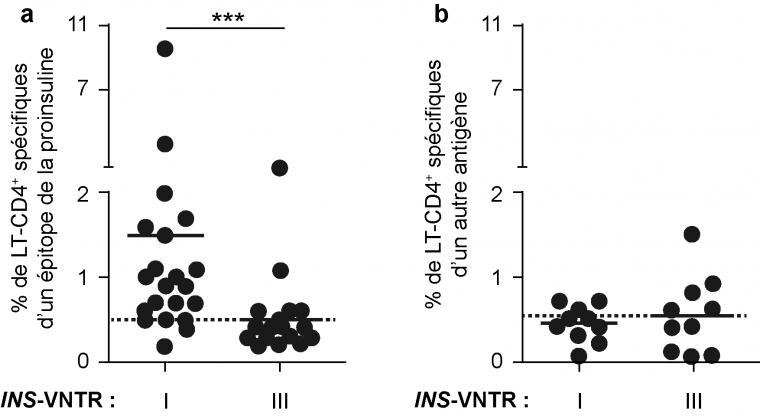
Le polymorphisme du locus INS_VNTR serait associé à une susceptibilité au diabète de type 1. Il existe ainsi des allèles protecteurs (classe III) associés à de très faibles niveaux de lymphocytes T autoréactifs et à l’inverse des allèles non protecteurs (classe I) présents chez les individus diabétiques associés à des niveaux élevés, en périphérie, de lymphocytes autoréactifs dirigés contre un épitope de l’insuline.
Chez les individus possédant des allèles à risque, l’ARNm de l’insuline et l’insuline elle-même sont moins exprimés dans le thymus. Ce niveau d’expression plus faible de l’insuline entraînerait une diminution de la sélection négative des lymphocytes T autoréactifs et permettrait ainsi à un plus grand nombre de s’échapper vers la périphérie augmentant la susceptibilité à la maladie 5.
Les sujets présentant des allèles INS-VNTR de classe I non protecteurs ont des niveaux élevés de lymphocytes T CD4+ spécifiques de la proinsuline comparativement aux sujets porteurs des allèles protecteurs de classe III de ce même locus. Il n’y a pas de différence entre ces sujets, concernant le pourcentage de lymphocytes T CD4+ spécifiques d’un autre antigène. Le symbole *** indique des différences statistiquement significatives.
Le gène CTLA-4
Le gène CTLA-4 code la protéine 4 associée aux lymphocytes T cytotoxiques (CTLA-4). Cette protéine se lie aux molécules CD80 et CD86 présentes sur les cellules présentatrices d’antigènes. Cette liaison agit comme un frein en réduisant l’activité des lymphocytes T notamment celle des lymphocytes T régulateurs.
Il existe différents variants du gène CTLA-4, dont certains diminuent l’efficacité de freinage exercée par CTLA-4. Les lymphocytes T auto-réactifs peuvent ainsi s’activer plus facilement contre les cellules du corps, notamment les cellules β du pancréas. Ceci engendre un risque accru de maladies auto-immunes dont le diabète de type 1 1.
Le gène IL2RA
Le gène IL2RA, code la sous-unité α du récepteur à l’IL-2, également appelée CD25. Cette protéine est exprimée par les lymphocytes T régulateurs CD4+CD25+, les lymphocytes T mémoires et les monocytes activés. Comme vu précédemment, ces lymphocytes T régulateurs sont responsables de l’élimination des lymphocytes T auto-réactifs dans le thymus et en périphérie.
Des études fonctionnelles et de cartographie génétique fine ont identifié plusieurs variants du gène IL2RA qui contribuent au risque de diabète de type 1 2.
Une origine épigénétique et environnementale
Des recherches ont montré que même dans le cas d’individus présentant des haplotypes à hauts risques (identifiés chez 90 à 95 % des enfants atteints) seuls 5 % développent un diabète 3. Cela suggère que des facteurs autres que génétiques, épigénétiques et/ou environnementaux, jouent un rôle dans la manifestation de la maladie.
Des facteurs épigénétiques
La discordance de développement du diabète de type 1 chez certains jumeaux monozygotes 4 a conduit une équipe franco-germano-britannique à réaliser une étude d’association à l’échelle épigénomique 5 en examinant chez ces jumeaux la méthylation de sites CpG pour un certain nombre de gènes associés au diabète de type 1. Il ressort de cette étude que les individus atteints et non atteints présentent des profils de méthylation différents. Cela montre que des facteurs épigénétiques pourraient jouer un rôle dans l’apparition de la maladie 67.
Influence des infections virales
Parmi les facteurs externes suggérés, figurent les infections par des entérovirus (échovirus et Coxsackievirus). Les anticorps anti-Coxsackievirus B sont présents chez de nombreuses personnes atteintes ou non du diabète de type 1. Leur présence, conjointement à d’autres facteurs prédisposant au diabète de type 1, constituerait un risque du développement de la maladie 89.
Plusieurs mécanismes permettraient d’expliquer cette observation, tel que le mimétisme moléculaire. Ainsi lors d’une infection par un Coxsackievirus B, l’organisme produit des anticorps et des lymphocytes T dirigés contre les antigènes viraux. Certains de ces antigènes viraux présenteraient des similitudes structurales avec des antigènes du soi exprimés par les cellules β, ce qui entraînerait la destruction auto-immune de ces dernières, conduisant au développement d’un diabète de type 1 10.
Influence de la saisonnalité
Des études suggèrent qu’il existerait un lien entre le mois de naissance d’une personne et son risque de développer un diabète de type 1. Les personnes nées pendant les périodes de plus forte incidence virale auraient plus de chance de contracter des maladies virales durant leurs premiers mois de vie, ce qui pourrait plus tard augmenter le risque de développer un diabète de type 1. Ceci pourrait expliquer pourquoi les régions où les saisons sont marquées présentent les taux d’incidence les plus élevés 1112.
Influence de la vitamine D
Le récepteur de la vitamine D est exprimé par plusieurs cellules dont les lymphocytes. De plus en plus d’études suggèrent une forte association entre la voie de signalisation en aval de ce récepteur et la régulation des réponses immunitaires. Ainsi une carence en vitamine D est associée à un risque accru de maladies auto-immunes dont le diabète de type 1 13. Le suivi d’une cohorte de 12 000 naissances a révélé que les enfants recevant une supplémentation en vitamine D avaient un risque réduit de développer la maladie comparativement à ceux n’ayant pas reçu de supplémentation. Bien qu’encore controversée, la vitamine D aurait un effet bénéfique dans la prévention du diabète de type 1, probablement en raison de son rôle dans la modulation des processus inflammatoires, ce qui permettrait de maintenir la tolérance 1415.
Influence du régime alimentaire
Les études épidémiologiques de cohortes portant sur des nourrissons à haut risque, montrent qu’une durée d’allaitement maternel exclusif supérieure à quatre mois et l’introduction du lait de vache après cet âge constitueraient des facteurs protecteurs contre le diabète de type 1 16.
Il a été proposé que la protection immunitaire supplémentaire conférée par les anticorps maternels transmis par l’allaitement contribuerait à réduire la fréquence des infections entérovirales précoces, susceptibles d’entraîner un diabète de type 1 1718.
Par ailleurs, les personnes atteintes de diabète de type 1 présentent généralement des altérations du microbiote intestinal, qui est moins diversifié que chez les personnes non atteintes 19.
| Facteurs de risques | Facteurs protecteurs |
|---|---|
| Coxsackievirus du groupe B | Allaitement maternel prolongé |
| Introduction précoce du lait de vache | Supplémentation en vitamine D |
| Hautes latitudes | Acides gras polyinsaturés |
| Saisons froides | Microbiote intestinal diversifié |
Traitements
Thérapies moléculaires
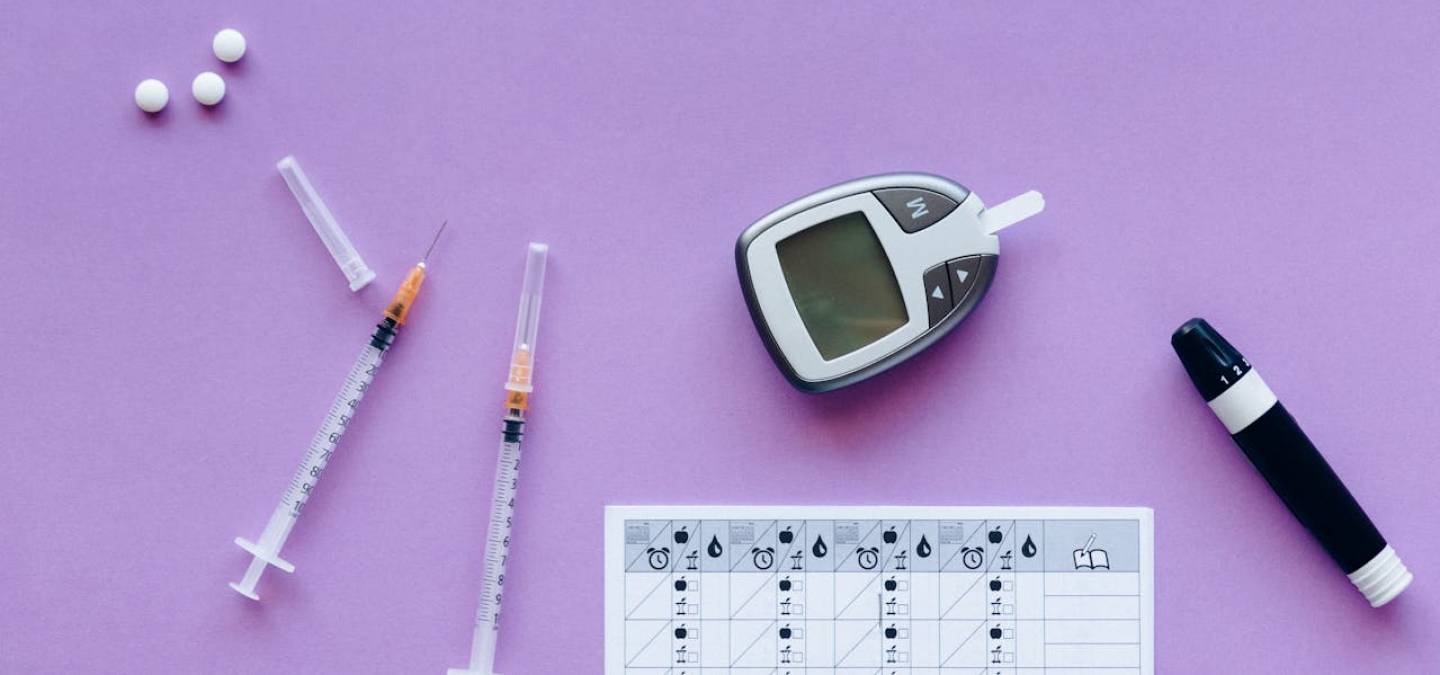
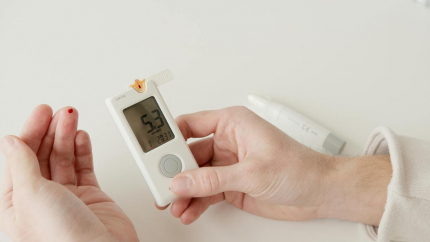
Le lecteur de glycémie (au centre) permet de suivre soi-même sa glycémie. Il faut au préalable piquer la peau à l'aide de l'autopiqueur (posé sur la table). La goutte de sang est placée sur une bandelette elle-même insérée dans le lecteur. La glycémie est ici de 5,3 mmol/L. Une glycémie « normale » est comprise entre 4 et 6 mmol/L (soit entre 0,7 et 1,1 g/L). Le lecteur de glycémie permet à une personne diabétique de vérifier qu'elle n'est pas en situation d'hyperglycémie, ni en situation d'hypoglycémie (ce qui peut arriver en cas de prise d'une trop grande quantité d'insuline).
Chez les individus diabétiques, le maintien de la glycémie à la valeur consigne de 1 g/L a consisté pendant longtemps à l’auto-administration d’insuline exogène par voie sous-cutanée. Cependant, ce traitement présente divers inconvénients dont la nécessité d’un contrôle régulier de la glycémie par le patient (Figure 8), un long délai avant l’apparition de l’insuline dans le sang (entre dix et vingt minutes), des oscillations glycémiques fréquentes entre hypoglycémie (liée à une trop grande injection d’insuline par rapport aux besoins) et hyperglycémie et la détérioration de la qualité de vie du patient liée à tous ces aspects.
Afin de remédier à cela, depuis 2015, des analogues ultra-rapides de l’insuline ont été mis au point. Leurs caractéristiques pharmacocinétiques permettent notamment d’écourter le délai de distribution de l’insuline dans le sang à quatre ou cinq minutes 1. Des études récentes ont par ailleurs montré qu’ils permettaient d’éviter l’hypoglycémie qui peut sinon se produire pendant et après un exercice physique 2.
Des recherches ont également été conduites en matière d’insuline dite « intelligente », dont la visée est la réduction du stress et de la charge mentale liée à la surveillance permanente de sa glycémie par le patient. Ces formes d’insuline peuvent être rendues biodisponibles en fonction de la glycémie grâce à un couplage à des molécules glucosensibles. Le principe est simple : ces molécules glucosensibles sont conçues pour réagir spécifiquement aux variations du taux de glucose dans le sang. Ainsi, lorsqu’il y a une augmentation de la glycémie, la molécule glucosensible se lie au glucose, déclenchant ainsi la libération de la molécule thérapeutique couplée (dans notre cas l’insuline).
Les chercheurs ont également mis au point des formulations et des dispositifs d’administration moins contraignants pour le patient : moins douloureux, avec moins de risques d’erreurs et plus de confort au quotidien. Ces dispositifs comprennent des hydrogels, des membranes, des nanovésicules, des patchs à réseaux de micro-aiguilles et des liposomes à appliquer sur la peau ou à injecter. Cependant, la construction de systèmes d’insuline intelligents capables de réguler la glycémie tout en évitant l’hypoglycémie reste difficile à réaliser 3.
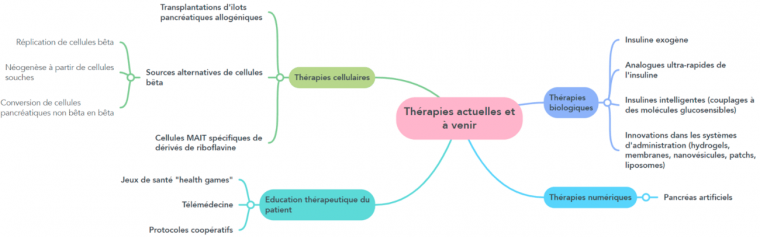
Thérapies cellulaires
À côté de ces thérapies moléculaires, des thérapies cellulaires visant à remplacer les cellules β endommagées par des cellules β fonctionnelles ont été développées.
Ainsi a débuté la transplantation d’îlots pancréatiques allogéniques. Les données publiées montrent qu’environ 54 % des patients peuvent se passer d’insuline exogène dès la fin de la première année. Cependant, bien que cette thérapie soit jugée comme très prometteuse, les transplantations sont associées à des phénomènes de rejet à long terme conduisant la plupart des patients transplantés à recourir à nouveau à l’administration d’insuline exogène quelques années plus tard. Les recherches actuelles se focalisent ainsi sur l’amélioration de l’immunosuppression avant la transplantation 1.
De nouvelles stratégies émergent pour générer de nouvelles cellules β afin de remplacer celles qui sont défectueuses. Ces recherches se concentrent sur la stimulation de la division des cellules β encore présentes, la création de nouvelles cellules β à partir de cellules souches pancréatiques et la conversion de cellules pancréatiques non-β en cellules β fonctionnelles. Cependant, ces approches se heurtent à des difficultés notamment l’inefficacité des mitogènes sur les cellules β humaines et les risques de développement tumoral associés au fort pouvoir de prolifération des cellules souches 1.
Systèmes de pancréas artificiels
Des thérapies récentes cherchent à réduire les contraintes liées à l’auto-administration d’insuline. Les pancréas artificiels, par exemple, associent un capteur de glucose en continu, une pompe à insuline et une intelligence artificielle. Ces dispositifs ajustent l’administration d’insuline en fonction des besoins du patient. Cependant le patient doit encore indiquer à l’appareil la prise d’un repas ou la réalisation d’une activité physique. Des progrès restent à faire quant à l’automatisation de ces actions et l’application de tels systèmes à de jeunes enfants ou aux personnes présentant un diabète instable 2.
Autres stratégies
D’autres stratégies visent à l’éducation thérapeutique des patients via les réseaux sociaux, les « jeux de santé » (health games), la télémédecine et les protocoles coopératifs. Ainsi l’ambition de la plateforme d’éducation thérapeutique DiVE (Diabetes Virtual Éducation), a pour objectif d’aider les patients de 10 à 18 ans à acquérir les bons réflexes et les connaissances sur leur maladie.