GLP-1 et GIP sont des hormones qui sont libérées peu après un repas.
GIP : glucose-dependent insulinotropic polypeptide, ou peptide insulinotrope dépendant du glucose ; GLP-1 : glucagon-like peptide 1.
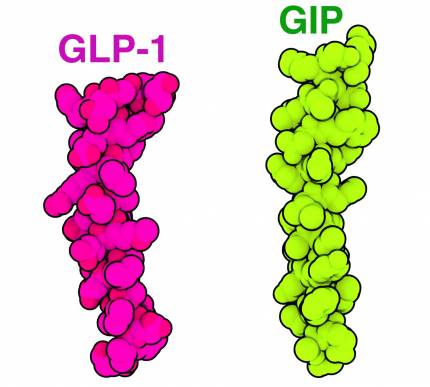
Votre corps maintient avec soin votre taux de glucose sanguin dans une étroite fourchette de valeurs. Un excès de glucose peut endommager les organes, tandis qu’un manque de sucre peut entraîner un état de confusion, voire une perte de connaissance. Lorsque vous mangez, les glucides sont transformés en oses (dont le glucose) et pénètrent dans le sang, augmentant ainsi la glycémie. Cependant, quelques minutes après le début du repas, les cellules de votre intestin se mettent également en action et commencent à sécréter deux hormones peptidiques : GIP (glucose-dependent insulinotropic polypeptide, ou peptide insulinotrope dépendant du glucose) et GLP-1 (glucagon-like peptide 1), représentées sur la figure 1. Ensemble, ces hormones sont connues sous le nom d’incrétines. Les incrétines circulent jusqu’au pancréas, où elles activent les cellules qui sécrètent de l’insuline, une autre petite hormone peptidique. L’insuline est transportée vers différents tissus dans tout le corps et entraîne l’absorption, par les cellules, du glucose présent dans le sang.
Une diversité d’effets
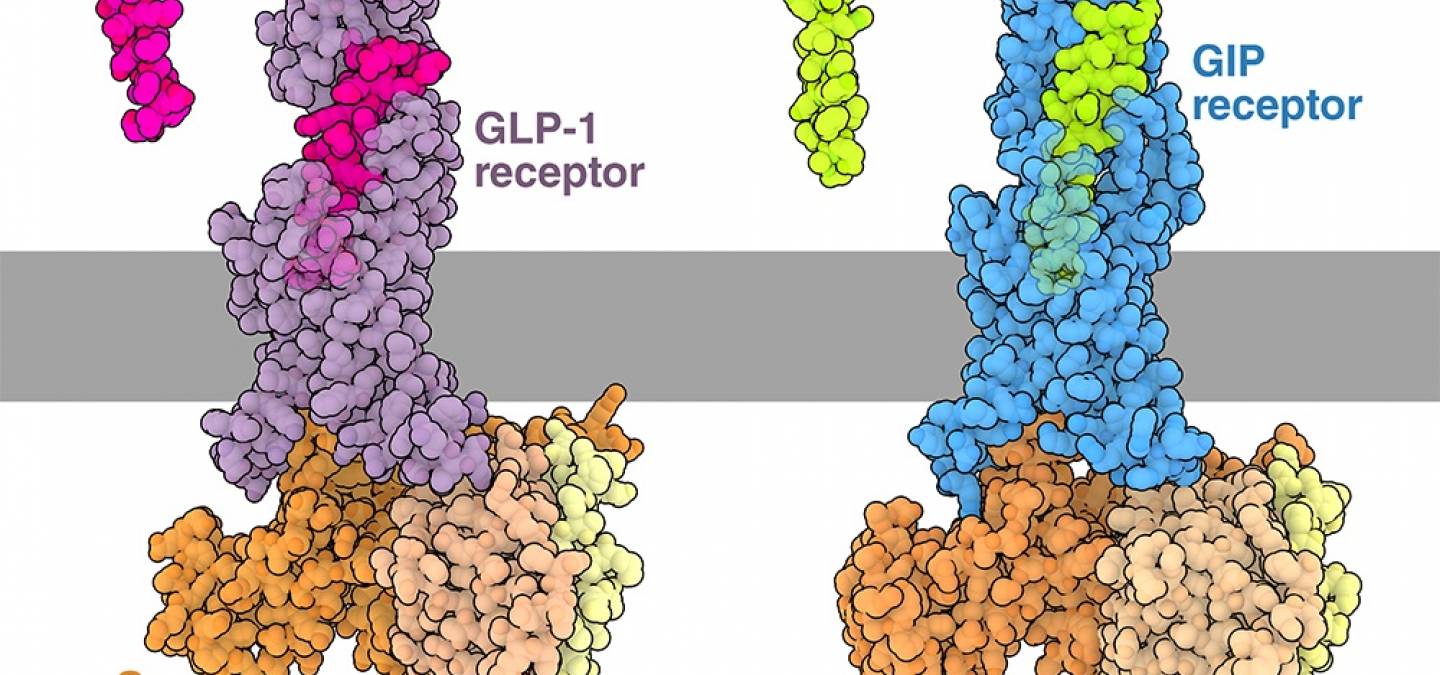
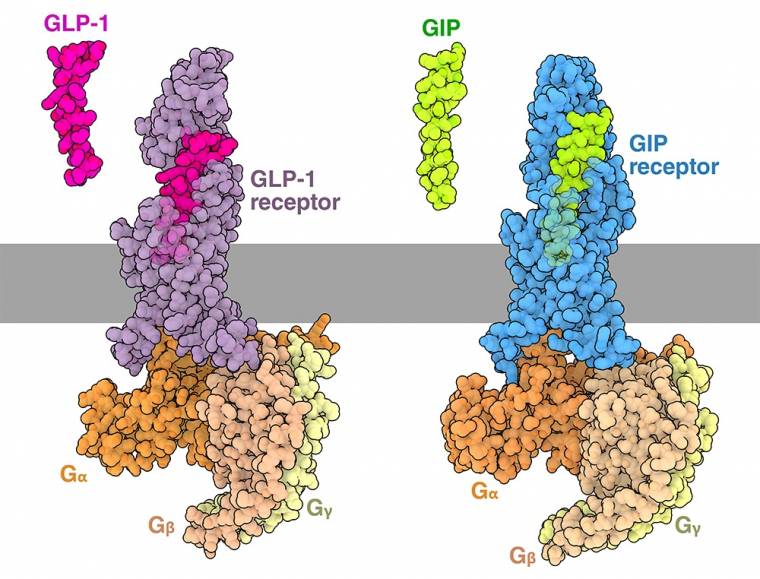
Les hormones GLP-1 et GIP peuvent activer les cellules en se liant à leurs récepteurs respectifs, situés sur la membrane plasmique (Figure 2). L’incrétine GLP-1 est représentée liée au récepteur GLP-1, (entrée de la banque de données des protéines (PDB) 6B3J) 1. À droite, le GIP est représenté lié au récepteur GIP (entrée PDB 7RA3) 2. Les récepteurs GLP-1R et GIPR font tous les deux partie de la grande famille très diversifiée des récepteurs couplés aux protéines G (RCPG). Les membres de cette famille permettent de répondre à divers signaux extracellulaires, tels que les odeurs, les neurotransmetteurs et les hormones (comme l’adrénaline, qui se lie aux récepteurs adrénergiques).
À l’état inactif, les récepteurs couplés aux protéines G sont liés à une protéine G. Lorsqu’ils sont liés à leur ligand, les récepteurs couplés aux protéines G subissent un changement de conformation qui facilite le recrutement et l’activation d’une protéine G par la libération de GDP et son échange ultérieur avec un GTP. La protéine G, qui est composée de trois sous-unités appelées alpha, bêta et gamma, se divise alors en deux parties. La sous-unité alpha liée au GTP peut se déplacer et activer des voies en aval, tandis que les sous-unités bêta et gamma peuvent également se dissocier et déclencher des voies complémentaires. De nombreux récepteurs couplés aux protéines G, notamment GLP-1R et GIPR, se couplent à la protéine G stimulatrice, Gs, qui active l’adénylate cyclase produisant l’AMP cyclique (ou AMPc), un second messager. Pour en savoir plus, vous pouvez lire un ancien article de la molécule du mois sur les protéines G.
De nombreux types cellulaires différents expriment les récepteurs GLP-1R et GIPR et utilisent les protéines G dans la transmission des signaux, mais la liaison des incrétines peut avoir des conséquences très différentes selon les tissus 1. Alors que la liaison au GLP-1 provoque la sécrétion d’insuline par les cellules pancréatiques, dans le cerveau, le GLP-1 active les neurones de l’hypothalamus, ce qui entraîne une sensation de satiété. Dans l’estomac et l’intestin, la liaison du GLP-1 sur les muscles lisses et le système nerveux, réduit les contractions musculaires et permet aux aliments de rester plus longtemps dans l’estomac. Bien que les incrétines aient des effets importants et étendus sur différents organes, leurs actions ne sont pas durables ; le GLP-1 et le GIP ne peuvent circuler que pendant quelques minutes avant d’être inactivés. L’enzyme dipeptidyl peptidase 4 (DPP4) est responsable de la dégradation des incrétines.
Les leçons tirées des monstres de Gila
Les monstres de Gila sont de lents reptiles venimeux qui vivent dans le sud-ouest des États-Unis. Les scientifiques ont observé que, bien qu’ils ne consomment que quelques repas copieux par an, les monstres de Gila n’ont aucun mal à maintenir leur glycémie. Des études ultérieures menées dans les années 1990 ont montré qu’un composant peptidique du venin du monstre de Gila pouvait déclencher la synthèse et la libération d’insuline par le pancréas. Ce composé spécifique a été nommé l’exendine-4.
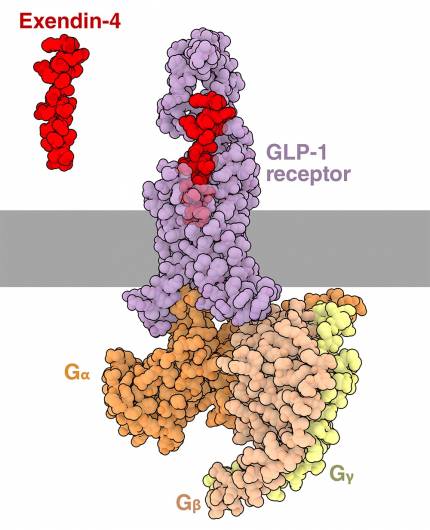
L’exendine, représentée en rouge, se lie au récepteur GLP-1R, représenté en violet. Le récepteur couplé aux protéines G est associée à une protéine Gs, dont les trois sous-unités sont représentées en orange (alpha), saumon (bêta) et jaune (gamma).
En plus d’être présent dans le venin, l’exendine-4 est également produite de manière endogène par le monstre de Gila, où elle ralentit la digestion et aide à maintenir la glycémie malgré de longues périodes de jeûne. Il est intéressant de noter que l’exendine-4 possède une structure et une fonction similaires au GLP-1 1, mais qu’elle résiste à la dégradation par la peptidase DPP4, ce qui lui permet de rester dans la circulation sanguine pendant des heures plutôt que quelques minutes seulement. L’exendine-4 a finalement permis de développer l’exénatide, un traitement contre le diabète et le premier agoniste du récepteur GLP-1 approuvé pour un usage médical. La figure 3 représente l’exendine-4 liée au récepteur GLP-1 (entrée PDB 7LLL).
Comparer la façon dont GLP-1, l’exendine 4 et GIP se lient aux différents récepteurs
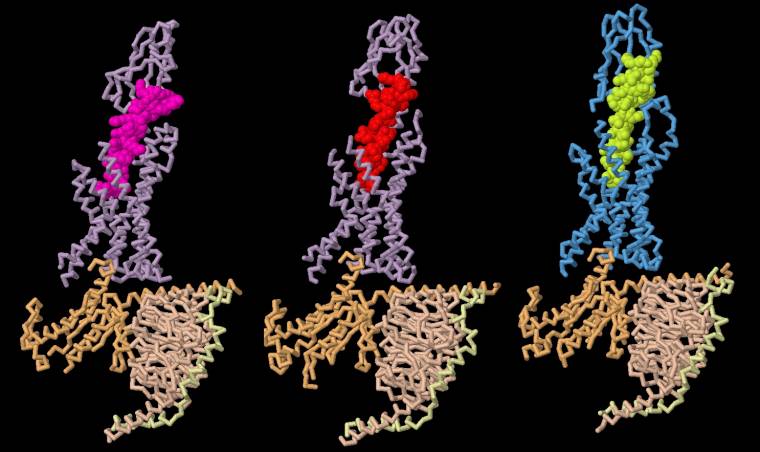
Le GLP-1 (entrée PDB 6B3J), l’exendine-4 (entrée PDB 7LLL) et le GIP (entrée PDB 7RA3) se lient aux récepteurs de manière similaire, une extrémité du peptide se liant profondément dans une poche du domaine transmembranaire du récepteur, et l’autre extrémité du peptide se liant au domaine extracellulaire. Vous pouvez examiner de plus près ces liaisons en vous rendant sur la page de l’article d’origine (en anglais), et en cliquant sur l’onglet JSmol de la section Exploring the structure.
À gauche, l’hormone GLP-1 est représentée en rose dans son récepteur GLP-1R. Au centre, l’exendine, est représentée en rouge liée au même récepteur GLP-1R. À droite, l’hormone GIP est représentée en vert liée à son récepteur GIPR.
Pour aller plus loin
-
Découvrez comment la glycémie est régulée par l’insuline et le récepteur de l’insuline, et comment fonctionnent les insulines de synthèse en lisant ces trois anciens articles de la molécule du mois : Insulin, Insulin Receptor et Designer Insulins. Vous trouverez aussi sur le site Planet-Vie : le diabète de type 1.
-
Vous pouvez en apprendre davantage sur les protéines G et les récepteurs couplés aux protéines G en relisant d’anciens articles de la molécule du mois et de la base de données sur les protéines. Vous pouvez aussi apprendre à modéliser un récepteur couplé aux protéines G avec du papier.
Ce texte correspond à la traduction par Cédric Bordi de l’article Molecule of the Month : Incretins 1 écrit par Janet Iwasa en octobre 2025 sur le site PDB-101, le portail éducatif de la base de données sur les protéines (PDB).