Les bioaérosols représentent un risque sanitaire majeur en raison de leur persistance dans l’air et de leur capacité à transmettre des maladies. La diffusion des bioaérosols peut être involontaire, via la respiration, la ventilation ou des activités humaines, mais aussi volontaire dans le cas d’actes bioterroristes. Par conséquent, leur détection est essentielle pour la santé publique. Dans cette revue, nous proposons une vue d’ensemble des diverses méthodes d’échantillonnage et de détection des pathogènes contenus dans les bioaérosols.
Les bioaérosols, un risque sanitaire majeur
Les bioaérosols correspondent à des suspensions aériennes de micro-organismes comme des bactéries ou des virus, de fragments de ceux-ci, de spores ou encore de protéines comme des toxines. La définition de la taille des bioaérosols ne fait pas consensus : elle varie du micromètre à la centaine de micromètres 1.
Les bioaérosols représentent un risque sanitaire important. En effet, ils peuvent contenir des pathogènes causant des maladies à voie d’entrée par inhalation. Pour les maladies d’origine bactérienne, on citera notamment la tuberculose (Mycobacterium tuberculosis) ou encore les infections à Legionella, responsables de pneumonies (légionellose). Plus rarement, la peste pulmonaire (Yersinia pestis) ou la maladie du charbon (Bacillus anthracis) peuvent être transmises par voie aérienne 2. Pour ce qui est des maladies virales, on citera la grippe (famille influenza) et les infections à coronavirus, dont le Covid-19 (causé par le virus SARS-CoV-2) est un représentant 3. Enfin, des champignons pathogènes peuvent aussi produire des spores dans l’air ambiant, comme c’est le cas d’Aspergillus fumigatus, de différentes espèces de Penicillium, Cryptococcus, Histoplasma… 4 ou encore être transmis de manière interhumaine (Pneumocystis). En plus de causer des maladies respiratoires, les aérosols peuvent parfois contaminer d’autres voies et transmettre ainsi des virus infectant les intestins, comme c’est le cas des norovirus, responsables de gastro-entérites 5.
Les bioaérosols peuvent être générés par la respiration humaine ou animale, la toux et les éternuements, mais aussi par la manipulation ou le mouvement de matière organique en décomposition (excréments, compost), directement à partir des sols (vents, retournements) ou des points d’eau (lacs, océans, aquariums, piscicultures) ou par la simple présence d’humains dans une pièce, du fait des courants de convections induits par la chaleur des corps 6. Certaines infrastructures ou activités humaines peuvent également disperser des aérosols : le traitement des eaux usées, les activités agricoles comme la récolte, le labourage et l’épandage de fumier, et la production alimentaire 7. Les bioaérosols peuvent rester en suspension dans l’air pendant des heures voire des jours, et se diffuser par la ventilation des bâtiments ou par le vent sur des centaines de mètres 8910. Par exemple, le SARS-CoV-2 peut rester infectieux pendant plus de trois heures dans des aérosols 11.
On distingue en général deux types de transmission par bioaérosol : par gouttelettes et par particules. Dans le cas d’une gouttelette, l’agent biologique est contenu dans une phase liquide, formant un ensemble dont la taille peut aller jusqu’à quelques dizaines de micromètres. Les particules, dépourvues de liquide, peuvent présenter des tailles équivalentes aux gouttelettes, mais également être plus petites (entre 0,5 et 10 µm), auquel cas elles restent en suspension dans l’air plus longtemps 12. Le diamètre même de la gouttelette ou de la particule influe fortement sur sa transmission : plus une particule est petite, plus les probabilités sont grandes qu’elle puisse pénétrer profondément dans les voies respiratoires. De même, une particule de taille réduite sera moins influencée par les forces gravitationnelles et pourra demeurer en suspension dans l’air pour une période prolongée et diffuser loin de sa source 1314.
Enfin, des bioaérosols peuvent se former accidentellement dans des laboratoires manipulant des microorganismes pathogènes. En effet, des opérations comme la centrifugation ou le pipetage peuvent émettre des bioaérosols, et ainsi potentiellement contaminer le personnel 15. Des normes inadéquates de biosécurité peuvent également entraîner des fuites de laboratoire. C’est ainsi qu’en 1979, à Sverdlosk (URSS), la mauvaise gestion du remplacement d’un filtre de sécurité a entraîné la libération de spores de Bacillus anthracis, causant la mort de 66 personnes 16. Au-delà des accidents, les bioaérosols sont parfois utilisés dans un cadre volontaire, lors d’actes bioterroristes ou bien de guerre biologique, comme cela a été le cas lors de la Seconde Guerre mondiale, avec la dispersion de spores de Bacillus anthracis par l’armée japonaise 17.
Bien que les cas de bioterrorisme soient rares, et qu’un nombre limité d’agents pathogènes aient été utilisés 18, les risques liés à l’utilisation de bioaérosols comme armes biologiques doivent être pris en compte.
Les bioaérosols peuvent aussi être générés volontairement en laboratoire afin de les étudier, ce qui doit être fait dans des conditions de biosécurité adaptées 19. Dans ce cadre, l’échantillonnage et l’analyse des bioaérosols vise principalement à comprendre les modes de transmission de micro-organismes pathogènes. De tels travaux ont par exemple été particulièrement importants durant la pandémie de Covid-19, pour savoir si le virus à l’origine de cette maladie, le SARS-CoV-2, se transmettait plutôt par l’air ou par contact direct de la peau avec des personnes ou des surfaces contaminées.
Détection et identification d’agents infectieux
La détection des agents infectieux dans les bioaérosols repose principalement sur deux méthodes : la PCR (polymerase chain reaction) et la culture des micro-organismes.
Le plus souvent, le but de l’échantillonnage des bioaérosols est de mettre en évidence la présence d’un micro-organisme particulier dans l’air. C’est en particulier le cas lors d’études sur les caractéristiques de la transmission d’un pathogène. Dans ce cas, le génome du micro-organisme d’intérêt étant connu, il suffit d’utiliser des amorces spécifiques d’une séquence de ce génome pour amplifier par PCR le matériel génétique du pathogène et ainsi le mettre en évidence. La détection de virus ayant un génome à ARN nécessite une étape préalable de rétrotranscription. Par ailleurs, ces virus sont plus difficiles à mettre en évidence car leur génome est moins stable et plus facilement dégradé durant l’échantillonnage.
La PCR réalisée peut-être quantitative (qPCR) grâce à l’ajout dans le milieu réactionnel d’un agent intercalant de l’ADN, qui émet de la fluorescence de manière proportionnelle à la quantité d’ADN synthétisée 20. Il est ainsi possible d’estimer la concentration du micro-organisme d’intérêt dans le bioaérosol.
L’identification des micro-organismes présents dans un bioaérosol peut également être réalisée grâce à des cultures sur des milieux spécifiques. Ces méthodes sont plus longues à mettre en œuvre (la culture peut prendre plusieurs jours alors que la PCR ne nécessite que quelques heures) mais offrent l’avantage de démontrer que le matériel biologique récupéré dans les bioaérosols est encore vivant, donc potentiellement infectieux. Les cultures sont notamment utilisées pour mettre en évidence les bactéries du genre Legionella ainsi que Mycobacterium tuberculosis.
Les méthodes d’identification des micro-organismes contenus dans les bioaérosols présentées ici (PCR et cultures) ne peuvent se réaliser en phase gazeuse : elles nécessitent de passer en milieu liquide, ce qui implique du matériel additionnel, pas forcément disponible sur le terrain, et augmente donc le temps mis entre l’échantillonnage et la détection 21. Par ailleurs, une autre caractéristique de l’échantillonnage de l’air est que les quantités de pathogènes peuvent être très faibles, en deçà des limites de détection. Cela suppose donc la collecte d’une grande quantité d’air.
Les échantillonneurs pour bioaérosols
Détecter des pathogènes dans un bioaérosol requiert donc des méthodes spécifiques de collecte. Par exemple, s’il est vite apparu durant la pandémie de Covid-19 que la propagation du SARS-CoV-2 se faisait majoritairement par aérosols 22, la dynamique de ceux-ci et la propagation du virus en leur sein est moins bien connue. Les virions du SARS-CoV-2 sont difficilement conservés lors des échantillonnages haut débit, du fait de leur génome à ARN (plus fragile que l’ADN) et de leur faible taux d’émission.
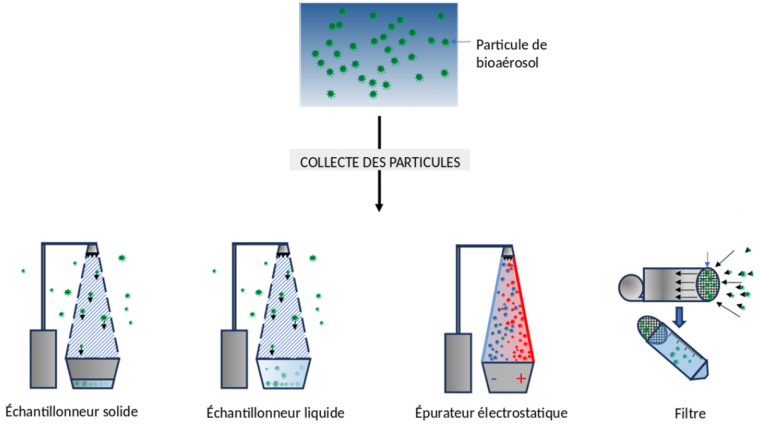
Les principaux échantillonneurs utilisés pour détecter des agents microbiens dans les bioaérosols sont les échantillonneurs actifs, qui nécessitent une source d’énergie pour collecter les particules (échantillonneurs à impacteurs liquides, à impacteurs solides, et épurateurs électrostatiques) ; a contrario, les filtres de systèmes de ventilation forment un exemple d’échantillonneurs passifs 23.
Les échantillonneurs à impacteurs solides (Andersen, à fente et à cyclone) possèdent une pompe à vide et sont efficaces pour capturer des bioaérosols de diamètre supérieur à 0,75 μm 2425 ; la pompe à vide crée une dépression qui attire l’air extérieur, et les bioaérosols en suspension avec, dans l’échantillonneur. De manière intéressante, les virions du virus influenza, responsable de la grippe, sont de petite taille (une centaine de nanomètres environ) mais se retrouvent principalement sur des gouttelettes de l’ordre du micromètre de diamètre 26, et peuvent ainsi être collectés par des échantillonneurs à impacteurs solides. Les échantillonneurs Andersen et à fente accélèrent les bioaérosols à travers des ouvertures étroites, les déviant de leur trajectoire pour les faire entrer en contact avec une surface solide contenant du milieu de culture, dans lequel les pathogènes sont ensuite identifiés 2728. Les échantillonneurs Andersen possèdent six étages de collecte, avec des ouvertures de tailles décroissantes permettant de piéger des bioaérosols de différentes tailles 29. Dans les échantillonneurs à cyclone, un vortex dévie les échantillons vers les parois où ils sont ensuite analysés par des processus communs aux autres échantillonneurs à impacteurs solides 30. Une limitation de ces échantillonneurs est la nécessité d’augmenter l’accélération pour collecter des bioaérosols de très petite taille, ce qui les endommage.
Dans les échantillonneurs à impacteur liquide (AGI-4, AGI-30, et BioSampler), une dépression pousse l’air extérieur à entrer dans la flasque contenant un liquide dans lequel les bioaérosols sont collectées puis analysées, souvent par test PCR ou ELISA 3132.
Dans les épurateurs électrostatiques, les bioaérosols chargés passent à travers un champ électrique et sont collectées sur l’électrode de charge opposée 3334.
Enfin, les filtres collectent les bioaérosols de manière passive. La taille des pores détermine la limite de détection (0,45 μm pour les filtres à cellulose, 0,1 μm pour ceux en polycarbonate, et de 0,2 à 5 μm pour les filtres en polytétrafluoréthylène PTFE) 35. De tels filtres peuvent être couplés à un échantillonneur afin de contrôler la taille maximale des particules collectées 36. Il est important de noter que pour la filtration d’air, contrairement à la filtration de liquide, le filtre peut retenir des éléments de diamètre bien inférieur à la taille des pores, ce qui s’explique par différents mécanismes (attraction électrostatique, diffusion…).
Les bioaérosols peuvent être collectés à l’aide de différents types d’échantillonneurs (solide, liquide, électrostatique) et de filtres. Une fois collectés, ces bioaérosols subissent des analyses pour la détection et l’identification des agents pathogènes.
Focus sur un exemple d’échantillonneur de bioaérosols : l’échantillonneur BIAFTS
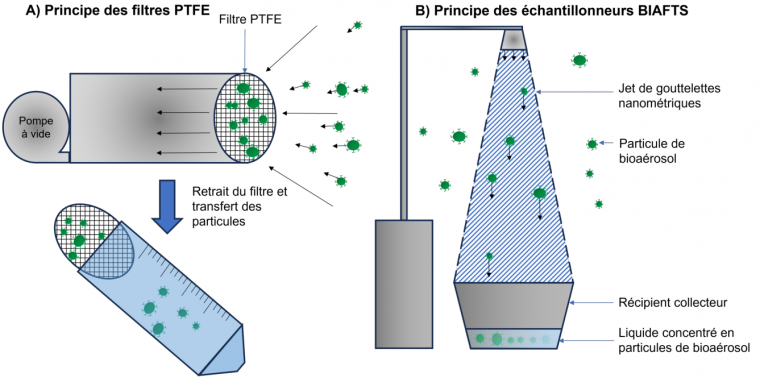
Parmi les projets développés pour mieux comprendre la dynamique de la pandémie de Covid-19, un prototype d’échantillonneur air-vers-liquide, appelé Bioaerosol fast sampler, ou BIAFTS, a vu le jour. Il se fonde sur la technologie dite du Counterfog, dans laquelle une brume de gouttelettes de l’ordre du nanomètre de diamètre est pulvérisée dans l’air et entraîne les pathogènes lorsque les gouttelettes retombent.
L’équipe de del Álamo s’est proposée de vérifier l’efficacité de ce prototype, en comparant le BIAFTS à un échantillonneur déjà éprouvé, utilisant des filtres PTFE. Les tests n’ont pas été réalisés avec le SARS-CoV-2, mais avec le bactériophage 1 ϕ29, de plus petite taille (35 nm) 2. Après dispersion en aérosol d’une quantité connue de virus dans une pièce de 25 m3, les deux échantillonneurs sont testés et la quantité de virus dans le liquide collecté est analysée par comptage d’unités formant plages (PFU, plaque-forming units) sur culture de Bacillus subtilis. Les résultats montrent que les deux types de collecteurs ont récupéré chacun entre 6 et 7 log PFU/m3, et que la collecte par le BIAFTS est cinq fois plus rapide : 1,4 m3 d’air collecté par minute, contre 0,3 pour les filtres PTFE. L’efficacité de la technologie BIAFTS est ainsi démontrée. Il convient cependant de noter, comme cela a été mentionné précédemment, que de très nombreux types d’échantillonneurs existent, et qu’il serait donc intéressant de comparer l’efficacité de l’échantillonneur BIAFTS avec d’autres sortes d’échantillonneurs, notamment ceux utilisant des technologies de capture similaires, comme les échantillonneurs à condensation.
Les filtres PTFE sont couplés à une pompe et retiennent dans leur maillage les particules du bioaérosol. Celles-ci sont ensuite transférées en phase liquide. Les collecteurs BIAFTS utilisent un jet de gouttelettes nanométriques pour faire chuter les particules du bioaérosol et les concentrer en phase liquide.
Le suivi de la dynamique des bioaérosols du phage ϕ29 a ensuite été testé pour les deux échantillonneurs dans un wagon de train. Des échantillons d’air ont été prélevés à intervalles réguliers, puis analysés par la même méthode que ci-dessus. L’équipe a ainsi observé que non seulement le prototype BIAFTS collectait 10 fois plus de particules que les filtres PTFE, mais qu’en plus la limite de détection du BIAFTS était de 0,5 µm. Sachant que le virus SARS-CoV-2 est généralement retrouvé dans des particules d’au moins 1 µm, la technologie BIAFTS semble donc efficace pour sa détection.
L’un des inconvénients des filtres PTFE est leur lenteur de collecte, de 0,3 m3 d’air/min seulement. Les collecteurs BIAFTS peuvent collecter 1,44 m3/min. L’équipe de del Álamo a donc réalisé en conditions de terrain, dans des chambres de malades hospitalisés pour cause de Covid-19, des relevés cinétiques de concentrations en particules de SARS-CoV-2 avec des collecteurs PTFE et BIAFTS 1. Les premiers n’ont permis qu’une estimation moyenne de la quantité de virus dans la pièce sur 2 h. Les seconds en revanche ont révélé des pics soudains de concentration en virus dans les chambres des patients, un phénomène passé jusque-là inaperçu et probablement lié à des dynamiques complexes de ventilation des salles et de projection d’aérosols par les patients.
Les collecteurs BIAFTS sont donc précis et collectent suffisamment rapidement les échantillons pour obtenir un suivi cinétique. Ils possèdent de plus l’avantage de filtrer une grande quantité d’air des virus qu’il contient.
Perspectives
Les échantillonneurs de bioaérosols sont actuellement principalement utilisés pour répondre à des questions de recherche fondamentale, en particulier pour mieux comprendre la dynamique de propagation des micro-organismes pathogènes transportés par les bioaéorosols.
Certains lieux semblent plus propices que d’autres à la dissémination de tels agents pathogènes et représentent des centres majeurs de transmission d’un pathogène lors d’une épidémie, ou bien des cibles pour d’éventuels bioterroristes. C’est notamment le cas des lieux où se concentrent de nombreuses personnes, comme les stations de métro 2, dont le confinement facilite l’accumulation et la stagnation des bioaérosols, et plus généralement des grands nœuds des réseaux de transport, comme les aéroports 3. En effet, à l’heure de la mondialisation, les échanges en avion (qui ont plus que doublé depuis l’an 2000) représentent une possibilité de propagation intercontinentale extrêmement rapide pour les pathogènes 4. C’est ainsi que le SARS-CoV-2, apparu en Chine fin 2019, s’est dispersé dans le monde entier en quelques mois à peine, alors que les épidémies de peste du Moyen Âge mettaient plusieurs années, voire décennies, à se propager. Ainsi, de tels lieux gagneraient à être activement surveillés en faisant usage des technologies citées ci-dessus.
La réactivité est cruciale en cas de crise : agir vite permet de limiter la propagation de l’agent en isolant les personnes contaminées et en empêchant de nouveaux individus d’être à leur tour contaminés, mais aussi de limiter les pertes humaines si l’on parvient à identifier suffisamment rapidement l’agent responsable. Une telle réactivité n’est pas possible pour le moment, car les échantillonneurs de bioaérosols ne sont pas installés en permanence dans les lieux stratégiques (nœuds des réseaux de transport par exemple). Par ailleurs, une fois collectés, l’analyse des échantillons nécessite une intervention humaine en laboratoire.
C’est pour pallier ces limites que depuis quelques années, la tendance est à la miniaturisation des appareils de collecte et de détection : le recours à des plateformes portatives de PCR se développe ainsi de plus en plus 56. Plus récemment encore, de plus en plus d’auteurs émettent l’idée d’utiliser des puces de microfluidique qui réaliseraient en autonomie et in situ les analyses nécessaires 78910. Ces puces représentent des « laboratoires intégrés » : elles réaliseraient au sein d’un même appareil portatif la collecte des échantillons (avec l’une des méthodes développées plus haut), leur acheminement via des micro-canaux vers une micro-plateforme d’analyse, et la détection des pathogènes. Par exemple, celle-ci peut se réaliser par détection des micro-courants électriques induits lors de l’hybridation entre un aptamère et les acides nucléiques d’un pathogène 11. Bien que peu mature, une telle technologie pourrait donc révolutionner la surveillance des bioaérosols.
Sur la même thématique
Le site BioAirNet (en anglais) propose des ressources pédagogiques au sujet des bioaérosols, autour de cinq thématiques : What does clean air mean and why is it important ? What are biological particulates and where do they come from ? How do we sample and analyse bioaerosols ? What effects can bioaerosols have on your health ? How can we help mitigate the risks ?
Remerciements
Nous remercions chaleureusement Caroline Duchaine (Université Laval et Centre de recherche de l’Institut universitaire de cardiologie et de pneumologie de Québec, titulaire de la chaire de recherche du Canada sur les bioaérosols) et Pascal Combemorel (responsable éditorial du site Planet-Vie) pour leur relecture, ainsi que Sophie Goyard (Institut Pasteur) pour ses précieux conseils.