L’oïdium du blé est une maladie causée par le champignon parasite Blumeria graminis. Si l’emploi de fongicides de synthèses et de cultivars de blé résistants permet de limiter les pertes de rendements causées par ce champignon phytopathogène, l’utilisation d’agents de biocontrôle comme les champignons mycorhiziens à arbuscules confère également une protection face à l’infection, tout en étant compatibles avec une agriculture plus durable.
Le blé est la deuxième céréale la plus consommée par l’humanité après le riz. Cette culture céréalière peut être soumise aux attaques de Blumeria graminis f. sp.1 tritici, champignon ascomycète biotrophe responsable de l’oïdium du blé, une maladie pouvant causer des pertes de rendement allant jusqu’à 25 %. La lutte contre ce parasite fait principalement appel à l’utilisation de cultivars résistants et à l’usage intensif et systématique de fongicides de synthèse, ces derniers posant des problèmes tant environnementaux que sanitaires. En outre, malgré le développement de nouveaux fongicides, les agriculteurs se trouvent confrontés à l’émergence de souches résistantes et au manque de durabilité de la lutte chimique. Il est donc nécessaire de développer des solutions de remplacement à cette dernière, pour une agriculture plus durable et plus respectueuse de la santé humaine et de l’environnement.
Dans ce contexte, d’autres méthodes de protection des plantes, telles que le biocontrôle, pourraient occuper désormais une place de choix. Le biocontrôle consiste à utiliser des composés naturels ou des organismes naturellement antagonistes des agents phytopathogènes, ou bien capables de stimuler les défenses naturelles des plantes, comme les champignons mycorhiziens à arbuscules. Ces champignons symbiotiques, regroupés dans le phylum des Glomeromycota et distribués sur l’ensemble des écosystèmes, colonisent la majorité des plantes terrestres. Aux avantages bien connus des champignons mycorhiziens à arbuscules sur la croissance végétale, s’ajoutent plusieurs bénéfices, notamment pour la survie des plantes, leur biodiversité, l’impact sur le microbiote du sol et le potentiel d’agent d’atténuation des stress environnementaux, tant abiotiques que biotiques.
À ce jour, le potentiel des champignons mycorhiziens à arbuscules dans la protection des plantes a été décrit le plus souvent dans le cas d’infections racinaires, mais très peu dans les maladies foliaires 2. De plus, l’effet protecteur de ces champignons a été rapporté dans le cadre d’interactions entre plantes et champignons pathogènes hémibiotrophes et nécrotrophes, mais beaucoup plus rarement dans le cas des agents fongiques biotrophes comme celui responsable de l’oïdium du blé.
Ainsi, nos travaux avaient pour objectif d’évaluer l’éventuel effet protecteur de l’inoculation mycorhizienne contre B. graminis3 en stimulant les défenses naturelles du blé tendre (Triticum aestivum) 45. Ils visaient à répondre à trois questions principales :
- Est-ce que la mycorhization protège le blé contre l’oïdium ?
- Quels sont les mécanismes impliqués dans la protection du blé contre l’oïdium en réponse à la mycorhization ?
- Quels sont les facteurs qui peuvent influencer la protection du blé contre l’oïdium en réponse à la mycorhization ?
Est-ce que la mycorhization protège le blé contre l’oïdium ?
Les cultures de blé ont été conduites en pots sur un substrat artificiel (2 volumes de sable + 1 volume de vermiculite + ½ volume de perlite) additionné de 10 % d’inoculum commercial (MycAgro, France) à base de l’espèce de champignon mycorhizien à arbuscules Funneliformis mosseae6 autoclavé (condition témoin) ou non (condition inoculée) dans des conditions contrôlées en chambres de croissance (12 h de jour à 18 °C, 12 h de nuit à 12 °C ; humidité relative de 70 %).
Les résultats ont été obtenus à partir de deux expériences indépendantes. Les résultats de chaque expérience sont issus de 15 plantules de blé prélevées à partir de trois pots distincts.
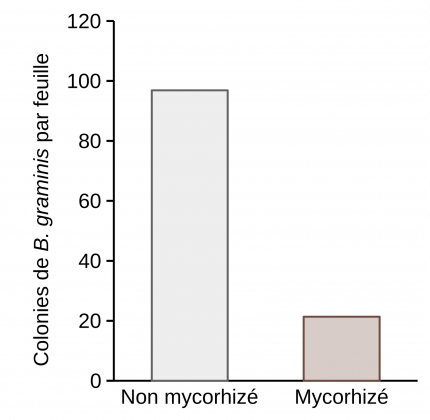
Après six semaines de culture, l’infection des plantules de blé a été effectuée par pulvérisation d’une suspension de spores de B. graminis (7,5 mL à 6,5.105 spores/mL). Le nombre de colonies sur les feuilles a été compté 12 jours après infection, sur des plantules âgées d’environ 8 semaines. Les taux d’infection par B. graminis ont été comparés chez des plants de blé mycorhizés ou non. Une réduction significative du nombre de colonies de B. graminis par feuille a été observée quand le blé est mycorhizé. Il passe de 96 chez les plants non mycorhizés à 21 chez les plants mycorhizés (Figure 1), ce qui correspond à un taux de protection de 78 % (voir Encadré 1). Ce résultat suggère que le champignon mycorhizien Funneliformis mosseae induit une résistance systémique chez le blé, contre l’infection par Blumeria graminis f. sp. tritici.
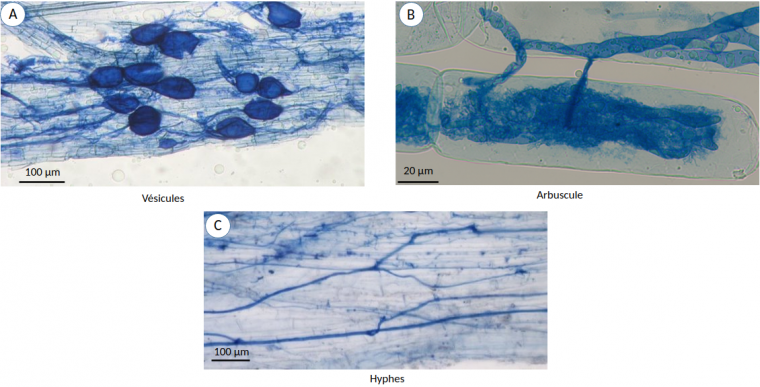
La mycorhization du blé cultivé avec l’inoculum mycorhizien a été vérifiée grâce à des observations microscopiques des racines de blé colorées au bleu de trypan (voir Encadré 2). Des structures spécifiques aux champignons mycorhiziens (arbuscules et vésicules) ont été observées au niveau des racines de plantules de blé inoculées avec F. mosseae démontrant l’établissement de la colonisation mycorhizienne chez le blé (Figure 2). Le taux total de mycorhization a été évalué à 38 %.
Différentes structures mycorhiziennes peuvent être observées : vésicules (A), arbuscule (B) et hyphes (C). Les vésicules constituent des structures de stockage (notamment de triacylglycérols), tandis que les arbuscules sont le siège d’échanges de nutriments entre les deux partenaires de la symbiose.
Encadré 1 : Évaluation des taux de protection contre B. graminis f. sp. tritici
Les plantules, mycorhizées ou non, âgées de 6 semaines, sont infectées avec une suspension de spores de B. graminis. Les spores sont prélevées à l’aide d’une pompe à vide et sont suspendues dans une solution de FC43 (heptacosafluorotributhylamine ou Fluorinert). La suspension des spores est calibrée à 500 000 spores/mL à l’aide d’une cellule de Malassez. 7,5 mL de la solution sont appliqués sur les plantules en pot à l’aide du pulvérisateur. Douze jours après l’infection par B. graminis, l’expression des symptômes est évaluée par comptage des colonies fongiques blanches sur les deux faces des feuilles. Les taux de protection sont calculés en appliquant la formule suivante :
Taux de protection = 100 × (Nombre de colonies sur les plantes témoins non mycorhizées – Nombre de colonies sur les plantes mycorhizées) / Nombre de colonies sur les plantes témoins non mycorhizées
Encadré 2 : Détermination des taux de mycorhization des racines
La quantification de la colonisation racinaire du blé par le champignon mycorhizien à arbuscules Funneliformis mosseae est réalisée après rinçage à l’eau distillée des racines, coloration au bleu de trypan 0,05 % (0,5 g de bleu de trypan/L dans un mélange eau, glycérol et acide lactique (1:1:1 v/v/v)) pendant 1 heure à 70 °C et éclaircissement dans une solution de KOH 10 % (v/v) pendant 1 heure à 70 °C. 100 fragments racinaires de 5 plantules issues du même pot sont placés entre lames et lamelles et observés au microscope optique (×100). Les structures fongiques observées à l’endroit de l’intersection de l’axe de l’objectif et le fragment racinaire sont quantifiées.
- p : aucune structure fongique.
- q : présence d’arbuscules.
- r : présence de vésicules.
- s : présence d’arbuscules et de vésicules.
- t : présence d’hyphes mycorhiziennes et absence d’arbuscules et de vésicules.
- g : nombre d’intersections.
Les taux de mycorhization total, arbusculaire et vésiculaire sont calculés grâce aux formules suivantes :
- Taux total (T) : T = 100 (g – p)/g
- Taux d’arbuscules (A) : A = 100 (q + s)/g
- Taux de vésicules (V) : V = 100 (r+ s)/g
Quels sont les mécanismes impliqués dans la protection du blé contre l’oïdium en réponse à la mycorhization ?
Le cycle de développement de Blumeria graminis
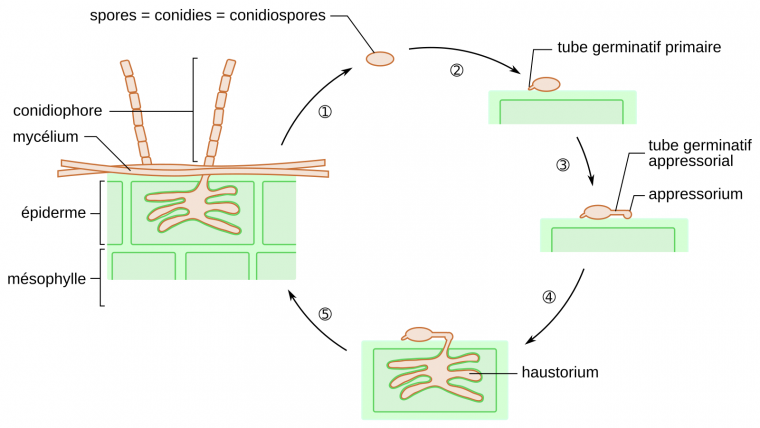
À la surface de la feuille de blé, la germination des conidies de B. graminis débute par l’émergence d’un tube germinatif primaire, puis celle d’un second tube germinatif nommé tube germinatif appressorial. Ce dernier se forme 5 à 8 heures après la perception de la surface de la feuille par le champignon. Suite à l’hydrolyse enzymatique de la cuticule, le tube germinatif appressorial traverse la paroi végétale et forme un appressorium. Celui-ci se différencie ensuite en haustorium au niveau de la membrane plasmique. Ce dernier assure le transfert des nutriments de la plante au champignon. À la surface de la plante hôte, se développe un mycélium qui forme des conidiophores. Ces derniers assurent la libération de nouvelles spores asexuées permettant la dissémination de l’agent pathogène (Figure 3).
1 : Les conidiophores relâchent des spores qui sont dispersées par le vent.
2 : Une fois arrivée sur la feuille d'une plante hôte, la spore produit un tube germinatif primaire.
3 : Un tube germinatif secondaire se forme et son extrémité terminale forme un appressorium.
4 : La mise en place de l'haustorium permet au champignon de se nourrir aux dépens de son hôte.
5 : Le mycélium se développe et met en place des conidiophores
NB : Blumeria graminis peut également se reproduire de manière sexuée.
Télécharger une version éditable au format SVG.
Effet de l’inoculation mycorhizienne sur le processus d’infection de B. graminis
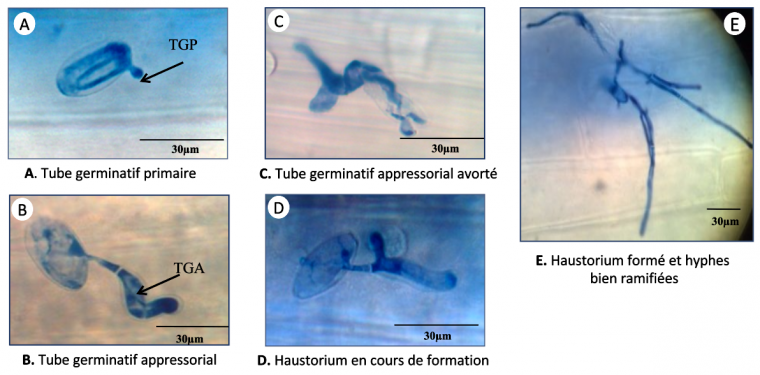
Nos résultats n’ont révélé aucune différence significative entre les plants mycorhizés et non mycorhizés concernant le stade « conidie avec un tube germinatif primaire » suggérant que la résistance induite par le champignon mycorhizien F. mosseae n’affecte pas la formation de ce tube. En revanche, le nombre de tubes germinatifs appressoriaux avec haustorium en cours de formation a été divisé par deux chez les plantes mycorhizées, ce qui montre que la mycorhization affecte la formation de l’haustorium (Tableau 1). Cela s’explique par une augmentation des tubes germinatifs appressoriaux avortés et de ceux sans haustorium. Toutes ces observations ont été effectuées 48 h après l’infection. Une observation un peu plus tardive, réalisée 72 h après l’infection, a montré que le nombre de tubes germinatifs appressoriaux avec haustorium bien formé était divisé par cinq chez les plantes mycorhizées. Il est à noter que la formation d’un haustorium est un facteur crucial pour la nutrition et le développement de l’agent pathogène fongique (Figure 4, Tableau 1).
L’ensemble de ces résultats suggère que la protection du blé contre B. graminis grâce à la mycorhization, peut s’expliquer par une réduction du nombre d’haustoriums formés dans les feuilles de blé mycorhizé.
|
Stade de développement de B. graminis |
Blé non mycorhizé |
Blé mycorhizé |
|
|---|---|---|---|
| Après 48 heures |
Tube germinatif primaire |
9,28 |
8,62 |
|
Tube germinatif appressorial avorté |
1 |
10,34* |
|
|
Tube germinatif appressorial |
41,23 |
57,76* |
|
|
Haustorium en cours de formation |
48,45 |
23,27* |
|
| Après 72 heures |
Haustorium formé et hyphes bien ramifiées |
40 |
8* |
Les stades A, B, C et D ont été observés 48 h après infection. Le stade E a été observé 72 h après infection. Tous les évènements ont été observés sur la troisième feuille de cinq plantules distinctes.
Effet de l’inoculation mycorhizienne sur les réactions de défense induites dans les feuilles de blé mycorhizé au niveau cytologique
Accumulation des polyphénols aux sites de pénétrations par B. graminis
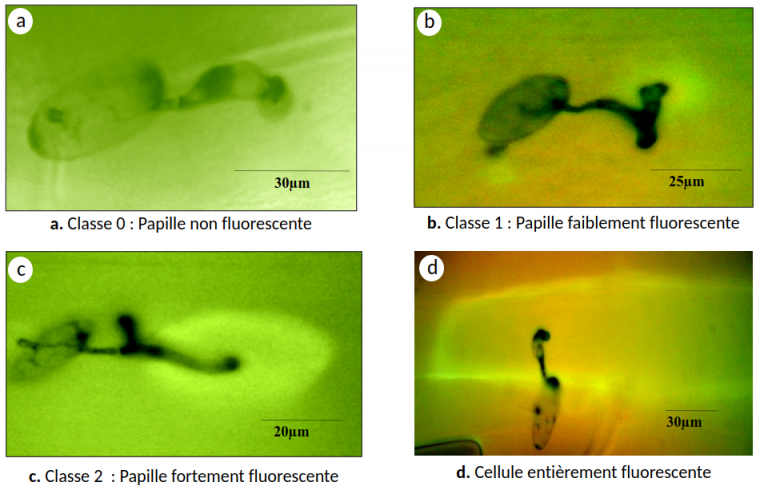
Au niveau des sites de pénétration de la feuille par B. graminis, la plante forme une papille qui accumule des composés phénoliques (voir Encadré 3). En fonction de l’intensité des composés phénoliques observés au microscope à fluorescence sous UV, trois classes ont été définies, classe 0 : papille non fluorescente, classe 1 : papille faiblement fluorescente et classe 2 : papille fortement fluorescente (Figure 5).
Tous les évènements ont été observés 48 h après infection sur la troisième feuille de cinq plantules distinctes.
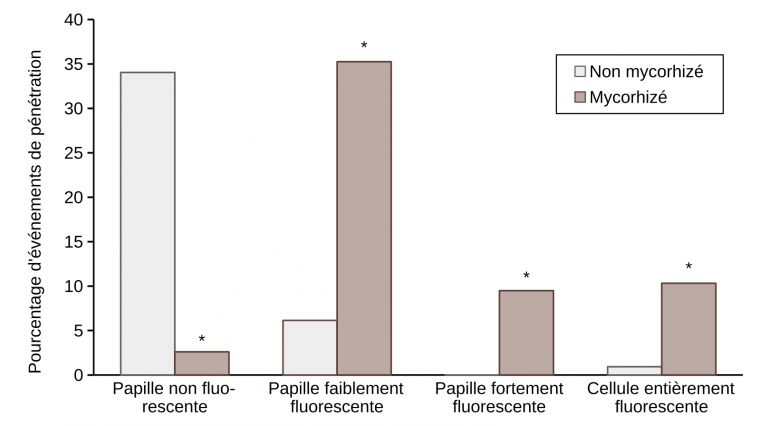
Nos résultats montrent que la réduction du nombre d’haustoriums observée précédemment serait associée à un pourcentage plus élevé de papilles fluorescentes au niveau des sites de pénétration du tube germinatif appressorial dans les cellules épidermiques des feuilles des plants mycorhizés, mais aussi à la présence de cellules entièrement fluorescentes dont le nombre est dix fois plus important dans ces feuilles que dans celles des plants non mycorhizés (Figures 5 et 6).
Tous les évènements ont été observés sur la troisième feuille de cinq plantules distinctes. L’astérisque indique une différence significative entre les plantules non mycorhizées et mycorhizées selon le test LSD (P ≤ 0,05).
Encadré 3 : Les papilles : des barrières formées en réponse à la pénétration d’un agent pathogène
En réponse à une infection, les plantes déposent des molécules jouant un rôle de barrière entre la membrane plasmique et la paroi des cellules situées au niveau de la zone de pénétration de l’agent pathogène. Ces dépôts prennent la forme de papilles. Les molécules incrustées dans la paroi correspondent à des polysaccharides, comme la callose, à des phénylpropanoïdes, comme la lignine et les composés phénoliques, à des protéines et glycoprotéines structurales, comme les glycoprotéines riches en hydroxyproline (HRGP), ou encore à des lipides, comme la subérine. L’ensemble de ces molécules confère à la paroi une meilleure résistance aux enzymes de dégradation pariétale produites par l’agent pathogène et constitue une barrière aux toxines et enzymes que ce dernier sécrète.
Accumulation de peroxyde d’hydrogène aux sites de pénétrations par B. graminis
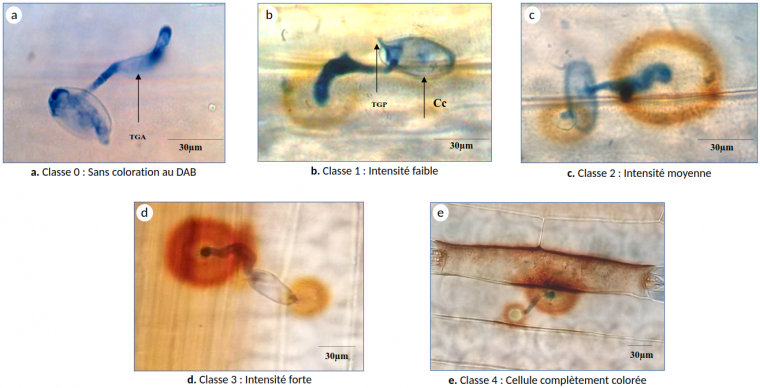
Lors de l’infection des feuilles de blé par B. graminis, une accumulation de peroxyde d’hydrogène (H2O2) dans les cellules épidermiques, autour des sites de pénétration par le tube germinatif appressorial de B. graminis, a été observée 21 h après infection grâce à une coloration au DAB (3,3‘-diaminobenzidine). Ce dernier polymérise localement dès qu’il est en contact avec H2O2 en présence de l’enzyme peroxydase. Plus la coloration marron est intense, plus l’accumulation de H2O2 est élevée. En fonction de l’intensité de cette coloration au DAB, quatre classes ont été définies : classe 0 : sans coloration au DAB, classe 1 : intensité faible, classe 2 : intensité moyenne, classe 3 : intensité forte et classe 4 : cellule entièrement colorée (Figure 7).
C : conidie; TGP: tube germinatif primaire; TGA: tube germinatif appressorial. Tous les évènements ont été observés 21 h après infection sur la troisième feuille de cinq plantules distinctes.
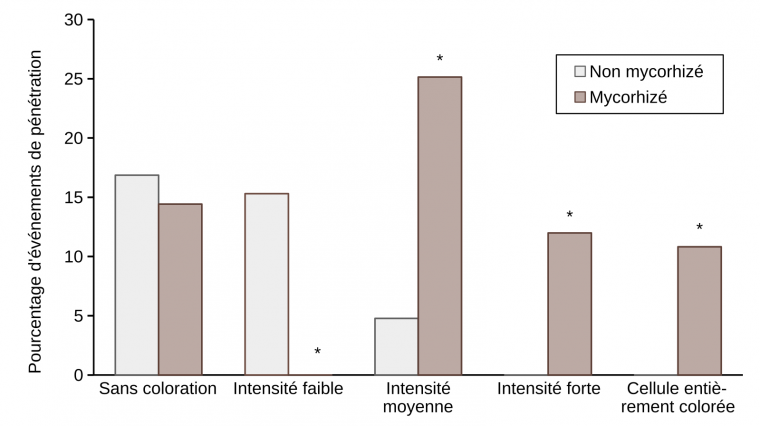
Les pourcentages d’événements de pénétration montrent que la réduction du nombre d’haustoriums formés est associée à un pourcentage plus élevé des papilles colorées au DAB, en particulier celles avec une intensité moyenne et forte au niveau des sites de pénétration du tube germinatif appressorial dans les cellules épidermiques des feuilles de plantes de blé mycorhizé (Figure 8).
Tous les évènements ont été observés 21 h après infection sur la troisième feuille de cinq plantules distinctes. L’astérisque indique une différence significative entre les plantules non mycorhizées et mycorhizées selon le test LSD (P ≤ 0,05).
D’après ces résultats, la protection du blé par F. mosseae peut être expliquée également par une accumulation de H2O2 dans les feuilles, soit au niveau des papilles formées, soit au niveau de la cellule entière.
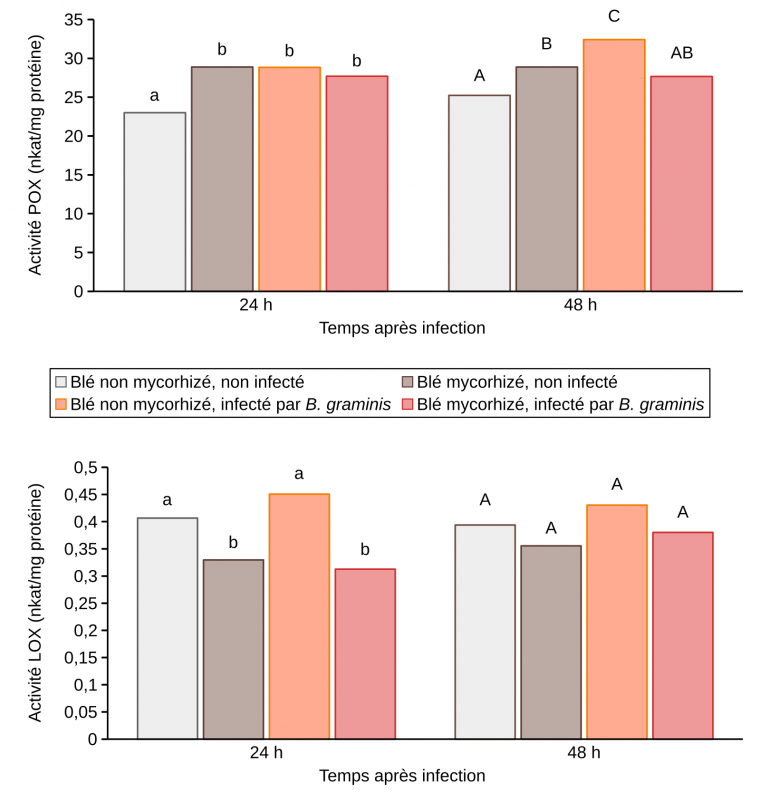
Effet de l’inoculation mycorhizienne sur l’expression de gènes codant des marqueurs de défense et sur l’activité peroxydase
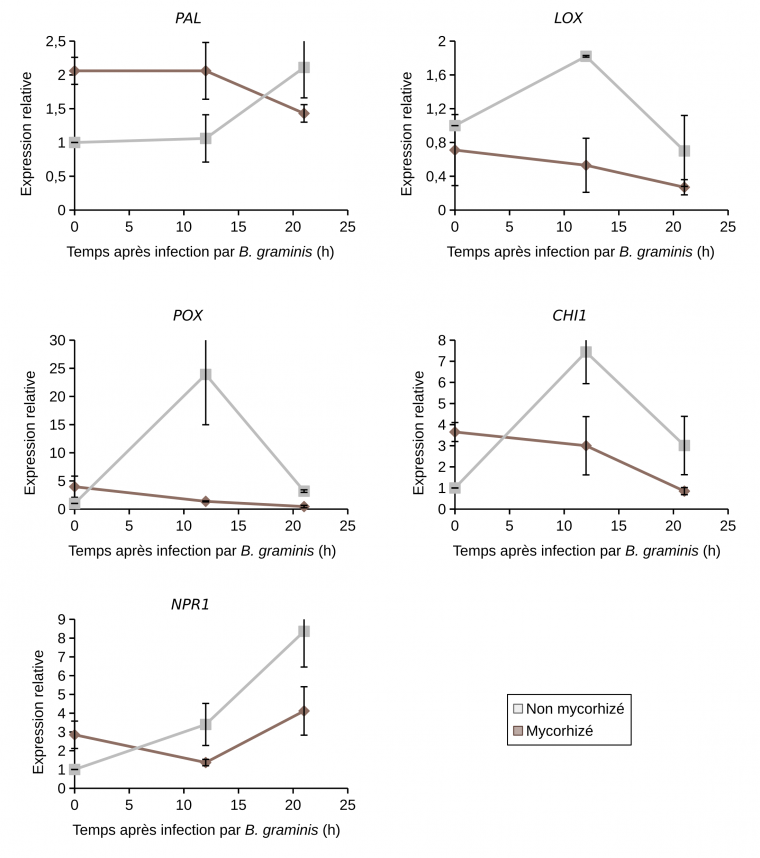
Pour examiner les mécanismes moléculaires impliqués dans la protection du blé contre l’oïdium en réponse à l’inoculation mycorhizienne, nous avons procédé à la mesure de l’expression de certains gènes codant des marqueurs de défense impliqués dans l’interaction blé-oïdium tels que la peroxydase (POX), la chitinase (CHI1), la phénylalanine ammonia-lyase (PAL), la Nonexpressor of Pathogenesis-Related Proteins 1 (NPR1) et la lipoxygénase (LOX).
Hors contexte infectieux (en absence de B. graminis), nous avons observé une surexpression des gènes POX, PAL, CHI1 et NPR1 dans les feuilles de plants de blé mycorhizé (Tableau 2) ainsi qu’une induction de l’activité enzymatique peroxydase (Figure 9). Ces résultats sont en faveur d’une élicitation des réactions de défense du blé en réponse à la mycorhization.
|
Nom du gène |
Niveau d’expression chez le blé mycorhizé, par rapport au blé non mycorhizé |
|---|---|
|
PAL |
2,09 |
|
LOX |
1,32 |
|
POX |
5 |
|
CHI1 |
4,6 |
|
NPR1 |
3,4 |
Effet de l’inoculation mycorhizienne avec Funneliformis mosseae et de l’infection par B. graminis sur les activités enzymatiques POX et LOX dans les feuilles de blé 24 et 48 h après infection par B. graminis. nkat : nanokatal.
Les valeurs indiquées correspondent à des moyennes. Les résultats sont issus de trois expériences indépendantes. Pour chaque expérience, la troisième feuille de 15 plantules prélevées à partir de 3 pots distincts, a été utilisée. Des lettres différentes indiquent des différences significatives entre les conditions d'un temps donné, selon le test LSD (P ≤ 0,05).
En contexte infectieux, c'est-à-dire en présence de B. graminis, ces mêmes gènes POX, PAL, CHI1 et NPR1 (à l'exception de LOX donc) étaient surexprimés chez les plantes non mycorhizées 12 heures après infection (et également 21h après infection pour PAL et NPR1) et réprimés chez les plantes mycorhizées (Figure 10). L’activité peroxydase était induite chez les plantes non mycorhizées 48 h après infection (Figure 9). Par contre, chez les plantes mycorhizées, aucune augmentation supplémentaire de l’activité peroxydase n’a été observée en présence du B. graminis. L’activité enzymatique de la LOX n’est pas modulée quel que soit le traitement observé sauf à 24h après infection chez les plants mycorhizés (Figure 9). L’ensemble de ces résultats suggère l’absence de potentialisation des réactions de défense chez le blé mycorhizé infecté (Encadré 4).
La mesure de l’expression des gènes a été réalisée par RT-qPCR (quantitative reverse transcription polymerase chain reaction), avant infection ou après 12 ou 21 h d'infection par B. graminis.
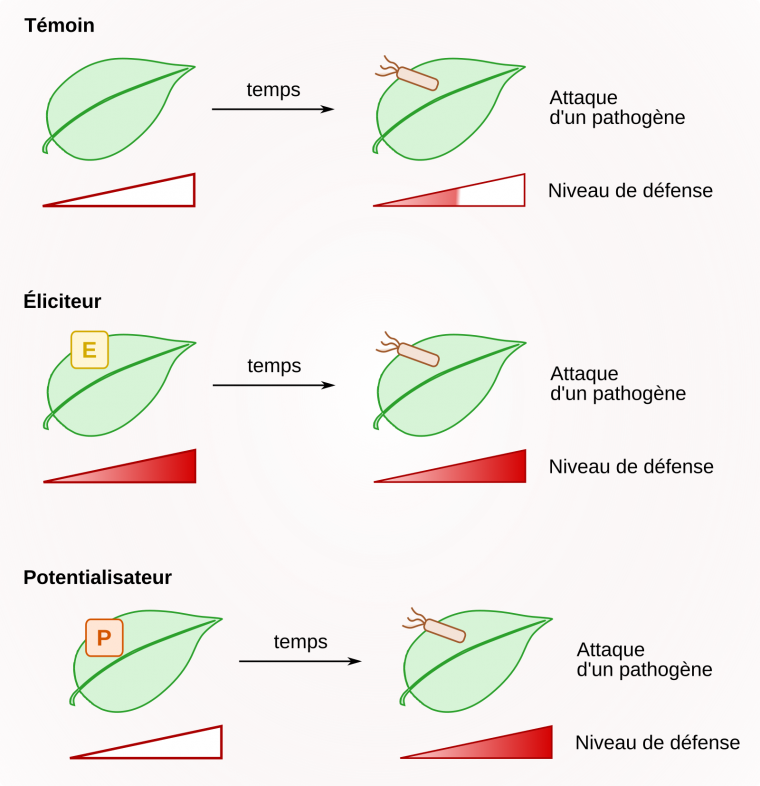
Encadré 4 : Les stimulateurs des défenses naturelles des plantes
Selon le réseau mixte technologique Elicitra, les stimulateurs des défenses naturelles des plantes se définissent comme « toute substance ou tout micro-organisme vivant non pathogène qui, appliqué sur une plante, est capable de promouvoir un état de résistance significativement plus élevé par rapport à une plante non traitée, face à des stress biotiques ». Les stimulateurs des défenses naturelles des plantes sont des molécules pouvant entraîner une élicitation ou une potentialisation (Figure 11). L’élicitation correspond à une activation continue des défenses de la plante, en réponse à l’éliciteur, indépendamment de la présence d’un agent pathogène. La potentialisation (ou priming en anglais) correspond à une sensibilisation de la plante suite à une interaction avec des symbiotes ou des parasites. Lors d’une attaque ultérieure par un agent pathogène, elle engendre des réactions de défense plus fortes que celles observées chez un témoin n’ayant pas subi de potentialisation.
Les stimulateurs des défenses naturelles des plantes sont des molécules qui provoquent l'élicitation ou la potentialisation des réactions de défense de la plante.
Télécharger une version éditable au format SVG.
Résumé
Un taux de protection important contre l’oïdium, estimé à 78 %, a été observé sur les feuilles de blé mycorhizé, suggérant l’induction d’une résistance systémique. Les mécanismes impliqués dans cette protection sont liés à une induction de réactions de défense. En effet, au moment de l’infection de la plante par B. graminis, une réduction du nombre d’haustoriums formés a été observée au niveau des cellules épidermiques des feuilles de blé mycorhizé, avec une accumulation de composés phénoliques et de H2O2, soit au niveau des papilles formées, soit au niveau de la cellule entière. Des suivis d’accumulation de transcrits (par RTqPCR), dans les feuilles de blé mycorhizé, en absence de toute infection par B. graminis, ont mis en évidence une surexpression de gènes codant des marqueurs de défense. Parmi ceux-ci, la peroxydase conduit à l’oxydation de plusieurs substrats phénoliques, ce qui permet la formation de lignine en présence d’H2O2, la phénylalanine ammonia-lyase est une enzyme catalysant la principale étape d’entrée dans la voie de synthèse des phénylpropanoïdes (groupe de molécules qui comporte en particulier la lignine, la subérine, les flavonoïdes…), la chitinase est capable d’hydrolyser la chitine des parois fongiques et la NPR1 est connue comme étant un élément clé de la régulation de la résistance systémique acquise chez les plantes.
L’ensemble de nos résultats démontre que la protection obtenue contre l’oïdium du blé en réponse à l’inoculation mycorhizienne correspondrait à une résistance induite par la mycorhization (en anglais MIR, pour Mycorrhiza-Induced Resistance). Dans nos conditions, les mécanismes associés à cette résistance ont conduit à la réduction du niveau d’infection par B. graminis (principalement en empêchant la formation de l’haustorium) et à une élicitation des réactions de défenses de type systémique plutôt qu’une potentialisation de celles-ci dans les feuilles de blé mycorhizé.
Encadré 5 : La symbiose plante – champignon mycorhizien, un délicat équilibre
L’établissement d’une symbiose entre une plante et un champignon mycorhizien débute par un dialogue moléculaire permettant le rapprochement des deux partenaires (production de strigolactones et de flavonoïdes par la plante, d’auxine et de lipochitooligosaccharides par le champignon). Une fois au contact de son hôte, des hyphes du champignon colonisent l’intérieur des racines, ce qui implique une digestion de la paroi. Ce processus entraîne une réponse immunitaire de l’hôte, qui peut toutefois être tempérée par le champignon. Par exemple, le champignon mycorhizien à arbuscules Rhizophagus irregularis produit une protéine, SP7, capable de se déplacer jusque dans le noyau des cellules de son hôte, la luzerne tronquée (Medicago trunculata). Là, SP7 interagit avec le facteur de transcription ERF19 de la luzerne, qui est impliqué dans la signalisation de l’éthylène. Cette interaction conduit à une diminution des processus de défense et favorise la mise en place de la biotrophie 1. Ainsi, l’installation d’un champignon mycorhizien déclenche une réponse immunitaire qui pourrait expliquer les effets protecteurs de la mycorhization face aux agents pathogènes. Par ailleurs, l’équilibre entre capacité de colonisation du champignon et résistance de la plante à celle-ci serait cruciale pour permettre l’établissement de la mycorhization.
Quels sont les facteurs qui peuvent influencer la protection du blé contre l’oïdium en réponse à la mycorhization ?
Très peu de paramètres pouvant influencer le niveau de protection des plantes mycorhizées ont été étudiés dans le cadre d’une résistance induite des plantes contre des agents pathogènes fongiques. Quelques travaux ont montré l’influence de différentes espèces mycorhiziennes à induire une protection contre des agents pathogènes racinaires 1234. En revanche, aucune étude ne décrit l’utilisation des champignons mycorhiziens à arbuscules pour protéger le blé.
En parallèle d’un travail sur différents inoculums mycorhiziens, qui pourraient posséder différentes efficacités pour induire une résistance, nous nous sommes également intéressés à l’impact de la concentration en phosphore sur cette protection induite. En effet, le phosphore est connu pour influencer la mise en place de la symbiose mycorhizienne lors d’une interaction entre une plante et un champignon mycorhizien. Qu’en est-il de la protection qui pourrait en découler ? Enfin, nous nous sommes interrogés sur l’influence du niveau de résistance du cultivar de la plante lors de ses interactions avec le champignon mycorhizien et le parasite.
Concentration en phosphore
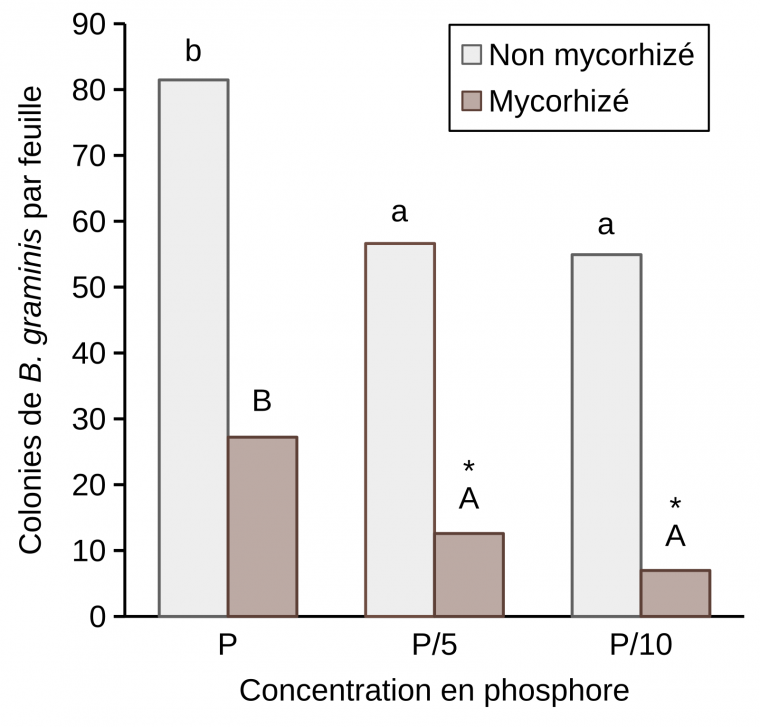
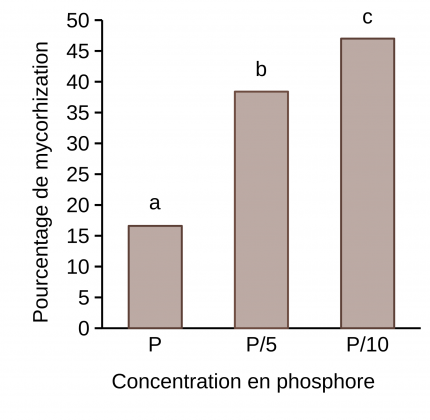
Trois concentrations de phosphore ont été testées et notées P (correspondant à 62 mg.L-1, c’est-à-dire 73 kg.ha-1, la dose moyenne utilisée au champ en France pour la culture du blé), P/5 et P/10.
Nos résultats ont montré une réduction du nombre de colonies de B. graminis sur les feuilles de blé non mycorhizé aux faibles concentrations, P/5 et P/10, par comparaison à P. Le même phénomène est observé chez les plantes mycorhizées. La mycorhization permet une protection quelle que soit la concentration de phosphore. Cette protection peut atteindre jusqu’à 78 et 82 % à P/5 et P/10 respectivement chez les plants mycorhizés par comparaison à leurs témoins non mycorhizés (Figure 12).
Les tests d’infection ont été réalisés sur des plantules de blé âgées de 6 semaines et les colonies ont été comptées 8 jours après infection. Les plantes ont été arrosées avec une solution de Hoagland’s. [P] = 62 mg/L.
Des lettres différentes indiquent des différences significatives entre les résultats obtenus avec différentes concentrations de phosphore sur des feuilles de blé non mycorhizé ou mycorhizé. L’astérisque indique une différence significative entre blé non mycorhizé et mycorhizé, pour une concentration donnée de phosphore, selon le test LSD (P ≤ 0.05). Les valeurs correspondent à des moyennes obtenues à partir de trois expériences indépendantes. Les résultats de chaque expérience sont issus de 15 plantules de blé prélevées à partir de trois pots distincts.
Les taux de mycorhization ont été déterminés sur des racines de plantules de blé âgées de 6 semaines. Les plantes ont été arrosées avec une solution de Hoagland’s. [P] = 62 mg/L.
Des lettres différentes indiquent des différences significatives entre les résultats obtenus avec différentes concentrations de phosphore. Les valeurs correspondent à des moyennes obtenues à partir de 3 expériences indépendantes Les résultats de chaque expérience sont issus de 15 plantules de blé prélevées à partir de trois pots distincts.
Par ailleurs, nous avons également observé que la diminution de la concentration en phosphore conduit à une augmentation du taux de mycorhization (Figure 13). Ces résultats confirment ce qui a été déjà largement décrit dans la littérature : l’établissement de la symbiose mycorhizienne est contrôlée par le régime de fertilisation au champ. Une fertilisation élevée en phosphore induit une diminution de la colonisation racinaire par les champignons mycorhiziens à arbuscules 1.
Encadré 6 : Phosphore et symbiose mycorhizienne
En plus de son implication dans la nutrition de la plante, le phosphate inorganique (forme de phosphore assimilable par les plantes) est un signal majeur nécessaire au maintien de la symbiose mycorhizienne arbusculaire 1. Des apports importants en phosphore inhibent le développement de la symbiose en favorisant la voie d’absorption directe par la plante, moins coûteuse en énergie pour celle-ci 2. La répression des transporteurs de phosphate, strictement induits en réponse à la symbiose mycorhizienne, se traduit par une accumulation de polyphosphate dans les arbuscules, une diminution significative de la concentration en phosphore dans les parties aériennes de la plante et une dégénérescence prématurée des arbuscules qui met un terme à l’interaction 3. L’avortement de la symbiose s’explique par la non réciprocité des échanges : la plante ne reçoit plus de phosphate du champignon, elle ne lui apporte donc plus de carbone. Étant un biotrophe obligatoire, le champignon mycorhizien ne peut plus se développer.
Ainsi, ces résultats mettent en évidence l’importance des conditions de préservation des champignons mycorhiziens à arbuscules dans les sols et de mise en œuvre de la symbiose mycorhizienne de façon à optimiser les services écosystémiques rendus. Ces champignons contribuent à favoriser la nutrition minérale des plantes hôtes dans des sols, carencés en phosphate notamment, contribuant ainsi à la réduction des intrants chimiques et au maintien des rendements. C’est pourquoi, ils apparaissent, aujourd’hui, parmi les acteurs clés à prendre en considération dans la mise en place de la transition agroécologique.
Type d’inoculum mycorhizien
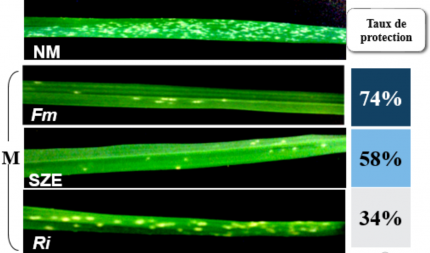
L’efficacité de protection du blé contre l’oïdium par trois types d’inoculums mycorhiziens a été testée en fixant la concentration du phosphore à P/5. Il s’agit de Rhizophagus irregularis, une espèce de champignon mycorhizien à arbuscules dont l’inoculum provient de notre laboratoire et deux inoculums commerciaux, l’un utilisant Glomus sp. (Solrize SZE) et l’autre le champignon ayant servi à réaliser nos expériences précédentes, F. mosseae.
Symptômes observés 8 jours après infection sur feuilles de blé du cultivar Orvantis infectés par B. graminis. Les plantes ont été arrosées avec une solution d’Hoagland contenant du phosphore à [P/5] = 12.4 mg/L.
NM: Non mycorhizé et M: mycorhizé avec Rhizophagus irregularis (Ri), Glomus sp. (SZE) ou Funneliformis mosseae (Fm) comme inoculum.
Nos résultats montrent que la protection contre B. graminis, dépend de l’inoculum utilisé. Le meilleur taux de protection contre B. graminis a été obtenu avec l’inoculum F. mosseae (74 %), suivi de Glomus sp. (58 %), puis de R. irregularis (34 %) (Figure 14). Par ailleurs, les résultats de taux de mycorhization ont montré une colonisation plus élevée avec F. mosseae (38,4 %), suivie de R. irregularis (19 %), puis Glomus sp. avec le taux le plus faible (8 %) (données non montrées). Ces résultats indiquent qu’un taux de mycorhization élevé n’est pas une condition nécessaire pour une bonne protection mais que l’espèce de champignon, la souche et/ou la formulation de l’inoculum utilisé semblent déterminants.
Cultivar de blé
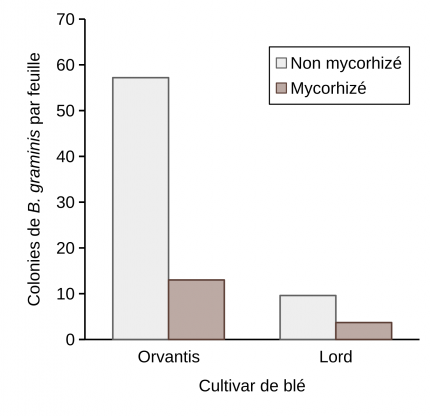
Deux cultivars de blé, Orvantis et Lord, respectivement modérément sensible et résistant à B. graminis, ont été testés. La figure 15 montre que chez les plantes non mycorhizées, l’infection par B. graminis est moins importante sur le cultivar le plus résistant, Lord, ce qui est cohérent avec son niveau de résistance au champ.
Le test d’infection a été effectué sur des plantules de blé âgées de 6 semaines et les colonies ont été comptées 8 et 11 jours après infection sur les cultivars de blé Orvantis et Lord respectivement. Les plantes ont été arrosées avec une solution de Hoagland contenant du phosphore à une concentration de [P/5] = 12,4 mg/L. Des lettres différentes indiquent une différence significative entre le nombre de colonies comptées sur les feuilles des cultivars de blé Orvantis (niveau de résistance = 5) et Lord (niveau de résistance = 7) non mycorhizé et mycorhizé.
Quel que soit le niveau de sensibilité du cultivar testé, la mycorhization permet une protection contre B. graminis aussi bien chez Orvantis que Lord. Ce taux de protection est estimé à 78 et à 61 % respectivement.
L’état de mycorhization chez les deux cultivars montre que les racines de Lord et Orvantis sont bien colonisées par F. mosseae avec un taux de colonisation racinaire légèrement inférieur chez Lord par rapport à Orvantis (données non montrées).
Il est important de noter que, quel que soit le niveau de sensibilité du cultivar testé, un gain de protection contre B. graminis a été obtenu chez les blés mycorhizés par comparaison aux blés non mycorhizés. Ces résultats soulignent l’importance de la prise en compte de ce paramètre, autant pour optimiser l’efficacité de la protection du blé contre l’oïdium en réponse à la mycorhization, que pour étendre l’utilisation de ces pratiques culturales à différents cultivars sensibles ou modérément sensibles à la maladie.
Résumé
Afin d’optimiser l’efficacité à protéger le blé contre l’oïdium via le phénomène de résistance induite par la mycorhization, il est important de contrôler les différents paramètres susceptibles d’influencer le taux de mycorhization et, surtout, l’efficacité de la protection induite. Nos résultats ont montré que la concentration de phosphore, le type d’inoculum mycorhizien ainsi que le niveau de résistance du cultivar de blé font partie des paramètres importants à prendre en considération pour favoriser la protection du blé en utilisant les champignons mycorhiziens. En utilisant une dose de phosphore cinq fois moins importante que la dose moyenne utilisée au champ en France pour la culture du blé, le taux de mycorhization des plants de blé par F. mosseae est multiplié par 2,3, tout en doublant le taux de protection contre l’oïdium. Néanmoins, une trop forte diminution de l’apport de phosphore va limiter la croissance de la plante, perte qui n’est pas compensée par la mycorhization (résultats non montrés).
Conclusion générale et perspectives
En conclusion, cette étude met en évidence le potentiel des champignons mycorhiziens à arbuscules comme agents de biocontrôle des maladies foliaires dans un contexte de transition agroécologique et en particulier l’intérêt de proposer l’inoculation du blé par ces champignons comme moyen de lutte alternative contre l’oïdium. Il est toutefois important de bien définir les conditions d’emploi de ces champignons. Il faut notamment déterminer les doses optimales des éléments nutritifs minéraux tels que le phosphore, afin d’assurer une croissance végétale satisfaisante ainsi qu’un taux de mycorhization suffisant à la mise en place du phénomène de résistance induite par la mycorhization. Il est également nécessaire de choisir l’inoculum mycorhizien approprié pour protéger le cultivar utilisé.
Pour compléter l’étude des mécanismes de défense impliqués dans la protection du blé contre l’oïdium en réponse à la mycorhization, il serait intéressant de rechercher d’autres marqueurs de résistance induite en ciblant par exemple des gènes codant d’autres protéines liées à la pathogenèse (PR pour pathogenesis-related proteins), qui sont des protéines produites par la plante en réponse à l’infection par un agent pathogène (chitinases, glucanases…). Il pourrait s’agir par exemple de la PR1 (connue pour être un bon marqueur de la résistance systémique acquise1 en réponse à différents pathogènes), de la PR2 (glucanase), ou encore de la LTP (protéine de transfert des lipides) impliquée dans la résistance du blé contre B. graminis. La mesure de l’expression d’autres gènes codant des protéines intervenant en particulier dans le renforcement des parois ou la formation de papilles (dépôt de callose, accumulation de composés phénoliques) comme la CAD (coumaroyl alcool déshydrogénase, intervenant dans la voie de synthèse de la lignine), la chalcone isomérase (CHI) et la chalcone synthase (CHS), intervenant dans la voie de synthèse de flavonoïdes serait également envisageable.
Par ailleurs, des approches plus globales de transcriptomiques et/ou métabolomiques permettraient d’identifier d’autres voies ou métabolites signaux, comme l’acide jasmonique, l’acide salicylique ou l’éthylène, qui seraient mobilisés chez le blé mycorhizé et potentiellement impliqués dans les phénomènes de résistance du blé contre B. graminis. Enfin, il est indispensable de tester l’efficacité de la mycorhization contre l’oïdium du blé au champ.