Pour la première fois, une équipe britannique a comparé les taux de mutations somatiques chez seize espèces de mammifères. Publiées dans Nature, leurs observations montrent qu’indépendamment de la durée de vie, la quantité de mutations atteinte en fin de vie est similaire. En effet, le taux de mutation diminue avec la longévité. Ce résultat est en faveur de la théorie selon laquelle le vieillissement serait induit par une accumulation de mutations : les animaux dont le génome mute plus rapidement vivent moins longtemps.
Les mutations touchant des gènes critiques (oncogènes ou suppresseurs de tumeurs) peuvent être responsables de cancers 1. Comme les espèces volumineuses possèdent un plus grand nombre de cellules, on pourrait penser qu’elles sont plus sujettes aux cancers. Cependant il n’en est rien. Par exemple, les souris sont autant touchées par les cancers que les éléphants : c’est le paradoxe de Peto 2. Alors, comment expliquer que la probabilité de développer un cancer ne soit pas corrélée au nombre de cellules – et donc à la masse – d’un organisme ? Serait-ce parce que le taux de mutation dépendrait de la masse des espèces ?
Par ailleurs, les processus de vieillissement seraient liés à des dommages moléculaires, tels que le raccourcissement des télomères 3 ou, bien que cela n’ait jamais été démontré, les mutations somatiques (c'est-à-dire les mutations ayant lieu dans une cellule somatique après la fécondation, et qui ne sont donc pas héritées des parents) 4. Cette dernière hypothèse, liant vieillissement et mutations somatiques, impliquerait que les espèces vivant plus longtemps accumuleraient des mutations moins rapidement. Il y aurait alors une dépendance entre le taux de mutation et l’espérance de vie des espèces.
Une équipe britannique a cherché à déterminer le lien entre taux de mutation somatique, masse et espérance de vie, en étudiant 16 espèces de mammifères, comme la souris, le rat-taupe nu ou l’être humain 5. Les espèces étudiées pèsent de 20 g à 800 kg et vivent de 2 à 80 ans. Les précédentes études à s’être intéressées aux taux de mutations somatiques n’avaient été réalisées que chez l’être humain. Ici, pour disposer d'un protocole unifié chez toutes les espèces étudiées, les chercheurs se sont concentrés sur les cryptes du colon, d’une part pour leur accessibilité et leur facilité de microdissection, et d’autre part car chaque crypte constitue une population clonale issue d’une cellule unique, ce qui permet de repérer facilement les mutations ponctuelles entre les cellules. De plus, les mutations s’y accumulent au cours du temps de façon linéaire 6, ce qui permet d’inférer un taux annuel de mutation, et de supposer qu’il est constant.
Ayant analysé les génomes entiers de 208 cryptes chez 56 individus, différents types de mutation ont pu être identifiés. Les substitutions ponctuelles les plus fréquentes témoignent de désaminations spontanées, d’erreurs de réparation ou de dommages oxydatifs 7. Dans un second temps, les insertions et délétions (indel) ainsi que les réarrangements chromosomiques ont également été considérés.
Connaissant l’âge de chaque individu, les chercheurs ont ensuite pu évaluer le taux annuel de mutation par génome chez chaque espèce. Les taux minimaux et maximaux sont séparés d’un facteur 16. En revanche, le bagage mutationnel accumulé en fin de vie est remarquablement similaire d’une espèce à l’autre (les minima et maxima ne sont séparés que d’un facteur 3). Les mutations s’accumulent donc à des vitesses très différentes, sans pour autant que leur quantité en fin de vie ne varie. Il semble alors qu’espérance de vie et taux de mutation soient directement liés.
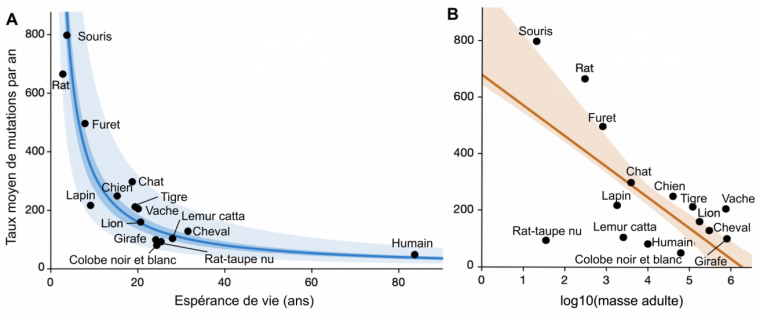
Pour vérifier ce postulat, les chercheurs ont tracé le taux de mutations en fonction de l’espérance de vie et montré qu’il suit un modèle exponentiel décroissant (Figure 1A). Cela confirme que les espèces vivant plus longtemps mutent moins vite. En considérant séparément les différents types de mutations (substitutions de désamination ou d’oxydation, insertions-délétions, mutations affectant le génome mitochondrial), les chercheurs ont retrouvé cette même corrélation. S’agissant de dommages d’origines très différentes, cela indique que le lien entre taux de mutation et longévité ne peut pas reposer sur une unique voie de réparation de l’ADN.
A. Corrélation entre le taux moyen de mutations par an et la durée de vie des espèces. Résultat d’un modèle linéaire mixte appliqué à chaque crypte. Pour une meilleure lisibilité, chaque point représente la moyenne des cryptes de chaque espèce.
B. Même modèle qu’en A, appliqué à la masse corporelle des espèces.
Sur chacune des deux figures, la ligne de couleur foncée représente le résultat de la régression utilisée, tandis que la zone colorée représente l'intervalle de confiance à 95 %. Sur la figure A, la zone plus claire correspond à un intervalle allant de la moitié au double de la valeur de la régression.
Le taux de mutation ne semble par contre pas corrélé à d’autres traits d’histoire de vie, comme la masse corporelle (Figure 1B), le taux métabolique basal ou la taille des portées. À titre d’exemple, la masse d’une girafe est 23 000 fois plus élevée que celle d’un rat-taupe nu, mais ces deux animaux présentent pourtant un taux de mutation et une espérance de vie similaire. Ainsi, parmi les traits d’histoire de vie étudiés par les auteurs, l’espérance de vie est le seul à être corrélé au taux de mutation.
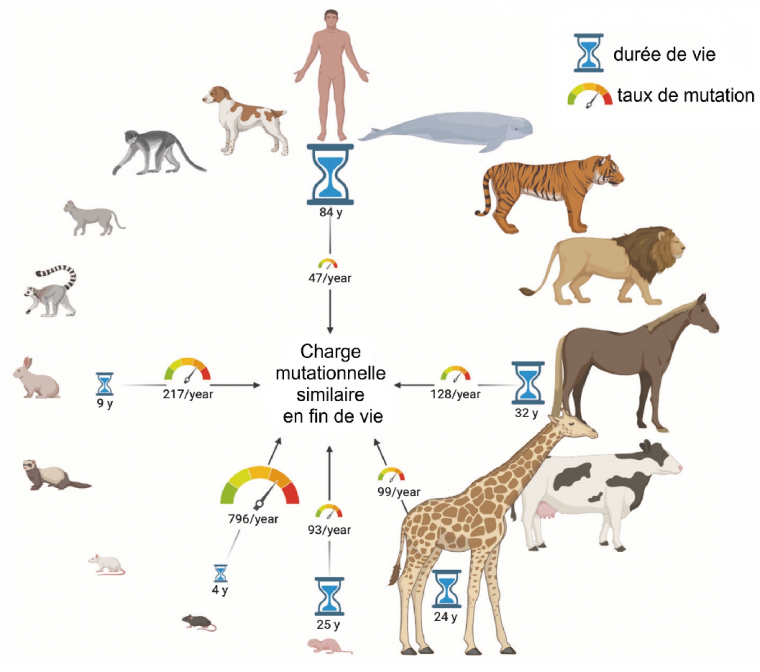
Peto avait observé que le nombre de cellules d’un animal ne conditionne pas la probabilité qu’il ait un cancer. Il en avait conclu que le taux de mutation devait varier d’une espèce à l’autre, hypothèse confirmée par les auteurs de cette étude. Cependant, ils montrent que ces variations du taux de mutation ne sont pas pas déterminées par le nombre de cellules, mais par l’espérance de vie de l’animal. À la fin de sa vie, chaque animal a accumulé le même nombre de mutations, mais à des vitesses différentes (Figure 2).
Pour chaque espèce représentée, l’espérance de vie (en années) est représentée par un sablier et le taux de mutation (en an-1) par un cadran de vitesse. Augmenter l’un revient à réduire l’autre et inversement, ce qui mène à une charge mutationnelle similaire en fin de vie.
Se pose tout de même la question de la généralisation de ces résultats. Restent-ils vrais pour d’autres tissus ? Peuvent-ils être élargis à d’autres espèces ? Il faut d’ailleurs prendre leur pertinence sur les espèces étudiées avec précaution, car certaines ne sont représentées que par un seul individu.
Il reste ensuite à comprendre pourquoi les espèces vivant plus longtemps présentent un taux de mutation plus faible. Il est probable qu’elles possèdent des systèmes de protection de l’ADN plus performants, comme cela a déjà été montré chez certaines espèces 12. Alors si certains animaux vivent moins longtemps que d’autres, c’est peut-être surtout parce qu’ils protègent moins bien leur ADN.