Les écosystèmes abritent une grande diversité d’espèces, de traits fonctionnels et d’interactions. Parce que les individus établissent des interactions multiples avec d’autres individus et avec leur environnement abiotique, les systèmes écologiques présentent des dynamiques complexes en réponse aux différents types de perturbations. Comprendre comment les systèmes écologiques, des populations aux écosystèmes, répondent aux perturbations et les mécanismes associés à leur résilience ainsi qu’à leur stabilité est un enjeu majeur de l’écologie contemporaine.
Catégories de perturbations et conséquences sur la réponse des écosystèmes
Qu’est-ce que la stabilité d’un écosystème ?
Dans un contexte de changements globaux, tous les systèmes écologiques sont soumis à des pressions croissantes dues aux activités humaines. La fragmentation des habitats altère le maintien des petites populations en limitant la dispersion des individus, la surconsommation d’intrants agricoles déséquilibre notamment le fonctionnement des écosystèmes aquatiques tandis que le changement climatique exacerbe ces différentes perturbations. En réponse, l’état d’un écosystème – comme un lac ou une prairie – est en perpétuel changement. Le mot « état » est utilisé ici comme un terme générique et peut aussi bien qualifier la diversité d’espèces, de traits, que la biomasse des espèces, ou bien encore le fonctionnement de l’écosystème en termes de cycles de la matière. Chacun de ces attributs peut répondre différemment aux diverses perturbations s’exerçant sur les écosystèmes (voir par exemple 1 pour le cas des écosystèmes arides).
La stabilité d’un système écologique peut être définie de différentes manières. Ce qui est stable est, par définition, ce qui se maintient dans le temps. La notion de stabilité comprend donc à la fois la capacité des populations et des écosystèmes à absorber les perturbations, c’est-à-dire à avoir un état qui change peu suite à une perturbation, et la capacité des écosystèmes modifiés suite à une perturbation à revenir à leur état initial.
Deux catégories de perturbations
La stabilité d’un écosystème peut être représentée comme la trajectoire d’une balle dans un paysage vallonné, appelé paysage de stabilité. Dans celui-ci, une vallée correspond à un état stable de l’écosystème. L’état de l’écosystème (la position de la balle dans le paysage) peut changer en fonction des perturbations que l’écosystème reçoit. On distingue traditionnellement deux grandes catégories de perturbations, les pulses et les presses.
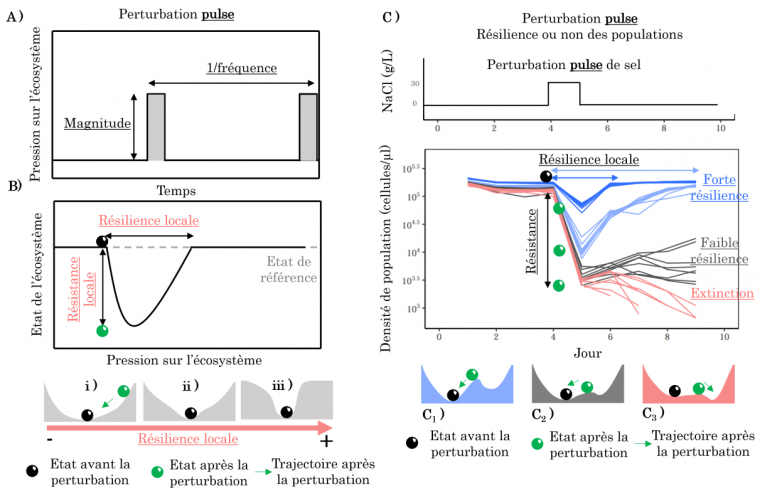
Les perturbations dites « pulse » sont des perturbations instantanées modifiant les pressions s’exerçant sur les populations ou écosystèmes sur une courte durée avant de se dissiper (Figure 1A). C’est le cas par exemple des événements de pollution comme la fuite d’un contaminant chimique ou bien des événements extrêmes (cyclones, feux de forêt). Ces perturbations peuvent être décrites par leur magnitude (impact sur l’état de l’écosystème) et leur fréquence.
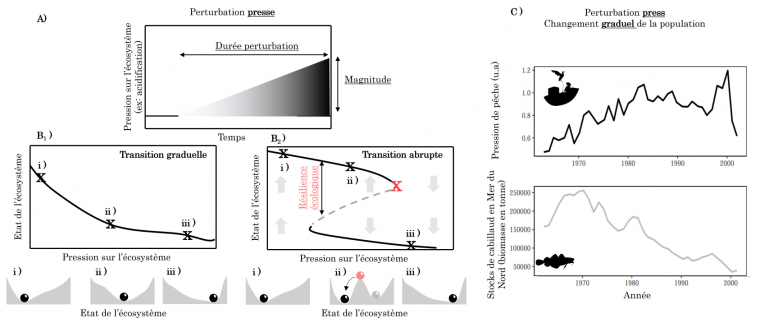
D’un autre côté, certaines perturbations modifient en continu l’abondance des espèces dans un écosystème ou bien la disponibilité en ressources. Ces perturbations, nommées « presse », peuvent être décrites par deux paramètres : leur durée et leur magnitude (Figure 2A). Par exemple, la pression de pêche diminue en continu les stocks de poissons (Figure 2B), l’acidification des écosystèmes aquatiques cause le blanchissement des coraux 2, et l’invasion d’une espèce peut modifier la composition des communautés locales 34.
En fonction de la magnitude de la perturbation (presse ou pulse), ainsi que de l’état initial de l’écosystème, l’écosystème peut revenir à son état d’équilibre avant la perturbation ou bien changer d’état. Ces deux devenirs d’un écosystème exposé à une perturbation forment deux paradigmes distincts de la stabilité en écologie, et qui ont historiquement évolué en parallèle 567. Dans la suite, en nous basant sur une expérience sur les levures, nous montrerons que les travaux récents permettent de faire le lien entre ces deux paradigmes 8.
Stabilité locale et retour à l’état d’équilibre
Le paradigme de la stabilité dite « locale » considère qu’un écosystème possède un seul état stable (une vallée dans le paysage de stabilité) vers lequel il reviendrait nécessairement. Dans l’exemple de la Figure 1B, un écosystème initialement dans un état dit stable (balle noire) est perturbé par une perturbation pulse et se retrouve dans un nouvel état (balle verte). Sa dynamique de rétablissement illustre deux caractéristiques de la stabilité locale. Premièrement, la résistance locale correspond à l’amplitude du changement d’état de l’écosystème en réponse à la perturbation. Pour une même perturbation, moins l’état de l’écosystème est altéré, plus l’écosystème est dit résistant. Deuxièmement, la résilience locale mesure le temps de retour à l’équilibre stable 910. Pour une même perturbation, un écosystème fortement résilient reviendra plus rapidement à son état initial qu’un écosystème peu résilient. Quelle que soit la perturbation que reçoit le système, la stabilité locale quantifie alors le retour du système à son état d’équilibre (correspondant au fond de la vallée). La forme du paysage dépend de la résilience de l’écosystème : plus l’écosystème est résilient, plus il reviendra vite à son état d’équilibre (Figure B i versus iii), ce qui peut être illustré par une vallée bordée de pentes raides.
A. Les perturbations pulses correspondent à l’augmentation rapide, mais transitoire d’une pression sur l’écosystème.
B. La résilience locale mesure le temps de retour d’un écosystème à son équilibre avant perturbation (référence) tandis que la résistance mesure à quel point l’état de l’écosystème (par exemple un stock de poissons, la biomasse de la végétation) est influencé par la perturbation. Dans le paysage de stabilité, plus la pente vers l’état stable est élevée, plus la résilience locale sera forte car le système reviendra plus rapidement à son état d’équilibre.
C. Dynamique de rétablissement de populations de levures soumises à un choc salé entre le jour 4 et 5. Certaines sont fortement résilientes et reviennent à la même abondance qu'avant la perturbation (courbes bleues), d’autres sont moins résilientes et ont un temps de retour très long (courbes noires), et certaines s’éteignent (courbes roses). Leur résilience dépend de la forme du paysage de stabilité illustrée pour chaque type de réponse en dessous (A1-A3). Pour les courbes bleues, la pente entre la vallée et le sommet est forte. La perturbation pulse va pousser la population en haut du col, mais cette dernière revient donc vite à l’état avant perturbation (résilience forte). Lorsque la pente diminue, les populations reviennent à leur état initial mais en un temps plus long (courbes noires). Enfin, lorsque le paysage change pour favoriser un état d’extinction de la population plutôt qu’un état où la population persiste (cas rose), le choc salé fait basculer les populations vers l’autre état stable correspondant à l’extinction des populations. Données issues de 1
Prenons l’exemple de la figure 1C pour illustrer ces concepts. Des populations de levures sont exposées à un milieu contenant du sel pendant quelques heures (un choc salé au jour 4) qui réduit considérablement l’abondance des individus dans les populations. Parmi toutes les populations, certaines sont très résistantes et résilientes car leur abondance diminue peu à la suite du choc salé et elles retournent rapidement à l’abondance qu’elles avaient avant la perturbation (courbes bleues). À l’inverse, d’autres sont moins résilientes et résistantes, car elles ont un temps de retour plus important (courbes noires). Enfin, certaines populations ne sont pas résilientes, car elles ne reviennent pas à leur état initial (courbes rouges). Il est intéressant de noter que, dans le cadre de cette expérience, la résilience et la résistance sont positivement corrélées. Bien que ce ne soit pas toujours le cas, une méta-analyse récente sur les résultats d’expériences de pulses (comment celle décrite précédemment) indique néanmoins que les systèmes ayant une plus forte résistance reviennent plus rapidement vers leur équilibre 1.
Il convient de noter que la définition de la stabilité locale est dépendante du type de perturbation s’appliquant sur l’écosystème 2. Un choc de sel plus long ou plus fort changerait la résilience et la résistance locales mesurées pour les mêmes populations de levures. Ainsi, la comparaison de la stabilité des écosystèmes à des perturbations ne peut se faire que lorsqu’ils sont soumis aux mêmes perturbations.
Perturbations et changement d’état d’un écosystème
Le deuxième paradigme de la stabilité en écologie est celui des états alternatifs. Ce dernier complémente celui de la stabilité locale en proposant que certains systèmes écologiques possèdent plusieurs états stables (appelés états stables alternatifs) et que des perturbations presses (mais aussi pulses) peuvent faire basculer le système d’un état stable à l’autre 34. Ainsi contrairement à ce qui est illustré en Figure 2B1, où l’état de l’écosystème change de manière graduelle à mesure que la magnitude de perturbation augmente, la théorie des états alternatifs suggère qu’arrivé à un certain niveau de pression, l’écosystème peut basculer vers un autre état, au fonctionnement drastiquement différent (Figure 2B2). Dans le paysage de stabilité décrit précédemment, cela suggère qu’il y a potentiellement deux vallées (ou plus) séparées par un col. Chacune des vallées correspond à un état possible pour l’écosystème, pouvant être atteint en fonction du point de départ ou de la perturbation exercée sur le système (Figure 2B2 i-iii). Considérons par exemple, la boule rose de la figure 2B2ii comme l’état initial du système. Si une petite perturbation vient pousser la boule à droite ou à gauche, les deux trajectoires de l’écosystème qui en résultent conduisent à deux états alternatifs (boule grise ou boule noire). De la même manière, si un écosystème est dans un des états stables (boule grise ou boule noire), une perturbation pulse d’une grande magnitude peut faire basculer l’écosystème dans l’autre état. C’est dans ce cadre que la résilience dite « écologique » a été définie comme la magnitude d’une perturbation qu’un système écologique peut absorber avant qu’il ne bascule vers un autre état alternatif : plus le pic est haut, plus le système est résilient. Dans ce paysage de stabilité, la résilience écologique correspond donc à la hauteur entre une vallée et le pic séparant les deux vallées, et elle change avec le niveau de pression exercé sur l’écosystème.
A. Les perturbations « presse » correspondent à l’augmentation (illustrée ici) ou à la diminution continue d’une pression. Lorsque les écosystèmes sont soumis à ces pressions, ils peuvent répondre de différentes manières.
B. Lorsque la perturbation change graduellement un écosystème (par exemple l’acidification des écosystèmes aquatiques), une réponse possible est le changement graduel de l’état de l’écosystème (B1). Une autre réponse possible est le changement abrupt de l’écosystème (B2) où, lorsqu’un seuil est atteint (croix rouge), l’état de l’écosystème bascule brusquement vers un autre état, très différent de l’état précédent. Dans les deux cas (B1, B2), la stabilité du système peut être représentée dans un paysage où la balle correspondrait à l’état de l’écosystème et les vallées, aux états stables pouvant être atteints par l’écosystème.
C. Exemple de changement graduel de l’abondance du cabillaud en mer du Nord entre 1960 et 2000 en réponse à une augmentation croissante de la pression de pêche (perturbation presse). u.a. = unité arbitraire. Données issues de l’Agence européenne de l’environnement 1.
Revenons à l’exemple du choc salé chez les levures pour illustrer la résilience écologique. Dans le paysage de stabilité, le choc salé a en fait déplacé l’abondance des populations de levures au-delà du pic séparant les deux vallées, basculant ainsi les populations de levures dans un nouvel état correspondant à l’extinction de la population (Figure 1C3). Enfin, en comparant le paysage de stabilité des populations bleues et rouges on peut remarquer que le paysage de stabilité n’a pas la même forme. Les populations rouges sont moins résilientes, car l’état correspondant à l’extinction de la population est maintenant plus facile à atteindre que l’état où la population de levures est abondante. Ainsi, une perturbation pulse peut faire basculer le système vers un état alternatif au fonctionnement différent.
Il est important de noter que le seuil au-delà duquel l’écosystème bascule varie en fonction de la variable considérée pour caractériser « l’état » de l’écosystème. Par exemple, des études ont montré que le couvert végétal dans les écosystèmes arides diminue rapidement au-delà d'un seuil d’aridité (donné par la formule 1 – précipitations annuelles/évapotranspiration potentielle) de 0,78 alors que les teneurs en carbone et en azote du sol diminuent quant à elles dès qu'un seuil d'aridité de 0,7 est franchi 123. De même, au sein d’une communauté, une perturbation peut diminuer l’abondance des populations sans qu’il n’y ait la moindre extinction d’espèce. Dans ce cas, alors que l’abondance des individus dans la communauté a drastiquement diminué, la diversité spécifique est restée identique.
Enfin, pour beaucoup de systèmes écologiques, une augmentation de la pression entraîne un changement graduel de l’état du système sans discontinuité apparente ni basculement vers un état alternatif au fonctionnement drastiquement différent (Figure 2B1). Par exemple, suite à l’augmentation de la pression de pêche sur le cabillaud en mer du Nord, la biomasse de cabillauds a diminué progressivement depuis les années 70, sans discontinuité apparente. De fait, hors des conditions de laboratoire où l’existence de ces états alternatifs est bien documentée, la démonstration de l’existence d’états alternatifs dans la nature est limitée à quelques exemples bien caractérisés. Nous présentons dans la suite quelques-uns de ces exemples.
Des exemples de basculement entre états stables alternatifs
Les transitions entre états eutrophes et oligotrophes dans les lacs
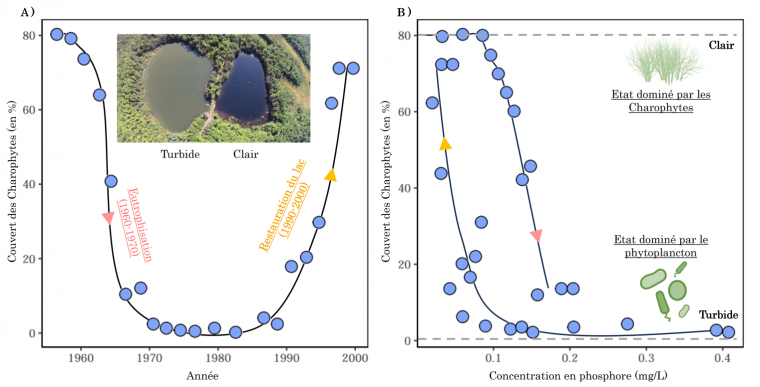
L’exemple classique d’états alternatifs dans les écosystèmes vient de l’étude des lacs peu profonds 4. Ceux-ci hébergent généralement une végétation se développant sur le fond du lac. En cas d’apports trop importants de nutriments (azote, phosphore), à cause par exemple du lessivage des intrants agricoles 5, le phytoplancton peut se développer aux dépens des autres végétaux et l’eau devient trouble. Ce phénomène d’eutrophisation a par exemple été observé au lac Veluwe aux Pays-Bas dans les années 60. Ce lac, qui était jusqu’alors dominé par des Charophytes, des algues vertes vivant principalement en eaux douces, a connu une importante prolifération du phytoplancton en seulement quelques années (Figure 3A). Cette bascule d’un état à l’autre a fait suite à l’utilisation croissante des intrants agricoles qui ont augmenté la concentration en phosphore dans le lac et stimulé la croissance du phytoplancton (Figure 3B) 6.
Dans les années 60, le lac Veluwe est passé d’un état oligotrophe, pauvre en nutriments, à eutrophe, riche en nutriments, suite à une augmentation des apports de phosphore (flèche rose). Cet apport de nutriments a stimulé la croissance du phytoplancton qui, en rendant l’eau turbide, a freiné la croissance des Charophytes. Dans les années 90, des efforts de restauration (réduction du nombre de poissons et de l’apport en phosphore ; flèche orange) a permis de restaurer le lac vers un état oligotrophe avec une eau claire, un contrôle du phytoplancton et une forte abondance des Charophytes. Le fait que la concentration en phosphore au-dessus de laquelle le lac s'est eutrophisé et que la concentration en dessous de laquelle il a été restauré ne soient pas les mêmes suggère l’existence d’une hystérèse (voir partie 3). Données issues de 12.
L’effet Allee et vulnérabilité des petites populations
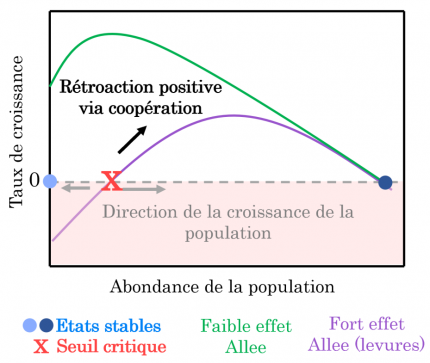
Dans certaines populations, des changements abrupts peuvent résulter des interactions de coopération entre individus pour se protéger des prédateurs, se reproduire ou se nourrir. C’est le cas par exemple au sein des populations de suricates dont la surveillance des prédateurs est réalisée par plusieurs individus. À l’échelle de la population, cette coopération réduit le risque de prédation et augmente le taux de croissance de la population lorsqu’il y a beaucoup d’individus pour surveiller les prédateurs par rapport à une situation où l’abondance de la population est faible et où la surveillance est donc insuffisante. Ce phénomène, appelé « effet Allee », fait que certaines populations ayant une faible abondance ne peuvent pas maintenir un niveau de coopération suffisant pour assurer la croissance de la population : leur taux de croissance devient négatif (Figure 4A) 1. Un taux de croissance négatif signifie que sans effort de conservation limitant la mortalité des individus, la population va rapidement s’éteindre.
L’effet Allee décrit une rétroaction positive entre les individus constituant la population via leur coopération dans le cadre d’accès aux ressources, de défense contre les prédateurs ou d’accès à la reproduction. Lorsque cet effet Allee est fort, les populations en faible abondance ont un taux de croissance négatif, car il y a trop peu d’individus pour une coopération efficace ce qui conduit à l’extinction de la population. Il y a donc une abondance seuil qui sépare la zone où le taux de croissance est négatif, de celle où le taux de croissance est positif (état instable). Au-dessus de ce seuil, le taux de croissance augmente jusqu’à ce que la compétition intraspécifique devienne dominante et conduise à une baisse du taux de croissance. La population finit alors par atteindre un état d’équilibre illustré par le point bleu foncé.
Ainsi, un fort effet Allee peut conduire à l’extinction rapide d’une population : si une perturbation diminue l’abondance de la population (par exemple en augmentant la mortalité de la population) au-dessous du seuil pour lequel le taux de croissance devient négatif, alors la population bascule vers un état stable correspondant à l’extinction (point bleu clair dans la Figure 4).
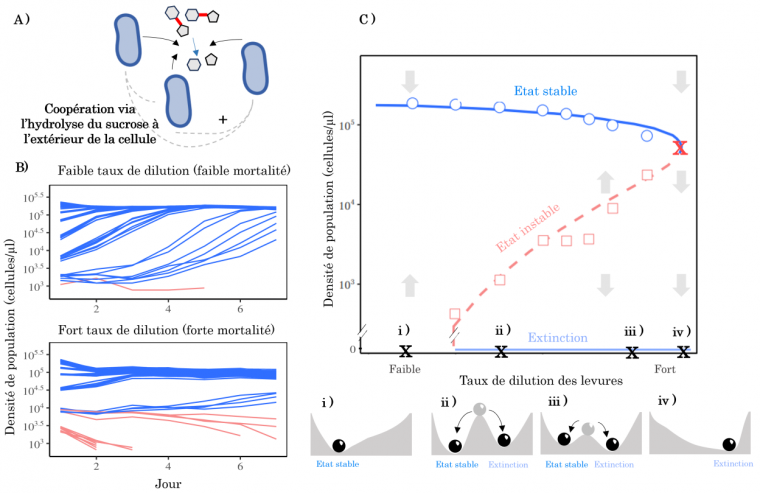
Illustrons ce concept avec un exemple expérimental. Chez les levures, la source de carbone vient principalement de sucres simples (glucose et fructose). Lorsque les levures se développent dans un milieu contenant du saccharose, elles l’hydrolysent à l’extérieur de la cellule via la sécrétion d’une invertase et importent le fructose et le glucose dans leur cellule 1. Parce que l’hydrolyse se fait en dehors de la cellule, la majorité des monosaccharides issus de l’hydrolyse diffuse dans le milieu et bénéficie à toutes les autres levures. À l’échelle d’une population, cela crée une dynamique de coopération entre cellules : chaque levure sécrète des invertases qui sont indirectement bénéfiques aux autres (à l’image des populations de suricates dont la surveillance par quelques individus bénéficie à toute la population ; Figure 5A). Cette dynamique de coopération permet aux levures d’avoir une croissance supérieure de 40 % quand l’abondance de la population est importante par rapport à lorsqu’elle est faible. Pour étudier l’effet d’un tel mécanisme de coopération sur les dynamiques de populations de levures, des auteurs ont cultivé différentes populations, chacune avec un taux de dilution quotidien différent (Figure 5B) 2. Plus le taux de dilution est élevé, moins les levures bénéficient de la coopération pour l’hydrolyse du saccharose, et donc plus leur taux de mortalité est élevé. La figure 5B présente deux exemples de dynamiques temporelles de populations de levures exposées à un taux de dilution faible ou élevé, pour différentes abondances initiales dans le milieu de culture. À faible taux de dilution, la plupart des populations ont des abondances qui augmentent jusqu’au septième jour de l’expérience (courbes bleues). À fort taux de dilution, plusieurs populations ayant une faible abondance initiale s’éteignent en quelques jours (courbes rouges). Répliquée pour différents taux de dilution, cette expérience montre que l’abondance des populations diminue petit à petit à mesure que le taux de dilution augmente, jusqu’à ce qu’une valeur seuil soit atteinte (croix rouge sur la Figure 5C). Au-delà de ce seuil, l’abondance de la population devient trop faible pour maintenir un niveau de coopération suffisant pour permettre à la population de persister : la population s’effondre brutalement.
A. Les levures présentent un effet Allee, car elles hydrolysent le saccharose (glucose et fructose liés par une liaison osidique en rouge) à l’extérieur de leur cellule ce qui crée une coopération à l’échelle de la population.
B. La conséquence de ce mécanisme de coopération est l’émergence de deux états alternatifs pouvant être obtenus en fonction des conditions initiales. Ainsi, pour les conditions initiales avec une importante abondance de levures dans le milieu, les populations persistent au cours des jours de l’expérience. Lorsque l’abondance des levures dans le milieu est faible, la coopération pour l’hydrolyse du saccharose peut être trop faible et ne permet alors pas à certaines populations de persister : ces populations s'éteignent (courbes roses). La comparaison des deux graphiques montre que lorsque le taux de mortalité des levures augmente, la fraction des populations qui s’éteignent augmente également.
C. Lorsque ces expériences sont répliquées pour des taux de mortalité des levures croissants (ce qui est obtenu expérimentalement en augmentant le taux de dilution du milieu de culture), l’abondance de la population diminue ce qui affecte négativement leur capacité à hydrolyser le saccharose jusqu’à un taux de mortalité seuil soit atteint (croix rouge). Au-delà ce seuil, les levures ne sont plus assez nombreuses pour survivre et la population s’éteint brusquement. En fonction des conditions initiales (boule grise), la population peut donc s’éteindre ou persister (boules noires dans le paysage ii). Plus les populations sont cultivées avec un taux de dilution proche du seuil critique, moins elles reviennent vite à leur équilibre à la suite d’une perturbation pulse (Figure 5B) et peuvent plus facilement basculer vers l’autre état stable (C-ii versus C-iii). Données issues de 1.
L’interprétation des dynamiques temporelles décrites en Figure 5B peut être faite à l’aide du paysage de stabilité décrit précédemment. Pour des taux de mortalité intermédiaires, les auteurs montrent qu’il existe deux états alternatifs possibles (représentés par les boules noires sur la figure 5C ii). en fonction des conditions initiales (boule grise dans le paysage ii) : la population peut soit s’éteindre ou persister (boules noires). Par exemple, pour un taux de mortalité des levures élevé, en fonction des abondances initiales des levures dans le milieu, les populations peuvent persister (courbes bleues dans la Figure 5B) ou bien s’éteindre par manque de coopération pour l’hydrolyse du saccharose (courbes roses). Les résultats décrits correspondent donc à l’effet Allee présenté dans la Figure 4 : il existe un niveau de coopération seuil au-delà duquel les populations de levures ne peuvent plus persister et s’éteignent. Enfin, de manière intéressante, plus les populations de levures sont cultivées dans des conditions proches de ce seuil critique, moins elles sont résilientes à des perturbations pulses (comme un choc salé ; Figure 5C ii – iii).
Dynamiques d’invasions et de changement de composition des communautés
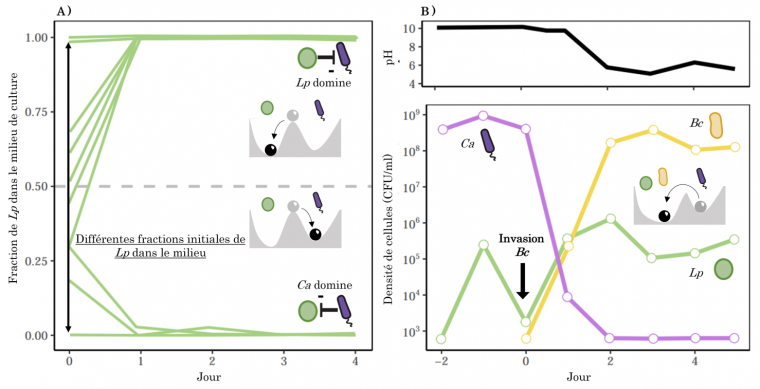
Enfin, de telles transitions peuvent être induites par des invasions biologiques. Corynebacterium ammoniagenes (Ca) et Lactobacillus plantarum (Lp) sont deux bactéries qui s’inhibent mutuellement. Lorsqu’elles sont mises ensemble en culture, on observe deux trajectoires possibles en fonction de leur abondance relative initiale (Figure 6A) 1. Lorsque L. plantarum domine initialement la coculture, elle acidifie le milieu, ce qui empêche le développement de C. ammoniagenes (exclusion compétitive). De la même manière, lorsqu’elle est initialement dominante, cette dernière alcalinise le milieu, ce qui empêche le développement de L. plantarum. Il y a donc deux états stables dans cet exemple (L. plantarum seule et C. ammoniagenes seule), pouvant être représenté par un paysage avec deux vallées.
Expérimentalement, il est possible de modifier l'équilibre d'une culture où C. ammoniagenes domine (et donc où L. plantarum est peu fréquente) en ajoutant une troisième espèce : Bacillus cereus (Bc). En diminuant le pH du milieu, cette dernière favorise la croissance de l’espèce acidophile et freine celle de l’espèce basophile (Figure 6B). Pour reprendre l'analogie du paysage de stabilité, cela signifie que l’invasion de Bacillus cereus a modifié la profondeur des deux vallées de telle sorte que l’état stable où L. plantarum domine est favorisé.
A. Lorsque deux espèces avec des optimums de pH différents sont mises en cocultures, deux états alternatifs peuvent être obtenus en fonction l’espèce qui domine initialement le milieu de culture. Par exemple lorsque Lactobacillus plantarum (Lp) est initialement en faible abondance dans le milieu de culture, Corynebacterium ammoniagenes (Ca) l'exclut du milieu en rendant le pH plus alcalin.
B. Lorsque C. ammoniagenes domine le milieu de culture et qu’une troisième espèce, Bacillus cereus (Bc), est introduite dans le milieu au jour 0, la communauté change d’état en deux jours : C. ammoniagenes est exclue, L. plantarum et B. cereus coexistent. Ce changement d’état de la communauté est dû à une diminution drastique du pH, d’alcalin à acide. Données issues de 1.
En répétant cette expérience avec différentes espèces de bactéries, les auteurs montrent qu’un tel changement d’état de la communauté ne nécessite pas que l’invasion soit réussie : si une bactérie non présente initialement est inoculée au milieu de culture et s’éteint après quelques heures d’expérience, elle peut tout même induire un changement de composition de la communauté bactérienne (de L. plantarum à C. ammoniagenes ou inversement) en modifiant de manière transitoire le pH du milieu de culture. En prenant un peu de recul, cet exemple, bien qu’expérimental, montre que les invasions biologiques peuvent avoir une incidence importante sur les communautés 1.
La littérature sur l’existence d’états alternatifs montre que les exemples des lacs ou des populations de levures ne sont pas isolés (Scheffer 2009). En effet, ces dernières décennies de nombreux travaux sur les récifs coralliens 23, les zones intertidales 4, les systèmes forêts-savanes 5 et les écosystèmes arides 67 suggèrent l’existence de plusieurs états alternatifs dans ces écosystèmes, ainsi que la possibilité de transitions entre ces états stables lorsque les conditions changent (acidification des océans, diminution du régime de pluie ou régime de feu, aridification d’un milieu respectivement). Bien que nous ne présentions ici que des exemples de bistabilité (deux états stables alternatifs), la théorie suggère l’existence de multistabilité dans certains systèmes écologiques (voir par exemple 8 pour une discussion de multistabilité des communautés écologiques). L'observation des mêmes types de réponse à différentes échelles (populations de levures, communautés bactériennes, écosystèmes lacustres) suggère que ces réponses sont dues à des mécanismes similaires.
Les rétroactions positives, mécanismes à double tranchant
L’analyse des mécanismes conduisant à de telles transitions abruptes entre états stables alternatifs suggère l’importance des boucles de rétroactions positives entre les organismes d'une part et entre les organismes et leur environnement d'autre part (DeAngelis 1986). Pour illustrer le concept de rétroactions, reprenons tout d’abord l’exemple de la figure 6B sur les états alternatifs dans les communautés bactériennes. Dans cet exemple, chaque bactérie modifie le pH du milieu et favorise ainsi sa propre croissance. Cela crée ainsi une boucle de rétroaction positive entre chaque population et le pH du milieu : plus une population est abondante, plus elle modifie le pH en sa faveur dans le milieu de culture.
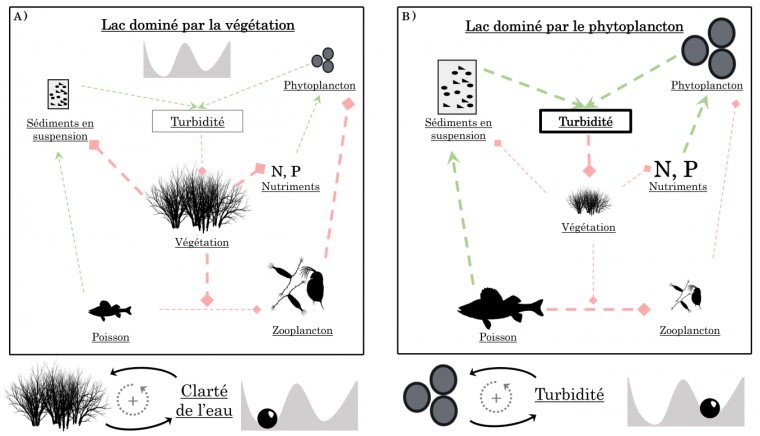
De la même manière, dans l’exemple des lacs peu profonds, la présence de Charophytes réduit la turbidité de l’eau via la stabilisation des sédiments (Figure 7A). En retour, la croissance des Charophytes est favorisée par une eau claire, car la lumière pénètre plus facilement la colonne d’eau et stimule la photosynthèse. De plus, la présence des Charophytes inhibe la possibilité d’un développement du phytoplancton par deux mécanismes. D’une part, ces végétaux offrent un habitat de refuge au zooplancton (comme les daphnies) lui permettant d’échapper à la prédation par les poissons. Ainsi protégé, le zooplancton se nourrit du phytoplancton ce qui limite le développement de ce dernier. D’autre part, comme les Charophytes utilisent les nutriments présents dans les sédiments et la colonne d’eau, ceux-ci ne sont pas disponibles pour le phytoplancton. Mis bout-à-bout, ces différents mécanismes tendent à maintenir un état dominé par la végétation via des boucles de rétroactions positives : plus il y a de végétation, moins il y a de sédiments en suspension et moins il y a de phytoplancton (Figure 7A).
A. Dans un lac dominé par la végétation submergée, le contrôle du phytoplancton se fait par différents mécanismes. La végétation stabilise les sédiments en suspension dans la colonne d’eau ce qui rend l’eau claire et favorise la photosynthèse. La végétation utilise les nutriments et sert de refuge pour le zooplancton prédaté par les poissons benthiques. Mis ensemble, ces mécanismes permettent de réguler le phytoplancton et génèrent une boucle de rétroactions entre la végétation et la clarté de l’eau.
B. À l’inverse, dans les lacs eutrophes, la forte abondance du phytoplancton rend l’eau turbide, ce qui limite la pénétration de la lumière dans l’eau et la croissance de la végétation. Aussi, les poissons peuvent plus facilement consommer le zooplancton non protégé par la végétation submergée, ce qui relâche le contrôle du zooplancton sur le phytoplancton.
Les flèches vertes correspondent à des effets positifs tandis que les lignes rouges à bout plein correspondent à des effets négatifs. Inspiré de 1.
La conséquence de ces rétroactions positives dans les systèmes écologiques est double. Premièrement, une perturbation de faible intensité sera nécessairement amplifiée par ces boucles de rétroactions positives et pourra avoir des conséquences importantes sur l’état de l’écosystème. Par exemple, l’exposition à un choc salin des populations de levures décrite précédemment diminue l’abondance des populations, ce qui affaiblit l’intensité de la coopération entre levures (moins d’interactions positives), augmentant le taux de mortalité des levures et donc l’abondance de la population. Deuxièmement, les boucles de rétroactions fonctionnent pour les deux états alternatifs : lorsqu’un lac passe d’un état oligotrophe à eutrophe, la rétroaction positive entre le phytoplancton et la turbidité du lac stabilise et maintient cet état eutrophe (Figure 7B). Ainsi, diminuer l'apport en phosphore dans le milieu, comme cela a été entrepris pour le lac Veluwe, n’est souvent pas suffisant pour retourner à un état oligotrophe où la présence des macrophytes serait stabilisée par une boucle de rétroaction positive avec la clarté de l’eau (Figure 7A). Autrement dit, la concentration de phosphore nécessaire pour passer d’un état lacustre à l’autre dépend de l’état dans lequel se trouve l’écosystème (un phénomène appelé hystérèse). Pour illustrer cela, prenons le lac Veluwe dans les années 60. Lorsque l’eutrophisation a débuté la concentration de phosphore était de 0,1 mg/L. Dans les années 90, la politique de restauration du lac mise en place a permis de diminuer la concentration de phosphore à 0,1 mg/L, mais sans que le lac ne passe d’un état stable eutrophe à oligotrophe pour autant. Ce n’est que lorsque la concentration de phosphore a été diminuée à 0,05 mg/L que le lac a de nouveau été dominé par des macrophytes (Figure 3B). Ainsi, le fait de retourner à une concentration à 0,1 mg/L en phosphore n’était pas suffisant pour entraîner le retour à l’état oligotrophe, à cause de la rétroaction positive entre le phytoplancton et la turbidité de l’eau. Dans une optique de conservation ou de restauration des écosystèmes, prendre en compte ces rétroactions positives ainsi que ce phénomène d’hystérèse semble donc essentiel. C’est ce que nous illustrons dans la partie suivante.
Du concept à la conservation : comprendre les dynamiques pour restaurer ou conserver les écosystèmes
Lorsqu’un écosystème bascule vers un état alternatif, comment mettre en place un effort de restauration efficace pour le faire retourner à son état d’origine, c’est-à-dire comment passer d’une vallée à l’autre dans le paysage de stabilité 12 ? Dans l’exemple des lacs, plusieurs stratégies de restauration ont été mises en place pour limiter le phénomène d’eutrophisation qui touche beaucoup de lacs en Europe à l’ère de l’agriculture intensive. Parmi les nombreux mécanismes impliqués dans la dominance du phytoplancton, deux leviers ont été testés : la réduction de l’apport en phosphore et le retrait des poissons des lacs 3. Les résultats d’une cinquantaine de lacs au Danemark et aux Pays-Bas suggèrent qu’en 4 à 6 ans, le retrait des poissons du lac a permis de diminuer la concentration en chlorophylle a (un marqueur de la quantité de phytoplancton) ainsi que la quantité de phosphore et d’azote, tout en étant associé à une augmentation de l’abondance des macrophytes. Dans l’exemple du lac Veluwe, la combinaison de la diminution du phosphore et du retrait des poissons du lac a permis la restauration du lac dans les années 90. Néanmoins, ce que montrent les auteur·rices de la méta-analyse, c’est que sans retraits réguliers des poissons des lacs ou bien sans diminution drastique des intrants agricoles, les efforts de restauration ne fonctionnent que sur quelques années, les lacs revenant à un état eutrophe sur des échelles de temps plus longues (> 8-10 ans) via la rétroaction positive entre le phytoplancton et la turbidité.
Des politiques de restauration ont aussi été appliquées aux zones humides (incluant mangroves et herbiers marins) car ces dernières sont dégradées à un rythme élevé (en moyenne 1 % de leur surface est perdue chaque année par eutrophisation, surexploitation, salinisation, et évènements climatiques extrêmes). Dans ces écosystèmes, la végétation est impliquée dans la même boucle de rétroaction que celle décrite au sein des lacs peu profonds et impliquant les particules en suspension, les sédiments et la turbidité de l’eau 4. C’est pourquoi les travaux théoriques suggèrent l’existence de deux états alternatifs : avec ou sans végétation. La restauration à large échelle de ces écosystèmes est particulièrement complexe sur le temps long, car ce sont des écosystèmes ouverts, soumis à un pâturage marin important, à une exposition directe aux pressions humaines et à de possibles tempêtes 5. Pour optimiser les efforts de restauration, une stratégie récemment proposée consiste à planter la végétation en îlots contenant de nombreux individus au lieu de planter la végétation de manière dispersée 67. En effet, lorsque les plantes sont agrégées en îlots, elles stabilisent les sédiments et modifient les courants d’eau, ce qui crée un environnement plus favorable pour la croissance des individus. Une rétroaction positive s’établit au sein des îlots de végétation : plus il y a de plantes dans l’îlot, plus les sédiments sont stabilisés, donc il y a plus de croissance des plantes 89. Cette stratégie augmente considérablement l’efficacité des politiques de restauration : les plantes survivent mieux aux différentes perturbations du milieu, présentent une biomasse plus importante et colonisent mieux l’espace que lorsqu’elles sont plantées de manière dispersée. Sachant que ces zones humides (herbiers marins, mangroves, tourbières, marais salants) jouent un rôle important dans le stockage de carbone, le développement de ces méthodes de restauration prenant en compte les rétroactions est essentiel. En effet, ces écosystèmes couvrent une faible fraction de la surface terrestre (entre 1 et 2 %) mais stockent 20 % du carbone organique mondial, car ils ont un taux de séquestration du carbone jusqu’à 5 fois plus important que les forêts terrestres ou les océans (200 g.C.m-2.an-1 pour les mangroves contre 40 g.C.m-2.an-1 pour les forêts tropicales par exemples 10). Dans un contexte d’augmentation globale des émissions de carbone, conserver les puits de carbone (écosystèmes qui absorbent et stockent le carbone) est plus que nécessaire. Cette conservation passe par l’utilisation des connaissances des rétroactions positives d’un système pour améliorer l’efficacité des efforts de restauration.
Conclusion
Les systèmes écologiques sont soumis à diverses perturbations de type presse et pulse, auxquelles ils répondent parfois de manière complexe, inattendue et rapide. Spécifiquement, la présence de rétroactions positives dans ces systèmes tend à amplifier les perturbations et peut les faire brusquement basculer vers un nouvel état caractérisé par une composition en espèces, en interactions ou un fonctionnement drastiquement différents. Tous les écosystèmes ne répondent donc pas de façon linéaire aux perturbations : passé un seuil, certaines transitions sont difficilement réversibles (voir aussi 1 pour une discussion sur ces seuils). De plus, la diversité des perturbations s’exerçant sur les écosystèmes et la spécificité de réponse à un type de perturbation par rapport à un autre mène à une vision de la stabilité comme multidimensionnelle, où plusieurs mesures de la stabilité se complètent afin de mieux comprendre un système écologique (par exemple, la résilience locale, la résilience écologique, la résistance ; parmi tant d’autres, voir 23).
Le couplage de l’écologie théorique, des études de terrain et des expériences en laboratoire permet de proposer et valider des hypothèses liées à la stabilité des systèmes écologiques (voir 4 pour un exemple récent). Bien qu’en laboratoire les fluctuations de l’environnement puissent être contrôlées, en conditions réelles, l’exposition à de multiples pressions et aux fluctuations de l’environnement rend la notion d’équilibre d’un écosystème plus difficile à appréhender 5. C’est pourquoi la caractérisation des dynamiques des systèmes écologiques, comme les tendances de déclin ou de croissance des populations et des communautés 6, ouvre une perspective importante pour mieux comprendre les dynamiques du vivant.
Remerciements. Je remercie Maëlys Boënnec, Mathieu Pélissier et Marine Beneat pour leurs retours précieux qui ont amélioré la clarté de la présentation. Merci aussi à l’éditeur, Pascal Combemorel, pour les nombreuses suggestions pour améliorer l’article.