Les plantes utilisent des réseaux hormonaux complexes pour relayer la perception d’agresseurs et reprogrammer leur métabolisme de la croissance vers des fonctions défensives. Parmi ces régulateurs, l’acide jasmonique définit une voie hormonale conservée pour l’induction d’un arsenal chimique diversifié afin de combattre insectes et infections microbiennes, et adapter le développement végétal à des conditions hostiles. L’élucidation des voies de gestion métabolique des jasmonates met au jour des carrefours inédits de régulation des réponses de défense adaptatives.
Contexte
Les plantes sont des organismes fixés qui ne peuvent fuir un environnement changeant et souvent hostile. Elles doivent au cours de leur cycle de vie, annuel ou pérenne, puiser des nutriments, croître, se développer et se reproduire sous des conditions souvent stressantes, incluant l’absence ou l’excès d’eau, les températures extrêmes, sans compter les attaques fréquentes d’insectes phytophages, de nématodes ou de microorganismes pathogènes tels que virus, bactéries ou champignons. Les plantes sont en interaction permanente avec des environnements biotiques complexes, à la fois dans leur partie aérienne et dans leur partie racinaire, se traduisant par des dialogues moléculaires avec de multiples partenaires, dont l’issue peut être bénéfique ou au contraire menacer la survie du végétal.
Des mécanismes conservés pour l’induction d’une diversité de défenses chimiques
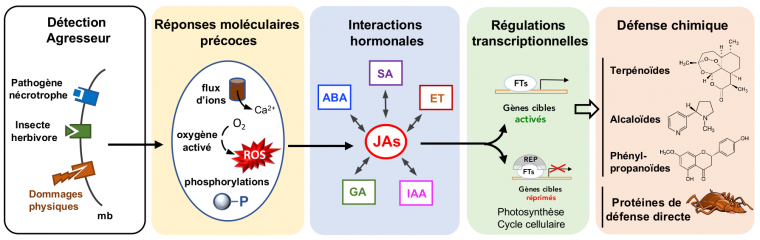
Certaines familles de plantes sont dotées d’organes ou de structures spécialisées ou sont riches en composés chimiques défensifs pré-existant à l’attaque. Cependant, de nombreuses défenses chimiques ne sont déployées qu’après perception de structures ou macromolécules étrangères ou simplement de dommages dans les tissus végétaux (Campos et al., 2014) ; Figure 1), une stratégie qui permet de réduire le coût énergétique des défenses et également de limiter les possibilités d’adaptation des agresseurs. L’agresseur provoque souvent des dommages physiques et secrète des enzymes lytiques (cutinases, pectinases, entre autres) digérant la paroi végétale. Les fragments de parois libérés, ainsi que des protéines effectrices vont être détectées par la plante et « éliciter » une réponse immune dans la zone attaquée. Les réponses rapides incluent des flux ioniques, des phosphorylations de protéines régulatrices, et les premières réponses transcriptionnelles. L’alerte précoce est ensuite relayée par la synthèse d’hormones de défense dont l’acide jasmonique (JA), un dérivé d’acide gras analogue aux prostaglandines médiatrices de l’inflammation produites chez les animaux (Wasternack et Hause, 2013). Par ailleurs, l’acide salicylique (SA), un dérivé aromatique, l’éthylène (ET), un gaz, ou encore l’acide abscissique, un sesquiterpénoïde, sont également des hormones associées à des réponses aux stress chez les plantes. Elles interagissent de façon particulière avec la voie JA dans chaque type d’agression pour contrôler l’activation d’un spectre de défenses efficaces (Pauwels et al., 2009; Pieterse et al., 2009). D’autres hormones, généralement associées au développement et à la croissance, comme l’auxine (IAA) ou les gibbérellines (GA) sont affectées également, par exemple pour ralentir temporairement la croissance au site d’attaque lorsque les ressources doivent être redirigées vers la défense.
Des éléments moléculaires conservés issus de l’agresseur (ici, un microorganisme nécrotrophe ou un insecte herbivore), ainsi que des dommages physiques sont perçus au niveau de la membrane cellulaire végétale et déclenchent des réponses moléculaires précoces. Celles-ci activent la synthèse de jasmonates qui vont reprogrammer le transcriptome de la zone attaquée vers des réponses de défense. Des changements dans d’autres voies hormonales ont lieu et modulent l’action des jasmonates. Les fonctions liées à la croissance comme la photosynthèse et le cycle cellulaire sont réprimés. De nombreux gènes de voies métaboliques sont induits et conduisent à l’accumulation de composés défensifs variés. Des protéines de défense directe sont également produites et contribuent à combattre l’agresseur. Mb : membrane ; ROS : formes activées de l’oxygène ; ABA : acide abscissique ; ET : éthylène ; GA : gibbérellines ; IAA : auxine ; SA : acide salicylique ; JAs : jasmonates; FT : facteur de transcription ; REP : répresseur.
Les jasmonates (JAs) constituent une classe de composés hormonaux, nommée d’après le membre fondateur, l’acide jasmonique (Figure 2), et comprenant de nombreux dérivés. Parmi ces derniers, le conjugué jasmonoyl-isoleucine (JA-Ile, voir ci-dessous) agit comme un régulateur central chez toutes les espèces végétales examinées. Son accumulation après une attaque va profondément modifier l’expression de centaines de gènes. Les gènes majeurs liés au cycle cellulaire, à la croissance ou à la photosynthèse seront largement réprimés. Au contraire, les gènes codant des protéines réduisant la digestibilité du tissu attaqué par des insectes, ou d’autres dotées de propriétés antimicrobiennes seront fortement stimulés (Campos et al., 2014). De plus, sous le contrôle de JA-Ile, les gènes de nombreuses voies métaboliques sont activés et conduisent à l’accumulation de métabolites spécialisés (également appelés métabolites secondaires), en général caractéristiques de chaque famille botanique (Wasternack et Strnad, 2017). Les trois classes majeures de composés spécialisés formés sous l’action de cascades de facteurs de transcription (FTs) particuliers (De Geyter et al., 2012) sont les terpénoïdes, les alcaloïdes et les phénylpropanoïdes (Figure 1). Des centaines voire des milliers de structures sont répertoriées, et plus encore restent à découvrir. Ainsi, chez différents groupes taxonomiques, le signal conservé JA-Ile induit la formation de métabolites variés, sélectionnés au cours de l’évolution par l’interaction de ces plantes avec leurs agresseurs et leur environnement. Ces voies métaboliques présentent souvent un intérêt biotechnologique, pour des applications pharmaceutiques, cosmétiques, agronomiques ou même alimentaires.
Nécrotrophes, biotrophes et saprophytes
En phytopathologie, le terme nécrotrophe qualifie les organismes tuant les tissus végétaux tout en se nourrissant au front de l’infection. Les pathogènes nécrotrophes se distinguent des biotrophes qui eux colonisent l’hôte en maintenant ses tissus en vie. Enfin, le terme de saprophyte désigne une dernière catégorie d’organismes qui se nourrissent de matière organique en décomposition (litières, arbres morts par exemple).
La voie de signalisation hormonale des jasmonates
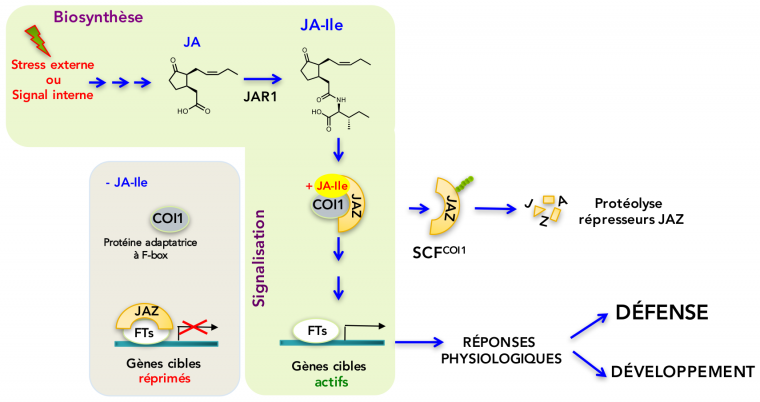
L’activation des réponses par JA-Ile a lieu selon un mécanisme moléculaire découvert en 2007 (Thines et al., 2007; Chini et al., 2007), dont l’architecture conservée est spécifique aux plantes, D’autres hormones végétales sont perçues selon un mécanisme similaire, mais les acteurs moléculaires sont différents (Santner et Estelle, 2009). En absence de JA-Ile, les gènes cibles sont maintenus silencieux par une classe de répresseurs protéiques appelés JAZ, qui bloquent divers facteurs de transcription (FTs) contrôlant des réponses variées dans différents organes (Figure 2). Lorsque JA-Ile est formé, suite à un stress ou à un signal interne, cette hormone va agir comme un ligand pour assembler un co-récepteur dont les éléments essentiels sont une protéine adaptatrice de la classe des F-box, appelée COI1, et le(s) répresseur(s) JAZ qui quitteront leurs partenaires FTs (Figure 2). Les JAZ seront alors ubiquitylés par la E3 ubiquitine ligase SCFCOI1, conférant une étiquette moléculaire qui va dicter leur dégradation par le protéasome, un complexe de destruction ciblée de protéines régulatrices. Les FTs seront libérés de la répression, et vont transcrire les gènes cibles en ARNm, conduisant à une réponse physiologique adaptée, par exemple une accumulation de composés défensifs et un état de résistance élevée aux pathogènes.
L’acide jasmonique (JA) est formé dans certaines situations de développement, mais surtout en réponse à des agressions externes. Il est activé par conjugaison en jasmonoyl-isoleucine (JA-Ile) par l’enzyme JAR1. En absence de JA-Ile, les gènes cibles sont réprimés, car l’action de divers facteurs de transcription (FTs) est bloquée par différents membres de la famille des répresseurs JAZ. Lorsque les niveaux de JA-Ile augmentent, celui-ci agit comme une colle moléculaire pour assembler un co-récepteur dont les éléments centraux sont la protéine adaptatrice COI1 et le(s) répresseur(s) JAZ. Ces derniers seront ubiquitylés (chaînon vert) par la E3 ubiquitine ligase SCFCOI1, conduisant à leur dégradation protéolytique. L’élimination des répresseurs JAZ permet la transcription des gènes cibles responsables des réponses physiologiques de défense ou de développement.
Régulation métabolique de la signalisation des jasmonates
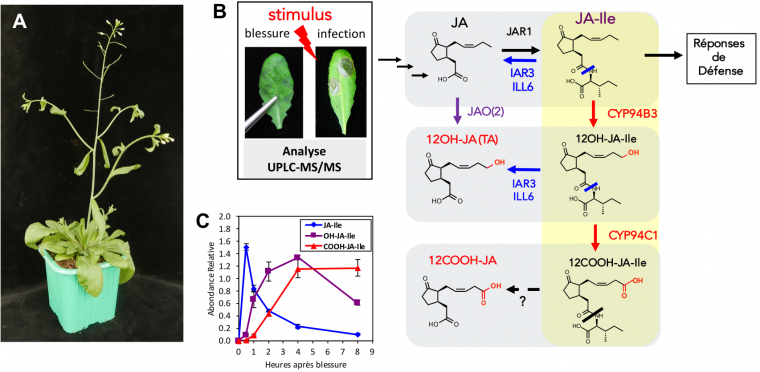
L’étude de l’hormone JA-Ile montre que celle-ci est elle-même sujette à une gestion complexe. Connaître ses mécanismes de formation, de signalisation et d’élimination est donc nécessaire pour comprendre et exploiter le potentiel défensif naturel des plantes. Nous utilisons la plante modèle de laboratoire Arabidopsis thaliana ou arabette des dames (Figure 3A) chez laquelle les recherches sont les plus avancées, mais la connaissance des fonctions des JAs progresse également chez des espèces d’intérêt agronomique comme la tomate, le riz ou le maïs (Borrego et Kolomiets, 2016; Dhakarey et al., 2016). Notre objectif est de décortiquer les modifications enzymatiques subies par les diverses formes pré- et post-hormonales des JAs et leur impact sur la dynamique et l’amplitude de la signalisation. Notre recherche est basée sur la génétique et la biochimie inverses, après identification de gènes candidats à l’aide d’outils bioinformatiques de co-régulation, suivie par leur caractérisation fonctionnelle in vitro et in planta. Celle-ci fait appel à l’analyse physiologique et moléculaire de plantes chez lesquelles le(s) gène(s) d’intérêt ont été inactivés par mutation, ainsi qu’à la production/purification des protéines codées dans un organisme hétérologue (chez des bactéries ou des levures) avant leur étude enzymatique. Des analyses quantitatives détaillées du contenu en JAs dans des extraits de telles plantes stimulées, ou dans des réactions enzymatiques in vitro sont ensuite nécessaires. La méthode analytique de choix est la chromatographie liquide couplée à la spectrométrie de masse (UPLC-MS/MS, ultra-perfomance liquid chromatography – tandem mass spectrometry) qui, après obtention des molécules de référence par synthèse chimique fournit des informations précieuses (Figure 3B et 3C).
Plus d’hormone ne suffit pas pour avoir plus de défense
Une observation initiale avait été qu’après une blessure mécanique des feuilles, mimant une attaque herbivore, les niveaux de tous les JAs examinés augmentent (Figure 3C). En particulier la concentration en JA-Ile présente rapidement un pic transitoire caractéristique, suggérant l’existence de voie(s) efficace(s) d’élimination du conjugué hormonal. Nous avons établi ces dernières années la nature de deux mécanismes d’élimination qui se mettent en place parallèlement à l’induction des défenses, et qui agissent soit par oxydation, soit par clivage de l’hormone JA-Ile.
A. Plant d’Arabidopsis thaliana, une espèce de la famille des Brassicacées (Crucifères), utilisée comme modèle de laboratoire.
B. Après un stimulus, par exemple une blessure mécanique ou une infection microbienne, la biosynthèse, la signalisation et le métabolisme des jasmonates sont activés. L’élimination du conjugué hormonal JA-Ile (formé par l’enzyme JAR1) est contrôlée par deux voies cataboliques : l’une consiste en l’oxydation médiée par des cytochromes P450 (CYP94, flèches rouges), qui génèrent des dérivés hydroxylé (12OH-) et carboxylé (-COOH), essentiellement inactifs ; l’autre représentée par les amido-hydrolases IAR3 et ILL6 (flèches bleues), qui déconjuguent JA-Ile, et génèrent aussi indirectement le dérivé 12OH-JA. La voie d’oxydation directe de JA en 12OH-JA par les enzymes JAO est représentée (flèche violette). TA : acide tubéronique.
C. Abondances relatives de JA-Ile et de ses deux catabolites, analysées par UPLC-MS/MS après blessure foliaire.
Le mécanisme oxydatif est catalysé par plusieurs membres de la super famille des cytochromes P450 (désignées par l’acronyme CYP), une classe importante de monooxygénases membranaires qui contribue massivement à la diversité du métabolisme spécialisé chez les végétaux, et également à la formation et l’inactivation de plusieurs hormones (Mizutani et Ohta, 2010). Des oxydases de la famille CYP94 oxydent successivement JA-Ile en 12OH-JA-Ile et en 12COOH-JA-Ile (Figure 3B), ce qui compromet partiellement (12OH-JA-Ile) ou totalement (12COOH-JA-Ile) leur capacité à assembler le co-récepteur, éliminant ainsi l’activité hormonale (Aubert et al., 2015). L’accumulation de ces dérivés oxydés reflète la décroissance de JA-Ile (Figure 3C), et permet d’en maîtriser les niveaux.
Au cours de cette recherche, une autre famille d’enzymes co-régulées a été caractérisée, sous la forme de deux amido-hydrolases (AH) appelées IAR3 et ILL6, dont le rôle est de déconjuguer JA-Ile vers JA, ce dernier étant inopérant pour la signalisation. De plus, IAR3/ILL6 clivent également 12OH-JA-Ile, pour générer le 12OH-JA (Figure 3B), connu de longue date sous le nom d’acide tubéronique, car induisant la tubérisation des racines de pomme de terre. Ce mode de formation de 12OH-JA via des intermédiaires conjugués était inattendu, et a constitué la première voie de synthèse décrite pour ce dérivé (Widemann et al., 2013). La découverte de l’activité de ces deux familles enzymatiques a redéfini une vision plus complexe de la grille métabolique des JAs, et explique comment le catabolisme de JA-Ile est à l’origine de plusieurs composés non conjugués, souvent plus abondants que l’hormone elle-même.
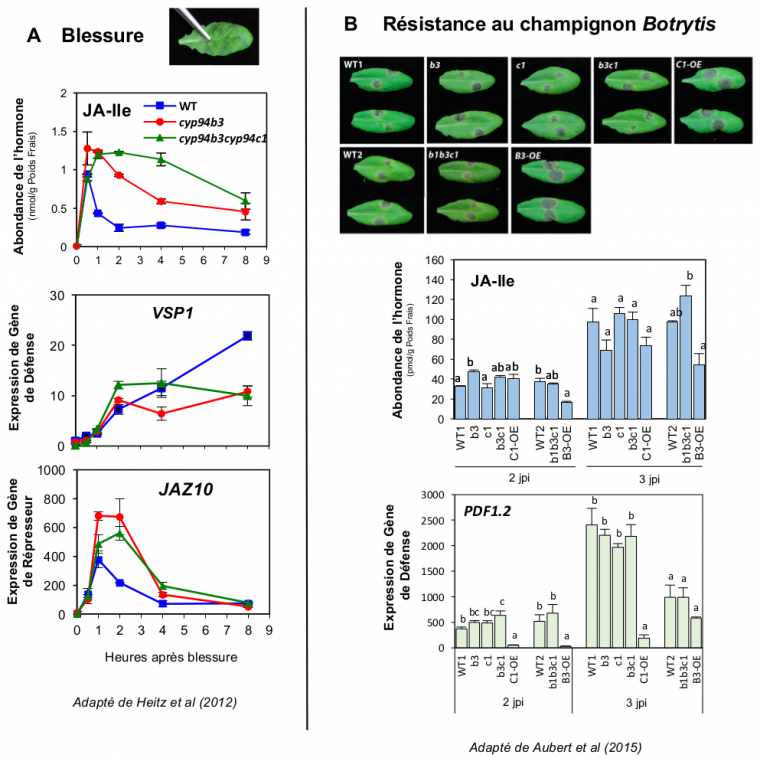
Il est possible en laboratoire d’inactiver les gènes codant ces enzymes ou au contraire de rendre leur activité permanente, puis d’étudier les conséquences sur les réponses JA-dépendantes. La surexpression ectopique des CYP94 ou des AH accentue le catabolisme de JA-Ile, affaiblit l’induction des défenses, et en conséquence la résistance contre des attaques d’insectes (Koo et al., 2011; Zhang et al., 2016) ou de champignon phytopathogène (Aubert et al., 2015), confirmant la fonction d’atténuation des réponses à JA-Ile des enzymes cataboliques.
À l’inverse, chez des mutants cyp94 ou ah, incapables d’éliminer l’hormone, JA-Ile atteint des niveaux anormalement élevés et persiste plus longtemps après blessure (Figure 4A), au détriment de ses catabolites. Une telle stabilité hormonale prolongée laissait présager des capacités défensives augmentées, mais en fait, il n’en est rien. En effet, ces lignées mutantes de plantes hyperaccumulant JA-Ile montrent curieusement des niveaux de défense et de résistance similaires (Figure 4B), voire inférieurs à ceux des plantes sauvages (Aubert et al., 2015; Heitz et al., 2012; Poudel et al., 2016). Ceci démontre le contrôle strict et sophistiqué de la signalisation JA-Ile, qui assure que même en présence de niveaux artificiellement élevés d’hormone, des régulations pour l’heure inconnues empêchent l’induction excessive des réponses. La sur-stimulation des gènes de répresseurs JAZ dans ces plantes (Figure 4A) ou un mécanisme de désensibilisation du co-récepteur pourraient contribuer à limiter l’amplitude des défenses. Il est donc important de poursuivre les recherches pour élucider d’autres niveaux de contrôle de l’action des JAs.
A. Lorsqu’une feuille est blessée, l’hormone JA-Ile (graphique supérieur) est accumulée de façon plus persistante que chez le sauvage (WT) lorsque un (cyp94b3) ou deux (cyp94b3cyp94c1) gènes codant des enzymes d’oxydation sont inactivés. Cependant, le gène de défense anti-insecte VSP1 (graphique central) n’est pas plus exprimé que chez WT, éventuellement du fait de la surinduction précoce de gènes de répresseurs JAZ, par exemple JAZ10 (graphique inférieur).
B. De nombreuses lignées de plantes testées et modifiées pour l’expression de gènes cataboliques CYP94 (soit inactivés pour les gènes CYP94, notés sur les photos b1, b3 et c1, soit surexprimant CYP94B3 ou CYP94C1, B3-OE ou C1-OE) ont été générées et analysées. Le surexpresseur C1-OE (mais peu B3-OE) montre une réduction des niveaux de JA-Ile (graphique central), ces deux lignées ont une expression affaiblie du gène de défense PDF1.2 (graphique inférieur) et sont bien plus sensibles à l’infection par le champignon Botrytis cinerea. Jpi : jours post-inoculation.
Détourner le flux pour réprimer les réponses : un nouveau mode de contrôle métabolique de la signalisation des JAs
Si l’on bloque génétiquement la route indirecte de formation de 12OH-JA décrite ci-dessus, il subsiste une partie de ce composé, suggérant l’existence d’une autre voie biosynthétique, une possibilité étant l’oxydation directe de JA en 12OH-JA (Figure 3B). Pour identifier une telle activité, nous avons exploré une autre classe d’oxygénases, solubles, dite « oxoglutarate-dépendante » (2ODD), déjà connue pour son implication dans le métabolisme d’autres hormones chez les plantes (Kawai et al., 2014), et dans laquelle nous avons identifié 3 membres co-régulés avec de nombreux gènes de la voie JA. Leur caractérisation nous a conduit à découvrir un nouveau mécanisme de répression des défenses qui fonctionne par détournement de flux métabolique en amont de l’hormone JA-Ile (Smirnova et al., 2017).
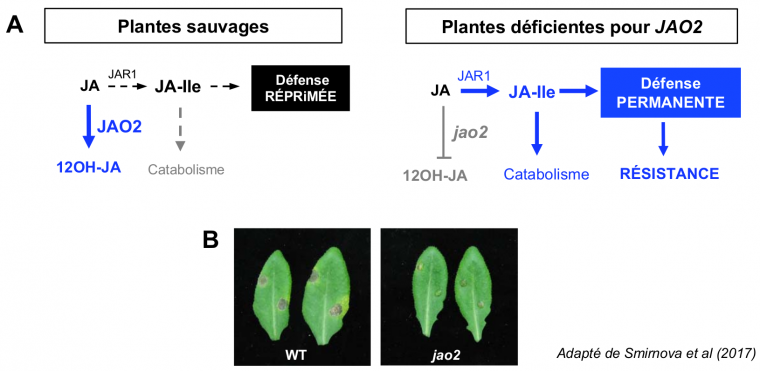
L’analyse in vitro de l’activité enzymatique de ces 3 protéines a en effet montré qu’elles oxydaient spécifiquement JA en 12OH-JA, et ont donc été appelées JAO, pour Jasmonic Acid Oxidases. Pour explorer leur impact physiologique sur les réponses aux JAs, des mutants inactivés dans chacun des gènes JAO ont été analysés. De façon surprenante, les plantes déficientes en JAO2, mais pas celles inactivées pour JAO3 ou JAO4, ont montré une forte augmentation de la résistance au champignon nécrotrophe Botrytis cinerea, qui dépend largement de la signalisation JA-Ile (Figure 4B). Des chercheurs hollandais ont également rapporté une résistance accrue à des larves d’insectes (Caarls et al., 2017) chez un mutant jao multiple. Nous avons ensuite détecté chez ces plantes mutées jao2 une expression élevée des défenses dans les feuilles en absence de toute stimulation, alors que celles-ci ne sont induites qu’après une attaque chez des plantes sauvages, lorsque JA-Ile est accumulé.
Cette dérégulation provient-elle de l’absence de formation de 12OH-JA chez jao2, ou est-elle une conséquence de l’excès de JA non oxydé par JAO2 ? Lorsque nous avons introduit chez le mutant jao2 des déficiences empêchant la formation (mutation jar1) ou la perception (mutation coi1) de l’hormone JA-Ile, les défenses sont revenues à des niveaux faibles, démontrant clairement que le phénotype de défense permanente chez jao2 dépend de la synthèse et de l’action de JA-Ile. Pourtant, le dosage des différentes formes hormonales n’a pas révélé d’accumulation augmentée de JA-Ile chez jao2 avant stimulation, contrairement à ses catabolites qui deviennent mesurables. La confrontation des résultats génétiques et biochimiques suggère un modèle dans lequel même avant stress, JAO2 oxyde constamment des niveaux faibles de JA, évitant la formation et l’action chroniques de JA-Ile, et contribue donc à maintenir les défenses réprimées lorsqu’elles ne sont pas nécessaires (Figure 4A). Lorsque JAO2 est rendue déficiente, cette diversion métabolique est supprimée ; un flux augmenté dans la voie JA-Ile alimente une signalisation permanente des défenses antimicrobiennes, qui peut être visualisée par une résistance élevée à l’infection fongique (Figure 4B).
Conclusion
Nos travaux mettent en lumière une grille complexe de modifications métaboliques des JAs (Figure 3B), dont l’orchestration permet la gestion fine et dynamique des niveaux du signal hormonal JA-Ile, pour un contrôle optimal de l’induction des défenses chimiques. Après un stimulus, la synthèse de JA-Ile et la dé-répression des gènes cibles se mettent en place, immédiatement accompagnées des voies cataboliques permettant l’élimination de l’hormone. Contrairement aux prévisions, la réduction expérimentale du catabolisme de JA-Ile, et donc la persistance de JA-Ile, n’a pas conduit à une induction augmentée des défenses naturelles des plantes, une perspective demandant d’autres recherches approfondies pour identifier les mécanismes limitants. Plus récemment, la découverte de nouvelles oxydases, agissant en amont de la formation de JA-Ile, a identifié une diversion métabolique inédite conduisant à la formation de 12OH-JA. De façon inattendue, cette voie d’oxydation directe de JA a un impact physiologique marqué sur la signalisation, puisque l’inactivation du gène JAO le plus exprimé (JAO2) entraîne une expression permanente de nombreuses réponses à JA-Ile, et une résistance élevée à plusieurs pathogènes. Il s’agit maintenant d’établir si un tel mécanisme de régulation métabolique de la signalisation défensive est conservé chez des espèces d’intérêt agronomique. Il pourrait ainsi constituer un levier d’action génétique ou chimique pour activer au besoin la signalisation JA-Ile et améliorer la résistance à certains ravageurs.
A. Chez les plantes de type sauvage (WT) disposant de l’activité JAO2, des traces de dérivé oxydé 12OH-JA sont formées en l’absence de stress, ce qui soustrait JA de la formation de l’hormone JA-Ile. La signalisation reste donc éteinte, et les défenses sont réprimées. Chez des plantes déficientes pour JAO2 (jao2), un excès de JA devient disponible pour une synthèse faible mais continuelle de JA-Ile, ce qui active une signalisation de défense permanente.
B. Visualisation de l’activation des défenses par observation des symptômes nécrotiques après inoculation foliaire du champignon Botrytis cinerea. JA : acide jasmonique ; JAO : Jasmonic Acid Oxidase.
Références
- Aubert, Y., Widemann, E., Miesch, L., Pinot, F., et Heitz, T. (2015). CYP94-mediated jasmonoyl-isoleucine hormone oxidation shapes jasmonate profiles et attenuates defence responses to Botrytis cinerea infection. J Exp Bot 66: 3879–3892.
- Borrego, E.J., et Kolomiets, M.V. (2016). Synthesis et Functions of Jasmonates in Maize. Plants (Basel) 5:
- Caarls, L., Elberse, J., Awwanah, M., Ludwig, N.R., de Vries, M., Zeilmaker, T., Van Wees, S.C.M., Schuurink, R.C., et Van den Ackerveken, G. (2017). Arabidopsis JASMONATE-INDUCED OXYGENASES down-regulate plant immunity by hydroxylation et inactivation of the hormone jasmonic acid. Proc Natl Acad Sci U S A 114: 6388–6393.
- Campos, M.L., Kang, J.H., et Howe, G.A. (2014). Jasmonate-triggered plant immunity. J Chem Ecol 40: 657–675.
- Chini, A. et al. (2007). The JAZ family of repressors is the missing link in jasmonate signalling. Nature 448: 666–671.
- De Geyter, N., Gholami, A., Goormachtig, S., et Goossens, A. (2012). Transcriptional machineries in jasmonate-elicited plant secondary metabolism. Trends Plant Sci 17: 349–359.
- Dhakarey, R., Kodackattumannil Peethambaran, P., et Riemann, M. (2016). Functional Analysis of Jasmonates in Rice through Mutant Approaches. Plants (Basel) 5:
- Heitz, T. et al. (2012). Cytochromes P450 CYP94C1 et CYP94B3 catalyze two successive oxidation steps of plant hormone Jasmonoyl-isoleucine for catabolic turnover. J Biol Chem 287: 6296–6306.
- Kawai, Y., Ono, E., et Mizutani, M. (2014). Evolution et diversity of the 2-oxoglutarate-dependent dioxygenase superfamily in plants. Plant J 78: 328–343.
- Koo, A.J., Cooke, T.F., et Howe, G.A. (2011). Cytochrome P450 CYP94B3 mediates catabolism et inactivation of the plant hormone jasmonoyl-L-isoleucine. Proc Natl Acad Sci U S A 108: 9298–9303.
- Mizutani, M., et Ohta, D. (2010). Diversification of P450 genes during land plant evolution. Annu Rev Plant Biol 61: 291–315.
- Pauwels, L., Inze, D., et Goossens, A. (2009). Jasmonate-inducible gene: What does it mean? Trends Plant Sci 14: 87–91.
- Pieterse, C.M., Leon-Reyes, A., Van der Ent, S., et Van Wees, S.C. (2009). Networking by small-molecule hormones in plant immunity. Nat Chem Biol 5: 308–316.
- Poudel, A.N., Zhang, T., Kwasniewski, M., Nakabayashi, R., Saito, K., et Koo, A.J. (2016). Mutations in jasmonoyl-L-isoleucine-12-hydroxylases suppress multiple JA-dependent wound responses in Arabidopsis thaliana. Biochim Biophys Acta 1861: 1396–1408.
- Santner, A., et Estelle, M. (2009). Recent advances et emerging trends in plant hormone signalling. Nature 459: 1071–1078.
- Smirnova, E., Marquis, V., Poirier, L., Aubert, Y., Zumsteg, J., Menard, R., Miesch, L., et Heitz, T. (2017). Jasmonic Acid Oxidase 2 Hydroxylates Jasmonic Acid et Represses Basal Defense et Resistance Responses against Botrytis cinerea Infection. Mol Plant 10: 1159–1173.
- Thines, B., Katsir, L., Melotto, M., Niu, Y., Mandaokar, A., Liu, G., Nomura, K., He, S.Y., Howe, G.A., et Browse, J. (2007). JAZ repressor proteins are targets of the SCF(COI1) complex during jasmonate signalling. Nature 448: 661–665.
- Wasternack, C., et Hause, B. (2013). Jasmonates: biosynthesis, perception, signal transduction et action in plant stress response, growth et development. An update to the 2007 review in Annals of Botany. Ann Bot 111: 1021–1058.
- Wasternack, C., et Strnad, M. (2017). Jasmonates are signals in the biosynthesis of secondary metabolites - Pathways, transcription factors et applied aspects - A brief review. N Biotechnol
- Widemann, E., Miesch, L., Lugan, R., Holder, E., Heinrich, C., Aubert, Y., Miesch, M., Pinot, F., et Heitz, T. (2013). The amidohydrolases IAR3 et ILL6 contribute to jasmonoyl-isoleucine hormone turnover et generate 12-hydroxyjasmonic acid upon wounding in Arabidopsis leaves. J Biol Chem 288: 31701–31714.
- Zhang, T., Poudel, A.N., Jewell, J.B., Kitaoka, N., Staswick, P., Matsuura, H., et Koo, A.J. (2016). Hormone crosstalk in wound stress response: wound-inducible amidohydrolases can simultaneously regulate jasmonate et auxin homeostasis in Arabidopsis thaliana. J Exp Bot 67: 2107–2120.