Définition des maladies neurodégénératives. Présentation de quelques mécanismes cellulaires et moléculaires pouvant en être à l'origine. Explication des difficultés de traitement de ces maladies.
Un enjeu de société majeur
Les maladies neurodégénératives (MND) représentent un enjeu sociétal important. En 2014 plus d’un million de français ont été touchés par ces pathologies et chaque année le nombre de nouveaux cas augmente à cause du vieillissement de la population, l’incidence étant directement liée à l’augmentation de l’âge [1]. La gravité de l’impact sur la qualité de vie des patients et de leurs aidants ainsi que le coût que représente le traitement de ces maladies ont incité le gouvernement français à créer en 2014 le plan maladies neurodégénératives (PMND 2014-2019) [2]. Ce plan se décline en trois grands axes prioritaires :
- améliorer le diagnostic et la prise en charge des malades ;
- assurer la qualité de vie des malades et de leurs aidants ;
- développer et coordonner la recherche.
C’est un défi majeur car les MND sont encore peu connues et il n’existe aucun traitement curatif. Actuellement, la médication traite non pas les causes mais uniquement les symptômes et ce avec de faibles effets sur la maladie et sa progression. Néanmoins, en France et dans le monde, de nombreuses équipes de recherche tentent de mieux connaître les causes de ces maladies et travaillent sur de nouvelles stratégies thérapeutiques.
Le PMND élaboré par le ministère des affaires sociales et de la santé est un acte fort et unique en son genre qui répond à l’urgence de la situation.
Définitions
Les MND sont caractérisées par une neurodégénérescence ; étymologiquement, ce mot est composé du préfixe « neuro- » qui désigne les cellules nerveuses, les neurones, et du radical « dégénérescence » qui renvoie au processus biologique de perte progressive de structures ou de fonctions, dans le cas d’un organe ou d’un tissu. Au sens strict, une maladie neurodégénérative est une condition pathologique affectant les neurones en les condamnant à une mort certaine. En pratique, ce terme recouvre un ensemble hétérogène d’affections de diverses populations de neurones du système nerveux incluant le cerveau et la moelle épinière.
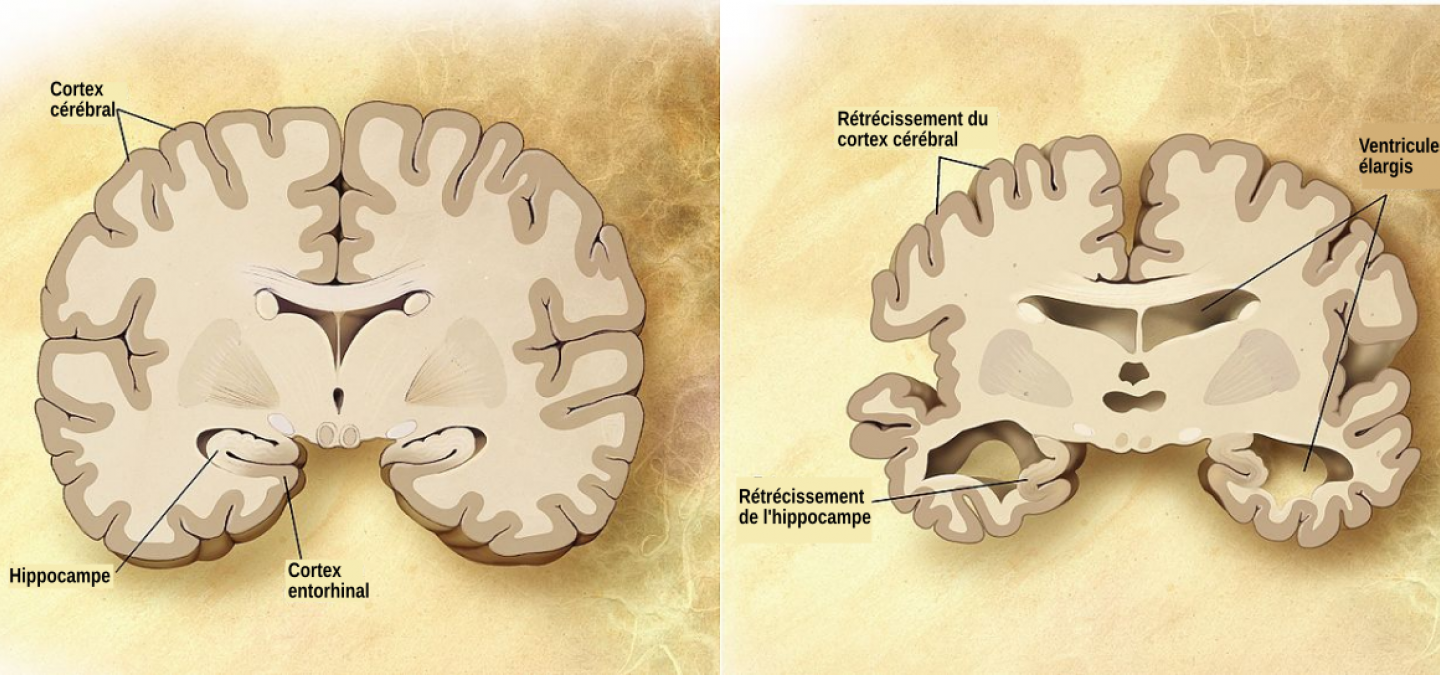
Illustration de la neurodégénérescence dans une maladie neurodégénérative, la maladie d’Alzheimer (cerveau de droite). La perte des neurones conduit à un rétrécissement du cortex cérébral et de l’hippocampe ainsi qu’un élargissement des ventricules latéraux, provoquant les différents symptômes.
Les neurones sont la brique élémentaire du système nerveux. Ils sont responsables du maintien des fonctions vitales de l’organisme comme la respiration, le rythme cardiaque, le rythme veille/sommeil, mais aussi des fonctions supérieures telles que le langage, l’apprentissage, la prise de décision, la motricité, les sens, etc. Chacune de ces fonctions est régie par un ensemble spécifique de neurones. Lorsque, dans une MND, un groupe de neurones est sélectivement détruit, cela provoque des symptômes très divers comme la perte de mémoire, une paralysie musculaire, des troubles mentaux, etc.
Des maladies hétérogènes
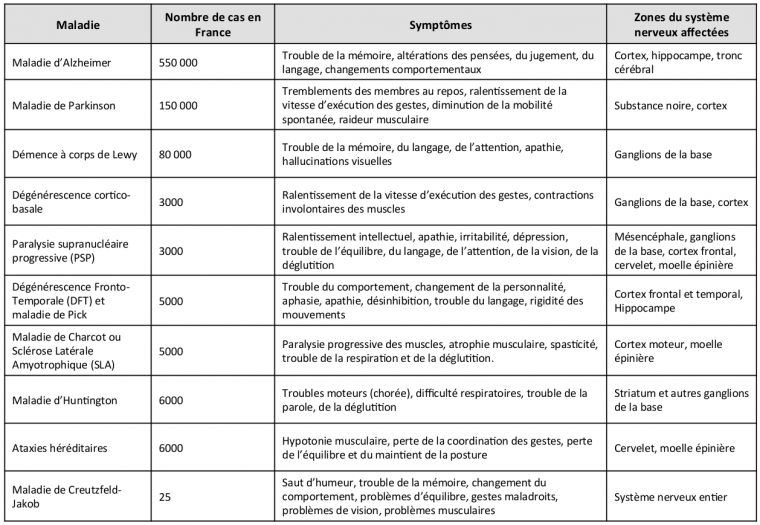
La classification des MND reste très difficile de par leur grande hétérogénéité. Les représentants les plus connus sont la maladie d’Alzheimer, la maladie de Parkinson et la maladie de Charcot ou sclérose latérale amyotrophique (SLA) ainsi que la chorée de Huntington. Ces exemples font partie d’une liste de plus d’une centaine de maladies [3].
Cette liste montre l’hétérogénéité des symptômes et des zones du système nerveux affectées. Dans certains cas, les symptômes et les zones affectées se croisent, permettant de regrouper les maladies en différentes classes comme les démences, les maladies parkinsoniennes, les maladies motrices, etc.
Les MND présentent une grande hétérogénéité aussi bien d’un point de vue symptomatique que physiopathologique. Les variations apparaissant d’une part entre les différentes pathologies et d’autre part entre les patients au sein d’une même pathologie rendent, évidemment, le diagnostic compliqué. De plus, il existe une très mauvaise corrélation entre la clinique et la neuropathologie, c’est-à-dire que les symptômes observés par le clinicien ne correspondent pas toujours aux affections neuronales retrouvées après des analyses biologiques comme lors des EMG, EEG, IRM, analyses de biopsies, ou prélèvements sanguins. La corrélation est également mauvaise entre la clinique et la génétique. En effet une mutation donnée peut engendrer divers symptômes et donner lieu à des progressions différentes. Quoi qu’il en soit, le diagnostic final ne pourra être validé définitivement que lors de l’examen post-mortem des patients [4].
Les multiples causes des MND sont encore largement inconnues [5]. Dans moins de 5 % des cas la maladie est due à une mutation dans un gène, qui peut être transmise à la descendance. Les 95 % restant sont des cas dit sporadiques, les patients n’ont pas d’antécédents génétiques familiaux, l’atteinte provient alors soit d’une mutation spontanée, soit de facteurs environnementaux ou d’autres facteurs encore inconnus Pour une même maladie, des cas génétiques et des cas sporadiques peuvent se présenter. À ce niveau on retrouve donc encore une grande hétérogénéité.
Certains cas sporadiques inexpliqués apparaissent de manière très restreinte géographiquement et temporellement. Ainsi, des facteurs environnementaux ont été mis en cause comme les pesticides, les métaux lourds, certains médicaments, des drogues addictives, ou même des virus [6]. Cependant les études épidémiologiques n’ont à ce jour pas encore pu démontrer clairement le lien entre certaines MND et ces facteurs. Pour certaines maladies comme la maladie d’Alzheimer le facteur âge a clairement été établi. En effet, plus les personnes sont âgées, plus elles ont de chance de développer la maladie. En plus de ces facteurs environnementaux, le stress a été pointé du doigt. Il pourrait créer une vulnérabilité accrue aux MND, mais les mécanismes ne sont pas encore élucidés [5, 7].
Les cas sporadiques seraient en réalité un mélange d’interactions génétiques et environnementales. L’expression de certains gènes ou mutations, favorisée ou défavorisée par l’action de certains facteurs environnementaux prédisposerait à développer telle ou telle MND. Cette susceptibilité génétique peut expliquer pourquoi dans un même environnement toxique certaines personnes développent une maladie et pas d’autres, ou différemment.
Mécanismes de mort des neurones
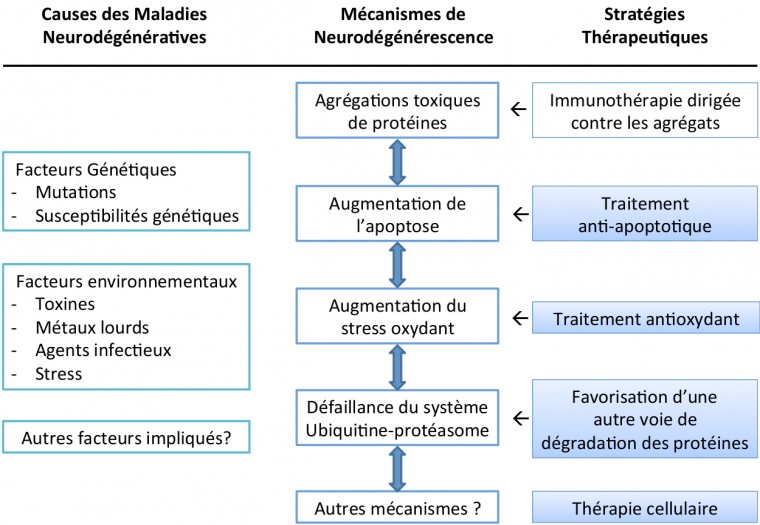
Si les causes de l’émergence des MND sont encore peu connues, les mécanismes de mort cellulaire ont été largement étudiés aussi bien chez l’homme que dans des modèles animaux de ces pathologies. Cependant, beaucoup de mécanismes ayant été proposés restent encore largement débattus au sein de la communauté scientifique. Cela est notamment dû à l’incroyable diversité des types de neurones affectés pouvant différer en termes de morphologie, de localisation, de rôle, ou de composition neurochimique ; mais aussi de la complexité de l’environnement dans lesquels ils se trouvent, le système nerveux.
Agrégation toxique de protéines
Malgré l’hétérogénéité apparente de ces maladies, il existe des mécanismes physiopathologiques communs. Celui qu’on retrouve dans quasiment toutes les MND est l’agrégation toxique de protéines.
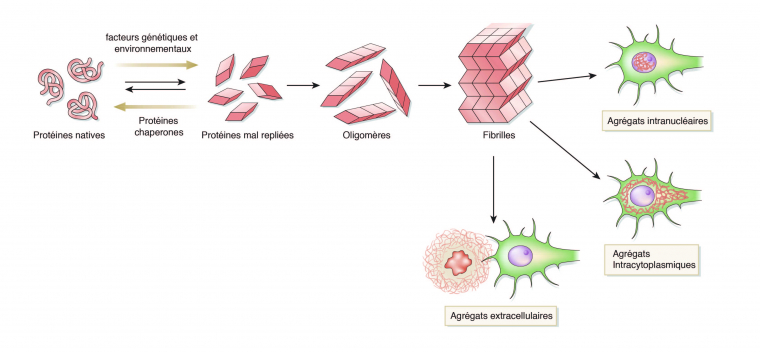
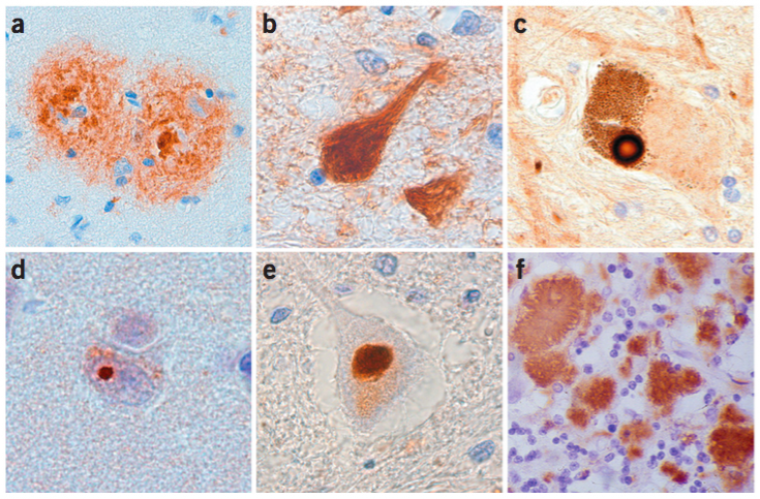
Le génome humain code environ 30 000 protéines qui ont chacune une forme et une ou plusieurs fonctions biologiques leur étant propres. Après leur synthèse, les protéines acquièrent une forme native spécifique en trois dimensions qui leur permet d’exercer leurs actions biologiques. Il arrive que sous certaines contraintes, des protéines présentent une forme anormale à cause d’un mauvais repliement. Dans des conditions physiologiques, ces protéines mal repliées sont soit corrigées par des protéines chaperonnes soit dégradées et éliminées par le système ubiquitine-protéasome ou par le système phagosome-lysosome (autophagie). Des facteurs tels que l’âge, les mutations génétiques, des changements de l’environnement intracellulaire, les variations de pH, le stress oxydant, ou les métaux lourds, peuvent conduire à l’augmentation de concentration de protéines mal repliées. Ces protéines normalement solubles vont alors s’agréger entre elles pour constituer des oligomères qui vont eux-mêmes s’agréger formant ainsi des fibrilles qui sont insolubles. Ces dernières vont alors former des inclusions intranucléaires ou intracytoplasmiques et peuvent également constituer des agrégats extracellulaires qu’on appelle alors plaques séniles [8].
(a) Plaque séniles dans le cortex d’un patient Alzheimer. (b) Agrégats de protéines Tau dans l’hippocampe d’un patient atteint de dégénérescence fronto-temporale. (c) Corps de Lewy dans la substance noire d’un patient parkinsonien. (d) Inclusion intranucléaire de polyglutamine dans le cortex d’un patient atteint de la chorée de Huntington. (e) Inclusion d’ubiquitine dans la moelle épinière d’un patient atteint de la sclérose latérale amyotrophique. (f) Protéine PrP dans le cervelet d’un patient atteint de la maladie de Creutzfeld-Jakob.
Il a été largement démontré que la présence de ces agrégats de protéines mal repliées corrèle avec la progression des MND [9]. Cependant, les mécanismes par lesquels leur toxicité est véhiculée restent encore obscurs [10]. Trois hypothèses peuvent expliquer cette toxicité :
- L’hypothèse de la perte de fonction : la mort neuronale serait causée par la perte de l’activité des protéines mal repliées et agrégées.
- L’hypothèse du gain de fonction : les protéines mal repliées et agrégées gagnent une fonction neurotoxique. Par exemple, leur accumulation extracellulaire pourrait engendrer l’interaction avec des récepteurs et provoquer une mort cellulaire programmée.
- L’hypothèse de l’inflammation : l’agrégation des protéines provoquerait une réaction inflammatoire au sein du système nerveux qui serait, à la longue, délétère pour les neurones.
Cependant ces mécanismes cellulaires n’expliquent ni la sélectivité des neurones touchés, ni la sélectivité des zones du système nerveux endommagées.
Augmentation de l’apoptose
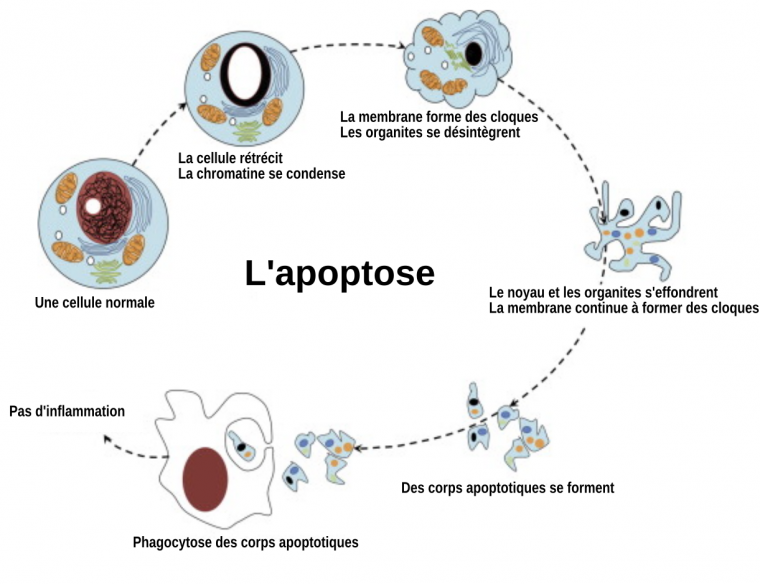
L’apoptose est un type de mort cellulaire programmée. Il s’agit d’un processus biologique déclenché par des signaux spécifiques qui conduisent à l’autodestruction de la cellule. C’est un mécanisme génétiquement programmé et qui intervient dans des conditions physiologiques normales pour limiter la prolifération cellulaire, notamment lors du développement de l’organisme où les cellules sont souvent produites en surnombre [5]. Ainsi, le corps peut spécifiquement détruire des cellules inutiles ou incompétentes à un moment et un endroit précis. C’est notamment un moyen de prévention des cancers.
Il semblerait que dans les MND, les agrégats extracellulaires pourraient servir de signal pour déclencher l’apoptose des neurones. Mais d’autres signaux existent sûrement dans ces maladies et ne sont pas encore connus [11]. L’hypothèse de l’apoptose est renforcée par le fait que ce mécanisme est très sensible aux changements génétiques et aux facteurs environnementaux, qui pour certains corrèlent avec le déclenchement et la progression de MND. De plus, il existe une balance entre des facteurs pro-apoptotiques et des facteurs anti-apoptotiques. Ainsi, le déclenchement de certaines maladies pourrait être le reflet du dérèglement de cette balance apoptotique.
Pour l’instant les résultats des études montrent seulement que la mort des neurones dans les MND se fait par apoptose, sans que l’on sache si une dérégulation de l’apoptose est à l’origine des maladies, ou si l’apoptose n’est qu’une conséquence d’autres facteurs qui la déclenche.
Augmentation du stress oxydant
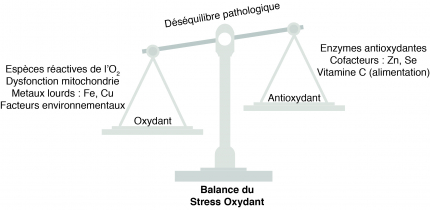
Le dioxygène est nécessaire à la vie de toute cellule de l’organisme. Cependant, les produits du métabolisme du dioxygène, appelés espèces réactives oxygénées (ROS en anglais), sont très toxiques pour la cellule. Ils incluent des radicaux libres comme l’O2•–(ion superoxyde), l'ion peroxynitrite ONOO–, le radical hydroxyle HO• et d’autres espèces moléculaires comme le peroxyde d’hydrogène H2O2. Ces composés ont un potentiel redox très important et peuvent donc très facilement oxyder les molécules avoisinantes comme les protéines, les lipides ou l’ADN, ce qui peut être délétère. C’est tout l’équilibre de la cellule qui est alors perturbé. Cependant il existe normalement un système de protection qui permet d’éliminer ces composés toxiques.
Les neurones sont, par nature, particulièrement sensibles au stress oxydant à cause de leur grande consommation en énergie, d’une exposition supérieure au dioxygène, d’un enrichissement en ions métalliques, de leur composition plus riche en acide gras polyinsaturés sensibles à l’oxydation et enfin de leur faible contenance en molécules antioxydantes. Dans les MND, le système de protection est débordé et n’arrive plus à contrer la production de ROS qui s’accumulent dans les neurones et les conduisent lentement vers leur mort, notamment par le mécanisme d’apoptose. Plusieurs marqueurs du stress oxydant ont notamment été retrouvés dans certaines MND [12].
Cependant, il n’a pas été montré si ce mécanisme peut être classé comme une cause ou une conséquence de la maladie. Le stress oxydant pourrait être une cause de l’agrégation des protéines, puisqu’en modifiant les protéines par oxydation ces dernières ne peuvent pas se replier correctement et auront donc tendance à s’agréger. Ce stress oxydant pourrait lui-même n’être qu’une conséquence de facteurs environnementaux ; les métaux lourds pourraient en effet favoriser la production de ROS [6, 12].
Dysfonctionnement du système ubiquitine-protéasome
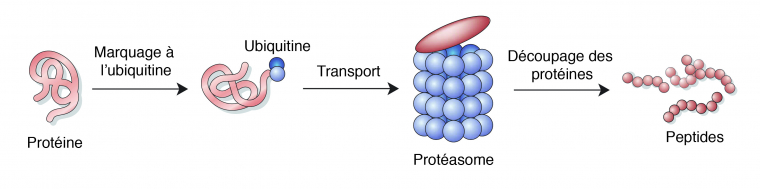
Une des voies de dégradation des protéines dans une cellule est le système ubiquitine-protéasome. Les protéines qui doivent être dégradées sont marquées par une protéine, l’ubiquitine, qui permet de les diriger vers le protéasome. Ce dernier est un complexe enzymatique qui va permettre de couper les protéines en peptides de 7 à 9 acides aminés qui seront ensuite hydrolysés puis recyclés hors du protéasome [13].
L’ubiquitine a été retrouvée sur des protéines présentes dans des agrégats de certaines MND, une preuve du dysfonctionnement du protéasome qui n’arrive plus à dégrader correctement les protéines marquées à l’ubiquitine. Cependant, les altérations du protéasome ne sont pas encore comprises et il n’a pas été démontré si ce système est un facteur clé initiateur ou juste un facteur aggravant [5, 9, 10].
Dans leur ensemble, les quatre mécanismes décrits ici pourraient être interdépendants. L’activation de l’un de ces mécanismes entraînerait alors les autres. Dans cette hypothèse, l’activation de l’apoptose semble être une conséquence finale et définitive conduisant à la mort des neurones. Il existe encore d’autres mécanismes pouvant expliquer la mort des neurones, ils sont soit spécifiques à des MND, soit encore très peu connus et largement débattus.
Traitements
À l’heure actuelle, il n’existe aucun traitement curatif pour soigner les MND [1, 2]. Les traitements donnés aux patients soignent les symptômes ou tentent de ralentir la progression de la maladie mais les causes réelles ne sont pas traitées. De plus, les médicaments actuels ont souvent des effets secondaires indésirables, qu’il faut également prendre en compte.
Quelles sont les raisons de cet échec ?
- Les causes exactes des MND ne sont pas encore connues, il est donc très difficile de développer un traitement efficace qui soigne la maladie le plus en amont possible.
- La nature même des MND ; en effet, elles ont des origines et des mécanismes multifactoriels. La plupart des traitements actuels ne traitent qu’un mécanisme cela ne peut donc soigner la maladie dans son ensemble.
- Les MND s’attaquent au système nerveux, un ensemble complexe et finalement encore peu compris. Le cerveau est quasiment inaccessible et les interventions chirurgicales sont très lourdes. De plus, il est protégé par la barrière hémato-encéphalique, qui empêche souvent le développement de nouveaux médicaments ne passant pas cette dernière.
- Le délai important entre le déclenchement de la maladie au sein du système nerveux et l’apparition des premiers symptômes visibles est souvent préjudiciable pour les patients. Le diagnostic est alors tardif, à ce stade les neurones sont déjà fortement affectés ou sont morts. Cela est dû à l’absence cruelle de bio-marqueurs permettant un diagnostic précoce.
- Il est difficile de sélectionner de bonnes cohortes de patients pour réaliser des études cliniques. Cela est dû à l’hétérogénéité entre les patients, ainsi qu’aux mauvais diagnostics, les maladies étant souvent confondues, mais également au manque de communication entre les différents services gérants les patients et les chercheurs.
- L’établissement de bons modèles animaux pour les MND reste encore difficile. Ces modèles sont actuellement imparfaits puisqu’ils ne réussissent pas à complètement reproduire les pathologies, ou possèdent des effets secondaires non retrouvés dans les MND.
- Les technologies permettant l’étude du système nerveux sont encore récentes et les mécanismes de morts des neurones n’ont été mis en évidence que depuis une dizaine d’année pour les MND.
Malgré les échecs des derniers essais cliniques, il reste encore beaucoup d’espoir. En effet, la science ne cesse de progresser et de nouvelles technologies ont été testées avec succès sur les modèles animaux et vont bientôt être transposées à l’homme. C’est par exemple le cas des immunothérapies, qui ont comme objectif de booster le système immunitaire qui peut alors éliminer les agrégats présents dans le milieu extracellulaire. Un autre exemple est celui des thérapies cellulaires où l’on injecte aux patients de nouveaux neurones générés à partir de cellules de leur peau. La limite de ces avancées technologiques des traitements se présente au niveau de l’éthique, tel qu’il a été possible de l’observer lors de l’utilisation de cellules souches fœtales pour traiter les patients atteints de MND. Ce sont également des questions auxquelles il serait intéressant de réfléchir et de débattre dans les années à venir.
Références
[1] http://invs.santepubliquefrance.fr/Dossiers-thematiques/Maladies-chroniques-et-traumatismes/Maladies-neurodegeneratives/Les-maladies-neurodegeneratives
[2] http://www.gouvernement.fr/action/le-plan-maladies-neuro-degeneratives-2014-2019
[3] Przedborski, S., Vila, M., & Jackson-lewis, V. (2003). Neurodegeneration : What is it and where are we ? J. Clin. Invest. 111:3–10
[4] Mok, W., Chow, T. W., Zheng, L., Mack, W. J., & Miller, C. (2004). Clinicopathological concordance of dementia diagnoses by community versus tertiary care clinicians, Am J. Alzheimer’s Dis Other Demen. 19(3), 161–165.
[5] Nieoullon, A. (2011). Neurodegenerative diseases and neuroprotection : current views and prospects. J Appl Biomed. 9: 173–183.
[6] Brown, R. C., Lockwood, A. H., & Sonawane, B. R. (2005). Neurodegenerative Diseases: An Overview of Environmental Risk Factors, Environ. Health Perspect 1250(9), 1250–1256.
[7] Esch, T., Stefano, GB., Fricchione, GL., & Benson, H. (2002). The role of stress in neurodegenerative diseases and mental disorders. Neuro endocrinol lett. 23(3): 199-208.
[8] Sweeney, P., Park, H., Baumann, M., Dunlop, J., Frydman, J., Kopito, R., … Hodgson, R. (2017). Protein misfolding in neurodegenerative diseases : implications and strategies. Translational Neurodegeneration. 1–13.
[9] Forman, M. S., Trojanowski, J. Q., & Lee, V. M. (2004). Neurodegenerative diseases : a decade of discoveries paves the way for therapeutic breakthroughs, Nature med. 10(10), 1055–1063.
[10] Kumar, V., Sami, N., Kashav, T., Islam, A., Ahmad, F., & Hassan, I. (2016). Protein aggregation and neurodegenerative diseases: from theory to therapy. Eur J. Med Chem.
[11] Mattson, M. P. (2000). Apotosis in Neurodegenerative disorders. Nature Reviews. 1, 120–129.
[12] Andersen, J. K. (2004). Oxidative stress in neurodegeneration : cause or consequence ? Nature Reviews Neurosci, supp. Vol 5, 18–25.
[13] Wang, J., & Maldonado, M. A. (2006). The Ubiquitin-Proteasome System and Its Role in Inflammatory and Autoimmune Diseases, Cell Mol Immunol 3(4), 255–261.