Cet article présente le résultat d'une étude réalisée sur une protéine en relation avec la maladie d'Alzheimer, par le Professeur Beaulieu, et publiée en 2010.
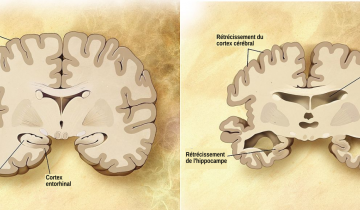
La maladie d’Alzheimer est une maladie neurodégénérative qui touche environ 25 millions de personnes dans le monde, et 860 000 en France en 2007. Elle se caractérise en particulier au niveau moléculaire par l’accumulation extracellulaire du peptide β-amyloïde (formant les plaques séniles ou plaques β-amyloïdes), et des modifications de la protéine Tau.
Cette dernière est une protéine associée à l’un des constituants du cytosquelette, les microtubules (on parle de MAP pour Microtubule-Associated Protein). Elle participe à la formation du faisceau microtubulaire trouvé dans l’axone. L’activité de Tau peut être régulée par phosphorylation, son affinité pour les microtubules étant diminuée lorsqu’elle est phosphorylée.
Dans la maladie d’Alzheimer, on observe une grande quantité d’une forme hyperphosphorylée de la protéine Tau qui va former des neurofilaments. Ces neurofilaments perturbent le fonctionnement des neurones, ce qui entraîne une dégénérescence neurofibrillaire.
L’interaction entre une molécule appelée FKBP52 et la protéine Tau a été étudiée par l’équipe du professeur Beaulieu. Le résultat vient d’être publié dans PNAS. Il démontre une interaction directe entre FKBP52 et Tau, la forme hyperphosphorylée de Tau liant beaucoup plus FKBP52 que la forme non-hyperphosphorylée. Au niveau fonctionnel, la présence de FKBP52 inhibe l’action de polymérisation des microtubules de la protéine Tau. Surtout, la surexpression de FKBP52 empêche l’accumulation de Tau dans les neurones.
Ces résultats ouvrent donc la voie à des recherches visant à activer la FKBP52 par un médicament, ce qui pourrait empêcher la formation des neurofilaments anormaux, et donc empêcher la dégénérescence neurofibrillaire de se produire. Il s’agit donc d’une piste de recherche qui pourrait permettre de lutter à terme contre la maladie d’Alzheimer.
Référence