Après avoir rappelé le cadre éthique de l'utilisation des cellules souches embryonnaires et précisé la différence entre totipotence et pluripotence, cet article présente les nouveaux espoirs, au printemps 2004, que l'utilisation des cellules souches du tissu adipeux et la découverte du gène Nanog permettent d'envisager.
Les cellules souches – embryonnaires, fœtales, adultes
Accidents, maladies dégénératives, tant de tissus de toute nature dégradés ou détruits… Les cellules souches pourraient participer à leur reconstruction.
Les cellules souches ont deux qualités que ne possèdent pas les autres cellules :
- leur capacité à se multiplier indéfiniment en culture in vitro, aussi longtemps qu’elles sont laissées dans un état indifférencié ; et
- leur aptitude à se différencier dès lors que leur sont proposés des facteurs adéquats.
Elles existent chez l’embryon, chez le fœtus et son cordon ombilical, ou chez l’individu né – qu’on qualifie alors… d’adulte.
Ces caractéristiques permettent d’envisager une utilisation thérapeutique des cellules souches humaines pour traiter certaines pathologies actuellement incurables.
Cependant, l’étude et/ou l’utilisation des cellules souches embryonnaires humaines, potentiellement les plus intéressantes, se heurtent à des problèmes éthiques liés au fait que leur obtention passe nécessairement par la destruction de l’embryon dont elles sont issues. Le débat éthique qui en découle dure depuis des années et n’est toujours pas terminé. A ce débat, les législations apportent une réponse qui varie selon les pays, mais aussi selon le moment où elles sont édictées.
En France, le Comité Consultatif National d’Ethique (CCNE), dans son projet de révision des lois bioéthique de janvier 2000, reconnaissait l’embryon comme une personne humaine potentielle dont le respect s’impose à tous […] considérait que le devoir de la société est de promouvoir le progrès thérapeutique et de hâter l’amélioration de la prévention et du traitement de maladies aujourd’hui incurables ou difficilement soignables […] et se prononçait pour une utilisation très encadrée des embryons surnuméraires, issus de la fécondation in vitro, en tant que sources de cellules souches.
Jusqu’au mois de juillet 2004, la législation française a interdit l’utilisation de ces embryons surnuméraires y compris pour la recherche. Seul était autorisé, depuis des décennies, l’établissement de lignées de cellules souches à partir d’embryons ou de fœtus issus d’avortements naturels ou provoqués.
En juillet 2004 dans sa loi sur la bioéthique, le Parlement a autorisé les chercheurs à utiliser les embryons surnuméraires ne faisant plus l’objet d’un projet parental – et cela, dans un cadre très réglementé, pour une période probatoire de cinq ans, et sous la condition que les deux parents aient donné leur accord.
En Europe, de nombreux pays disposent de ce droit depuis des années (Belgique, Danemark, Finlande, Grèce, Hollande, Suède et Grande-Bretagne) ce qui a entraîné chez eux un essor de la recherche dans ce domaine incroyablement évolutif.
Aux États-Unis, la situation est très complexe et diffère selon que les recherches sont menées sous l’égide d’institutions fédérales ou locales, sur des embryons surnuméraires obtenus avant ou après l’élection du président Bush de l’an 2000, ou selon qu’elles sont financées par des fonds publics ou privés…
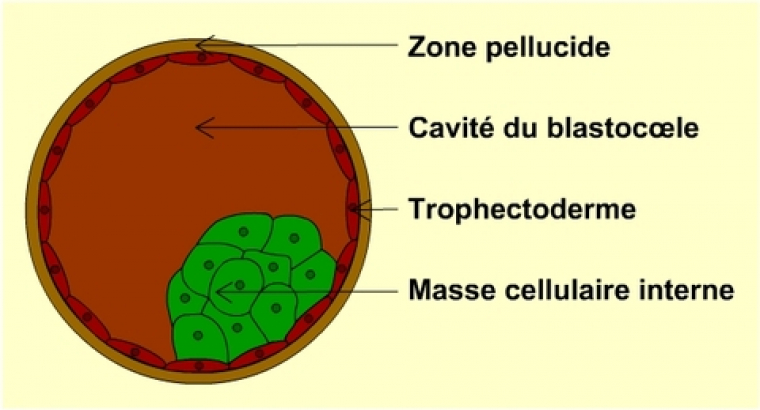
Les cellules souches embryonnaires, localisées dans la masse cellulaire interne du tout jeune embryon (voir schéma ci-dessous), sont exceptionnelles en ce qu’elles participent à l’édification de tous les tissus du futur individu. Cette totipotence les qualifie pour réparer tous les tissus, et les rend aptes à livrer une information, pour l’instant inégalée, sur le développement embryonnaire et son contrôle génétique.
Pour leur part, les cellules souches fœtales ou adultes, localisées en petit nombre dans tous les tissus (dont elles assurent la maintenance), n’ont pas une telle universalité : elles sont seulement multipotentes même si elles se révèlent plus multipotentes qu’on ne le pensait, comme l’étude des cellules souches du tissu adipeux l’a montré.
Les atouts du tissu adipeux adulte
Le tissu adipeux est aisé à prélever par liposuccion, et un individu, même mince, peut en livrer facilement un litre. Il contient des cellules souches, qui ont l’intérêt de se multiplier plus vite que celles obtenues à partir d’autres tissus adultes comme la moelle osseuse ou le cerveau par exemple. Ces cellules souches se différencient in vitro en cellules adipeuses, mais aussi en cellules musculaires, osseuses et même en cellules nerveuses, ce qui n’était pas attendu puisque les cellules nerveuses dérivent de l’épiderme alors que les cellules adipeuses proviennent du mésoderme.
Chacun pourrait donc disposer de ces cellules pour une autogreffe réparatrice, exempte de rejet. Et chacun pourrait les proposer, pour une allogreffe, à qui serait porteur d’un défaut génétique interdisant l’autogreffe. Les études préliminaires menées chez la souris ont ouvert cette voie.
Les avancées d’avril-juin 2004 chez la souris
Les chercheurs travaillant sur les cellules souches adultes du tissu adipeux de souris ont, au cours de ce printemps, engrangé trois beaux succès :
-
La réparation de fracture
On savait conduire, in vitro, la différenciation de cellules souches adipeuses de souris en cellules cartilagineuses et osseuses. Michael Longaker et son équipe, de l’université de Standford en Californie, sont parvenus à le faire in vivo sur des souris : ils ont pratiqué, chirurgicalement, une fracture trop large pour se réparer toute seule sur laquelle ils ont appliqué des cellules souches adipeuses adultes, disposées dans un polymère biodégradable d’apatite (un constituant naturel des os). Les fractures des souris témoins ne faisaient pas l’objet d’un tel traitement.
Douze semaines plus tard, les cellules souches avaient comblé en se différenciant 70 à 90 % de la fracture des souris traitées. Par comparaison, chez les souris témoins il n’était apparu qu’un tissu désorganisé et qui plus est seulement dans moins de 10 % des cas.
Pour l’instant, les essais cliniques pratiqués chez les humains, pour tenter de réparer les fractures graves, n’utilisent que des cellules souches provenant de la moelle osseuse.
-
L’expression de protéines spécifiques du muscle cardiaque
On savait obtenir l’expression de protéines spécifiques du muscle cardiaque (chaîne lourde de la myosine et troponine 1) à partir de cellules souches adipeuses en culture in vitro. John Fraser et l’entreprise de biotechnologie Macropore viennent de montrer qu’il était possible de le faire in vivo : ils ont injecté chez des souris au myocarde altéré, soit une simple solution saline, soit un million de cellules souches adipeuses induites, c’est-à-dire auxquelles avaient été fournis des facteurs de différenciation. Chez les souris du deuxième groupe, et chez elles seules, le myocarde s’est mis à exprimer les deux protéines spécifiques du muscle cardiaque.
-
La différenciation in vitro : vers des cellules nerveuses
Les chercheurs savaient obtenir in vitro des cellules qui ressemblent à des cellules nerveuses à partir de cellules souches adipeuses et d’un cocktail de facteurs de croissance et d’agents inducteurs.
Kristine Safford et Henry Rice, du centre médical de l’université Duke (Caroline du Nord, États-Unis), viennent de montrer, toujours in vitro, que ces cellules fonctionnaient bien comme des cellules nerveuses : elles expriment en effet des protéines spécifiques à ces dernières comme des protéines réceptrices de neurotransmetteurs.
Ainsi, le NMDA, une substance mimétique du neurotransmetteur glutamate, a la particularité de faire mourir les cellules nerveuses lorsqu’il est présent en trop grande quantité en produisant chez elles, une fois lié à leurs récepteurs au glutamate, un effet bien trop excitateur. Or, le NMDA a le même effet mortel sur les cellules souches induites ce qui démontre qu’elles reçoivent son message ; donc qu’elles expriment à leur surface les récepteurs NMDA du glutamate capables de le capter.
L’étape suivante consistera à passer à l’étude in vivo en introduisant dans un modèle animal de telles cellules induites.
Les perspectives
À la lumière de ces premiers résultats, il apparaît que les cellules souches adultes du tissu adipeux, qui ont l’intérêt d’être disponibles en quantité et de ne susciter aucun débat éthique, sont promises à un bel avenir dans la reconstruction des tissus dégradés ou perdus.
Ces résultats montrent aussi que les tissus auxquels on peut espérer aboutir sont de types plus variés que ceux vers lesquels s’orientent naturellement ces cellules, dès lors qu’on saura leur fournir les facteurs de différenciation adéquats.
Mais, il existe des centaines de types de cellules différentes chez l’homme, et il est fort peu probable que les seules cellules souches adipeuses, ou même d’autres types de cellules souches adultes, suffiront pour obtenir tous les types cellulaires. Un tel résultat ne semble accessible que via un élargissement et une diversification des sources disponibles de cellules souches.
C’est ainsi que la Grande-Bretagne vient de créer en mai 2004 une banque de cellules souches accessible aux chercheurs du monde entier, qui accueillera et stockera tous les types de cellules souches qu’on aura su isoler, qu’elles soient : embryonnaires, fœtales ou adultes.
Pour quelles recherches une telle banque de cellules pourra-t-elle être exploitée ? On peut citer quelques pistes :
-
L’identification accélérée, et presque industrielle, de facteurs de différenciation au moyen d’un système, aujourd’hui disponible, de criblage et de détection comparable à celui des biopuces.
-
L’établissement de lignées embryonnaires mutantes à partir de tout jeunes embryons mis à l’écart dans le cadre de la fécondation in vitro lorsqu’ils sont porteurs de mutations délétères. Ces lignées devraient permettre de mieux comprendre et de mieux soigner ces maladies génétiques, et peut-être un jour de les guérir.
-
On a identifié chez la souris le gène-maître Nanog qui, actif dans les cellules souches embryonnaires, déclenche leur multiplication indéfinie tout en interdisant leur différenciation. Des cellules embryonnaires totipotentes, mises au contact du produit de ce gène, pourraient donc bientôt fournir – et de façon très économe car à partir d’un seul embryon – des millions de leurs semblables. Et si l’on parvenait un jour à réactiver ce gène chez des cellules souches adultes, elles seraient ramenées à leur état totipotent, c’est-à-dire à une nature de cellules embryonnaires et le problème éthique soulevé par l’utilisation des embryons humains ne se poserait plus.
Les récents résultats de la recherche dans le domaine des cellules souches permettent d’envisager leur utilisation prochaine dans un but thérapeutique. Les limites de cette révolution médicale ne seront pas seulement dictées par celles de la science mais aussi par des réponses aux questions éthiques qu’elle soulève. Un débat faisant intervenir tous les acteurs de la société est en cours, et la récente mise au point législative sur le sujet n’en marque pas le terme. Nul doute que dans le domaine de l’utilisation des cellules souches, les limites du possible continueront à être définies en fonction du progrès des connaissances, mais aussi de l’évolution de la société.
Bibliographie
Commentaire de Marc Peschanski sur la loi de bioéthique (La Recherche – septembre 2004).
Quelques articles, en anglais et gratuitement accessibles en ligne, présentant les potentialités du tissu adipeux et celles du gène Nanog ; les références des articles originaux y sont mentionnées :
Pour aller plus loin
Depuis les années 2010 on sait reprogrammer (dédifférencier) des cellules adultes pour les rendre pluripotentes. Ces cellules souches pluripotentes induites (iPSC en anglais, induced Pluripotent Stem Cells) peuvent ensuite être redifférenciées in vitro par l’utilisation de facteurs de croissance adaptés. Il est ainsi possible d’obtenir une multitude de types cellulaires différents : cellules cardiaques, endothéliales, immunitaires, dendritiques, sanguines (plaquettes, globules rouges), musculaires (lisses et striées), hépatiques, rétiniennes, nerveuses, épithéliales, pancréatiques…
Voir le dossier INSERM à ce sujet.