Alors que l'on savait depuis quelques années produire des ovocytes à partir de cellules souches XX et des spermatozoïdes à partir de cellules souches XY, une équipe japonaise franchit un nouveau cap en ayant mis au point un protocole permettant d'obtenir des ovocytes à partir de cellules souches issues de souris mâles.
Ce texte a été initialement publié à cette adresse le 28 mars 2023 sur Actualités scientifiques Prépas, le blog d'actualités de Patrick Pla, maître de conférences à l'université Paris Saclay. La version proposée ici a été adaptée pour Planet-Vie.
Les cellules germinales sont des cellules particulières qui permettent la transmission du matériel génétique à travers les générations et la survie de l’espèce. Elles sont différenciées mais conservent une totipotence « latente » qui se révèle lorsqu’un gamète mâle et un gamète femelle se réunissent lors de la fécondation. Chez les Mammifères, les cellules germinales primordiales, dont sont issus les gamètes, sont induites dans des tissus extraembryonnaires de manière équivalente chez les mâles et les femelles. Ce n’est que plus tard que les chromosomes sexuels interviennent pour différencier ces cellules germinales primordiales en ovocytes et spermatozoïdes.
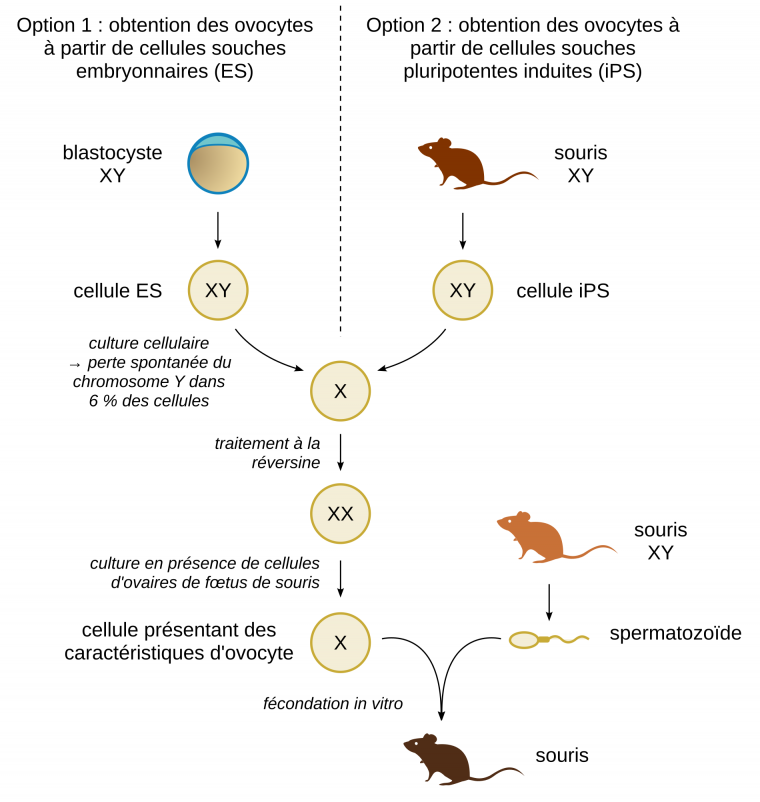
Depuis quelques années, les équipes de recherche qui travaillent avec les cellules souches pluripotentes (cellules souches embryonnaires (ES) ou cellules souches pluripotentes induites (iPS)) savent faire se différencier en ovocytes les cellules issues d’individus XX et en spermatozoïdes les cellules provenant d’individus XY. Les chercheurs japonais qui viennent de publier un article dans Nature, ont réussi l’exploit de produire des ovocytes à partir de cellules souches embryonnaires (et aussi de cellules iPS) qui provenaient de souris mâles 1. Pour ce faire, ils se sont appuyés sur un défaut qui apparait fréquemment dans les cultures de cellules souches pluripotentes : la perte de chromosomes. En effet, à moyen ou long terme, le maintien de ces cellules dans des conditions stimulant leur prolifération peut aboutir à des modifications d’ampleur de leur génome. Dans leurs travaux, les chercheurs ont sélectionné les cellules ayant perdu leur chromosome Y. La perte de ce chromosome est l’une des plus fréquentes (elle concerne 6 % des cellules en culture), car il est assez petit et une cellule avec un seul chromosome sexuel (X en l’occurrence) est tout à fait viable, contrairement à d’autres pertes de chromosomes.
Le nombre de chromosome X a été ensuite doublé par traitement avec la réversine, une molécule qui perturbe les points de contrôle lors du cycle cellulaire. Les cellules souches embryonnaires (désormais XX) ont été ensuite soumises au protocole de différenciation en ovocytes qui implique des cocultures avec des cellules provenant d’ovaires de fœtus de souris. En effet, les signaux échangés entre les cellules folliculaires et les cellules germinales ne sont pas encore bien caractérisés et il est donc impossible d’induire la différenciation par voie chimique uniquement. Des cellules présentant des caractéristiques d’ovocytes tant du point de vue morphologique que cytologique ont pu être obtenues, ce qui n’est jamais le cas avec des cellules souches embryonnaires XY soumises au même protocole. Ces ovocytes ont pu être fécondés avec des spermatozoïdes et après réimplantation dans une mère porteuse, les embryons obtenus ont pu donner des souriceaux normaux.
Télécharger une version éditable au format SVG.
Sources des images : blastocyste : CristofferSevilla, CC BY, Reactome ; souris : Kamil S Jaron, CC0, Phylopic.
Cependant, la procédure nécessite encore des améliorations : seulement 30 % des lignées de cellules souches embryonnaires devenues XX ont donné des ovocytes matures normaux dont seulement 40 % ont réussi à être fécondés. Et seulement 1 % des embryons réimplantés ont donné des souriceaux viables. Il y a donc encore beaucoup de chemin à parcourir pour d’éventuelles applications à l’espèce humaine. En attendant, cette technique facilitera la production de souris à faible niveau d’hétérozygotie (en fécondant un ovocyte issu de cellules iPS d’une souris XY avec les spermatozoïdes de cette même souris) et pourrait également permettre de sauver une espèce en danger à partir d’un seul mâle (au prix d’une baisse drastique de la diversité génétique).