Si l’on vous disait que les virus, eux aussi, mènent une vie sociale ? Les bactériophages coopèrent dans la lutte contre le système immunitaire bactérien, rentrent en compétition lorsqu’il s’agit d’infecter une même bactérie et… communiquent entre eux, se donnant ainsi des informations sur le nombre de bactéries déjà infectées ainsi que sur le nombre de bactéries résistantes aux infections. Ce mode de communication a été découvert en 2017 chez le bactériophage phi3T infectant les bactéries du genre Bacillus.
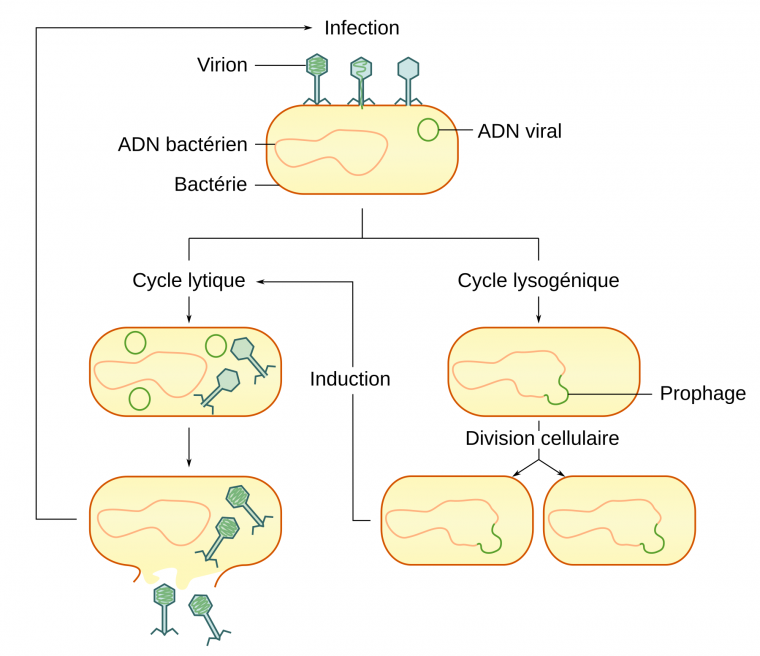
Les bactériophages sont des virus infectant les bactéries. Certains bactériophages présentent uniquement un cycle lytique, c’est-à-dire menant rapidement à la lyse de la bactérie et à la libération de nombreux virions. D’autres sont dits tempérés, c’est-à-dire qu’au moment de l’infection, ils peuvent soit lyser la cellule soit s’insérer dans le génome et rester dormant. Ils restent dans cet état jusqu’à l’induction, où le bactériophage est excisé et la lyse enclenchée (Figure 1).
Les bactériophages tempérés peuvent soit entrer en lyse, tuant l’hôte et libérant un grand nombre de virions, soit en lysogénie. Dans ce cas, leur génome s’insère dans celui de l’hôte et le bactériophage se multiplie donc, sous forme de prophage, au rythme des divisions bactériennes. Les bactériophages dormants peuvent plus tard entrer en lyse ; c’est l’induction.
La valeur sélective (fitness) d’un bactériophage tempéré va dépendre de l’adéquation entre le fait d’entrer en lyse ou en lysogénie et l’état de l’épidémie : par exemple si la densité bactérienne est importante, la lyse sera favorable, car le bactériophage produira de nombreux virions qui auront de grandes chances d’infecter à nouveau des bactéries. Au contraire, si la population bactérienne a été réduite du fait de l’infection, la production de virions est plus risquée et c’est donc la lysogénie qui maximise la valeur sélective, en permettant d’attendre des conditions plus favorables pour se reproduire. Après la pénétration du virus dans la bactérie, son entrée directe en cycle lytique ou son passage en cycle lysogénique conditionne ainsi l’avenir de sa descendance. Bien qu’en grande partie aléatoire 12, cette décision peut être influencée par différents facteurs. Par exemple, chez le bactériophage λ, il a été montré que plus il y a de bactériophages infectant en même temps la même cellule, plus ceux-ci tendront vers la lysogénie 3. En effet, le nombre de bactériophages co-infectant la même bactérie peut être vu comme une approximation du nombre de cellules voisines déjà infectées : s’il y a beaucoup de bactériophages libres, c’est sûrement qu’il ne reste plus beaucoup de bactéries non infectées, la lysogénie est donc préférable.
Des scientifiques ont récemment découvert chez le bactériophage phi3T un mode de communication moléculaire entre bactériophages influençant d'une part l’orientation vers la lyse ou la lysogénie et d'autre part le moment d’induction 4. Ils ont nommé ce système « arbitrium », d’après le terme latin pour décision (que l’on retrouve dans le mot arbitre et ses dérivés).
Le système arbitrium influence à la fois l’entrée en lyse ou en lysogénie et le moment de l’induction
Lors de l’infection, le système arbitrium influe sur l’entrée en lyse ou en lysogénie
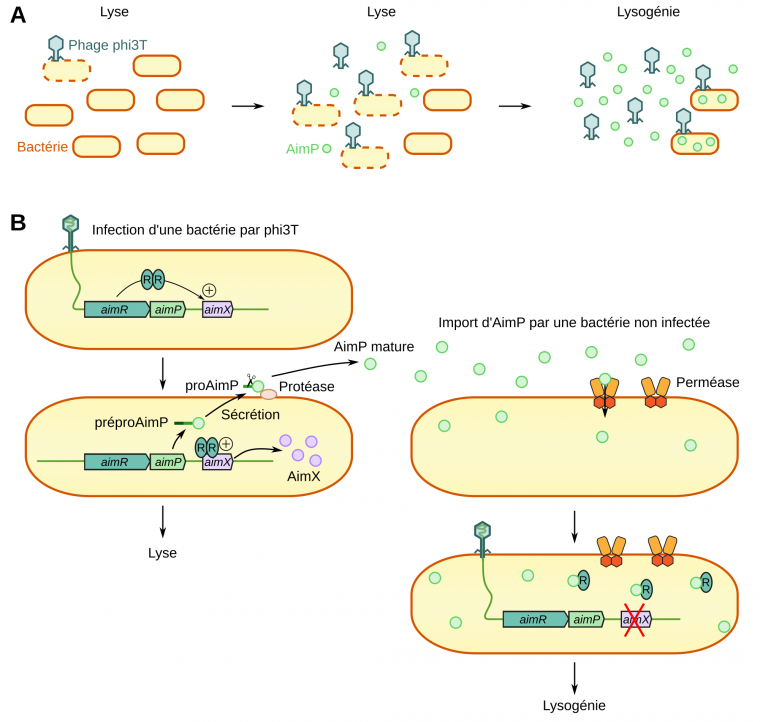
Les chercheurs ayant découvert le système arbitrium s’intéressaient à l’hypothétique existence d’une molécule échangée entre bactéries lors de l’infection par un bactériophage et prévenant les cellules voisines de cette infection. Ils ont ainsi trouvé une protéine nommée AimP produite par des bactéries infectées et induisant la lysogénie du bactériophage phi3T lors de l’infection des cellules voisines. Or, il s’est avéré que cette molécule n’était pas codée par la bactérie, mais par le bactériophage phi3T lui-même. Au moment de l’infection, le génome du bactériophage est exprimé et AimP est alors produite (Figure 2). Il s’agit d’une protéine de 43 acides aminés, exportée par la bactérie et clivée extracellulairement en un peptide de 6 acides aminés. Ce peptide est importé dans les bactéries voisines par la perméase Opp 5.
Une fois dans la cellule, AimP se fixe à une autre protéine, AimR et empêche sa liaison avec l’ADN. Or, AimR est nécessaire à la transcription du gène AimX, qui déclenche le passage en cycle lytique. Ainsi, l’entrée du peptide AimP inhibe la transcription d’un activateur de la lyse, AimX, et favorise donc la lysogénie.
A : Au début de l’infection les bactéries sont principalement lysées, puis lorsque AimP s’accumule dans le milieu, la lysogénie prédomine.
B : À gauche : Lorsque phi3T infecte une bactérie, le gène aimR est exprimé. Il code un facteur de transcription activant l’expression du gène aimX. La protéine AimX déclenche l’entrée en cycle lytique. Dans le même temps la protéine AimP est produite, sécrétée et maturée.
À droite : Dans les bactéries non infectées, la protéine AimP est importée. En se liant à AimR, AimP empêche l’expression du gène aimX, ce qui favorise la lysogénie.
Le système arbitrium influence le déclenchement de l’induction
Si la lysogénie est enclenchée, le génome du bactériophage s’intègre dans celui de la bactérie hôte et devient un prophage. L’induction du prophage, c’est-à-dire son excision et l’entrée en cycle lytique, est généralement déclenchée par la réponse SOS qui suit la détection de dommages dans l’ADN de l’hôte 1. Chez phi3T, l’induction dépend non seulement de la réponse SOS mais aussi de AimP 234. Si la réponse SOS est déclenchée, mais que AimP est présent en trop grande quantité, l’induction n’est pas déclenchée. Cela correspondrait à une situation où la survie de l’hôte est menacée, mais où la proportion de cellules susceptibles d’être infectées est faible. Il serait donc plus avantageux pour le prophage de rester dans l’hôte, celui-ci pouvant se rétablir, que d’entrer en lyse alors qu’il y a peu de cellules pouvant être infectées par les virions. De même, si AimP est en faible concentration mais que la réponse SOS n’est pas déclenchée, l’induction ne sera pas non plus déclenchée, l’hôte étant stable. Ainsi l’induction est la résultante de l’intégration de deux signaux : d'une part la quantité de AimP dans le milieu, qui est une approximation de la probabilité de succès d’infections après l’induction, et d'autre part l’intégrité du génome de l’hôte, qui renseigne sur les chances de survie de l’hôte et donc du prophage.
Comment AimX influence-t-il l’entrée en lyse ou en lysogénie ?
L’entrée en lyse ou en lysogénie dépend d’un réseau complexe d’interactions impliquant le système toxine/antitoxine MazF/MazE
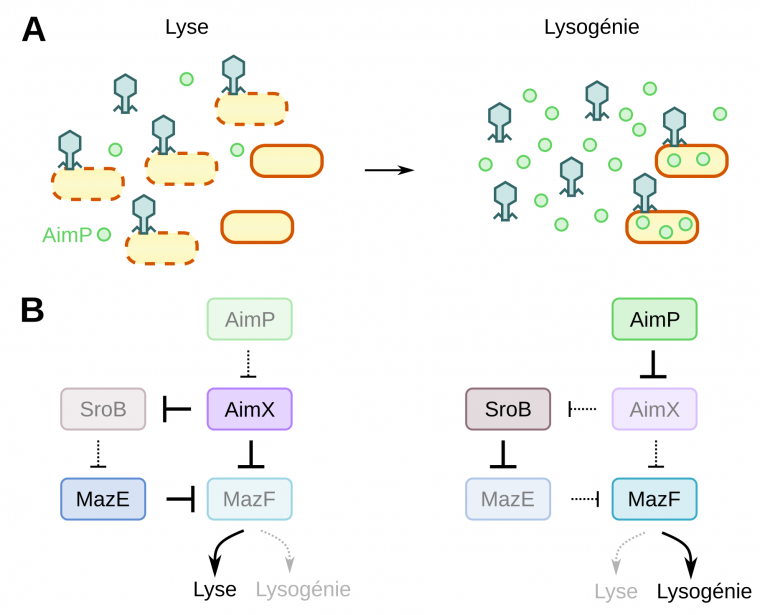
En cherchant comment AimX pouvait contrôler l’entrée en lyse ou en lysogénie, les chercheurs ont trouvé plusieurs protéines interagissant avec AimX : MazF et SroB. MazF est une toxine faisant partie, avec MazE d’un système toxine/antitoxine 5678. Ces systèmes mettent en jeu une protéine ayant un effet toxique sur la bactérie (MazF) et une antitoxine (ici MazE) au temps de vie plus court que la toxine et empêchant l’activité de celle-ci. La toxicité de MazF vient de son activité d’interférence à ARN, tandis que l’activité d’antitoxine de MazE s’explique par son interaction avec MazF au niveau de son site de liaison à l’ARN 9. Les expériences d’inactivation de la toxine MazF ont entraîné l’augmentation de la lyse et une diminution de la lysogénie, ce qui montre que l’activité de cette toxine inhibe la lyse et promeut la lysogénie. D’autre part, les chercheurs ont trouvé que, comme MazE, AimX avait une activité antitoxique en se fixant de la même manière que MazE sur le site actif de MazF, ce qui explique pourquoi AimX entraîne la lyse. De plus AimX inhibe SroB, qui lui-même inhibe MazE (Figure 3). Ainsi lorsque AimX n’est pas présent, SroB se fixe à MazE ce qui empêche l’activité antitoxique de MazE et donc promeut la toxicité de MazF, ce qui entraîne la lysogénie. Au contraire lorsque AimX est présent, MazE se fixe à MazF et le séquestre.
A : Au début de l’infection les bactéries sont principalement lysées, puis lorsque AimP s’accumule dans le milieu, la lysogénie prédomine.
B : AimP, AimX, SroB et le système toxine/antitoxine MazF/MazE forment un réseau complexe d’inhibition permettant de modifier la réponse du système (lyse ou lysogénie) selon une information entrante (la quantité de AimP).
Dans ce système de régulation complexe, le signal d’entrée est la concentration en AimP, régulant en sortie l’activité de MazF. En début d’épidémie, AimP est en faible quantité, AimX est transcrit et le réseau tend vers la séquestration de MazF et donc la lyse. Quand la proportion de bactéries infectées est importante, AimP est présente en grande concentration dans le milieu, AimX n’est plus transcrit et le réseau tend vers la libération de MazF et donc la lysogénie (Figure 3).
Comment la toxine MazF influe-t-elle sur l’entrée en lyse ou en lysogénie ?
Une partie de la voie de transduction du signal a donc été élucidée mais il reste à comprendre comment l’activité de MazF inhibe la lyse. Les études avancent deux hypothèses.
La première considère que MazF empêcherait la lyse en dégradant les ARN viraux impliqués dans le cycle lytique 1. En effet, MazF est une interférase à ARN, clivant les ARN portant la séquence UACAU 2. Or le génome de phi3T est enrichi en UACAU par rapport au génome bactérien. De plus, la mutation de MazF dans sa région à activité endonucléasique entraîne un phénotype similaire à l’inactivation de MazF ce qui impliquerait que l’activité ribonucléasique de la toxine est nécessaire à l’inhibition de la lyse 3.
La seconde hypothèse repose sur le fait que MazF et MazE constituent un couple toxine/antitoxine. Or de tels couples sont notamment connus dans le cas des infections abortives, c’est-à-dire dans des infections qui n’aboutissent pas à la libération de virions 4. Ce système repose sur le fait que suite à une infection lytique, la transcription du génome viral mobilise les ressources de la cellule, qui ne transcrit alors plus son propre génome. Toxine et antitoxine ne sont alors plus produites. Or, l’antitoxine, moins stable que la toxine, est rapidement dégradée. L’activité de la toxine tue alors la bactérie avant que le cycle du bactériophage ne soit complété, protégeant les bactéries voisines. Dans le cadre de l’infection par phi3T, la production d’AimP active indirectement la toxine MazF. Celle-ci provoquerait la mort des bactéries dans lesquelles le programme de lyse est activé, et où par conséquent le génome bactérien, et donc l’antitoxine MazE n’est plus exprimé. Par contre, les bactériophages entrés en lysogénie n’empêchent pas l’expression du génome bactérien et donc de l’antitoxine ; les bactéries survivent. Cette hypothèse est appuyée par le suivi de la dynamique de l’infection des mutants MazE/MazF qui est typique des infections abortives 5.
Les conséquences écologiques et évolutives du système arbitrium
Le système arbitrium renseigne sur le statut de l’épidémie virale
À la suite de l’infection d’un hôte, les bactériophages tempérés peuvent soit s’engager dans un cycle lytique, permettant une multiplication rapide au prix de la lyse de l’hôte ou dans un cycle lysogénique, durant lequel la multiplication est lente puisque dépendante de la reproduction de l’hôte. La plupart des bactériophages ont une probabilité de lysogénie constante, quel que soit le statut de l’épidémie. Or il apparaît qu’une stratégie avantageuse serait de s’engager dans un cycle lytique en début d’épidémie, lorsque les hôtes sont nombreux, mais de privilégier la lysogénie en fin d’épidémie, lorsque les hôtes se raréfient, ce qui permet le rétablissement de la population avant de réenclencher une période de lyse. C’est précisément ce que permet le système arbitrium en modifiant la probabilité de lysogénie selon la concentration en AimP. En effet, à chaque infection, des protéines AimP vont être produites, de sorte que la concentration en AimP est finalement proportionnelle au nombre de bactéries déjà infectées.
Des simulations informatiques montrent en effet que des bactériophages possédant un système de communication semblable à arbitrium sont plus compétitifs que des bactériophages tempérés utilisant une probabilité de lysogénie constante au cours de l’épidémie 6.
Le système arbitrium renseigne sur le nombre de cellules sensibles à l’infection
Phi3T possède la capacité d’évitement de surinfection : lorsque le virus est sous forme de prophage, l’hôte est immunisé aux nouvelles infections de phi3T, ce qui protège le prophage en même temps que l’hôte. Or, les prophages produisent aussi AimP. Ainsi, la concentration de cette protéine dans le milieu dépend à la fois du nombre de bactéries déjà infectées et du nombre de cellules lysogénisées donc « inaccessibles » aux virions libres.
Une forte concentration en AimP dans le milieu indique donc qu’il existe peu de cellules sensibles à l’infection dans la population. Dans ces conditions, des analyses théoriques prédisent que le virus devrait utiliser la concentration d’AimP pour augmenter la lysogénie lors d’une nouvelle infection mais aussi diminuer l’induction du prophage des bactéries lysogènes 7. Les mesures expérimentales sur le phi3T confirment la capacité du virus à moduler sa décision en fonction de la concentration du signal. Cette validation des prédictions théoriques confirme l’hypothèse selon laquelle le virus aurait acquis un mécanisme de régulation génétique particulièrement sophistiqué pour modifier sa stratégie d’exploitation en fonction de la disponibilité de la ressource (les cellules sensibles à l’infection) dans l’environnement. Quoi qu’il en soit, l’évolution du système arbitrium, encore imparfaitement comprise, fait l’objet de nombreuses recherches 89.
Conclusion
La découverte du système de communication arbitrium illustre les capacités d’adaptation des bactériophages. Ce système permet de suivre les variations du nombre de virus et de cellules sensibles et d’adopter ainsi des stratégies en adéquation avec les fluctuations de leur environnement. Cet exemple de communication virale rappelle celui de détection du quorum (quorum sensing) des bactéries. Ce système permet à ces dernières de modifier l’expression de leurs gènes afin de l’adapter au mieux aux variations démographiques de leur population. La perméase Opp qui importe AimP dans la bactérie est d’ailleurs connue pour son rôle dans l’import des peptides de communication des systèmes de détection du quorum.
Le système arbitrium se retrouve chez d’autres bactériophages que le bactériophage phi3T mais aussi de manière homologue dans d’autres éléments génétiques mobiles comme les plasmides 10. Selon la famille à laquelle le bactériophage appartient, le peptide produit diffère et celui-ci n’affecte que les bactériophages la même famille. En d’autres termes, le mode de communication arbitrium est spécifique d'une famille de phages. Par ailleurs, dans la plupart de ces systèmes, et contrairement à ce qui est observé chez phi3T, AimX agit non pas sous la forme d’une protéine mais sous la forme d’un ARN non codant pour inhiber la lysogénie. Il reste donc encore beaucoup à comprendre sur ce système de communication : quelles sont les différences entre les systèmes où AimX est protéique et ceux où AimX est nucléique ? Comment MazF inhibe-t-il la lyse ? Existe-t-il d’autres systèmes de communication moléculaire entre virus ?