La coccinelle arlequin, Harmonia axyridis, présente un polymorphisme remarquable des motifs colorés qui ornent ses élytres. Cette grande variété de formes n'est pourtant due qu'à un seul gène, pannier, dont la séquence codante est identique chez tous les individus mais dont les séquences régulatrices varient. En fonction des allèles qu'elles possèdent, les coccinelles vont donc produire la protéine Pannier, impliquée dans la coloration noire, à des endroits différents de leurs élytres.
Certaines coccinelles possèdent des élytres (ailes antérieures durcies qui recouvrent les ailes postérieures) noires avec deux gros points rouges. D’autres possèdent deux petits points rouges additionnels vers l’arrière, ou sont décorées d’une douzaine de petits points rouges. À l’inverse, il existe des coccinelles avec des élytres rouges, ornées d’une vingtaine de points noirs. Toutes ces coccinelles arlequin, bien que très différentes d’aspect extérieur, appartiennent pourtant à la même espèce, H. axyridis.
Introduction
L’existence de formes distinctes de coloration au sein d’une même espèce est un phénomène courant chez les insectes. En particulier, la coloration noire de l’ensemble ou d’une partie du corps, appelée mélanisme, a longtemps été étudiée du point de vue écologique et, plus récemment, du point de vue génétique (Majerus 1998; Gompel et al. 2005; Yassin et al. 2016). Un des cas les plus célèbres chez les insectes est le mélanisme industriel observé depuis le 19e siècle chez un papillon, la phalène du bouleau (Van't Hof et al. 2016). Cet exemple classique des manuels de biologie évolutive illustre un type de mélanisme, l’assombrissement du corps entier. Cependant, la plupart des mélanismes ne créent des motifs de couleurs discrets et complexes que sur certaines parties du corps des insectes. Les mécanismes génétiques par lesquels ces motifs mélaniques polymorphes sont générés (le fameux lien génotype – phénotype) et les mécanismes évolutifs grâce auxquels ils sont maintenus dans les populations naturelles restent largement inconnus. Si la coccinelle arlequin (ou asiatique) Harmonia axyridis est emblématique des espèces qui, utilisées initialement pour la lutte biologique deviennent envahissantes et nuisibles (Roy et al. 2016), elle est également la championne du polymorphisme de coloration chez les coléoptères, avec plus de 200 formes discrètes de coloration décrites dans ses populations naturelles à travers le monde (Tan 1946). Ces formes correspondent pour l’essentiel à des variations spatiales au niveau des élytres de zones de couleur noire sur un fond rouge/orange (Figure 1).
Pourquoi existe-t-il des coccinelles rouges à points noirs et des coccinelles noires à points rouges ?
Les enfants – comme les adultes – se sont posés un jour cette question. Les scientifiques aussi, comme l’atteste de nombreux travaux sur le sujet depuis les années 1920, certains réalisés par des figures marquantes de la biologie évolutive telles que le généticien Theodosius Dobzhansky (1900 – 1975) ou l’écologiste Michael Majerus (1954 – 2009) (Dobzhansky 1933; Majerus 1994). Ainsi, chez la coccinelle arlequin on sait depuis les années 1950 que les différentes formes de couleur résultent de variations génétiques situées dans une seule région du génome, mais sans que l’on ne sache exactement laquelle (Tan 1946). Nous avons uni nos expertises de recherche (en génomique des populations et biologie du développement) pour répondre à cette question, et notre collaboration a permis d’identifier les variations génétiques responsables des différents motifs de coloration chez la coccinelle arlequin. Nous avons ainsi identifié un gène qui, à lui seul, dicte toutes les instructions nécessaires pour dessiner les différents motifs qui décorent les ailes de ces « bêtes à bon Dieu ». Ces résultats ont été publiés en août 2018 dans la revue Current Biology.
Le gène pannier détermine différents motifs de coloration
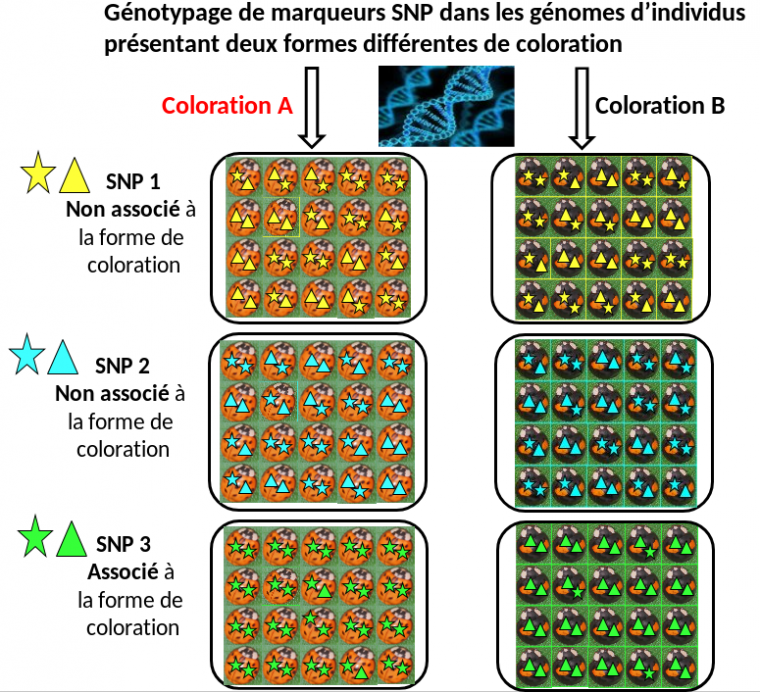
Dans un premier temps, nous avons séquencé (pour la première fois) le génome complet de la coccinelle arlequin. Puis nous avons comparé les génomes entiers de nombreuses coccinelles arlequin présentant différentes formes de coloration au sein de plusieurs populations naturelles réparties aux quatre coins du monde, ceci afin d’identifier la région du génome associée aux variations de coloration (Figure 2 ; Gautier 2015). De la même manière, des gènes responsables de maladies peuvent être identifiés chez l’homme en comparant les génomes de patients et d’individus sains.
Les techniques récentes de séquençage de l’ADN permettent de caractériser un très grand nombre (typiquement plusieurs millions) de variations au niveau des bases nucléotidiques (A, T, G et C), appelées marqueurs SNP (single nucleotide polymorphism en anglais, ou polymorphisme mononucléotidique en français), réparties tout le long des génomes des individus étudiés. On considère ici trois SNP différents (en jaune, bleu et vert), correspondant donc à trois régions du génome différentes et existant en deux versions, représentées par une étoile et un triangle. Pour les SNP 1 et 2, les individus de coloration A ou B ne présentent pas préférentiellement l’une des deux versions de ces SNP. Par contre, on constate que la variante étoile du SNP3 est associée à la coloration A alors que la variante triangle est liée à la coloration B. Cela signifie donc que le gène responsable de la coloration est situé à proximité du site du SNP 3.
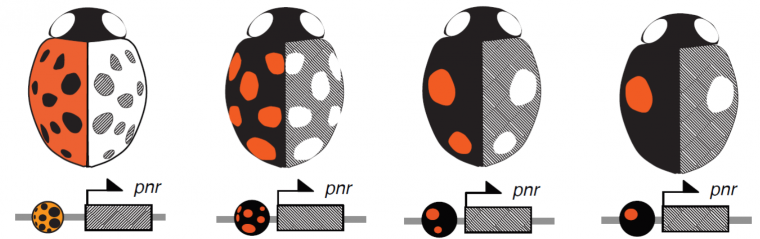
Nous avons ainsi identifié une région bien précise du génome d’ H. axyridis, dont les variations de séquences sont corrélées avec les variations de coloration. Cette région s’étend sur deux gènes voisins. L’inactivation successive de l’expression de ces deux gènes candidats par la méthode dite « d’interférence par ARN » a permis de trancher : le gène responsable de la formation des motifs noirs sur les élytres se nomme pannier (Figure 3).
Les différentes formes de colorations sauvages de la coccinelle arlequin (a-d) perdent leur coloration noire (e-h) lorsque le gène pannier est inactivé par la technique dite « d’interférence par ARN ».
Le gène pannier a été découvert initialement chez la drosophile dans les années 1980. En général, les généticiens nomment un gène en référence aux malformations visibles sur les individus mutants pour le gène en question, et souvent avec un zeste d’humour. En l’occurrence pour le gène pannier, c’est la forme de l’embryon mutant similaire à un panier (pannier en anglais) qui a inspiré le nom du gène. Étonnamment, chez aucun autre insecte le gène pannier ne semblait lié à la production de motifs de coloration. Par la suite, en révélant la localisation de la protéine produite par le gène pannier, par des marquages avec des anticorps produits spécifiquement contre la protéine Pannier d’Harmonia, nous avons mis en évidence que le gène pannier est activé (ou exprimé) pendant la formation des élytres. Plus précisément le gène pannier s’active dans différentes populations de cellules de l’élytre qui préfigurent exactement là où la pigmentation noire apparaîtra chez l’adulte (Figure 4). Le gène pannier code un facteur de transcription, qui, là où il est produit, contrôle l’expression d’autres gènes qui assurent la production de pigment noir par ces cellules et donc la formation des fameux points noirs (chez les coccinelles « rouges ») ou du fond noir (chez les coccinelles « noires »).
L’expression de la protéine Pannier est révélée par immunomarquage dans un élytre en formation pour les motifs colorés rouge à points noirs (A1-3) et noir à points rouges (B1-3). Les territoires où la protéine est présente (zones blanches sur les images en microscopie confocale : A2-3 ; B2-3) correspondent aux futurs territoires noirs tandis que les endroits où Pannier est absente correspondent aux futures zones rouges. Échelles : barre noire = 1 mm, barre blanche = 100 µm.
Le profil d’expression du gène pannier est lui-même contrôlé par des séquences d’ADN dites régulatrices, situées à proximité du gène pannier. Ces séquences régulatrices agissent comme des interrupteurs génétiques : elles activent le gène pannier dans différents territoires des élytres. De manière analogue, l’éclairage dans les différentes pièces d’une maison est contrôlé par de multiples interrupteurs, répartis dans les différentes pièces. Chaque interrupteur peut être activé indépendamment des autres, et donc l’éclairage de chaque pièce peut être contrôlé de manière autonome. Il en va de même pour l’expression des gènes : leur expression dans différents territoires cellulaires résulte de l’activation de multiples interrupteurs génétiques, indépendants les uns des autres (Prud'homme et al. 2007; Carrol et al. 2009). C’est la composition moléculaire en bases d’ADN (A, T, G, C) des séquences régulatrices qui dictent leur activité (là où elles sont actives). Lorsqu’une séquence régulatrice varie, son activité varie également. Dans le cas des coccinelles, les motifs colorés sont distincts selon les individus car ceux-ci possèdent des séquences régulatrices différentes, menant à un profil d’expression du gène pannier variable. Les motifs colorés chez la coccinelle arlequin sont donc produits par différents allèles du gène pannier qui sont tous des variants, non pas de la séquence codante, mais des séquences régulatrices (Figure 5). Les fréquences des allèles de pannier fluctuent selon les populations, créant ainsi des compositions de couleur très bigarrées au sein des populations naturelles de la coccinelle arlequin de par le monde.
Les zones de l’élytre, où l’ensemble séquences régulatrices – région codante s’activent, assurant la production de pigment noir dans les cellules concernées, sont colorées en gris.
Comment se fait-il que les différents morphes de couleurs se maintiennent dans les populations naturelles d’H. axyridis, alors qu’ils peuvent tous s’accoupler ? En effet, des recombinaisons devraient se produire entre les différents allèles du gène pannier, créant de nouveaux motifs. Or il n’en est rien ! La comparaison des séquences régulatrices des différents allèles de pannier révèle de fortes divergentes de composition moléculaire, avec notamment la présence d’une longue séquence dont l’orientation sur le génome est inversée selon les allèles. Cette divergence est telle qu’elle empêche vraisemblablement les séquences de recombiner localement entre elles. Ainsi, si les allèles ne peuvent pas recombiner entre eux, ils sont préservés dans les populations naturelles.
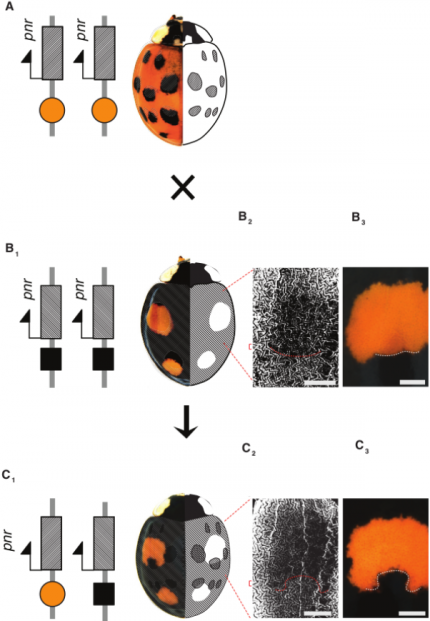
Le croisement d’une coccinelle homozygote pour l’allèle fond-rouge-20-points-noirs (A) et d’une coccinelle homozygote pour l’allèle fond-noir-quatre-points-rouges (B) donne naissance à une coccinelle hétérozygote possédant également quatre points rouges mais de formes différentes (C). En effet, chez les descendants, le gène pannier s’exprime dans tous les territoires où il était exprimé chez les parents (domaines hachurés sur les figures A et B). Par exemple, au niveau des taches antérieures de l’élytre, l’absence d’expression de pannier chez le parent B (B2) donne un point rouge globalement circulaire (B3). Par contre, chez le descendant du croisement, le gène pannier est exprimé dans le bas de cette zone circulaire (C2) créant une sorte d’encoche noire dans la tache rouge (C3). Barres d’échelles : 0,5 mm.
Que se passe-t-il lorsque deux coccinelles présentant des motifs différents se reproduisent ? Lorsque l’on croise des individus homozygotes pour pannier, on constate que les descendants hétérozygotes obtenus présentent une coloration noire partout où au moins l’un des deux parents est noir (Tan 1946). Autrement dit, l’ensemble des zones noires des descendants correspond à l’union des zones noires des deux parents. On peut donc établir la relation de dominance suivante entre les allèles du gène pannier : allèle fond-noir-deux-points-rouges > allèle fond-noir-quatre-points-rouges > allèle fond-noir-12-points-rouges > allèle fond-rouge-20-points-noirs (voir la Figure 1 pour une illustration de ces quatre principaux motifs de coloration). Au niveau moléculaire, cela signifie que le patron d’expression du gène pannier des descendants correspond à l’union des patrons d’expression des deux parents (Figure 6). Ce phénomène augmente encore la complexité du polymorphisme des motifs de couleur chez la coccinelle asiatique. En effet, si nous avons restreint notre étude aux quatre types de motifs les plus fréquents (Figure 1), près de 200 motifs colorés ont été décrits dans les populations naturelles de part le monde. Cette diversité de motifs est due d’une part à la diversité des combinaisons alléliques que l’on peut obtenir chez les hétérozygotes, mais elle pourrait également être due à de rares évènements de recombinaisons entre allèles et à des mutations de novo générant de nouveaux variants moléculaires dans les séquences régulatrices du gène pannier.
Conclusion et perspective
En conclusion, chez la coccinelle arlequin les différents motifs de couleurs trouvent leur origine génétique dans des variations de l’activation spatiale d’un seul gène qui orchestre la mise en place des différents motifs de mélanisation des élytres. Des mécanismes similaires pourraient également être reponsables de la diversité de pigmentation observée chez d’autres espèces. Plus généralement, ces résultats illustrent de quelle manière des variations au niveau d’un seul gène (génotypes) peuvent, dans certains cas au moins, générer une impressionnante diversité de phénotypes.
Il est fortement suspecté que la coloration d’une coccinelle, et donc les variations au niveau de pannier, affectent d’autres caractères impliqués dans sa survie et sa reproduction et que ces effets reflètent en partie des réponses à des phénomènes de sélection naturelle (par exemple adaptation des coccinelles au climat). Dans ce contexte, une perspective intéressante concerne le caractère envahissant de la coccinelle arlequin, qui depuis son aire native en Asie, a récemment colonisé les quatre continents (Amérique du Nord, du Sud, Europe, et Afrique du Sud). De manière surprenante, la diversité des formes de couleur de H. axyridis s’avère restreinte sur les continents envahis (Roy 2016). En effet, dans la plupart des régions envahies (sauf en Europe), seule la forme non-mélanique (élytres rouges ornées d’une vingtaine de points noirs) est présente. Jusqu’à maintenant, il n’a pas été possible de déterminer si la quasi-fixation d’une seule forme de coloration dans l’aire envahie est due à des contingences historiques, démographiques (et donc à de simples effets aléatoires) ou à un processus de sélection naturelle favorisant la forme non-mélanique au cours de l’invasion. Nos découvertes sur les régions du génome responsables des variations de coloration nous permettront peut-être de trancher entre ces deux hypothèses.
Références
Références générales
- Carroll S., Prud’homme B., Gompel N. (2009) La régulation des gènes, moteur de l’évolution. Pour la science #375.
- Dobzhansky T. (1933) Geographical Variation in Ladybeetles. American Naturalist 67, 97-126.
- Gautier M. (2015) Genome-Wide Scan for Adaptive Divergence and Association with Population-Specific Covariates. Genetics 201, 1555–1579.
- Gompel N., Prud’homme B., Wittkopp, P. J., Kassner V. A., Carroll S. B. (2005) Chance caught on the wing: cis-regulatory evolution and the origin of pigment patterns in Drosophila. Nature 433, 481–487.
- Majerus M.E.N. (1994). Ladybirds. Collins New Naturalist, London, p 367.
- Majerus M. E. N. (1998) Melanism: Evolution in action. Oxford University Press, Oxford, p338.
- Prud'homme B, Gompel N, Carroll S.B (2007) Emerging principles of regulatory evolution . Proc Natl Acad Sci U S A., vol. 104 Suppl 1, pp. 8605-8612, 2007.
- Roy H. E., Brown P. M. J., Adriaens T., Berkvens N., Borges I., Clusella-Trullas S., ... Zhao Z. (2016). The harlequin ladybird, Harmonia axyridis: global perspectives on invasion history and ecology. Biological Invasions 18, 997-1044.
- Tan C. (1946) Mosaic dominance in the inheritance of color patterns in the lady-bird beetle, Harmonia axyridis. Genetics 31, 195–210.
- Van't Hof A.E., Campagne P., Rigden D.J., Yung C.J., Lingley J., Quail M.A., Hall N., Darby A.C., Saccheri, I.J. (2016). The industrial melanism mutation in British peppered moths is a transposable element. Nature 534, 102–105.
- Yassin A., Delaney, E.K., Reddiex, A.J., Seher, T.D., Bastide, H., Appleton, N.C., Lack, J.B., David, J.R., Chenoweth, S.F., Pool, J.E., et al. (2016). The pdm3 Locus Is a Hotspot for Recurrent Evolution of Female-Limited Color Dimorphism in Drosophila. Current Biology 26, 2412–2422.
Référence de la publication sur laquelle se base cet article
Gautier M, Yamaguchi J, Foucaud J, Loiseau A, Ausset A, Facon B, Gschloessl B, Lagnel J, Loire E, Parrinello H, Severac D, Lopez-Roques C, Donnadieu C, Manno M, Berges H, Gharbi K, Lawson-Handley L, Zang LS, Vogel H, Estoup A, Prud'homme B. Current Biology 2018 Aug 20. pii: S0960-9822(18)31068-6. doi: 10.1016/j.cub.2018.08.023.