Cet article présente une méthode permettant de distinguer les phénotypes et génotypes des individus d'une famille, en ce qui concerne le type d'hémoglobine contenu dans leurs globules rouges. La méthode utilisée ici met en oeuvre la technique d'électrophorèse sur gel d'agarose.
Principe
Plusieurs maladies héréditaires qualifiées d’hémoglobinopathies, comme les thalassémies et la drépanocytose, affectent l’un des deux gènes codant les chaînes de l’hémoglobine humaine adulte, hémoprotéine tétramérique constituée de deux chaînes alpha et de deux chaînes bêta.
La drépanocytose est une affection génétique due à une mutation ponctuelle dans le gène codant la chaîne bêta. Elle est caractérisée par la substitution de l’acide glutamique, en position 6 de la structure primaire, par une valine. Il en résulte une hémoglobine anormale (HbS) qui a tendance à polymériser lorsque la pression partielle en dioxygène diminue, en particulier dans le sang périphérique, contrairement à l’hémoglobine normale (HbA) qui ne présente pas cette propriété.
La présence de cette hémoglobine anormale dans les globules rouges aboutit à une pathologie qui peut être plus ou moins grave en fonction de divers autres facteurs génétiques et environnementaux, principalement chez les homozygotes. Cette pathologie peut être détectée par l’observation microscopique du sang, dans lequel on observe des hématies déformées, qualifiées de falciformes (en forme de faucille).
La simple substitution de la valine en position 6 dans la structure primaire de la chaîne bêta confère à l’hémoglobine S une charge électrique globale inférieure à celle de l’hémoglobine A. Il en résulte que lorsque les deux hémoglobines HbS et HbA sont placées sur un gel d’électrophorèse, elles ne migrent pas de la même façon ce qui permet de les identifier dans un simple hémolysat de globules rouges. On peut alors aisément en déduire le phénotype moléculaire du porteur puis son génotype.
Dans l’enseignement de la biologie, le cas de la drépanocytose est prototypique ; il constitue non seulement un exemple historique de vérification du bien fondé du « dogme central de la biologie moléculaire », mais aussi des relations complexes entre génotype et phénotype qui interviennent dans l’évolution. L’allèle muté, bien que morbide, s’est maintenu à un taux élevé dans le pool génique de certaines populations, en raison de l’avantage sélectif qu’il confère dans les zones d’endémie du paludisme. Les parasites responsables de cette maladie, du genre Plasmodium, se révèlent en effet moins pathogènes chez les porteurs de l’allèle muté.
Pour toutes ces raisons, il est intéressant d’utiliser l’électrophorèse pour identifier les deux hémoglobines, par exemple dans une simulation de situation réelle.

Protocole
Sur le plan technique, il s’agit d’une simulation pouvant correspondre à la distribution des hémoglobines A et S dans trois générations, au sein d’une famille. Il s’agit, à partir des résultats de l’électrophorèse des hémoglobines des différents membres de cette famille virtuelle, de déterminer leurs phénotypes moléculaires, d’en déduire leurs génotypes et de dresser l’arbre généalogique correspondant.
Les échantillons utilisés pour réaliser l’électrophorèse sont des solutions fabriquées artificiellement avec des hémoglobines A et S du commerce, dissoutes à raison de 2,5 mg/mL dans du tampon d’électrophorèse préalablement oxygéné par une agitation vigoureuse. Pour chaque « membre de la famille », on place dans un tube Eppendorf étiqueté 100 µL de solution. Les échantillons correspondant aux individus homozygotes pour HbA sont constitués de 100 µL de la solution d’hémoglobine A, les échantillons correspondant aux individus homozygotes pour HbS sont constitués de 100 µL de la solution d’hémoglobine S et les échantillons correspondant aux individus hétérozygotes sont constitués d’un mélange de 50 µL de la solution d’hémoglobine A et de 50 µL de la solution d’hémoglobine S.
Un tel volume permet de réaliser 20 pistes d’électrophorèse avec la technique des gels supportés prêts à l’emploi. On se référera à l’arbre généalogique du paragraphe « exploitation » pour la correspondance entre solutions d’hémoglobine et membres de la famille.
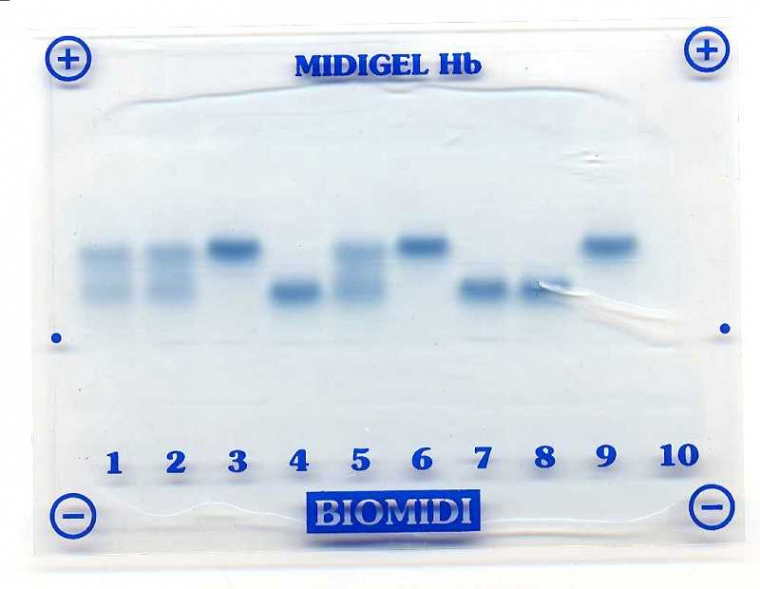
L’électrophorèse est menée à 110 V pendant 50 minutes sur un Midigel Hémoglobine (BIOMIDI) selon la procédure indiquée à la page du protocole.
Résultats
Le recours à l’électrophorèse peut être justifié par un problème et une question :
Problème : « Pour confirmer l’origine génétique de la drépanocytose d’un garçon, on cherche à identifier, au sein de sa famille, les porteurs de l’allèle de la maladie »
Question : « On a extrait l’hémoglobine des globules rouges des individus de cette famille et on a soumis les échantillons à l’électrophorèse sur gel d’agarose. Pouvez-vous identifier les génotypes de ces individus et construire l’arbre généalogique de la famille ? »
Le gel présenté ci-dessous montre les résultats obtenus.
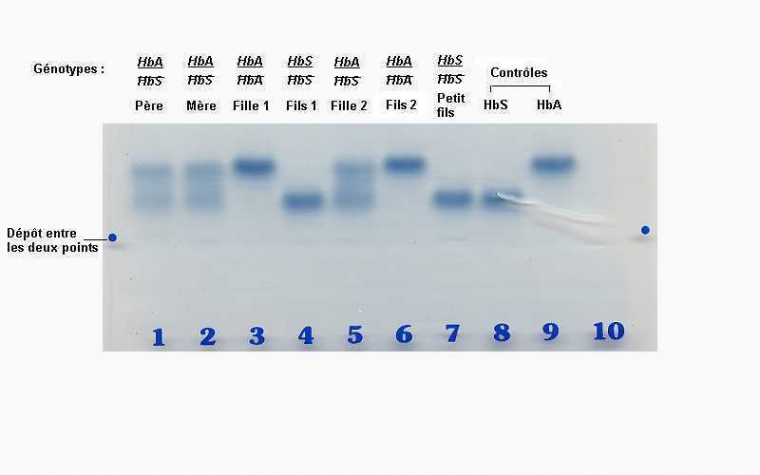
Les sept membres dont l’hémoglobine a été analysée sont les deux parents (pistes 1 et 2), leurs quatre enfants (pistes 3 à 6) et un petit enfant (piste 7).
En outre, deux références sont constituées par un échantillon d’hémoglobine S (piste 8) et un échantillon d’hémoglobine A (piste 9).
Exploitation
Dans un premier temps, on identifie les bandes d’hémoglobine pour en déduire les génotypes des différents individus.
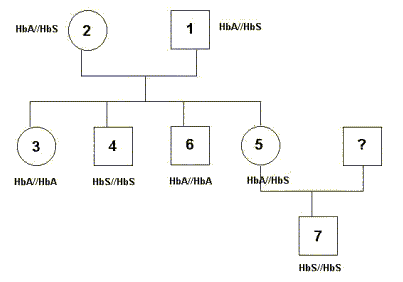
Dans la représentation de l’arbre généalogique les numéros dans les cases correspondent aux numéros (bleus) des pistes de l’électrophorèse.
Puis dans un deuxième temps on en déduit l’arbre généalogique