Les bactéries Wolbachia influencent la manière dont est déterminé le sexe chez les cloportes.
L’évolution des animaux est notamment conditionnée par des interactions complexes avec des micro-organismes, la plus intime étant l’endosymbiose, un type de symbiose dans laquelle un partenaire microbien vit à l’intérieur des cellules de son hôte. L’endosymbiose a joué un rôle clé dans l’émergence des formes de vie majeures sur Terre et dans l’évolution de la diversité biologique. Son importance est parfaitement illustrée par l’existence des mitochondries et des chloroplastes, qui découlent d’évènements d’endosymbioses avec des bactéries. Des résultats accumulés au cours de ces dernières années montrent que les endosymbiotes affectent de nombreuses fonctions de leurs hôtes, telles que la nutrition, le développement, la défense contre des ennemis naturels ou encore l’immunité.
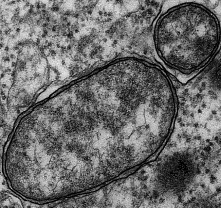
La taille moyenne d'une cellule de Wolbachia est d'environ 1 µm.
Nos travaux sur les isopodes terrestres, plus connus sous le nom de cloportes (Figure 1), et leurs bactéries Wolbachia (Figure 2) illustrent parfaitement comment les micro-organismes endosymbiotiques peuvent influencer un autre processus biologique fondamental des animaux : le déterminisme du sexe (Cordaux et al. 2011, Cordaux et Gilbert 2017).
Le déterminisme chromosomique du sexe
Le déterminisme du sexe est l’une des voies développementales les plus fascinantes chez les animaux : il gouverne la différenciation sexuelle des individus en mâles ou en femelles. Chez les animaux, les différences sexuelles entre les mâles et les femelles sont généralement déterminées par des facteurs sexuels chromosomiques, communément portés par des chromosomes sexuels. Selon les espèces, il existe deux grands systèmes de chromosomes sexuels, appelés hétérogamétie mâle et femelle. Dans le cas de l’hétérogamétie mâle, que l’on rencontre par exemple chez les mammifères (dont l’espèce humaine), les mâles possèdent deux chromosomes sexuels différents, X et Y, et les femelles deux copies du chromosome sexuel X. L’hétérogamétie femelle, rencontrée par exemple chez les oiseaux, correspond quant à elle à la situation symétrique : ce sont les femelles qui possèdent deux chromosomes sexuels différents (Z et W), tandis que les mâles possèdent deux copies du même chromosome (Z). En général, les chromosomes sexuels Y et W portent l’information génétique qui initie le développement des individus respectivement en mâle et en femelle.
Le déterminisme cytoplasmique du sexe
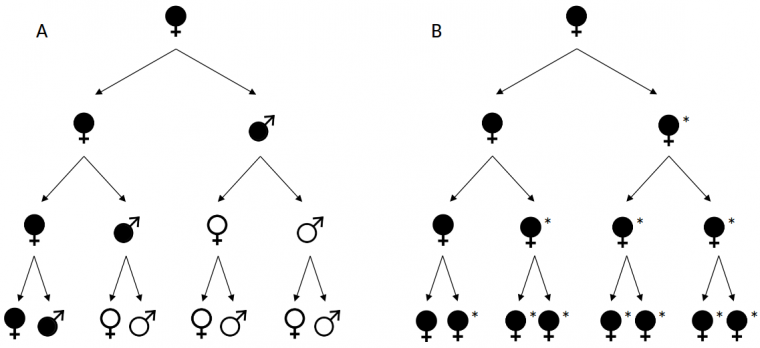
Dans certaines espèces, le déterminisme du sexe peut aussi être affecté par des microbes endosymbiotiques héritables, un phénomène appelé déterminisme cytoplasmique du sexe. En effet, certains micro-organismes intracellulaires sont transmis de façon verticale d’une génération d’hôtes à la suivante par le cytoplasme des ovocytes maternels, et non par les spermatozoïdes paternels. Il est donc plus avantageux pour de tels endosymbiotes d’être présents chez des femelles qui pourront les transmettre à leurs descendants, plutôt que chez des mâles qui ne les transmettront pas à leurs descendants (Figure 3). Cela explique pourquoi certains endosymbiotes ont développé la capacité à transformer leurs hôtes mâles en femelles. C’est notamment le cas des bactéries Wolbachia qui sont capables de féminiser les cloportes mâles.
A. Endosymbiote n’affectant pas le déterminisme du sexe de son hôte. B. Endosymbiote à effet féminisant (*: mâle génétique converti en femelle phénotypique). Noir/blanc : individu porteur/non porteur d’endosymbiote. À chaque génération, les individus sont croisés avec des animaux du sexe opposé et produisent deux descendants.
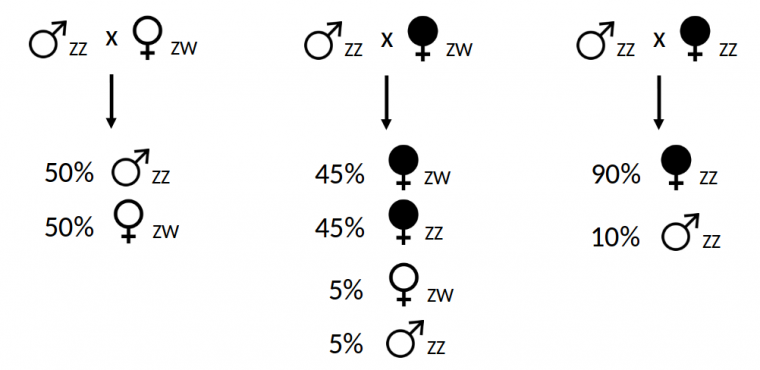
Dans l’espèce de cloporte la plus étudiée, Armadillidium vulgare, il existe un déterminisme chromosomique du sexe basé sur une hétérogamétie femelle ZW/ZZ. Lorsqu’une femelle cloporte ZW se reproduit avec un mâle ZZ, leur descendance est composée à parité de femelles ZW et de mâles ZZ en raison de la transmission mendélienne des chromosomes sexuels (Figure 4). Pourtant, dans certaines populations, il arrive régulièrement que certaines femelles produisent des descendances hautement biaisées en faveur des femelles (environ 90 %). Ce phénomène est causé par la présence de bactéries Wolbachia qui induisent le développement des embryons de cloportes en femelles, et ce quels que soient les chromosomes sexuels portés par les embryons (Figure 4). En particulier, les embryons génétiquement mâles (ZZ) porteurs de Wolbachia se développent en femelles phénotypiques qui, une fois l’âge adulte atteint, seront à leur tour en mesure de transmettre Wolbachia à leur propre descendance. Le mécanisme moléculaire de la féminisation induite par Wolbachia est inconnu. Néanmoins, on observe que la glande androgène produisant l’hormone androgène responsable de la masculinisation ne se différencie pas lors du développement des embryons mâles ZZ porteurs de Wolbachia. Cela conduit au développement d’un phénotype femelle chez ces embryons.
Légende : ZZ/ZW : statut homo/hétéro-gamétique des individus. Le taux de transmission de Wolbachia est de 90 %.
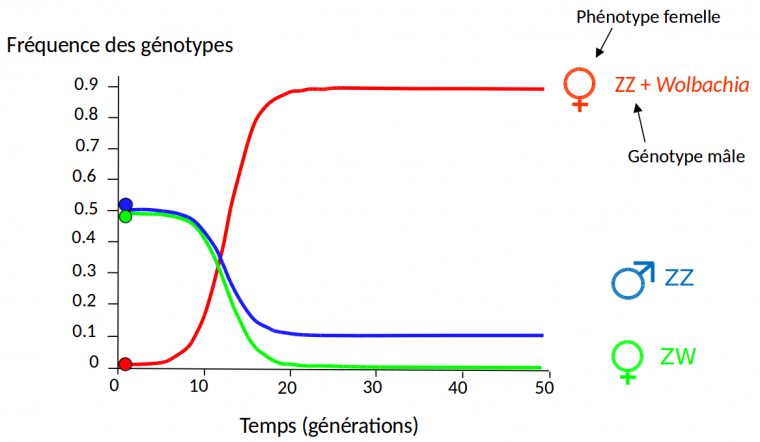
Une conséquence importante du phénomène de féminisation, prédite par les modèles théoriques et confirmée par des observations sur le terrain, est l’élimination à terme du chromosome sexuel W dans les populations d’ A. vulgare où les bactéries Wolbachia féminisantes sont présentes. En effet, étant donné que les femelles génétiques ZW produisent des descendances comportant 50 % de femelles (ZW) tandis que les femelles ZZ porteuses de Wolbachia produisent des descendances comportant environ 90 % de femelles (ZZ), on s’attend à la perte des femelles ZW à l’équilibre (Figure 5). Dès lors, le déterminisme du sexe passe sous le contrôle de Wolbachia dans ces populations. En effet, tous les individus sont des mâles chromosomiques ZZ. Parmi eux, ceux qui possèdent Wolbachia se développent en femelles tandis que les individus sans Wolbachia se développent en mâles. Étant donné que le taux de transmission de Wolbachia d’une mère à ses descendants est d’environ 90 %, il en résulte que les portées sont composées d’environ 90 % de femelles (à qui les bactéries Wolbachia ont été transmises par la mère) et 10 % de mâles (qui n’ont pas hérité Wolbachia de leur mère) (Figure 5). Cela signifie que le facteur du déterminisme du sexe femelle qui était originalement localisé dans le compartiment nucléaire de la cellule (le chromosome sexuel W) est désormais localisé dans le compartiment cytoplasmique de la cellule (Wolbachia). Ainsi, le système A. vulgare/Wolbachia est un exemple parfait de déterminisme cytoplasmique du sexe.
Les femelles ZZ + Wolbachia ont été introduites à un taux de 0,01 et le taux de transmission de Wolbachia est de 90 %. À l’équilibre (après une vingtaine de générations), les femelles génétiques ZW ont disparu de la population.
L’élément f : d’un déterminisme cytoplasmique à un déterminisme chromosomique du sexe
Étonnamment, Il existe une troisième voie pour le développement des femelles chez A. vulgare. En effet, certaines lignées de cloportes femelles sont curieusement dépourvues à la fois de chromosome sexuel W et de Wolbachia féminisantes. Comment, dans ce cas, ces individus peuvent-ils se développer en femelles ? Il a été proposé en 1984 par Jean-Jacques Legrand et Pierre Juchault que le facteur déterminant le sexe femelle dans ces lignées de cloportes, baptisé élément f, pourrait être un fragment du génome de la bactérie Wolbachia portant l’information génétique déclenchant la féminisation, et qui aurait été transféré et intégré dans l’un des chromosomes du génome du cloporte. Malheureusement, cette hypothèse n’était pas testable à l’époque en raison de limitations liées aux outils méthodologiques d’alors. Ce verrou technologique a enfin pu être levé grâce au développement très récent de nouvelles technologies de séquençage à très haut débit de l’ADN constituant les génomes des organismes vivants.
Nous avons ainsi séquencé et décrypté le génome d’un cloporte femelle porteur de l’élément f et nous l’avons comparé au génome de Wolbachia (Leclercq et al. 2016). Cette comparaison nous a permis de mettre en évidence que l’élément f est un locus génomique correspondant à environ 80 % du génome de Wolbachia et intégré dans un chromosome du cloporte. Cette intégration s’est produite très récemment à l’échelle évolutive car la séquence de l’élément f est presque identique à la séquence du génome de Wolbachia. Pourtant, alors que l’intégration originale comprenait environ 1,5 Mpb du génome de Wolbachia, l’élément f dans sa version actuelle occupe environ 3 Mpb, en raison de réarrangements génomiques (tels que des duplications et des délétions) qui se sont accumulés dans l’élément f depuis son intégration dans le génome du cloporte.
Ce processus d’acquisition d’information génétique d’un organisme (ici une bactérie) par un autre organisme non apparenté (ici le cloporte) est connu sous le nom de « transfert horizontal de gènes ». Chez les animaux, le transfert horizontal de gènes constitue l’exception à la règle selon laquelle le patrimoine génétique se transmet de génération en génération, de manière verticale, des parents à leurs descendants. Cela ne veut pas dire pour autant que le transfert horizontal de gènes est insignifiant en termes d’évolution biologique des animaux. En effet, dans certains cas, les gènes transférés horizontalement ont permis à leurs receveurs d’acquérir de nouvelles fonctions biologiques. L’élément f du cloporte illustre parfaitement cette notion d’innovation biologique que peut conférer le transfert horizontal de gènes à un animal.
Des analyses de biologie moléculaire nous ont permis de montrer que l’élément f est en parfaite liaison génétique avec le sexe femelle (c’est-à-dire présent uniquement dans le génome des femelles) et localisé dans une région génomique hémizygote (c’est-à-dire présente à l’état haploïde dans un génome par ailleurs diploïde). Il s’avère que ces deux caractéristiques sont des signatures typiques de la région du génome impliquée dans le déterminisme du sexe. Étant donné que le chromosome W est absent chez les femelles porteuses de l’élément f, cela signifie que c’est l’élément f qui est responsable du déterminisme du sexe femelle dans ces lignées de cloportes. Autrement dit, chez ces cloportes, il y a eu substitution du système de déterminisme du sexe : à l’origine porté par un chromosome de cloporte, il est maintenant déterminé par le génome d’une bactérie, intégré à celui du cloporte par transfert horizontal !
Une implication importante de ce transfert horizontal concerne la compréhension des mécanismes d’évolution du déterminisme du sexe et des chromosomes sexuels chez les animaux. En effet, le chromosome du cloporte dans lequel l’élément f est intégré correspond précisément à la définition d’un chromosome sexuel W, c’est-à-dire le chromosome qui porte l’information génétique du déterminisme du sexe femelle. Ainsi, le transfert horizontal de gènes d’une bactérie symbiotique vers son hôte constitue un nouveau mécanisme évolutif pouvant expliquer l’origine des chromosomes sexuels chez les animaux. Plus globalement, il apparaît que la présence de bactéries Wolbachia féminisantes chez le cloporte est non seulement à l’origine de l’élimination du chromosome W ancestral, mais elle est également à l’origine d’un nouveau chromosome sexuel W par transfert horizontal. Cela signifie que Wolbachia a causé un remplacement de chromosomes sexuels W chez le cloporte, un phénomène qui a déjà été observé dans de nombreuses espèces d’animaux mais pour lequel les causes restent généralement méconnues. Finalement, le système A. vulgare/Wolbachia constitue une illustration spectaculaire et originale de la façon dont les microbes peuvent influencer des processus biologiques fondamentaux chez les animaux et, ainsi, profondément impacter leur évolution et leur biologie.
Pour aller plus loin
- Cordaux R., Bouchon D. & Grève P. (2011) The impact of endosymbionts on the evolution of host sex-determination mechanisms . Trends in Genetics. 27, 332-341.
- Leclercq S., Thézé J., Chebbi M.A., Giraud I., Moumen B., Ernenwein L., Grève P., Gilbert C. & Cordaux R. (2016) Birth of a W sex chromosome by horizontal transfer of Wolbachia bacterial symbiont genome . Proceedings of the National Academy of Sciences of the USA. 113, 15036–15041.
- Cordaux R. & Gilbert C. (2017) Evolutionary significance of Wolbachia -to-animal horizontal gene transfer : female sex determination and the f element in the isopod Armadillidium vulgare . Genes. 8, 186.