La myéline, permettant une conduction rapide des influx nerveux, est apparue chez les Gnathostomes, les Vertébrés à mâchoires. Une équipe de Cambridge a mis en évidence que le gène RetroMyelin, d'origine rétrovirale, est crucial pour la formation de la gaine de myéline.
Ce texte a été initialement publié à cette adresse le 11 mai 2024 sur Actualités scientifiques Prépas, le blog d'actualités de Patrick Pla, maître de conférences à l'université Paris Saclay. La version proposée ici a été adaptée pour Planet-Vie.
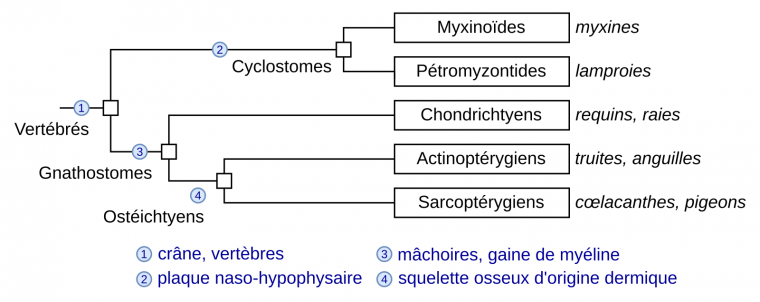
La gaine de myéline qui entoure les axones permet de transmettre les influx nerveux par une conduction saltatoire et donc rapide, même sur de longues distances. La myéline et les gènes critiques pour la myélinisation, tel que le gène codant la protéine MBP (pour Myelin Basic Protein), sont probablement apparus chez l’ancêtre commun des Gnathostomes, les Vertébrés à mâchoires (Figure 1). En effet, les gaines de myéline sont présentes dans l’ensemble de ce groupe, mais pas chez les Cyclostomes tels que la myxine et la lamproie. Chez ces derniers, ainsi que chez les Chordés non vertébrés et chez les Protostomiens, une conduction plus rapide de l’influx nerveux ne peut se faire que par une augmentation du diamètre de l’axone (comme dans l’axone géant de calmar) mais elle a ses limites. Chez ces organismes, des cellules gliales entourent les axones, ce qui isole les axones les uns des autres dans des faisceaux et évite les « fuites de courant ». Cependant, la gaine de myéline compacte permettant la conduction saltatoire ne se retrouve que chez les Gnathostomes et constitue donc l’un de leurs caractères dérivés partagés exclusifs.
Seuls quelques caractères dérivés sont indiqués. D’après Classification phylogénétique du vivant, tome 2, Lecointre et Le Guyader, 2017.
Malgré les avantages fonctionnels significatifs associés à la myélinisation, l’origine génétique de l’apparition de cette propriété fondamentale dans l’évolution des Vertébrés restait inexpliquée. Des chercheurs et chercheuses de l’université de Cambridge, au Royaume-Uni, ont montré dans un récent article de Cell qu’un gène issu évolutivement d’un rétrovirus code un ARN indispensable pour la formation des gaines de myéline par les oligodendrocytes dans le système nerveux central 1.
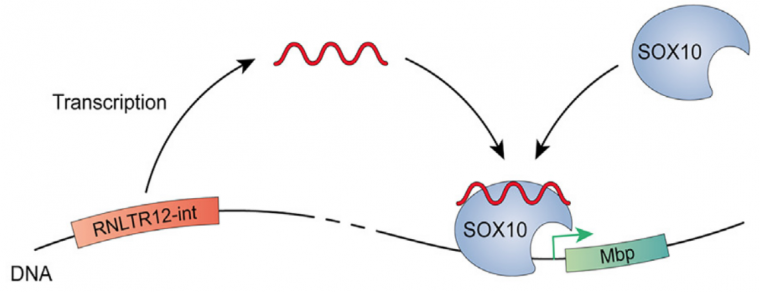
Ce gène appelé RNLTR12-int (que les auteurs ont rebaptisé RetroMyelin) code un ARN non traduit qui s’associe avec le facteur de transcription SOX10. Cette interaction est nécessaire pour que SOX10 puisse activer l’expression de MBP, une protéine cruciale pour la formation des gaines de myéline. RetroMyelin est présent chez tous les Gnathostomes et n’est pas présent chez les Cyclostomes ou d’autres Cordés (et il est absent également chez les Protostomiens).
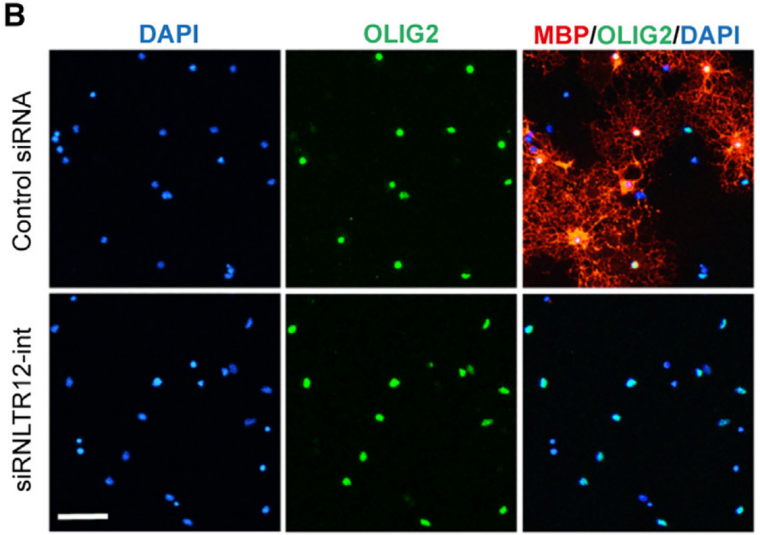
Des précurseurs d’oligodendrocytes de rat sont cultivés in vitro dans un milieu qui stimule leur différenciation. En présence d’un siARN (ARN interférent) témoin, ils se différencient en exprimant OLIG2 (immunofluorescence verte) et MBP (qui permet de produire des gaines de myéline) (immunofluorescence rouge). En présence d’un siARN aboutissant à la dégradation de l’ARN RNLTR12-int (ou RetroMyelin), OLIG2 est bien exprimé mais pas MBP, suggérant que les oligodendrocytes survivent et se différencient, mais incomplètement, et qu’ils sont incapables de produire des gaines de myéline. Barre d'échelle : 60 µm.
RNLTR12-int (RetroMyelin) agit par l’intermédiaire d’un ARN non traduit qui s’associe au facteur de transcription SOX10, ce qui le rend capable de se fixer sur le promoteur du gène codant MBP et d’activer sa transcription.
L’origine rétrovirale du gène codant RetroMyelin est signée par les séquences flanquantes du gène, qui sont très similaires aux séquences des rétrotransposons, des éléments mobiles du génome d’origine rétrovirale. Au cours de l’évolution, ces séquences peuvent se déplacer dans le génome (en produisant un ARN puis, par rétrotranscription, un ADN qui s’intègre dans le génome) sans produire de particules virales. Durant cette phase, où les rétrotransposons sont mobiles, leurs séquences peuvent accumuler des mutations. Puis de nouvelles mutations peuvent aboutir à leur sédentarisation. Des chercheurs avaient déjà découvert que des gènes nécessaires à la formation du placenta ont évolué de cette manière 1.
L’analyse poussée de la distribution des séquences RetroMyelin dans le génome de 22 espèces de Gnasthostomes suggère que la phase de sédentarisation s’est passée indépendamment dans différents phyla et non pas chez l’ancêtre commun des Gnasthostomes, comme on pourrait le croire en appliquant le principe de parcimonie. La sédentarisation du rétrotransposon RetroMyelin constituerait donc une convergence évolutive dans les différents grands groupes de Gnasthostomes.
Cependant cette étude laisse certaines questions en suspens. RetroMyelin joue-t-il un rôle dans la formation des gaines de myéline du système nerveux périphérique, où elles sont produites par les cellules de Schwann et non par les oligodendrocytes ? Il est permis de le penser dans la mesure où MBP et SOX10 sont également exprimés dans les cellules de Schwann. Ensuite, si l’on a découvert que le gène RetroMyelin était nécessaire à l’activation du gène MBP, il reste à préciser également l’origine de ce dernier, nécessaire à la formation de la myéline et présent uniquement chez les Gnathostomes.