Les chants des oiseaux font partie de nos paysages sonores. Aigus ou graves, longs ou courts, constitués d'un nombre élevé ou au contraire restreint d'unités sonores, ces chants varient en fonction des espèces, des localités et des individus. Comment sont produits ces chants ? Quelles fonctions remplissent-ils ?
Un peu plus de 10 000 espèces d’oiseaux existent à l’heure actuelle, et vivent dans la plupart des milieux et écosystèmes aériens de notre planète. Ils interagissent entre eux, entre individus d’une même espèce, entre individus d’espèces différentes d’oiseaux, avec d’autres espèces animales et végétales, dans des environnements différant par leurs facteurs biotiques et abiotiques. Au sein d’un écosystème donné, que ce soit un jardin, une forêt, un littoral, une zone humide… un observateur attentif, peut percevoir directement leur présence : on peut observer visuellement les oiseaux, et on peut les entendre, ou mieux, les écouter. En effet, comme bon nombre d’espèces de Vertébrés et d’Arthropodes, ils produisent des sons ayant valeurs et fonctions de signaux de communication1.
À l’oreille humaine, les sons produits par les oiseaux sont très variés : courts, longs, aigus, graves, modulés en fréquence, organisées ou non en séquences… Il y a une grande diversité sonore, entre les espèces, et au sein d’une espèce donnée. Comprendre cette diversité de comportements sonores repose sur la démarche d’observation et expérimentale d’une discipline scientifique au carrefour des neurosciences et de l’écologie : l’éthologie, et plus particulièrement la bioacoustique.
Intéressons-nous de plus près aux vocalisations des oiseaux, à la manière des éthologues bioacousticiens, c’est-à-dire munis d’un microphone et d’un enregistreur, d’un ordinateur équipé de logiciels permettant l’analyse acoustique, d’un haut-parleur, de jumelles, d’un carnet de terrain et d’un crayon et tentons d’explorer quelques questions fondamentales permettant d’aborder un comportement à savoir comment les oiseaux chantent-ils et pourquoi chantent-ils ?
Dans le langage courant, on parle du cri d’une chouette ou d’une mouette, mais du chant d’un merle ou d’un pinson. À quoi font référence ces différents noms ? La distinction entre cri et chant par les scientifiques repose sur plusieurs grandes caractéristiques, que les réponses aux questions comment ? et pourquoi ? permettent de mettre en évidence. Tout d’abord, en ce qui concerne la structure acoustique des vocalisations, les cris sont des vocalisations de courte durée, de structure souvent complexe – c’est-à-dire qu’ils sont constitués par plusieurs fréquences produites en même temps, ayant ou non un rapport harmonique entre elles2 ; les chants sont en général constitués de plusieurs unités sonores, souvent des sons purs, enchaînées dans une séquence. De plus, les cris sont produits sans apprentissage préalable, et sont majoritairement innés, alors que les chants nécessitent avant leur émission un apprentissage, par imitation d’un ou plusieurs chants tuteurs. Enfin les cris sont impliqués dans des fonctions variées, comme la quémande alimentaire, l’alarme, le maintien du contact à plus ou moins grande distance, alors que les chants sont associés à la fonction de reproduction, de compétition entre individus du même sexe et de sélection par les individus du sexe opposé.
| Cris | Chants | |
|---|---|---|
| Structure acoustique | Vocalisations de courte durée, de structure complexe | Plusieurs unités sonores, souvent des sons purs, enchaînées dans une séquence |
| Apprentissage | Non | Oui, par imitation d’un ou plusieurs chant(s) tuteur(s) |
| Fonctions | Quémande alimentaire Alarme Maintien du contact entre individus |
Défense du territoire Sélection sexuelle |
Les quatre questions de Nikolaas Tinbergen
Dans un article publié en 1963 et intitulé On aims and methods of Ethology, Nikolaas Tinbergen formule quatre questions qui doivent guider les recherches visant à comprendre un comportement.
- Quels sont les mécanismes à l’origine du comportement, c’est-à-dire quels facteurs internes (neurobiologiques, physiologiques) et externes (stimuli environnementaux) déclenchent le comportement d’intérêt ?
- Quelles sont les fonctions du comportement et leurs conséquences en termes de survie et de succès reproducteur ?
- Quelle est l’ontogenèse du comportement ? Ou, formulé autrement, comment le comportement d’intérêt apparaît-il et se met-il en place dans la vie d’un individu ? (part de l’inné et de l’acquis)
- Quelle est la phylogenèse du comportement ? Comment a-t-il émergé et évolué au cours du temps ?
Comment les oiseaux chantent-ils ?
Quelles sont les structures impliquées dans le chant ?
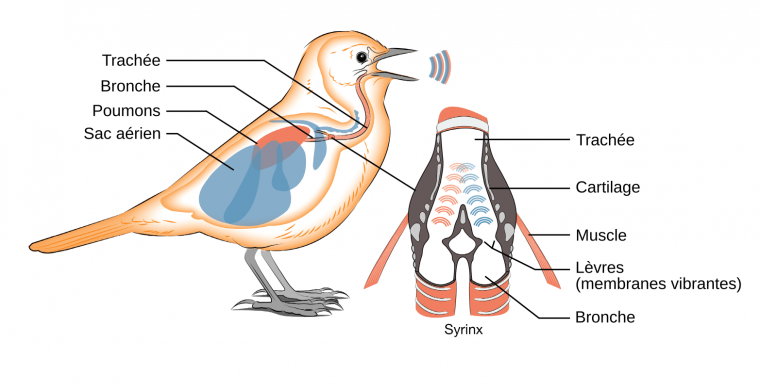
Les sons émis par les oiseaux, du fait qu’ils sont produits par un organe vocal, la syrinx1 portent le nom de vocalisations2. La syrinx est constituée par des membranes dont la tension est contrôlée par des muscles internes et externes, attachés à des anneaux cartilagineux des conduits respiratoires. Chez la grande majorité des oiseaux, la syrinx est trachéobronchiale, c’est-à-dire localisée à l’intersection de la trachée et des bronches (Figure 1). Elle est ainsi située beaucoup plus bas dans l’appareil respiratoire que le larynx des mammifères, également constitué de membranes et de muscles, mais situé, lui, en haut de la trachée. En raison de cette localisation particulière, les oiseaux présentent deux sources sonores, une au niveau de chaque bronche sous leur jonction avec la trachée. Les vocalisations peuvent être alors produites sur deux voix, indépendamment ou simultanément.
Les muscles de la syrinx sont innervés, indépendamment des côtés gauche et droit, par une branche du nerf hypoglosse1 (nerf crânien XII). Ce nerf est constitué par l’ensemble des axones de neurones moteurs émergeant du tronc cérébral. Dans le pallium (structure des Archosauriens analogue au cortex des Mammifères, [1]), des aires nerveuses, appelées noyaux, concentrent les corps cellulaires de neurones, des interneurones et des cellules gliales, qui contrôlent la production des vocalisations (Figure 2).
cHV : noyau caudal du HVC ; DLM : noyau dorsolatéral antérieur ; HVC : higher vocal center ; L : champ L ; LMAN : noyau latéral magnocellulaire du nidopallium antérieur ; NCM : noyau caudomédian ; NIf : noyau interface du nidopallium ; nXIIts : branche trachéosyringale du nerf hypoglosse XII ; RA : noyau robuste de l’arcopallium ; X : aire X.
Si on lèse expérimentalement ces aires cérébrales impliquées la production des vocalisations, les oiseaux deviennent incapables d’en émettre certaines (Figure 3) [3]. Les cellules dans ces aires cérébrales, ainsi que les cellules musculaires de la syrinx, expriment des récepteurs particuliers à certaines hormones stéroïdes, notamment la testostérone, la déhydrotestostérone et l’estradiol. En se fixant à leurs récepteurs, qui sont des facteurs de transcription agissant sur un vaste panel de gènes, ces hormones peuvent moduler l’expression des vocalisations. Les hormones stéroïdes sont produites de manière beaucoup plus importante avant la saison de reproduction par les gonades des oiseaux mâles et/ou femelles1. Ceci est dû à l’activation de l’axe hypothalamohypophysaire par l’augmentation de la durée de la photopériode. Les hormones stéroïdes produites au niveau des gonades circulent dans le sang et se fixent sur leurs organes cibles exprimant des récepteurs, ce qui module non seulement l’expression des vocalisations, mais également leurs structures acoustiques [4,5]. En plus des gonades, le cerveau des oiseaux lui-même est, chez de nombreuses espèces, un lieu de conversion des androgènes en œstrogènes, via l’enzyme aromatase. Ainsi, au niveau du noyau HVC, l’estradiol, produit à partir de la testostérone active la transcription de gènes dont certains codent des facteurs neurotrophiques (Brain Derived Neurotrophic Factors) agissant sur la croissance et la différenciation des neurones [4,6]. Lors de l’hiver dans les zones tempérées et boréales, la diminution de la photopériode induit une baisse de la production d’hormones. C’est pourquoi très peu d’oiseaux chantent en hiver, ou bien chantent plus rarement. Évidemment nous parlons ici des espèces sédentaires, qui ne migrent pas, ou d’espèces dont les lieux de migration se situent en France métropolitaine.
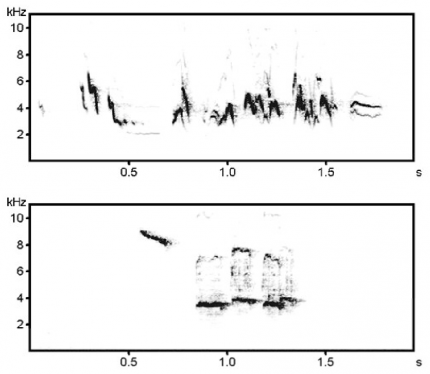
Chaque chant est représenté sous la forme d’un oscillogramme – en haut – et d’un spectrogramme – en bas. Enregistrements sonores extraits de [7] Marler & Slabbekoorn, 2004.
Comment les oiseaux entendent-ils et perçoivent-ils les vocalisations ? L’oreille des oiseaux est composé par un tympan (dissimulé par les plumes ; les oiseaux n’ont pas de pavillon externe), qui entre en vibration lorsque les ondes sonores arrivent à son contact. À l’arrière du tympan, se trouve un osselet, la columelle, qui transmet et amplifie les vibrations à une fenêtre en arrière de laquelle se situe la cochlée, structure comportant des cellules sensorielles mécanoréceptrices ciliées. Les mouvements des cils de ces cellules créent des potentiels d’actions, remontant le long des axones regroupés constituant le nerf auditif. Ces axones projettent dans des structures cérébrales qui, in fine, traiteront et décoderont les informations (Figure 2).
Diversité inter et intraspécifique dans le chant des oiseaux
La comparaison du chant de différentes espèces d’oiseaux permet de mettre en évidence une énorme diversité inter et intraspécifique des vocalisations. L’utilisation de logiciels adaptés de visualisation et d’analyse des sons1 révèle l’existence de deux grandes catégories de vocalisations : des vocalisations plutôt courtes, constituées d’un petit nombre d’unités sonores ou d’une seule unité, appelées cris, et des vocalisations plus longues constituées par plusieurs unités sonores différentes, nommées chants. Attardons-nous sur cette deuxième catégorie de vocalisations.
Du haut vers le bas : rouge-gorge familier, troglodyte mignon, fauvette à tête noire et alouette des champs (extrait). Chez ces quatre espèces, les chants sont constitués par l’enchaînement d’unités sonores différentes. Entre les quatre espèces, le nombre d’unités sonores différentes, les paramètres temporels et fréquentiels de ces unités sonores, les intervalles de temps entre les unités sonores, et la durée du chant, sont différents.
Documents à télécharger
De haut en bas et de gauche à droite : rouge-gorge familier (Erithacus rubecula), troglodyte mignon (Troglodytes troglodytes), fauvette à tête noire (Sylvia atricapilla), alouette des champs (Alauda arvensis).
Crédits : rouge-gorge : PierreSelim, CC BY-SA, Wikimedia ; troglodyte mignon : Agustín Povedano, CC BY-NC-SA, Flickr ; fauvette à tête noire : Agustín Povedano, CC BY-NC-SA, Flickr ; alouette des champs : Neil Smith, CC BY-SA, Wikimedia.
Lorsque l’on enregistre une fauvette à tête noire, une alouette des champs, un rouge-gorge familier, un troglodyte mignon (Figures 4 et 5), on constate, à l’oreille et en regardant les sonagrammes, que ces quatre oiseaux produisent des unités sonores différentes et agencées, structurées, de manières différentes. Ces différences sont utilisées par les ornithologues et les ornithophiles [8] pour identifier et distinguer les différentes espèces. Nous verrons plus loin que les oiseaux eux-mêmes utilisent ces différences, pour s’identifier à l’échelle spécifique.
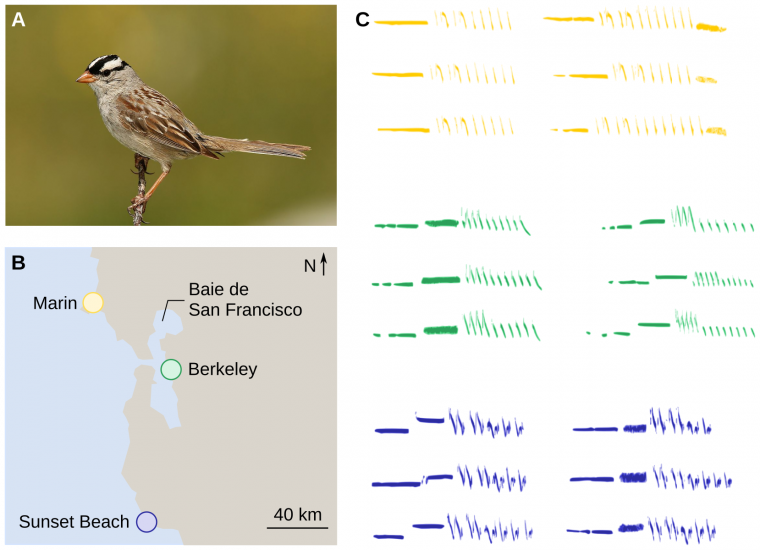
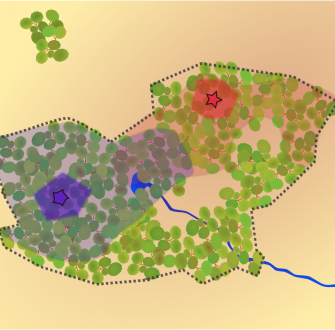
À l’échelle des populations, les vocalisations d’individus d’une même espèce sont plus semblables entre elles si elles sont produites par des individus d’une même population et proches géographiquement que si elles sont produites par des individus de populations différentes éloignées géographiquement. Les premières descriptions et études exhaustives de ce phénomène, reposant sur une analyse attentive des spectrogrammes1 ont été réalisées sur un bruant américain, le bruant à couronne blanche. Tout autour de la baie de San Francisco, dans des populations distantes de quelques dizaines de kilomètres, les oiseaux chantaient différemment (Figure 6). C’était la première description scientifique et documentée d’un dialecte chez les oiseaux [9].
A : Bruant à couronne blanche (Zonotrichia leucophrys). B : Localisation des trois populations de bruant à couronne blanche étudiées, autour de la baie de San Francisco (États-Unis). C : Spectrogrammes de chants de six individus différents, enregistrés dans chacune des trois populations.
Crédits : A : Wolfgang Wander, CC BY-SA, Wikimedia ; B : Pascal Combemorel, d'après Khartis, C : Pascal Combemorel, d'après Alcock [10].
Un dialecte correspond à la variation géographique d’une vocalisation, à plus ou moins grande distance. Lorsque les populations ou groupes d’oiseaux sont séparés par quelques kilomètres, on parle de microdialecte, ou de variation microgéographique, comme cela a été mis en évidence par exemple chez l’alouette des champs. Chez cet oiseau de milieu ouvert, les individus d’une même localité partagent des enchainements d’unités sonores, communs à toute la localité, que l’on n’enregistre pas chez des individus établis dans une autre localité – qui eux-mêmes partagent d’autres séquences d’unités sonores (Figure 7) [11].
Chaque unité sonore (ou syllabe) est identifiée par un nombre. Les trois individus partagent une séquence de syllabes (encadrée en rouge), et les individus 1 et 2 partagent une séquence de syllabes plus longue (encadrée en orange) (d’après [11]).
Les chants sont des vocalisations apprises par imitation
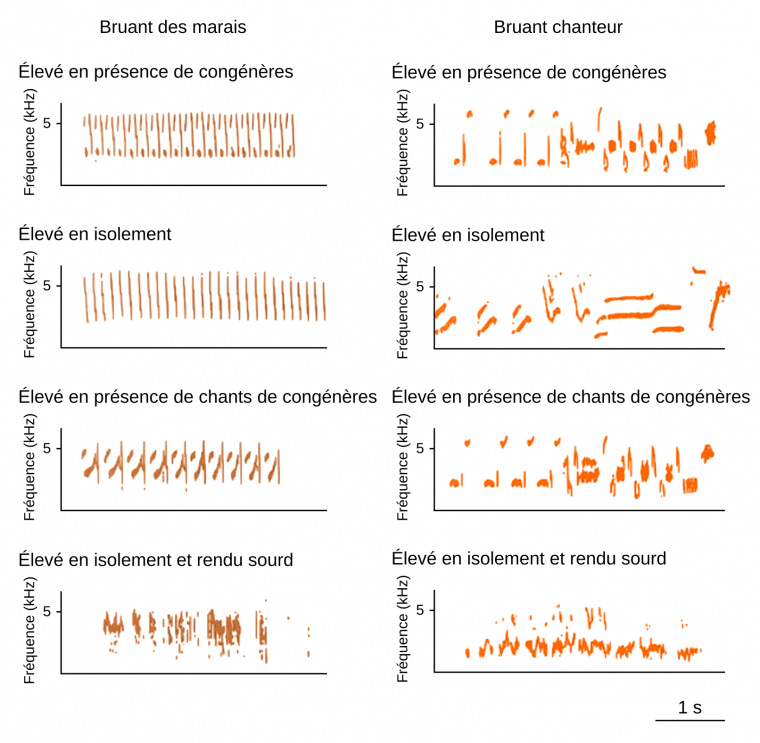
Après les premières observations et descriptions de phénomènes de dialectes chez les oiseaux, les scientifiques s’interrogèrent sur l’origine de ces dialectes et posèrent l’hypothèse que les variations géographiques observées dans les chants d’individus de la même espèce étaient, comme dans les dialectes humains, un phénomène culturel qui reposait sur la transmission des vocalisations par apprentissage. S’ensuivirent alors de nombreuses expériences, en conditions contrôlées de laboratoire afin de tester cette hypothèse. Peter Marler, notamment, travailla en captivité avec deux espèces de bruants : le bruant chanteur et le bruant des marais (espèces nord-américaines). Il fit tout d’abord la prédiction que si les chants étaient appris en copiant ceux des congénères, des oisillons élevés en l’absence de congénères ne développeraient pas un chant normal pour l’espèce. Il fit également la prédiction que les oiseaux privés d’audition, ne pouvant non seulement pas entendre des congénères, et ne pouvant pas non plus s’entendre eux-mêmes vocaliser, ne développeraient pas un chant normal. Une dernière prédiction était que des oisillons élevés en l’absence de congénères, mais en présence de chants de congénères, via leur diffusion par haut-parleur, développeraient des chants ressemblant aux chants de l’espèce. Toutes ces prédictions furent validées (Figure 8) [12,13] puis sur la base d’autres expériences en laboratoire, généralisées : les oiseaux produisent à l’âge adulte un chant appris par imitation d’un ou plusieurs chants tuteurs.
Les oiseaux élevés en isolement total et ne pouvant pas eux-mêmes s’entendre produisent, à l’âge adulte, des vocalisations sans syntaxe et au sein desquelles aucune unité sonore n’est distinguable. Les oiseaux élevés en présence de chants de congénères ont un répertoire vocal (nombre de syllabes différentes) significativement supérieur aux oiseaux élevés en isolement. Les effets de la diffusion artificielle de chants de congénères sont différents entre le bruant des marais et le bruant chanteur. Chez le bruant des marais, les effets de l’isolement sont plus importants que chez le bruant chanteur. Les capacités d’apprentissage vocal sont aussi liées à la présence de contacts tactiles et visuels.
Les tuteurs sont généralement les parents des oiseaux. L’apprentissage a lieu pendant une période sensible, temporellement bornée, et constituée de deux phases qui peuvent partiellement se chevaucher ou non. Au cours de la phase sensorielle, un chant tuteur doit être entendu par le jeune oisillon – sans cela il ne développera pas de chant normal à l’âge adulte. Pendant la phase sensorimotrice, le jeune oiseau s’exerce et produit des vocalisations variables et plastiques, comparant ce qu’il s’entend produire à ce qu’il a mémorisé comme chant à copier. Cette phase sensorimotrice s’achève par la cristallisation des vocalisations, c’est-à-dire par leur expression structurée et définitive1 [14]. Les capacités d’apprentissage dépendent également de contraintes innées : un jeune oiseau ne peut pas apprendre n’importe quelle vocalisation, il existe des contraintes anatomiques et neurophysiologiques.
Parallèlement, les chercheurs se sont intéressés au substrat neurobiologique de ces apprentissages et ont mis en évidence des structures cérébrales particulières dans le cerveau des oiseaux chanteurs, contrôlant spécifiquement l’apprentissage des vocalisations (Figure 2). Si ces structures sont lésées pendant la période sensible, les jeunes oiseaux deviennent incapables d’apprendre à produire des vocalisations ou incapables de les cristalliser [15]. Par ailleurs ces noyaux contiennent des neurones auditifs spécifiquement activés par l’audition de vocalisations modèles, puis par les propres vocalisations de l’oiseau [16]. On observe également une plasticité dans les noyaux du chant pendant le développement de celui-ci : établissement de connexions nerveuses entre ces structures [17], incorporation de nouveaux neurones, même à l’âge adulte [18], expression de récepteurs aux hormones par les cellules nerveuses et expression de certains gènes spécifiquement pendant la période de mise en place [17].
Tous les oiseaux chantent-ils ?
Toutes les vocalisations ne nécessitent pas un apprentissage préalable pour être produites. En effet si on isole un jeune diamant mandarin (petit passereau endémique d’Australie et d’Indonésie, devenu animal domestique et modèle de laboratoire) et qu’il ne peut entendre pendant son développement ni les vocalisations de son espèce, ni les siennes, il produira tout de même à l’âge adulte certaines vocalisations de son répertoire spécifique, tout en étant incapable d’en émettre d’autres. Un tel individu produira ainsi différentes vocalisations courtes, que l’on nomme cris, constituées par un unique élément sonore, mais pas de chant constitué par l’enchaînement d’unités sonores différentes dans une même séquence (Figure 9) [19].
Première ligne : vocalisations produites par les jeunes, seconde ligne : vocalisations produites par les adultes pendant des comportements affiliatifs (liens sociaux), troisième ligne : vocalisations produites par les adultes dans des contextes agressifs ou d’alerte, quatrième ligne : le chant, vocalisation apprise et produite uniquement par les mâles adultes (d’après [20]).
Par ailleurs, si l’on réalise la même expérience avec un moucherolle phébi, celui-ci sera à l’âge adulte capable de produire l’ensemble des vocalisations de son répertoire spécifique [21]. Chez la poule1, la caille japonaise, ou la tourterelle, de même, isoler les jeunes oiseaux de leurs congénères ne les empêchera pas de produire à l’âge adulte les cris de leur espèce [22-24].
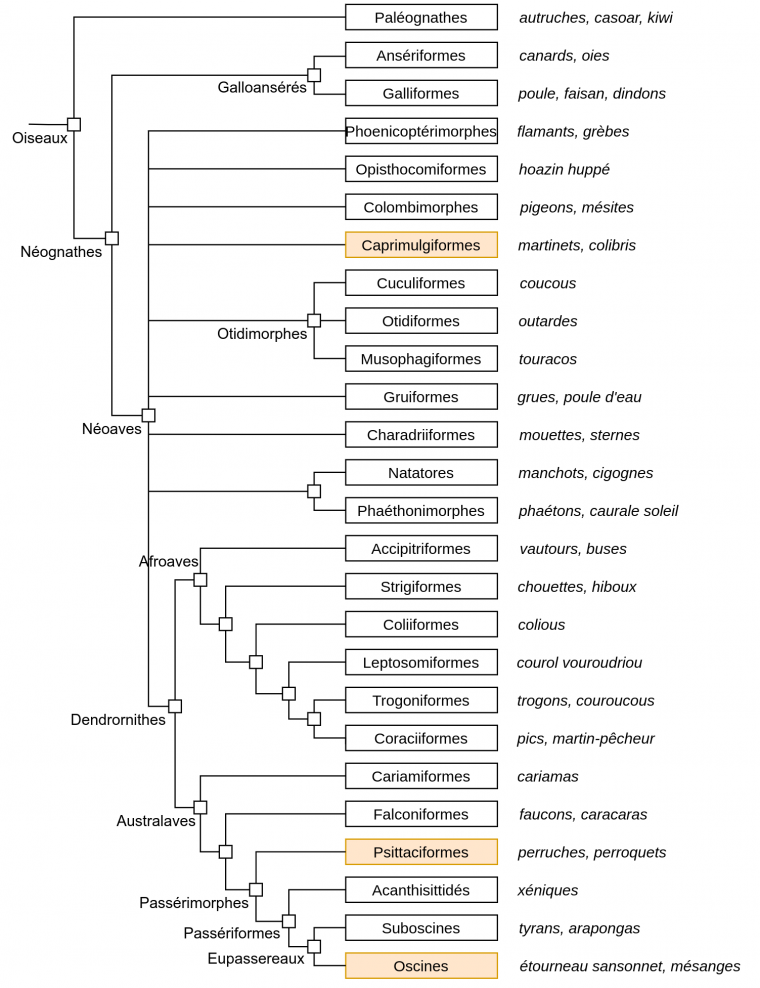
Ainsi, pour être produites à l’âge adulte, certaines vocalisations, en général de longue durée et constituées par l’enchaînement d’unités sonores différentes, doivent être apprises par imitation, et d’autres, non. Ces vocalisations sont appelées chants et existent dans 3 groupes d’oiseaux : les oiseaux chanteurs, ou Oscines2, les Psittaciformes (perroquets et perruches), et les Trochiliformes (colibris) qui, ensemble, représentent plus de la moitié des espèces actuelles d’oiseaux. Des structures cérébrales particulières contrôlant l’apprentissage des vocalisations ont été retrouvées dans toutes les espèces étudiées de ces trois groupes [25]. De telles structures n’existent pas chez les oiseaux produisant des vocalisations sans apprentissage préalable, comme le moucherolle phébi (Suboscine), la poule ou la caille (Galliforme), ou la tourterelle (Colombimorphe). La position dans l’arbre phylogénétique des Oiseaux de ces trois groupes suggère fortement une apparition convergente de la capacité à produire des vocalisations apprises par imitation (Figure 10).
Le caractère « production de vocalisations apprises par imitation » existe chez trois taxons, représentés en orange : les Trochiliformes (au sein des Caprimulgiformes), les Psittaciformes et les Oscines.
Pour résumer, les chants peuvent être définis comme des vocalisations particulières, composées par des unités sonores différentes, nommées notes ou syllabes, organisées selon une certaine syntaxe, apprises par imitation, par des oiseaux possédant un substrat neurobiologique particulier indispensable à l’apprentissage. L’observation et l’écoute des oiseaux ont montré que les chants peuvent être produits par les mâles et les femelles, de manière individuelle, ou en duos, ou seulement par les mâles. Cela dépend des espèces et de leur origine géographique : on trouve chez les espèces d’Oscines non migratrices de régions tropicales beaucoup plus d’espèces où les mâles et les femelles chantent, que dans les régions tempérées où le chant femelle semble plus rare. Par exemple, chez les merles noirs, les troglodytes mignons, les alouettes des champs, seuls les mâles adultes et subadultes chantent1. Alors que chez le rouge-gorge familier, mâles et femelles chantent (Figure 11). Une revue intensive récente de la littérature a mis en évidence que des chants sont produits par les femelles chez 70 % des espèces d’oiseaux chanteurs et des reconstitutions phylogénétiques montrent que l’état ancestral chez les Oscines était la présence de chant chez les deux sexes [27] : le chant n’est donc pas une innovation évolutive des mâles, mais une perte secondaire chez les femelles de certaines espèces. On peut ici faire remarquer les facteurs à l’origine de cet « oubli » du chant des oiseaux femelles dans les travaux et dans la littérature scientifique. Tout d’abord, les espèces les plus étudiées initialement étaient des espèces de milieux tempérés chez qui le chant femelle est plus rare ; les études d’espèces tropicales, chez qui le chant femelle est plus fréquent, ne se sont développées que plus récemment. De plus, dans de nombreuses espèces chez qui mâles et femelles chantent, les deux sexes sont monomorphiques et il est impossible de les distinguer visuellement, de sorte que les chants sont attribués a priori aux mâles. Par ailleurs, chez de nombreuses espèces, les femelles chantent moins abondamment que les mâles. Vinciane Despret note que la manière de voir le chant des oiseaux, et de s’interroger sur sa présence et ses fonctions, a été en partie modifiée sous l’impulsion de femmes scientifiques, qui ont peu à peu elles-mêmes été plus nombreuses, et plus écoutées [28].
Pourquoi les oiseaux chantent-ils ?
La défense du territoire
Beaucoup d’espèces d’oiseaux chanteurs sont territoriales : elles défendent un espace contenant des ressources (nourriture, abri, espace lié à la reproduction et la nidification…). Les individus signalent leur présence sur leurs territoires par différents comportements : manifestations visuelles (postures, mouvements) et manifestations sonores, notamment. Si les intrus persistent dans leur présence sur le territoire, les interactions peuvent être plus directes : comportements d’approche, de menace, attaques physiques… La première démonstration expérimentale du rôle des chants dans la défense territoriale a été réalisée par Krebs, sur le terrain, chez des mésanges charbonnières [29]. Chez cette espèce, seuls les mâles chantent, et chaque individu produit plusieurs types de chants, constitués par des syllabes différentes. Lorsqu’on les observe attentivement, on note que les mâles occupent des endroits particuliers où ils chantent de manière répétée, que l’on peut appeler postes de chant. On peut cartographier et délimiter un espace en faisant se rejoindre les différents points de postes de chant. Les chercheurs ont placé dans ces espaces des haut-parleurs, après avoir préalablement capturé et gardé précieusement à l’écart les individus qui les occupaient. Les haut-parleurs diffusaient soit un seul type de chant de mésange charbonnière, soit plusieurs types de chants, soit rien du tout (témoin silencieux). Le temps au bout duquel d’autres mésanges charbonnières étaient visibles et présentes sur le territoire était noté. Les résultats ont clairement montré que les territoires étaient réoccupés beaucoup moins rapidement si un haut-parleur diffusait un type de chant de mésange charbonnière, et encore moins rapidement s’il en diffusait plusieurs. Ainsi les chants contribuent à la défense du territoire, et plus ils sont variés, plus leurs effets sont importants.
Par contre, si l’on diffuse les chants d’individus d’une autre espèce, on observe les mêmes résultats qu’avec le témoin silencieux. Cela indique d’une part que le chant d’un oiseau porte en lui une information sur l’identité spécifique de l’émetteur et d’autre part que la défense du territoire est avant tout dirigée vers les individus de la même espèce, qui sont en compétition pour l’accès aux mêmes ressources. On parle de « signature spécifique » : des paramètres acoustiques particuliers, propres à l’espèce, codent un message sur l’identité spécifique dans le signal. Par exemple, chez l’alouette des champs, il a été montré que c’était le rythme, et le rapport son/silence qui étaient utilisés par les alouettes pour reconnaître une autre alouette [30].
En plus de l’identité spécifique, d’autres informations sont codées, décodées et interprétées dans les chants des oiseaux. Par exemple, le microdialecte utilisé par l’émetteur peut signer sa localité géographique d’origine. Chez l’alouette des champs, de nouveau, les microdialectes permettent aux individus d’une même localité de se reconnaître entre eux et constituent ainsi une sorte de mots de passe commun à tous les voisins. Lorsqu’on diffuse à un mâle établi dans son territoire (i) le chant d’un individu voisin, (ii) le chant d’un individu « étranger » établi dans un territoire éloigné de quelques kilomètres ou (iii) le chant de cet individu étranger artificiellement orné de séquences de syllabes partagées par les voisins – un chant chimérique en quelque sorte – les résultats des observations des réponses comportementales de l’oiseau testé sont très claires : le niveau d’agressivité suscité par un chant étranger est supérieur à celui d’un chant voisin, et un chant chimérique suscite le même faible niveau de réponses agressives qu’un chant voisin. Ainsi chez l’alouette des champs, il y a une tolérance vis-à-vis des voisins, établis dans des territoires proches, et représentant probablement une menace moins importante que celle d’individus inconnus peut-être à la recherche d’un territoire. Ce comportement de tolérance des voisins a été appelé phénomène du cher-ennemi [31]. Il passe par l’identification et la reconnaissance des voisins, via les messages codés dans le chant de proclamation territoriale [10]. Il a également été montré que dans ces séquences de syllabes partagées, l’ordre des syllabes était important : les mots de passe sont mémorisés avec une certaine syntaxe, qui doit être conservée pour que l’information soit décodée [32].
Chez le troglodyte mignon, à l’inverse de l’alouette des champs, l’information dans les chants sur l’identité des voisins conduit les mâles territoriaux à attaquer de manière significativement plus agressive un haut-parleur diffusant le chant d’un individu voisin qu’un haut-parleur diffusant le chant d’un individu étranger en début de saison de reproduction, puis à être également agressif envers un chant voisin et un chant étranger pendant le reste de la saison [33]. Chez cette espèce, le codage de l’information semble porté par l’intégralité du chant, qui est court, et non par des séquences particulières du chant. Ainsi chez les oiseaux, selon les espèces, les individus voisins peuvent être ou non considérés comme des « chers-ennemis » [31], en fonction de la pression qu’ils exercent sur les territoires de leurs voisins, ou sur les partenaires de leurs voisins, et leur identification passe par l’écoute et l’interprétation de leurs chants.
D’autres analyses acoustiques ont montré que les chants des alouettes comportent également des séquences de syllabes propres à chaque individu, qui n’existent pas dans les chants des individus voisins et constituent donc une sorte de signature individuelle. Parallèlement, une expérience de diffusion de chants a été réalisée pour tester l’hypothèse selon laquelle les individus s’identifient individuellement. Le principe est le suivant : un haut-parleur diffusant le chant du voisin de droite est placé du côté du voisin de droite, et ensuite de l’autre côté (c’est-à-dire à un endroit d’où il n’est pas attendu d’entendre le voisin de droite). Comment répondent les oiseaux ? Ils manifestent plus de comportements de défense territoriale (approche du haut-parleur, déplacements, cris, chants…) en réponse au chant d’un voisin diffusé d’un côté ne correspondant pas à l’emplacement de son territoire. Ainsi, les alouettes des champs, par le chant, identifient individuellement leurs voisins et répondent plus agressivement lorsqu’est mimée une situation où le voisin a bougé de son territoire, situation reflétant potentiellement des velléités d’intrusion territoriale [34].
Outre des informations sur leur identité, les oiseaux codent aussi des informations sur leur état émotionnel dans leurs chants. Si l’on reprend l’exemple de l’alouette, les mâles chantent légèrement différemment lorsqu’ils chantent de manière spontanée, au-dessus de leurs territoires1, et lorsqu’ils chantent en réponse à une intrusion territoriale : dans ce dernier cas ils produisent plus de syllabes de basse fréquence, plus de syllabes par unités de temps, et répètent la structure acoustique avec plus de précision [35]. Ces paramètres acoustiques pourraient ainsi être utilisés pour moduler les échanges entre individus.
Ces relations chantées entre individus du même sexe, ici des mâles, dans le cadre d’une affirmation de présence sur un territoire participent à la compétition intrasexuelle, et aux relations entre voisins. Elles existent également entre individus de sexe opposé, dans l’autre cadre de la sélection sexuelle : les relations d’attraction et de séduction intersexuelles.
La reproduction
Le comportement des femelles n’est pas facile à tester en conditions naturelles. En effet, contrairement aux mâles qui, dans le cadre de relations de compétition, effectuent des réponses comportementales démonstratives, les femelles tendent à être discrètes, sauf si elles chantent et défendent elles-mêmes le territoire. Néanmoins des expériences pionnières ont montré chez un certain nombre d’espèces cavicoles que les chants des mâles attiraient les femelles, en utilisant un protocole un peu similaire à celui utilisé pour tester la fonction des chants dans les relations territoriales entre mâles. Chez le gobemouche noir, le gobemouche à collier, ou l’étourneau sansonnet, un haut-parleur placé à proximité d’un nichoir diffusant un chant de mâle attirait significativement plus de femelles non appariées qu’un haut-parleur muet ou diffusant un son témoin [36,37].
En raison de la difficulté à tester les comportements des femelles sur le terrain, comprendre comment les chants des mâles participent à la stimulation des femelles passe souvent par des études corrélatives indirectes entre des caractéristiques des chants des mâles et des estimations de succès de reproduction (date de l’appariement, durée de l’appariement, nombre d’œufs pondus, survie des jeunes…). Ainsi, il a été montré chez de très nombreuses espèces que les individus mâles ayant de grands répertoires (plus de syllabes ou plus de types de chants) étaient significativement plus fréquemment appariés (voir [38] pour une revue). La taille du répertoire est par ailleurs corrélée chez de nombreuses espèces avec l’âge, la condition physique du mâle, et la survie des jeunes. Il est ainsi possible que les femelles perçoivent dans les chants des indications sur la qualité des mâles et que cela participe au choix de leur partenaire.
Des études en laboratoire ont aussi été effectuées : des femelles mésanges charbonnières, préalablement mises sous traitement hormonal stéroïdien stimulant la réceptivité sexuelle étaient soumises à la diffusion par haut-parleurs de plusieurs chants différant par le nombre de types de chants. Les réponses comportementales des femelles, estimées en mesurant le nombre de postures de sollicitation de l’accouplement étaient positivement corrélés au nombre de types de chants différents dans les signaux diffusés [39]. Chez une autre espèce, le canari domestique également étudié en laboratoire1, les femelles préfèrent des chants de mâle incluant des syllabes particulières, qualifiées a posteriori de syllabes sexy par les auteurs de ces études [40]. Ces syllabes particulières sont caractérisées par une large bande fréquentielle entre le début et la fin de la syllabe (une forte modulation de fréquence) et un taux de répétition important. De manière tout à fait intéressante, il a été montré que ces syllabes sexy étaient mécaniquement difficiles à produire par la syrinx, et que leurs caractéristiques tendaient vers les limites de l’organe vocal [41]. Ainsi, les femelles préfèrent des parties de chant difficiles à produire, qui peuvent refléter des qualités physiques et d’apprentissage particulières chez les mâles. Il a aussi été montré, en modifiant artificiellement certains paramètres acoustiques des chants, que cette préférence résultait d’un biais sensoriel chez les femelles : elles sont séduites par des valeurs exagérées de bande de fréquence et de taux de répétition, en dehors de la gamme de production réelle des mâles [42]. C’est l’existence de telles préférences qui mène, par sélection sexuelle, à l’évolution des caractéristiques des chants des mâles. L’évolution de ces caractéristiques est toutefois contrainte par les structures préexistantes et nécessaires au chant (syrinx, structures cérébrales…) ainsi que par celles nécessaires à la réception de ce chant (oreille interne).
Outre des informations sur la qualité des mâles, les chants renferment d’autres informations importantes pour les femelles, permettant la reconnaissance de l’espèce, ou de la population, via les dialectes. Tout d’abord, il a été montré que les femelles sont plus sensibles à des chants familiers, comme les chants ressemblant à ceux de leurs pères [43]. Par exemple chez le diamant mandarin2, dans un dispositif ingénieux dans lequel l’oiseau captif déclenche la diffusion d’un chant en se posant sur des perchoirs, les femelles s’installaient significativement plus sur le perchoir déclenchant la diffusion du chant de leurs pères, ou d’un chant ressemblant à celui de leurs pères [43]. Ainsi, pendant la période d’écoute et d’imprégnation des jeunes oisillons, les femelles, chez les espèces où elles ne chantent pas, peuvent apprendre les caractéristiques des chants de leur espèce, et de leurs populations. Une fois adultes, chez de nombreuses espèces, les femelles préfèrent les dialectes locaux, comme cela a été montré par exemple chez le bruant chanteur [44], ou un autre bruant de milieu tropical lui, le bruant chingolo [45]. Ainsi, le chant peut participer à l’isolement reproducteur précopulatoire, souvent en combinaison avec d’autres facteurs (dispersion des individus, réponses territoriales des mâles aux chants d’autres dialectes, influence de l’environnement sur la structure acoustique des chants…). Cela peut même aller jusqu’à la spéciation. Tout autour du plateau himalayen, il existe un cercle de sous-espèces de pouillots verdâtres (Phylloscopus trochiloides), dont les études bioacoustiques et génétiques ont montré que le moteur de la spéciation était la dérive culturelle du chant [46,47].
Les oiseaux apprennent à chanter, chantent et communiquent différents messages qui contribuent à la valeur sélective des individus. Quels sont les facteurs écologiques influençant les chants ayant contribué à leurs mises en place et leurs maintiens dans l’environnement ?
Les facteurs écologiques influençant les chants
Chaque oiseau émetteur chante dans un certain environnement, un certain milieu. Certaines espèces occupent un habitat plutôt forestier, et dans différentes strates de la forêt, d’autres vivent en milieu ouvert. Chaque environnement, chaque écosystème peut avoir des influences physiques différentes sur les signaux acoustiques et leur propagation, qui vont avoir un effet direct sur la distance de transmission du signal, et donc potentiellement sur la distance de transmission des messages. En particulier, dans les milieux forestiers, le couvert de la végétation, les feuilles, les troncs d’arbres et les branches constituent autant d’obstacles qui réfractent et réfléchissent les ondes sonores et modifient la structure des signaux acoustiques originels par des phénomènes d’écho – comblement des intervalles de temps entre les unités sonores – et de filtration sélective des fréquences, notamment des hautes fréquences [48]. De plus l’intensité du signal acoustique qui se propage dans l’environnement s’atténue avec la distance de propagation, en fonction de l’absorption atmosphérique et de la structure de la végétation. Par exemple, un air chaud et sec augmente la transmission des sons, et un feuillage dense augmente l’atténuation. Les facteurs météorologiques tels la pluie ou le vent influencent également la transmission des signaux sonores. De ces principes physiques découlent les prédictions que les signaux envoyés dans un environnement donné seront adaptés à la transmission dans cet environnement : c’est l’hypothèse de l’adaptation acoustique [49].
En effet l’ensemble de ces facteurs exercent des pressions de sélection sur les systèmes de communication, et dans la mesure où ces communications participent à la valeur sélective des individus en ayant des conséquences sur leur survie ou leur reproduction, la sélection naturelle agit sur les systèmes de communication aux différentes étapes de la chaine de transmission de l’information. Si l’on regarde l’ensemble des études sur ces sujets, il y a bel et bien un effet global du couvert végétal sur les paramètres fréquentiels du chant, en particulier sur les valeurs des fréquences de plus forte intensité (fréquence pic), qui sont plus basses chez les espèces vivant en milieu fermé que chez les espèces vivant en milieu ouvert [50]. On observe ainsi des signaux présentant des structures convergentes entre espèces d’oiseaux chanteurs éloignées phylogénétiquement mais occupant des habitats similaires, et des signaux divergents chez des espèces phylogénétiquement proches mais occupant des habitats différents (voir [51] pour une revue).
Il faut cependant garder à l’esprit que d’autres facteurs exercent des pressions de sélection sur les signaux acoustiques, comme les relations interspécifiques (les prédateurs et les parasites peuvent être attirés par les manifestations sonores) ainsi que les contraintes biomécaniques et physiologiques s’exerçant sur la production et la réception des signaux. Il faut aussi se souvenir que les adaptations peuvent être comportementales : l’utilisation de postes de chants ou d’écoute, surélevés, augmente l’efficacité dans la transmission ou la réception des chants. Enfin, il faut bien comprendre que si le signal est le support physique de l’information, celle-ci n’est codée que dans certains paramètres. Ce sont donc ces paramètres, et non pas l’ensemble du signal, qui sont adaptés à la transmission de l’information. Par exemple, le troglodyte mignon, parce qu’il est un des plus petits passereaux européens3 et que son appareil vocal est allométriquement lui aussi de très petite taille, chante un chant très aigu constitué par une succession très rapide de notes modulées en fréquence. Pourtant, cet oiseau vit dans les sous-bois, où son chant aigu semble à première vue (à première écoute !) mal adapté du fait de la filtration des hautes fréquences par la végétation. Mais les paramètres physiques de son chant codant l’information spécifique sont la modulation de fréquence, et le rythme d’émission des notes, paramètres acoustiques qui ne sont pas dégradés par leur propagation dans un milieu de sous-bois encombré d’obstacles. D’autre part, le troglodyte se perche pour chanter, et pour écouter le chant des intrus [52] !
Conclusion
Les chants des oiseaux, produits après apprentissage, constituent des cultures. Leurs architectures syntaxiques complexes portent de multiples informations (sur l’espèce, sur la population, sur l’individu…) permettant communication et interrelations, en particulier en contexte reproducteur. Le milieu exerce des contraintes sur leurs paramètres physiques, et d’autres facteurs de sélection, en particulier de sélection sexuelle, ont agi sur leur évolution. Il est possible de les comprendre grâce à des approches et méthodologies scientifiques croisées et à différentes échelles, depuis la cellule jusqu’à l’écosystème : anatomie, neurobiologie et neurophysiologie, physique du son, génétique… Les oiseaux sont des virtuoses qui émerveillent et inspirent aussi les esprits naturalistes, poètes, musiciens, curieux. Ils constituent également des morceaux, des strates, des éléments important des paysages sonores, et font partie intégrante de la biophonie et de nos univers perceptifs. En 2020, les activités humaines générant bruits et anthropophonie polluante se sont interrompues pendant de nombreuses semaines, et les humains ont pu redécouvrir – souvent avec surprise et joie – leurs oreilles et prêter attention aux sons des autres vivants, en particulier aux chants et aux cris des oiseaux. Pourtant, depuis plusieurs décennies, les populations d’oiseaux deviennent de moins en moins abondantes, comme le montrent les indicateurs de biodiversité. Comme l’écrit si bien Marielle Macé, « les oiseaux non-chantent notre monde abîmé. Leur extinction en effet bruisse, accuse, témoigne : elle chante le souvenir, le deuil ou l’imagination d’une terre bien traitée. Chants et non-chants, paysages de disparitions, gémissement muet des eaux… il y a en effet beaucoup à entendre. Ce n’est pas seulement que les choses du monde se soient tues, qu’elles se taisent et fassent entendre qu’elles se taisent, c’est aussi qu’on n’écoute pas très bien » [53]. Alors écoutons-les.
Références
Articles scientifiques
[1] Reiner, A., Perkel, D. J., Mello, C. V., & Jarvis, E. D. (2004). Songbirds and the revised avian brain nomenclature. Annals of the New York Academy of Sciences, 1016, 77–108. https://doi.org/10.1196/annals.1298.013
[2] Marler, P., & Doupe, A. J. (2000). Singing in the brain. Proceedings of the National Academy of Sciences, 97(7), 2965-2967.
[3] Nottebohm, F., Stokes, T.M., & Leonard, C.M. (1976). Central control of song in the canary, Serinus canarius. Journal of Comparative Neurology, 165(4), 457-486. doi:10.1002/cne.901650405
[4] Fusani, L., Metzdorf, R., Hutchison, J.B., & Gahr, M. (2003). Aromatase inhibition affects testosterone-induced masculinization of song and the neural song system in female canaries. Journal of Neurobiology,I(2), 370-379. doi:10.1002/neu.10141
[5] Alward, B.A., Cornil, C.A., Balthazart, J., & Ball, G.F. (2018). The regulation of birdsong by testosterone: Multiple time-scales and multiple sites of action. Horm Behav. 104,32-40. doi:10.1016/j.yhbeh.2018.04.010
[6] Dittrich, F., Feng, Y., Metzdorf, R., & Gahr, M. (1999). Estrogen-inducible, sex-specific expression of brain-derived neurotrophic factor mRNA in a forebrain song control nucleus of the juvenile zebra finch. Proceedings of the National Academy of Sciences, 96(14), 8241-8246.
[7] Marler, P. R., & Slabbekoorn, H. (2004). Nature's music: the science of birdsong. Elsevier.
[8] Raphoz, F. (2018). Parce que l’oiseau. Editions Corti.
[9] Marler, P., & Tamura, M. (1962). Song "Dialects" in Three Populations of White-Crowned Sparrows. The Condor,64(5), 368-377. doi:10.2307/1365545
[10] Alcock, J. (2009). Animal behavior: An evolutionary approach. Sinauer Associates.
[11] Briefer, E., Aubin, T., Lehongre, K., & Rybak, F. (2008). How to identify dear enemies: the group signature in the complex song of the skylark Alauda arvensis. Journal of Experimental Biology, 211(3), 317-326.
[12] Marler, P., & Sherman, V. (1983 ). Song structure without auditory feedback: emendations of the auditory template hypothesis. Journal of Neuroscience, 3, 517 – 531.
[13] Marler, P., & Sherman, V. (1985). Innate differences in singing behaviour of sparrows reared in isolation from adult conspecific song. Animal Behaviour, 33(1), 57-71.
[14] Marler, P. (2004). Science and birdsong: the good old days. In: Nature's music: the science of birdsong (Marler, P. R., & Slabbekoorn, H. , eds), Elsevier, pp 1-37
[15] Scharff, C., & Nottebohm, F. (1991). A comparative study of the behavioral deficits following lesions of various parts of the zebra finch song system: implications for vocal learning. Journal of Neuroscience, 11(9), 2896-2913. doi:10.1523/JNEUROSCI.11-09-02896.1991
[16] Solis, M. M., & Doupe, A. J. (1997). Anterior forebrain neurons develop selectivity by an intermediate stage of birdsong learning. Journal of Neuroscience, 17(16), 6447-6462.
[17] Gahr, M. (2007). Sexual differentiation of the vocal control system of birds. Advances in genetics, 59, 67-105.
[18] Goldman, S. A., & Nottebohm, F. (1983). Neuronal production, migration, and differentiation in a vocal control nucleus of the adult female canary brain. Proceedings of the National Academy of Sciences, 80(8), 2390-2394.
[19] Immelmann, K. (1969).Song development in the zebra finch and other estrildid finches. In: Bird Vocalizations (Hinde, R. A., ed.). Cambridge Univ. Press, Cambridge, pp. 64—74.
[20] Elie, J.E., & Theunissen, F.E. (2016). The vocal repertoire of the domesticated zebra finch: a data-driven approach to decipher the information-bearing acoustic features of communication signals. Animal Cognition,19,285–315. https://doi.org/10.1007/s10071-015-0933-6
[21] Kroodsma, D. E., & Konishi, M. (1991). A suboscine bird (eastern phoebe, Sayornis phoebe) develops normal song without auditory feedback. Animal Behaviour, 42(3), 477-487.
[22] Derégnaucourt, S., Saar, S., & Gahr, M. (2009). Dynamics of crowing development in the domestic Japanese quail (Coturnix coturnix japonica). Proceedings of the Royal Society B: Biological Sciences, 276(1665), 2153-2162.
[23]Konishi, M. (1963). The Role of Auditory Feedback in the Vocal Behavior of the Domestic Fowl. Zeitschrift für Tierpsychologie, 20(3), 349-367.
[24] Nottebohm, F., & Nottebohm M. (1971). Vocalizations and breeding behaviour of surgically deafened ring doves (Streptopelia risoria). Animal Behaviour, 19, 313–327.
[25] Jarvis, E. D., Ribeiro, S., da Silva, M. L., Ventura, D., Vielliard, J., & Mello, C. V. (2000). Behaviourally driven gene expression reveals song nuclei in hummingbird brain. Nature, 406(6796), 628–632. https://doi.org/10.1038/35020570
[26] Lecointre, G., & Le Guyader, H. (2017). Classification phylogénétique du vivant. 4éd. Belin, Paris: France.
[27] Odom, K. J., Hall, M. L., Riebel, K., Omland, K. E., & Langmore, N. E. (2014). Female song is widespread and ancestral in songbirds. Nature Communications, 5(1), 1-6.
[28] Despret, V. (2019). Habiter en oiseau. Éditions Actes Sud.
[29] Krebs, J.R. (1977). Song and territory in the Great tit Parus major. In: Evolutionary Ecology (Stonehouse B., Perrins C., eds). Palgrave, London, pp. 47-62
[30] Aubin, T., & Bremond, J. C. (1983). The Process of Species‐specific Song Recognition in the Skylark Alauda arvensis. An Experimental Study by Means of Synthesis. Zeitschrift für Tierpsychologie, 61(2), 141-152.
[31] Temeles, E. J. (1994). The role of neighbours in territorial systems: when are they 'dear enemies'? Animal Behaviour, 47(2), 339-350.
[32] Briefer, E. F., Rybak, F., & Aubin, T. (2013). Does true syntax or simple auditory object support the role of skylark song dialect? Animal Behaviour, 86(6), 1131-1137.
[33] Courvoisier, H., Camacho-Schlenker, S., Aubin, T. (2014). When neighbours are not “dear enemies”: a study in the winter wren Troglodytes troglodytes. Animal Behaviour, 90, 229-235.
[34] Briefer, E., Aubin, T., & Rybak, F. (2009). Response to displaced neighbours in a territorial songbird with a large repertoire. Naturwissenschaften, 96(9), 1067-1077.
[35] Geberzahn, N., & Aubin, T. (2014). Assessing vocal performance in complex birdsong: a novel approach. BMC biology, 12(1), 1-9.
[36] Eriksson, D., & Wallin, L. (1986). Male bird song attracts females — a field experiment. Behavioral Ecology and Sociobiology,19,297–299. https://doi.org/10.1007/BF00300645
[37] Mountjoy, D.J., & Lemon, R.E. (1991). Song as an attractant for male and female European starlings, and the influence of song complexity on their response. Behavioral Ecology and Sociobiology,28, 97–100. https://doi.org/10.1007/BF00180986
[38] Collins, S. (2004). Vocal fighting and flirting: the functions of birdsong. In: Nature’s music: the science of birdsong, (Marler, P. R., & Slabbekoorn, H. , eds), Elsevier, pp 39-79.
[39] Baker, M., Bjerke, T., Lampe, H., & Espmark, Y. (1986). Sexual Response of Female Great Tits to Variation in Size of Males' Song Repertoires. The American Naturalist,128(4), 491-498.
[40] Vallet, E., & Kreutzer, M. (1995). Female canaries are sexually responsive to special song phrases. Animal Behaviour, 49(6), 1603-1610.
[41] Podos, J. (1996). Motor constraints on vocal development in a songbird. Animal Behaviour, 51(5), 1061-1070.
[42] Drăgănoiu, T. I., Nagle, L., & Kreutzer, M. (2002). Directional female preference for an exaggerated male trait in canary (Serinus canaria) song. Proceedings of the Royal Society of London. Series B: Biological Sciences, 269(1509), 2525-2531.
[43] Riebel, K., Smallegange, I. M., Terpstra, N. J., & Bolhuis, J. J. (2002). Sexual equality in zebra finch song preference: evidence for a dissociation between song recognition and production learning. Proceedings of the Royal Society of London. Series B: Biological Sciences, 269(1492), 729-733.
[44] Searcy, W. A., Nowicki, S., Hughes, M., & Peters, S. (2002). Geographic song discrimination in relation to dispersal distances in song sparrows. The American Naturalist, 159(3), 221-230.
[45] Danner, J.E., Danner, R.M., Bonier, F., Martin, P.R., Small, T.WW, & Moore, I.T. (2011). Female, but not male, tropical sparrows respond more strongly to the local song dialect: implications for population divergence. The American Naturalist, 178(1), 3-63. doi:10.1086/660283
[46] Irwin, D. E., Bensch, S., & Price, T. D. (2001). Speciation in a ring. Nature, 409, 333–337.
[47] Irwin, D. E., Bensch, S., Irwin, J. H., & Price, T. D. (2005). Speciation by distance in a ring species. Science, 307, 414–416.
[48] Bradbury, J. W., & Vehrencamp, S. L. (1998). Principles of animal communication. Sinauer Associates, Inc.
[49] Morton, E.S. (1975). Ecological sources of selection on avian sounds. The American Naturalist, 109, 17–34
[50] Boncoraglio, G., & Saino, N. (2007). Habitat structure and the evolution of bird song: a meta‐analysis of the evidence for the acoustic adaptation hypothesis. Functional Ecology, 21(1), 134-142.
[51] Slabbekoorn, H. (2004). Singing in the wild: the ecology of birdsong. In: Nature’s music: the science of birdsong, (Marler, P. R., & Slabbekoorn, H. , eds), Elsevier, pp 178-205.
[52] Mathevon, N., & Aubin, T. (1997). Reaction to conspecific degraded song by the wren Troglodytes troglodytes: territorial response and choice of song post. Behavioural Processes, 39(1), 77-84.
[53] Macé, M. (2019). Nos cabanes. Editions Verdier.
Ressources complémentaires
Livres et magazines
La Symphonie animale : Comment les bêtes utilisent le son. Antonio Fischetti, Stéphane Quinson. Ed. Vuibert.
Dossier la Salamandre n°227 : L’orchestre des animaux. Mai 2015.
Le grand orchestre animal. Bernie Krause. Ed. Flammarion
Le son à petits pas. Antonio Fischetti, Marion Puech. Ed. Actes Sud Junior.
Sur internet
Les oiseaux, des maîtres chanteurs sous la loi du milieu, Nicolas Mathevon et Thierry Aubin, Pour la Science, janvier 2002 (article réservé aux abonnés).
The Forgotten Female: How a Generation of Women Scientists Changed Our View of Evolution, Kathi Borgmann, All About Birds, juin 2019.
Dans les secrets du « parler oiseau », M. Lochouarn, Banque des savoirs, juin 2010.
Pas si bêtes, la chronique du monde sonore animal, Céline du Chéné, France Culture.
La chronique de la Terre au Carré – le son de la Terre, France Inter.
Le chant du capitaine de la forêt, Antonio Fischetti, CNRS Images, 2011.
La forêt qui parle, Banque des savoirs, octobre 2011.
Hélène, une chercheuse à l’écoute des oiseaux, Romuald Drot, Canal U, janvier 2019.