La biologie du développement s’intéresse notamment aux changements de formes chez les organismes vivants. Bien que cette question soit par essence géométrique, elle implique à la fois des régulateurs biochimiques (comme les gènes et les hormones) et des facteurs mécaniques (rigidité des tissus, contraintes physiques). Des développements récents en imagerie et en modélisation permettent aujourd’hui d’intégrer ces différents composants pour mieux comprendre les mécanismes contrôlant la morphogenèse des êtres vivants. Ici, sur la base de nos travaux sur le méristème apical caulinaire d’Arabidopsis thaliana, j’invite le lecteur à entrer dans notre laboratoire pour illustrer cette nouvelle dynamique, en étudiant un mécanisme essentiel pour la forme des plantes : la synthèse de la cellulose dans les parois végétales, et son intégration dans une boucle de rétroaction mécanique.
Comme tous les êtres vivants, les plantes sont capables de percevoir et de répondre aux forces physiques. Les exemples caricaturaux sont bien connus. Ainsi, la sensitive (Mimosa pudica) ferme ses feuilles rapidement si on la touche et la dionée (Dionaea muscipula) piège des proies dans ses feuilles modifiées qui peuvent se fermer lorsqu’un insecte (ou même un petit vertébré) touche ses poils. Bien que ces réponses soient complexes, impliquant notamment des signaux secondaires électriques, le premier stimulus est une déformation, un signal mécanique. Outre ces exemples ponctuels, toutes les plantes perçoivent les forces, et cela est crucial pour leur développement. Ainsi, étant fixées, les plantes sont constamment soumises au vent, à la pluie, au poids de la neige sur les branches… autant de sources de contraintes mécaniques externes. Les plantes répondent à ces forces en se rigidifiant. Celles situées dans des lieux ventées, comme les plantes d’altitude, ont un port nain, mais peuvent acquérir une taille plus grande dans des habitats plus protégés. Inversement, des plantes placées dans un milieu clos et sans aucun vent, comme cela a été testé dans la grande serre « Biosphère 2 » en Arizona ont grandi « trop » vite en raison de la faible rigidification de leurs tiges, et ont même versé sous leur propre poids ! Ces exemples montrent que les contraintes mécaniques externes façonnent le développement des végétaux Mais celui-ci dépend également de signaux mécaniques internes, comme le montrent de récentes découvertes.
Des données accumulées depuis plus de quarante ans démontrent le rôle majeur des processus biochimiques et génétiques dans le contrôle du développement des organismes vivants. Par exemple, chez les plantes, le célèbre modèle ABC propose que la combinatoire de facteurs de transcription est suffisante pour déterminer l’identité des organes floraux (sépales, pétales, étamines, carpelles). Ce modèle a été établi en étudiant différents mutants, ce qui a permis de déterminer si tel ou tel gène était nécessaire à la genèse d’une forme. Il s’agit toutefois de liens de causalité indirecte car un gène ne contrôle pas directement la géométrie d’un tissu ou d’un organe. Changer de forme, c’est changer de structure, et par définition, la structure implique les lois de la mécanique. Par conséquent, pour établir un lien de causalité entre gène et forme, nous devons aussi comprendre comment les gènes et autres facteurs biochimiques modifient la composante mécanique associée aux cellules, tissus et organes.
Les plantes présentent certains avantages pour cette étude. En particulier, leur mécanique est relativement simple : chez les plantes, les cellules sont entourées d’une paroi rigide qui empêche les changements de forme par migrations des cellules, comme c’est le cas dans le développement des organismes animaux,. Par ailleurs, la paroi végétale résiste à la pression de turgescence (c.-à-d. une pression hydrostatique d’origine osmotique) de la cellule. Cette pression est de l’ordre du MPa, soit 10 fois la pression atmosphérique ; les cellules animales développent des pressions osmotiques bien plus faibles, de l’ordre du kPa. Chez les plantes, les changements de forme se font donc principalement par croissance, la pression de turgescence en étant le « moteur » et la paroi, le « frein ». Les cellules végétales peuvent ainsi être représentées mécaniquement comme un ballon avec une enveloppe (la paroi) tendue par la pression interne (de turgescence). Par ailleurs, les cellules végétales sont collées les unes aux autres par la « lamelle moyenne », une colle moléculaire riche en pectine. Cette propriété des tissus végétaux empêche les migrations cellulaires, et simplifie grandement l’analyse des changements de forme des tissus (Cosgrove, 2005).
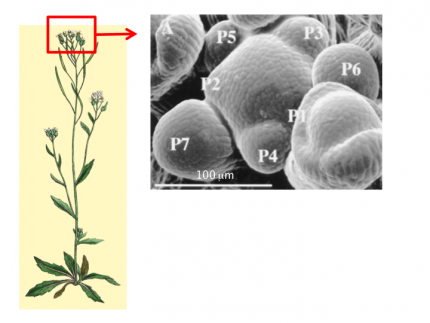
À gauche : partie aérienne de la plante Arabidopsis thaliana. À droite : méristème apical caulinaire d’Arabidopsis thaliana observé au microscope électronique à balayage. Le dôme central correspond au méristème sensu stricto (ici un méristème d’inflorescence); il est entouré de plusieurs très jeunes organes plutôt sphériques (les jeunes boutons floraux notés, du plus jeune au plus âgé, P1 à P7). Notez la présence de plis dans le domaine frontière séparant le méristème des organes en croissance.
Prenons un exemple de tissu végétal présentant des changements de forme marqués : le méristème apical caulinaire. Il s’agit d’un groupe de cellules en divisions qui a deux fonctions : une fonction de production d’organes (feuilles, sépales, pétales, étamines, etc.) et une fonction d’auto-renouvellement ce qui permet à la plante de maintenir une production d’organes pendant toute sa vie. Le méristème a donc un rôle clé dans l’architecture des plantes. Il présente également une morphologie complexe qui en fait un modèle de choix pour étudier les processus moléculaires de la morphogenèse dans des tissus peu différenciés.
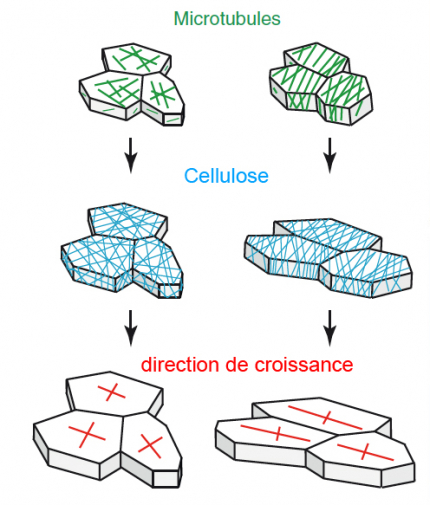
L’orientation des microtubules (en vert) contrôle le dépôt des microfibrilles de cellulose (en bleu) qui déterminent la direction de croissance des cellules (en rouge) : la pression de turgescence est le moteur de la croissance, et l’orientation de la cellulose restreint la croissance dans une direction perpendiculaire aux arceaux de cellulose. À gauche, les microtubules ne présentent pas d’orientation préférentielle : les cellules peuvent grandir dans toutes les directions. Par contre, à droite, les microtubules sont globalement parallèles les uns aux autres, ce qui impose aux cellules une direction de croissance orthogonale.
Pour comprendre la forme globale de la plante et des tissus végétaux, nous devons d’abord déterminer les paramètres géométriques qui déterminent la forme de chaque cellule. Ces paramètres sont au nombre de deux : la vitesse de croissance (c.-à-d. la vitesse à laquelle une cellule augmente irréversiblement son volume) et la direction de croissance (c.-à-d. la direction dans laquelle la cellule grandit)(Coen et al., 2004). La vitesse de croissance est modulée en rendant la paroi plus ou moins extensible grâce à l’action de certaines protéines et enzymes, qui synthétisent, relâchent, lient ou digèrent des composés pariétaux (Cosgrove, 2005). Chez Arabidopsis, il y a environ 1 500 gènes qui contrôlent le remodelage de la paroi, ce qui suggère une forte complexité dans cette régulation. La direction de croissance est également le résultat de la modulation des propriétés mécaniques de la paroi. Ainsi, si certaines faces d’une cellule sont plus rigides que les autres, la cellule grandira dans une direction préférentielle. Ici, les plantes présentent une autre spécificité : contrairement aux animaux chez qui la direction de croissance est le résultat de multiples régulateurs, chez les plantes, un facteur domine devant tous les autres. En effet, les parois des cellules végétales présentent en général une forte anisotropie mécanique, c’est-à-dire qu’elles sont en général plus rigides dans une direction donnée. Cela est dû à la présence d’arceaux rigides de cellulose qui sont déposés dans la paroi et empêchent l’élongation cellulaire parallèle à la direction de ces arceaux. Bien que l’analogie ait ses limites dans ce cas, les ressorts présentent le même type d’anisotropie mécanique : ils peuvent se déformer plus facilement dans la direction perpendiculaire aux arceaux. Des études antérieures ont montré que le cytosquelette microtubulaire localisé sous la membrane plasmique (aussi appelé microtubules corticaux) contrôle le dépôt orienté de la cellulose dans la paroi (Paredez et al., 2006).
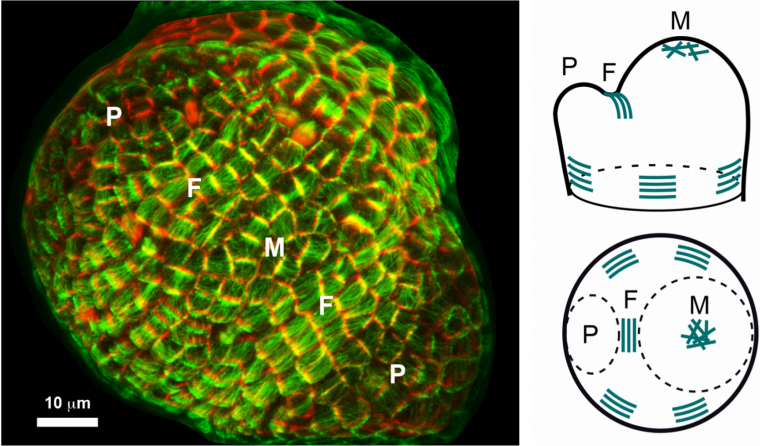
Revenons au méristème apical caulinaire : nous observons des microtubules aux orientations multiples et changeantes au sommet du méristème, et des microtubules tous alignés dans la même direction dans le domaine frontière entre méristème et jeune organe en croissance. Il existe donc une forte corrélation entre forme du tissu et orientation des microtubules, ce qui n’est pas surprenant étant donné le rôle primordial des microtubules dans le contrôle de la forme des cellules. L’alignement des microtubules dans la zone frontière permettrait le dépôt de fibres de cellulose orientées dans la même direction, formant ainsi un anneau de constriction autour de l’organe qui faciliterait la formation d’un pli entre méristème et organe.
À gauche : Une protéine fluorescente (GFP) est fusionnée à une protéine associée aux microtubules. La coloration verte permet ainsi d’identifier le réseau des microtubules dans le méristème (M) ici vu de dessus. La coloration rouge marque le contour des cellules. Deux jeunes organes (primordia P) émergent à la périphérie du méristème. Les cellules du domaine frontière (F) entre organe et méristème présentent des microtubules tous alignés dans la même direction. À droite : Schéma d’interprétation décrivant le patron des microtubules dans le méristème. En haut à droite : vue de profil. En bas à droite : vue de dessus.
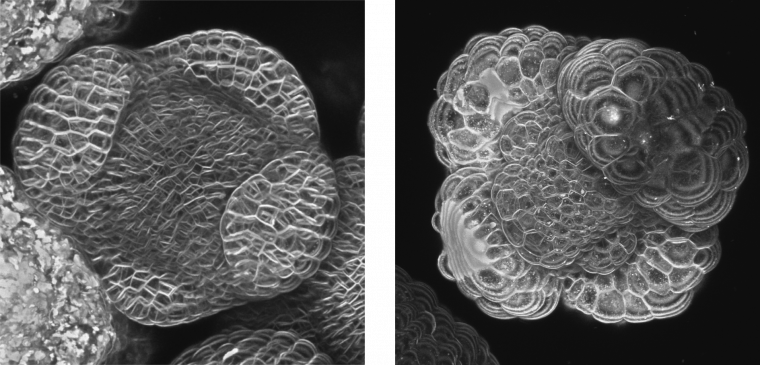
Comment explorer cette hypothèse ? Pour tester le rôle morphogénétique des microtubules, nous avons utilisé l’oryzaline, une drogue au mode d’action similaire à la colchicine et qui dépolymérise les microtubules. Dans ces conditions, nous avons pu observer que le pli est nettement moins marqué. De manière plus générale, la dépolymérisation des microtubules rend les cellules isodiamétriques et les organes sphériques : il n’y a plus de direction de croissance préférentielle aux niveaux cellulaire et supracellulaire. Cette expérience extrêmement simple permet de démontrer à nouveau le rôle fondamental des microtubules dans le contrôle de la direction de croissance des cellules, et permet aussi de révéler l’impact sur la forme du tissu, ici, dans le cas du pli entre organe et méristème.
Méristème floral en croissance avant (à gauche) et après dépolymérisation des microtubules par l’oryzaline (à droite). Notez la forme sphérique des 4 sépales : les organes ont perdu leur direction de croissance préférentielle. Les cellules ont également une croissance isotrope qui les fait ressembler à des bulles de savon. Les deux images sont à la même échelle.
Cette première analyse nous permet de comprendre comment les régulateurs génétiques du méristème pourraient contrôler sa forme, notamment en modulant la dynamique et l’orientation des microtubules, et ainsi, les propriétés mécaniques des parois végétales. Toutefois, cette vision est bien trop simpliste. Comme tout système, vivant ou non, les tissus végétaux sont soumis à des rétro-actions. Lorsque le tissu change de forme, les contraintes mécaniques changent aussi. Par exemple, lorsqu’on ajoute un étage à une maison, la charge augmente et il faut vérifier que la structure peut soutenir cette charge. De la même façon, quand le tissu se plie au niveau du méristème, de nouvelles contraintes émergent. Comment peut-on connaître leurs amplitudes et leurs directions ?
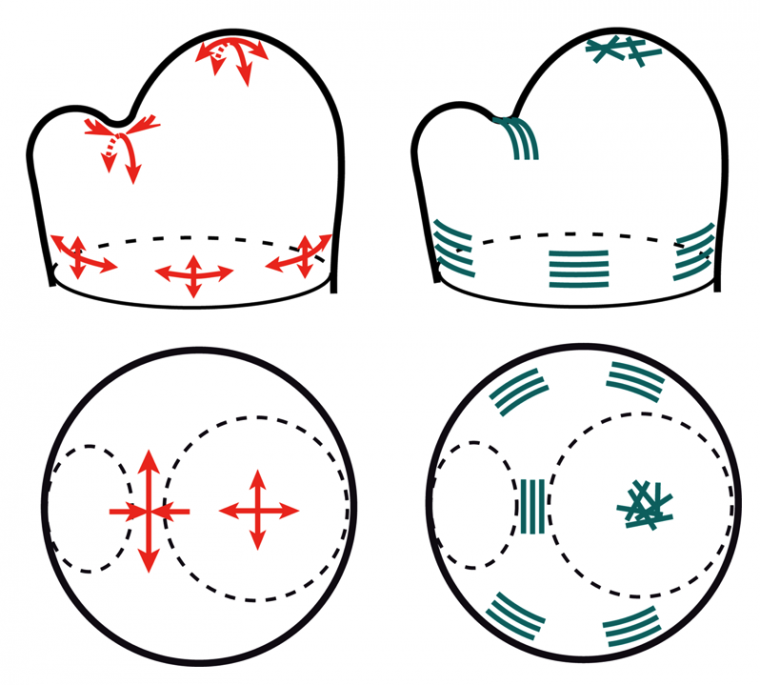
Les forces étant invisibles par nature, nous devons utiliser l’outil mathématique pour prédire l’intensité et l’orientation des contraintes mécaniques dans les tissus. Si l’on suppose que le tissu végétal est élastique, et que l’épiderme est limitant pour la croissance et sous tension (des hypothèses soutenues par une littérature abondante, voir par ex. Kutscera and Niklas, 2007), nous pouvons comparer le méristème à un ballon avec une enveloppe en tension (l’épiderme) et un tissu interne en compression. Outre le caractère pédagogique d’une telle analogie, cette comparaison nous permet de calculer facilement le patron des contraintes mécaniques dans le tissu, sur la base de connaissances bien établie en ingénierie des matériaux et des coques. Nous obtenons ainsi une carte des contraintes dans le méristème, avec des tensions dans toutes les directions au sommet du méristème, et des tensions tangentielles très fortes dans le pli entre méristème et organe. On voit ici que les tensions (prédites) et les microtubules (observés) sont co-alignés. Nous formulons donc l’hypothèse que les microtubules s’alignent le long des directions des tensions, couplant ainsi la morphogenèse avec la physique via les microtubules.
En haut : méristème apical caulinaire vu de profil avec sur le côté gauche l’émergence d’un nouvel organe. En bas : vue du dessus. En rouge, le patron des tensions dans le méristème et en bleu, l’orientation des microtubules corticaux.
Au sommet du méristème, les tensions sont isotropes (de même intensité dans toutes les directions de l’espace), les microtubules ne présentent pas d’orientation préférentielle. Au niveau de la zone frontière, les tensions sont très anisotropes : elles sont beaucoup plus fortes dans la direction de l’axe du pli. Les microtubules sont alignés par rapport à cet axe. Enfin, sous le méristème, les tensions circonférentielles induites par la forme cylindrique de la tige sont deux fois plus fortes que les tensions axiales (dans le sens d’allongement de la tige). Les microtubules sont orientés dans le sens de la circonférence. On observe donc dans ces trois zones un co-alignement entre tensions et microtubules.
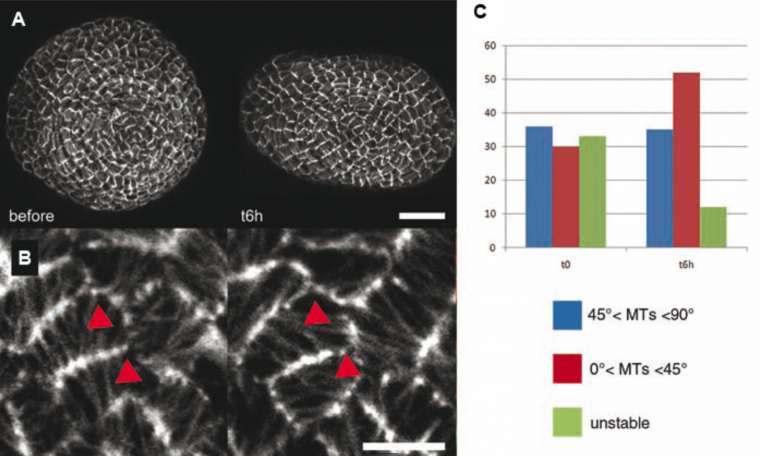
Il s’agit toutefois d’une prédiction. Pour vérifier cette hypothèse, nous pouvons modifier localement le champ de forces dans le méristème et voir si les microtubules changent leur orientation. Ainsi, en comprimant le méristème dans un micro-étau, nous pouvons induire des tensions perpendiculaires à la compression. Dans ces expériences, une majorité de cellules présente des microtubules qui se réorientent le long des tensions maximales, comme prédit par notre modèle.
A. méristème apical caulinaire vue du dessus avant et 6 heures après compression latérale provoquée par la pression de deux lames de chaque côté du méristème. Barre d’échelle : 20 µm. B. Zoom sur quelques cellules : réorientation des microtubules après compression. Barre d’échelle : 5 µm C. Quantification de la réponse des cellules à la compression. Six heures après l’application de la contrainte, le nombre de cellules ne présentant pas d’orientation préférentielle des microtubules diminue (en vert) tandis que le nombre de cellules dont les microtubules font un angle de plus de 45° par rapport aux deux lames reste stable (bleu) et que le nombre de cellules dont les microtubules ont un angle inférieur à 45° par rapport aux lames augmente (rouge).
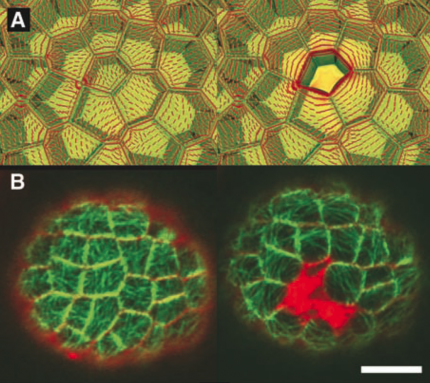
A. Modélisation des contraintes mécaniques dans l’épiderme du méristème avant et après ablation d’une cellule : les tensions (en rouge) deviennent circonférentielles autour de l’ablation. B. Observation des microtubules avant et 6 heures après l’ablation de deux cellules dans l’épiderme (en rouge au centre) : les microtubules forment un anneau circonférentiel autour de l’ablation.
Dans une autre expérience, nous générons une ablation cellulaire dans l’épiderme grâce à un laser UV. Cette ablation induit des tensions circonférentielles autour de la cellule tuée. Cette réponse mécanique peut être modélisée (voir figure ci-dessous). Encore une fois, nous avons observé une réorientation des microtubules parallèle à la direction des tensions, i.e. circonférentielle autour de la cellule tuée.
En utilisant une approche de modélisation, nous avons pu coder cette nouvelle règle (« les microtubules s’alignent sur la direction des tensions maximales ») dans un modèle mécanique du méristème. Ce modèle a reproduit in silico l’orientation des microtubules observé in vivo.
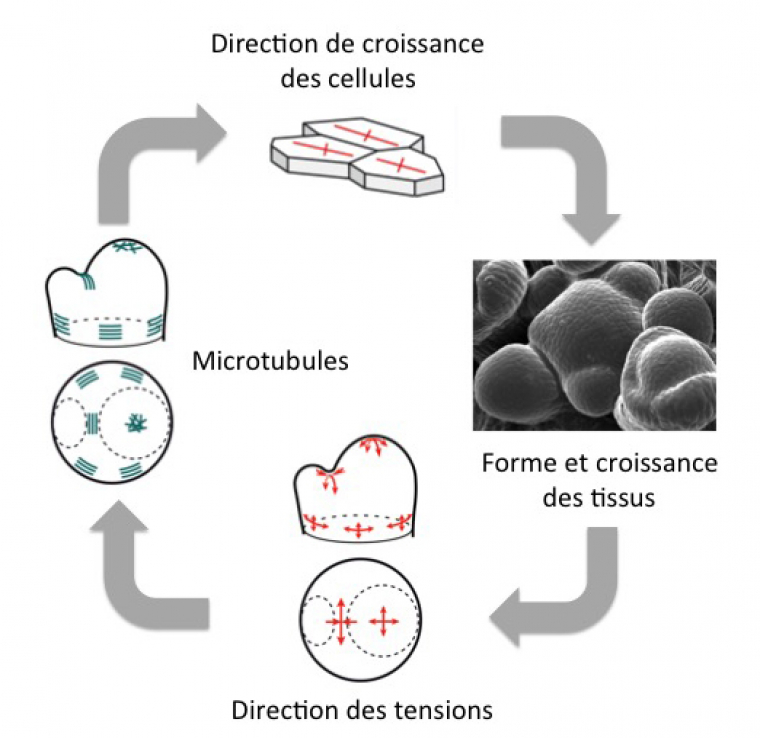
En conclusion, non seulement les facteurs biochimiques contrôlent les changements de forme en modulant les propriétés mécaniques des cellules (par ex. via les microtubules), mais en retour, les changements de forme modulent le patron des forces qui à leur tour sont perçues et modifient le comportement des facteurs biochimique. Il s’agit donc d’une boucle de rétroaction biochimique et mécanique : les microtubules sont responsables de la direction de croissance des cellules, qui contrôle la forme des tissus ; celle-ci détermine la direction des tensions, qui orientent les microtubules.
Ce théorème végétal semble être généralisable aux autres parties de la plante, mais aussi aux autres espèces végétales, étant donné la conservation du couple microtubule-cellulose au cours de l’évolution de la lignée verte. Ainsi, en alignant la cellulose le long des tensions, les cellules végétales résistent aux contraintes mécaniques en rigidifiant leur paroi dans une direction préférentielle, un peu comme l’architecte qui construit un mur vertical pour résister à la gravité. Ce théorème a également des échos dans le monde animal. Ainsi, les os des mammifères se renforcent continuellement dans la direction des contraintes maximales (loi de Wolff) : En résistant aux contraintes, les os changent leur architecture interne, un peu comme les cellules végétales qui modifient l’architecture de leur exosquelette (la paroi) en réponse aux forces mécaniques.
Les implications de cette boucle de rétroaction sont nombreuses. Ainsi, la forme cylindrique des tiges prescrit une tension circonférentielle, et donc un renforcement des parois dans cette direction, contribuant à leur croissance unidirectionnelle (voir par ex. (Landrein et al., 2013)). De même, lorsque des organes présentent des différentiels de croissance (le cas général), des tensions émergent entre région à croissance rapide et région à croissance lente. De telles tensions alignent les microtubules et contribuent à la forme finale des organes, en canalisant leur direction de croissance (Hervieux et al., 2016). Outre leur rôle dans le dépôt de la cellulose, les microtubules corticaux ont aussi un rôle clé dans l’orientation des plans de division des cellules végétales, et les données s’accumulent pour montrer que les cellules végétales se divisent en général perpendiculairement aux tensions maximales, le plan de division s’alignant parallèlement à celles-ci (Lintilhac and Vesecky, 1984)(Louveaux et al., 2016).
Comme indiqué plus haut, le développement végétal est le résultat d’un grand nombre de facteurs. Outre les microtubules, les contraintes mécaniques affectent aussi d’autres régulateurs biochimiques. Ainsi, le gène SHOOT MERISTEMLESS qui est nécessaire au maintien du méristème apical caulinaire est plus fortement exprimé dans les zones frontières du méristème apical caulinaire. En utilisant des perturbations mécaniques, il a été montré que l’activité du promoteur de ce gène peut être induite par des contraintes mécaniques, fournissant ainsi une seconde boucle de rétroaction dans ce tissu (Landrein et al., 2015). Plus généralement, il est maintenant bien établi que l’expression des gènes des plantes est sensible aux perturbations mécaniques. Ainsi, il est estimé que 2,5 % du génome d’Arabidopsis est induit quelques minutes après qu’un plante ait été touchée ou déformée (Lee et al., 2005). Les plantes peuvent ainsi percevoir et répondre aux contraintes mécaniques externes (vent, toucher…) et internes (croissance et déformation).
Contrairement aux animaux, les voies de mécanotransduction restent par contre assez méconnues. Plusieurs canaux mécanosensibles ont été identifiés, comme le canal MSL8 impliqué dans la croissance du tube pollinique (Hamilton et al., 2015), le récepteur FERONIA impliqué dans la réponse des racines à la rigidité du substrat (Shih et al., 2014) ou la protéine DEK1 impliquée dans la différenciation de l’épiderme (Tran et al., 2017). À l’avenir, la caractérisation des différentes voies de mécanotransduction sera certainement un élément essentiel pour intégrer complètement la mécanique dans le lien entre gènes et formes.
Remerciements
Ce projet de recherche a été initié par Jan Traas (ENS Lyon) et Yves Couder (université Paris 7), en collaboration avec Henrik Jönsson (université de Cambridge, Royaume-Uni) et Elliot Meyerowitz (Caltech, USA). Aujourd’hui, le projet s'est développé notamment grâce à de nombreuses interactions avec Arezki Boudaoud (ENS Lyon), et l’ensemble du laboratoire Reproduction et Développement des Plantes.
Références
- Bringmann, M., Landrein, B., Schudoma, C., Hamant, O., Hauser, M.-T., and Persson, S. (2012). Cracking the elusive alignment hypothesis: the microtubule-cellulose synthase nexus unraveled. Trends Plant Sci. 17, 666–674.
- Coen, E., Rolland-Lagan, A.-G., Matthews, M., Bangham, J.A., and Prusinkiewicz, P. (2004). The genetics of geometry. Proc. Natl. Acad. Sci. U. S. A. 101, 4728–4735.
- Corson, F., Hamant, O., Bohn, S., Traas, J., Boudaoud, A., and Couder, Y. (2009). Turning a plant tissue into a living cell froth through isotropic growth. Proc. Natl. Acad. Sci. U. S. A. 106, 8453–8458.
- Cosgrove, D.J. (2005). Growth of the plant cell wall. Nat. Rev. Mol. Cell Biol. 6, 850–861.
- Hamant, O., Heisler, M.G., Jonsson, H., Krupinski, P., Uyttewaal, M., Bokov, P., Corson, F., Sahlin, P., Boudaoud, A., Meyerowitz, E.M., et al. (2008). Developmental patterning by mechanical signals in Arabidopsis. Science 322, 1650–1655.
- Hamilton, E.S., Jensen, G.S., Maksaev, G., Katims, A., Sherp, A.M., and Haswell, E.S. (2015). Mechanosensitive channel MSL8 regulates osmotic forces during pollen hydration and germination. Science 350, 438–441.
- Hervieux, N., Dumond, M., Sapala, A., Routier-Kierzkowska, A.-L., Kierzkowski, D., Roeder, A.H.K., Smith, R.S., Boudaoud, A., and Hamant, O. (2016). A Mechanical Feedback Restricts Sepal Growth and Shape in Arabidopsis. Curr. Biol. CB.
- Landrein, B., Lathe, R., Bringmann, M., Vouillot, C., Ivakov, A., Boudaoud, A., Persson, S., and Hamant, O. (2013). Impaired cellulose synthase guidance leads to stem torsion and twists phyllotactic patterns in Arabidopsis. Curr. Biol. CB 23.
- Landrein, B., Kiss, A., Sassi, M., Chauvet, A., Das, P., Cortizo, M., Laufs, P., Takeda, S., Aida, M., Traas, J., et al. (2015). Mechanical stress contributes to the expression of the STM homeobox gene in Arabidopsis shoot meristems. ELife 4, e07811.
- Laufs, P., Grandjean, O., Jonak, C., Kiêu, K., and Traas, J. (1998). Cellular parameters of the shoot apical meristem in Arabidopsis. Plant Cell 10, 1375–1390.
- Lee, D., Polisensky, D.H., and Braam, J. (2005). Genome-wide identification of touch- and darkness-regulated Arabidopsis genes: a focus on calmodulin-like and XTH genes. New Phytol. 165, 429–444.
- Lintilhac, P.M., and Vesecky, T.B. (1984). Stress-induced alignment of division plane in plant tissues grown in vitro. Nature 307, 363–364.
- Louveaux, M., Julien, J.-D., Mirabet, V., Boudaoud, A., and Hamant, O. (2016). Cell division plane orientation based on tensile stress in Arabidopsis thaliana. Proc. Natl. Acad. Sci. U. S. A. 113, E4294-4303.
- Paredez, A.R., Somerville, C.R., and Ehrhardt, D.W. (2006). Visualization of cellulose synthase demonstrates functional association with microtubules. Science 312, 1491–1495.
- Shih, H.-W., Miller, N.D., Dai, C., Spalding, E.P., and Monshausen, G.B. (2014). The receptor-like kinase FERONIA is required for mechanical signal transduction in Arabidopsis seedlings. Curr. Biol. CB 24, 1887–1892.
- Tran, D., Galletti, R., Neumann, E.D., Dubois, A., Sharif-Naeini, R., Geitmann, A., Frachisse, J.-M., Hamant, O., and Ingram, G.C. (2017). A mechanosensitive Ca2+ channel activity is dependent on the developmental regulator DEK1. Nat. Commun. 8, 1009.