Le développement embryonnaire est le fruit de deux types de processus morphogénétiques : des processus biomécaniques, donnant à l’organisme sa forme géométrique, et des processus biochimiques de différenciation, donnant aux différents tissus et organes leurs fonctions physiologiques. Les premiers ont été abondamment étudiés avant la découverte du génome, alors que les seconds ont focalisé l’attention des biologistes du développement depuis la deuxième moitié du siècle dernier. Les deux ont commencé à être couplés pour l’étude du contrôle génétique de la morphogenèse biomécanique durant les années 90. Aujourd’hui, on découvre que les contraintes mécaniques exercent en retour un contrôle sur la différenciation biochimique des cellules. L’embryogenèse apparaît donc comme le produit du couplage réciproque entre les deux types de morphogenèse, l’une de nature biochimique, l’autre de nature biomécanique.
Historique des approches biomécaniques et biochimiques du développement embryonnaire
La biologie s’attache notamment à l’étude des formes du vivant, c’est-à-dire aux propriétés géométriques des organes et organismes vivants, ces caractéristiques ayant été les seules observables à l’œil nu, avant l’avènement de la microscopie à la fin du XVIe siècle. Aristote par exemple réalisa des observations directes du développement d’embryons de poulet qu’il extrayait systématiquement de leur coquille aux différents stades de leur développement. Il proposa, dès le IIIe siècle avant JC, que la formation d’un organe donné (comme le foie de l’embryon de poulet) au cours du développement est induite après la formation de l’organe qui lui préexiste (son cœur), suggérant un lien de cause à effet entre l’existence de l’un et la production de l’autre [1].
L’étude des propriétés morphologiques du vivant atteint son apogée de la fin du XIXe au début du XXe siècle, avec les approches biomécaniques de His, Roux, d’Arcy Thompson ou encore Leduc. Ils introduisirent les lois physiques de la mécanique newtonienne dans le but d’expliquer la génération des formes des organismes vivants comme une réponse mécanique aux contraintes de croissance de leur tissu au cours du développement (Figure 1a) [2-5].
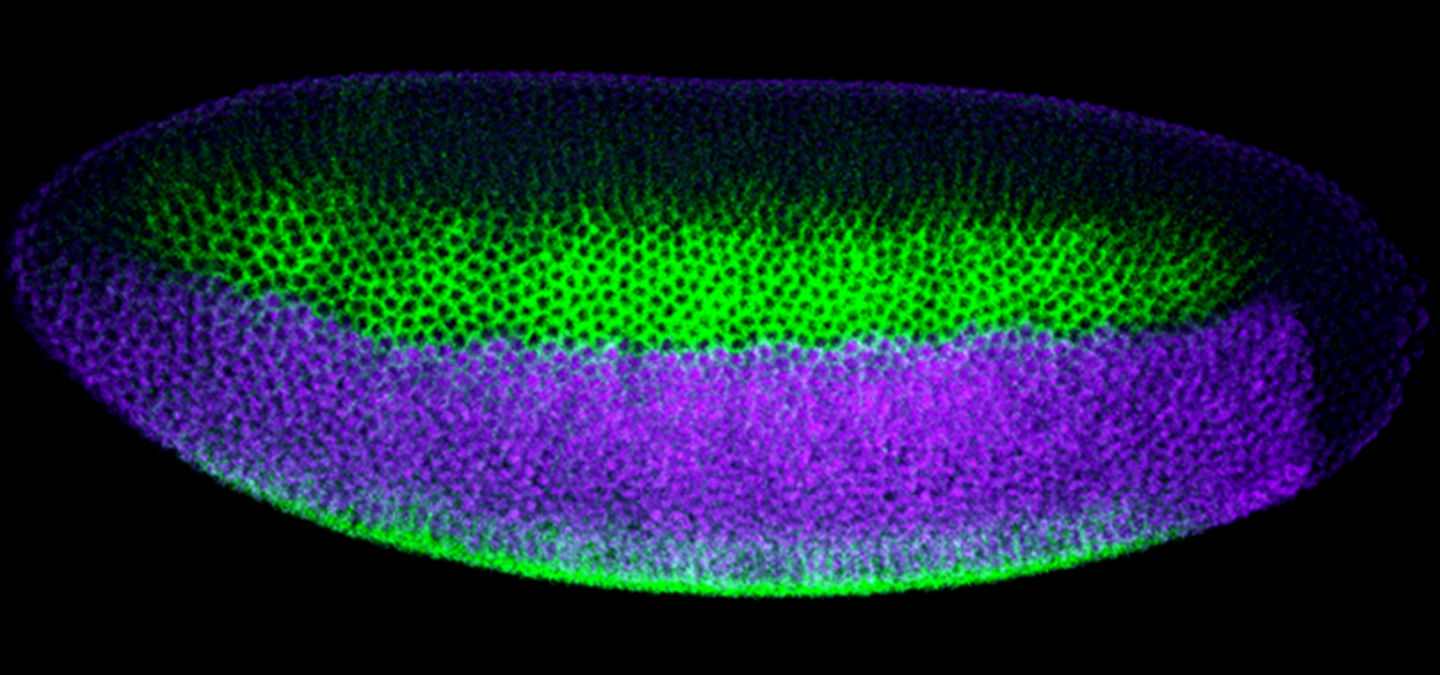
a Changements de formes biomécaniques animales par modulation de croissance tissulaire (Thompson, 1917). b Différenciation biochimique des grandes parties du corps de la drosophile le long de l’axe antéro-postérieur par les homéogènes qui s’expriment très tôt au cours de l’embryogenèse
La découverte des principes d’hérédité génétique, en particulier grâce aux travaux de Mendel, permis de montrer que les propriétés de l’organisation de la matière vivante ne pouvaient être réduites à leurs seules propriétés physiques macroscopiques, et relevaient de phénomènes moléculaires alors encore inconnus à l’époque. L’avènement de la biologie moléculaire au milieu du XXe siècle a en effet révélé, en particulier après la découverte du génome, la richesse et la complexité des processus moléculaires à l’œuvre au sein de chaque cellule, de chaque organe, de chaque organisme. Les molécules organiques comme les protéines, l’ADN et les ARN subissent en permanence un très grand nombre de réactions biochimiques qui permettent aux cellules et aux organes, et donc à l’organisme, de développer des tissus de nature différente (muscles, neurones, etc. [6], Figure 1b). En d’autres termes, les tissus vivants ne se réduisent bien sûr pas à la forme physique et aux lois biomécaniques qui en régissent la production, mais sont aussi le théâtre de nombreux processus biochimiques complexes qui font la spécificité de la matière vivante.
Ces fonctions biochimiques permettent de déterminer les tissus en grands domaines allant donner lieu à différents types d’organes. L’un des exemples les plus connus est la segmentation de l’embryon en différents domaines d’expression génique produisant des protéines du développement responsables de la détermination des différentes parties du corps le long de l’axe antéro-postérieur. La découverte il y a trente ans environ de gènes appelés « homéogènes » a montré de façon remarquable que la structure linéaire antéro-postérieure du corps (son organisation linéaire le long de l’axe bouche-anus) est génétiquement inscrite le long de chromosomes. Lors de la croissance du tronc de l’embryon, ces chromosomes sont lus par la machinerie cellulaire du début à la fin. Celle-ci active tour à tour les gènes requis pour initier la différenciation du tissu le plus antérieur, puis des différents éléments du tronc, et enfin du tissu le plus postérieur. Ainsi lorsque le corps embryonnaire croît, la séquence des gènes des chromosomes se retrouve exprimée dans le même ordre le long du corps de l’organisme, et constitue alors ses grands domaines de différenciation antéro-postérieurs [7]. Cette découverte a été remarquable à plus d’un titre, car elle a permis de trouver que ces gènes étaient essentiellement les mêmes chez de nombreux Métazoaires. Tous les organismes appartenant à ce taxon ont donc hérité d’un même ancêtre commun les homéogènes qui structurent l’axe antéro-postérieur de leurs corps [8,9].
Ces résultats ont également permis de revenir sur une controverse scientifique vieille de deux cents ans. À l’époque, Geoffroy Saint-Hilaire, tenant d’une origine commune à toutes les espèces, s’était opposé à Buffon, tenant d’une origine distincte des espèces, en particulier des Arthropodes (Insectes, crustacés…) et des Vertébrés (poissons, Mammifères…). Les résultats récents, et en particulier sur la conservation des homéogènes chez les Métazoaires, ont donc donné raison à Geoffroy Saint-Hilaire.
Ce n’est que très récemment que les chercheurs se sont rendu compte que bien plus que simplement coexister, les propriétés physiques biomécaniques des tissus et organes de l’échelle macroscopique (leur forme) et les propriétés biochimiques de l’échelle microscopique des cellules qui les composent (leurs fonctions biochimiques), interagissent. L’étude de cette interaction relève du tout nouveau domaine de la biologie que l’on nomme aujourd’hui la « mécanobiologie ». Nous allons voir que cette interaction est vitale, car au cœur de l’émergence des premiers organes au tout début du développement embryonnaire. Mais elle peut aussi s’avérer jouer un rôle délétère, par exemple au cours de processus de dérégulation tels que le développement tumoral.
Le contrôle génétique de la morphogenèse biomécanique
Chez la drosophile, le tube gastrique et le mésoderme se constituent pratiquement au même moment, par la formation de deux types de tubes. Le premier se forme à la fois depuis le pôle antérieur et depuis le pôle postérieur de l’embryon. Ces deux parties s’allongent et finissent par fusionner au centre de l’embryon pour former le tube gastrique. Le tube à l’origine du mésoderme se forme d’abord tout le long de la partie ventrale de l’embryon, puis rentre d’un seul coup à l’intérieur de celui-ci générant ensuite différents organes (système cardiaque, muscles…) (Figure 2a).
a Mouvements morphogénétiques de la gastrulation dans l’embryon de drosophile : (1) invagination du mésoderme, (2) convergence-extension et invagination de l’endoderme antérieur et postérieur. b Invagination du mésoderme en coupe transversale, en réponse à la stabilisation apicale de la myosine-II (en rouge). c Vue ventrale du mésoderme : (1) phase stochastique instable de constriction apicale, (2) suivie de la phase coordonnée de constriction stable apicale des cellules du mésoderme menant à son invagination. d Rétablissement de la stabilisation apicale de la myosine-II et de l’invagination du mésoderme par une indentation douce du mésoderme d’un mutant snail, chez lequel on observe, en l’absence de manipulation, ni stabilisation apicale de la myosine-II ni invagination du mésoderme.
Quelles forces physiques sont à l’œuvre pour générer de tels changements morphologiques, de telles courbures du tissu embryonnaire ? Il ne s’agit pas, dans ce cas précis, d’une croissance tissulaire régulée de façon différentielle en fonction de la localisation sur l’embryon comme aurait pu le proposer d’Arcy Thomson, car les cellules ne se divisent pas à ce stade du développement chez l’embryon de drosophile. Les forces sont en réalité générées par une protéine, qui se trouve être un véritable petit moteur à l’échelle moléculaire : la myosine-II. Cette molécule vient, sous l’effet de signaux biochimiques génétiquement régulés, s’accumuler sur la surface externe du mésoderme (Figure 2b). En interagissant avec les polymères d’actine, la myosine-II provoque une contraction de la surface externe du mésoderme. Celle-ci diminue alors en comparaison de la surface interne, et cela induit la courbure nécessaire à l’invagination du mésoderme [10,11]. On voit ici une interaction de l’échelle biochimique microscopique vers la forme physique macroscopique, permise par la myosine-II. Des protéines, codées par le génome, agissent ainsi comme générateurs de formes pour constituer les premiers organes de l’embryon.
Le contrôle de l’activité de la myosine-II par les contraintes biomécaniques embryonnaires
Mais il y a plus. À y regarder de plus près, on observe que l’arrivée de la myosine-II sur la surface externe des cellules du mésoderme se fait en deux phases distinctes. La première dure deux à trois minutes, et est instable et stochastique : elle induit donc la contraction instable et aléatoire de la surface externe des cellules du mésoderme (aussi appelée pulsation ou fluctuation de formes apicales), ce qui ne permet pas son invagination. La seconde, qui suit immédiatement, est stable et coordonnée : toutes les surfaces externes des cellules du mésoderme se contractent en même temps, ce qui provoque l’invagination du mésoderme [12] (Figure 2c). Nous avons proposé que la stabilisation de la myosine-II sur la surface externe des cellules lors de cette seconde phase est activée en réponse aux sollicitations mécaniques développées par la phase de contraction stochastique des cellules [13]. Pour le tester, nous avons travaillé sur des embryons mutants pour le gène snail, qui ne produisent plus de contractions, ni stochastiques ni coordonnées dans le mésoderme. Nous avons déformé le mésoderme de ces embryons de quelques micromètres à l’aide d’une pointe douce micro-manipulée. En réponse à cette contrainte mécanique on observe la réactivation de la redistribution apicale de la myosine-II et sa stabilisation, qui permet le rétablissement de la contraction stable de la surface externe des cellules, et donc l’invagination du mésoderme ; autant de processus défectueux dans l’embryon mutant (Figure 2d) [13]. En d’autres termes, on rétablit un comportement moléculaire actif menant à la production d’une forme biomécanique normale dans un mutant qui ne les possédait plus, juste en déformant doucement son mésoderme.
Afin de réaliser une étude plus fine que par l’utilisation d’une pointe micro-manipulée, nous avons mimé les contractions instables et stochastiques de forme de la surface externe du mésoderme par voie magnétique, chez un mutant snail (incapable de produire de telles contractions). Après injection de liposomes magnétiques dans les cellules du mésoderme, nous avons approché un réseau linéaire de micro-aimants de 10 microns (ordre de grandeur de la taille d’une cellule) et séparés les uns des autres de 20 microns. La particularité de ces micro-aimants tient dans le fait que l’on peut y faire osciller à notre guise le champ magnétique (Figure 3a). Ainsi, les cellules magnétisées se contractent en présence du champ magnétique sous les aimants, et se relâchent une fois le champ coupé. L’amplitude du mouvement ainsi induit artificiellement est de l’ordre de 0,5 microns par cellule seulement, et sa fréquence mime exactement celles des pulsations snail-dépendantes (Figure 3b). Le résultat a été le suivant : le déclenchement de la stabilisation apicale de la myosine-II, de la constriction collective des apex des cellules du mésoderme et de l’invagination du mésoderme (Figure 3b,c) [14].
a Positionnement du mésoderme de l’embryon ayant subi l’injection de liposomes magnétiques face à un réseau de micro-aimants fluctuants permettant de mimer quantitativement les pulsations instables snail dépendantes dans les mutants de snail défectifs en pulsations. b Observation des pulsations magnétiquement induites dans le mutant de snail défectif en pulsations, et déclenchement de l’invagination du mésoderme dans le mutant de snail défectif en invagination. c Le processus d’activation mécanique de stabilisation apicale de la myosine-II menant à l’invagination du mésoderme dépendent de la voie de transduction du signal mécano-sensible Fog. d Les contraintes mécaniques exercées par l’invagination du mésoderme sur le pôle postérieur de l’embryon activent la stabilisation apicale de la myosine-II et l’invagination de l’endoderme postérieur par l’activation de la même voie mécanosensible Fog.
L’invagination du mésoderme provoque à son tour des contraintes mécaniques sur les cellules de l’endoderme du pôle postérieur de l’embryon (partie postérieure du futur tube gastrique). Il a été possible de montrer, par voie magnétique encore, que ces contraintes déclenchent la stabilisation apicale de la myosine-II dans les cellules de l’endoderme postérieur et initient la formation du tube gastrique postérieur [14] (Figure 3d). Les deux processus (au niveau du mésoderme d’abord, de l’endoderme ensuite) relèvent du même processus d’activation mécanique de la voie de signalisation biochimique dite « Fog ».
Ceci a permis de démontrer que le déclenchement de la gastrulation est provoqué dans l’embryon de drosophile par les pulsations contractiles instables et stochastiques des apex des cellules du mésoderme. Ces contractions activent la voie de transduction du signal biochimique Fog menant à la stabilisation apicale de la myosine-II qui provoque, mécaniquement, l’invagination de l’endoderme et du mésoderme.
On le voit, c’est l’interaction entre la myosine-II, molécule produit du génome, et la forme biomécanique des cellules qui est requise pour la formation du mésoderme et de l’endoderme. C’est en effet l’activité stochastique de la myosine-II qui induit les déformations mécaniques stochastiques cellulaires qui en retour amplifient l’activité biochimique de la myosine-II dans le mésoderme, et l’activent dans l’endoderme, ce qui est requis pour leur invagination.
Il existe donc bien une interaction entre la forme biomécanique macroscopique des tissus cellulaires et l’activité biochimique d’une molécule produit du génome qui, dans ce cas précis, est la myosine-II, protéine centrale de la morphogenèse embryonnaire.
Le contrôle mécanique de la différenciation biochimique
Comme nous l’avons vu plus haut, si la forme d’un organe peut être nécessaire à sa fonction biologique (il faut bien un tube gastrique pour ingérer des aliments), elle ne lui est généralement pas suffisante (encore faut-il être capable de digérer ces aliments). En plus d’avoir une forme particulière, il faut donc qu’un organe soit composé de cellules différenciées, réalisant des fonctions spécifiques. La différenciation des cellules passe par l’expression de seulement certaines parties du génome, permettant de produire des protéines assurant la fonction de ces cellules. Ainsi, le tissu mésodermique qui s’invagine est par exemple caractérisé par la production de Twist, un facteur de transcription. Celui-ci induit la production, à partir du génome, d’un très grand nombre de protéines, lesquelles vont progressivement permettre la mise en place des organes issus du mésoderme. Twist est donc une protéine impliquée dans la différenciation du mésoderme.
a La forte expression de Twist (protéine impliquée dans la différenciation du mésoderme et de l’endoderme) à la fin de l’invagination du mésoderme, b est perdue à plus de 80 % dans le mutant de snail chez qui l’invagination ne se produit plus, c et se trouve rétablie totalement dans le mutant de snail indenté (voir Figure 2d) pour lequel l’invagination active a été rétablie mécaniquement.
Or, nous avons pu mesurer dans l’embryon mutant de snail décrit ci-dessus (chez lequel il n’y a pas invagination du mésoderme) que la production de Twist chute très rapidement dans le mésoderme non invaginé. Cependant, si l’on réactive l’invagination par la stimulation mécanique douce précédemment décrite, on réactive alors la production de Twist. Celle-ci se fait donc en réponse aux contraintes mécaniques développées par le mouvement d’invagination [15] (Figure 4). En d’autres termes, la forme biomécanique du mésoderme permet sa différenciation biochimique.
Un tel processus permet la coordination entre morphogenèse biochimique et morphogenèse biomécanique. Seules les cellules qui se seront invaginées subiront des contraintes mécaniques, donc exprimeront Twist et se différencieront en mésoderme. Ceci assure que seules les cellules internes (s’étant invaginées) donnent des dérivés mésodermiques.
Nous avons pu montrer que cette même propriété est à l’œuvre, et vitale, dans la différenciation fonctionnelle du tube gastrique antérieur de l’embryon de drosophile. En effet, Twist est aussi exprimé dans le futur endoderme antérieur de l’embryon de drosophile et est impliqué dans la spécification de cet autre feuillet embryonnaire. Or, la production de Twist est aussi mécaniquement induite dans le futur tube gastrique antérieur par sa compression causée par le mouvement de convergence extension de la gastrulation (Figure 1a). Par ailleurs, un défaut dans la quantité de Twist induite mécaniquement mène au défaut de différenciation précoce du tube gastrique antérieur de l’organisme. Celui-ci n’est alors plus fonctionnel sur le plan digestif à 20 h de développement, ce qui mène à la mort des larves 4 à 5 jours après leur éclosion (Figure 5) [16,17].
a La compression uni-axiale latérale faible (de l’ordre de 10 %) de l’embryon de drosophile induit l’expression du gène twist, normalement uniquement ventral, sur le dos de l’embryon. b La forte expression de Twist dans les cellules de l’endoderme antérieur (entre les flèches rouges) est due à la compression de celle-ci par le mouvement de convergence extension de la gastrulation (voir Figure 2a). L’expression de Twist est perdue dans un mutant de bicoid, nanos torso-like chez lequel ce mouvement est absent c La forte expression de Twist est aussi perdue dans un embryon dont l’intégrité mécanique a été perturbée par photo-ablation d’une partie du tissu bloquant le mouvement de convergence-extension dans l’embryon sauvage (à gauche), puis rétablie en mimant de façon quantitative le mouvement de compression des cellules de l’endoderme antérieur par injection de nano-particules magnétiques dans les cellules dorsales adjacentes et application d’un champ magnétique contrôlé (à droite).
On le voit, la forme des tissus, ou plus exactement les contraintes de déformation associées à leurs changements de forme, jouent un rôle clef, et vital pour le développement des processus de différenciation de nature biochimique de l’organisme. Ces contraintes permettent en effet d’initier la formation des organes internes d’origine mésodermique et endodermique.
Les mécanismes moléculaires de la transduction d’un signal mécanique en un signal biochimique
Mais par quel mécanisme moléculaire un signal de nature mécanique peut-il être traduit en un signal biochimique ? Dans un certain nombre de cas, ces processus dits de « mécanotransduction » ont pu être mis en évidence, in vitro (sur molécules uniques) ou in cellulo (en culture cellulaire). Les pores ioniques qui traversent les membranes plasmiques, par exemple, sont connus pour permettre le transport sélectif d’ions en réponse aux tensions membranaires qui entraînent des changements de leurs conformations [18]. Les contraintes mécaniques peuvent également provoquer des changements de la configuration tridimensionnelle des protéines des jonctions adhérentes, ce qui va permettre leur phosphorylation [19]. Ces changements de conformation induits modifient donc l’état biochimique de la protéine, et l’activent pour lui donner une fonction bien précise dans la cellule.
C’est probablement ce qui se passe pour l’induction mécanique de l’expression de Twist dans le mésoderme dans l’embryon de drosophile. Nous avons pu montrer qu’elle était initiée par la phosphorylation mécaniquement induite d’une molécule du cytoplasme de la cellule faisant partie des jonctions d’adhérence intercellulaires : la β-caténine [15] (Figure 6a). En effet la phosphorylation du site Y654 (tyrosine, en position 654) de cette protéine est connue pour inhiber l’interaction de la β-caténine avec les autres constituants moléculaires des jonctions, et donc provoquer son relargage dans le cytoplasme. Une fois passée du cytoplasme au noyau, la β-caténine active le facteur de transcription TCF, ce qui provoque la transcription du gène twist, et donc la production de la protéine Twist. La phosphorylation mécaniquement induite du site Y654 de la β-caténine provoque donc le relargage d’une partie du pool de β-caténine des jonctions vers le cytoplasme puis le noyau de la cellule, ce qui va provoquer in fine l’expression de la protéine de différenciation du mésoderme Twist.
a L’invagination du mésoderme provoque la phosphorylation mécaniquement induite du site Y654 de la β-caténine Vue ventrale de l’invagination du mésoderme d’embryons de drosophile. b L’activation de la β-caténine est également causée le premier mouvement morphogénétique chez le poisson-zèbre, l’épibolie. La β-caténine active ensuite le gène brachury, responsable de la différenciation du mésoderme. Cela suggère que le mode mécanotransductionel de détermination biochimique du mésoderme des Bilatériens est hérité de celui d’Ultrabilateria, l’ancêtre commun de ce groupe d’animaux. c Ce processus est encore conservé dans l’activation mécanique de la voie tumorale β-caténine dans les tissus sains de colon comprimés par la pression de croissance tumorale magnétiquement mimée, ou génétiquement induite (pas montré ici), chez la souris.
Le rôle de la mécanotransduction dans l’émergence du mésoderme il y a 570 millions d’années
Les Bilatériens sont un groupe d’animaux partageant comme caractères dérivés un plan de symétrie bilatérale et la présence, en plus de l’ectoderme et de l’endoderme, d’un troisième feuillet embryonnaire : le mésoderme. Les approches purement biochimiques et génétiques peinent depuis deux décennies à trouver quel signal a été à l’origine de l’émergence du mésoderme chez l’ancêtre commun de tous les Bilatériens, vieux d’environ 570 millions d’années. Si le rôle de la β-caténine dans la différenciation du mésoderme a été montré chez de nombreuses espèces, aucun signal biochimique susceptible d’activer cette protéine qui soit commun à tous les Bilatériens n’a été mis en évidence jusqu’ici. Or, nous avons montré, chez le poisson-zèbre, comme chez la drosophile, deux espèces divergeant directement à partir de l’ancêtre commun des Bilatériens, que les premiers mouvements morphogénétiques de l’embryogenèse induisent mécaniquement la phosphorylation du site Y654 de la β-caténine (Figure 6b). Celle-ci est alors activée et provoque la différenciation du mésoderme, dans les deux espèces. Nos observations permettent donc de proposer que l’émergence du mésoderme, il y a 570 millions d’années, a été permise par l’activation mécanique de la phosphorylation de la β-caténine [15].
De façon amusante, depuis nos premières observations dans l’embryon de drosophile, la mécanosensibilité de la voie β-caténine a été trouvée impliquée dans de nombreux autres processus physiologiques. Elle est par exemple impliquée chez le fœtus de souris, pour lequel la formation des articulations osseuses nécessite des chocs mécaniques entre les extrémités des différents os. Ces chocs sont dus aux contractions spontanées des muscles lors du développement embryonnaire et activent la β-caténine. Cette activation inhibe la différenciation en chondrocytes des cellules présentes au niveau de l’articulation, ce qui permet d’éviter la soudure des os composant celle-ci [20]. L’activation mécanique de la β-caténine est également impliquée dans l’inhibition de l’adipogenèse, ce qui expliquerait que les traitements médicaux mécaniques vibratoires du corps tout entier permettent de réduire à hauteur de 20 % le poids des patients atteints d’obésité [21,22]. Elle est enfin observée de façon plus générale en réponse à des sollicitations mécaniques artificielles en culture cellulaire sur des épithéliums de cellules de Mammifère [23]. Mais de façon plus préoccupante, nous l’avons aussi découverte comme impliquée dans les processus de progression tumorale, ou la pression de croissance d’une tumeur, exercée de façon permanente pendant au moins un mois chez la souris, active dans les tissus sains avoisinants les programmes de développement tumoraux par phosphorylation de la Y654 de la β-caténine. Il y a donc en fait une réactivation des voies mécanosensibles du développement, mais au sein du tissu adulte, en réponse à ces contraintes anormales. Cela mène alors à des processus tumoraux dans les tissus sains, donc à l’amplification et à la propagation des tissus tumoraux (Figure 6c) [24].
Conclusion
On le voit, la biologie du développement vit actuellement une profonde évolution au cours de laquelle, ni l’approche avant tout physique du développement du début du siècle dernier, ni l’approche avant tout génétique de la moitié du siècle dernier, ne peuvent permettre, à elles seules, de saisir les mécanismes du développement embryonnaire, Il n’y a en effet pas de déterminisme de nature purement mécanique, pas plus que purement génétique, dans le développement embryonnaire. Nous saisissons aujourd’hui que le développement est la résultante du couplage étroit, permanent, et réciproque, entre les morphogenèses biomécaniques et les morphogenèses biochimiques. La biologie du développement a donc commencé à confirmer par l’expérience depuis un peu plus d’une décennie que le devenir d’un organisme en développement résulte en bonne partie des interactions entre son génome et sa contingence physique qui, dans le cas précis, consiste en sa forme biomécanique. Par extrapolation à l’âge adulte, il se pourrait bien que ce type d’interaction soit généralisable avec l’ensemble des paramètres qui constituent l’environnement physique de l’organisme, bien plus complexe qu’avec la seule mécanique de l’organisme lui-même, et donc bien difficilement prédictible a priori.
Références
- Aristote. Génération des Animaux. II, 22, 523 a 515.
- Thomson, D. A. W. On growth and Form. (1917).
- Leduc, S. La Biologie Synythétique. Etude de Biophysique. (1912).
- His, W. Unsere Korperform und Das Physiologische problem ibrer entstebung. (1875).
- Roux, W. in Biological Lectures of Marine Biology. (ed Ginn) 149-190 (Laboratory Woods Hole, 1894).
- Montavon, T. & Duboule, D. Chromatin organization and global regulation of Hox gene clusters. Philos Trans R Soc Lond B Biol Sci 368, 20120367, doi:10.1098/rstb.2012.0367 (2013).
- Prochiantz, A. Les anatomiues de la pensée. (1995).
- Langlois, C. Étienne Geoffroy Saint-Hilaire, un « naturaliste visionnaire ». Vol. https://planet-vie.ens.fr/article/2371/etienne-geoffroy-saint-hilaire-naturaliste-visionnaire.
- De Robertis, E. M. Evo-devo: variations on ancestral themes. Cell 132, 185-195, doi:10.1016/j.cell.2008.01.003 (2008).
- Young, P. E., Pesacreta, T. C. & Kiehart, D. P. Dynamic changes in the distribution of cytoplasmic myosin during Drosophila embryogenesis. Development 111, 1-14 (1991).
- Dawes-Hoang, R. E. et al. folded gastrulation, cell shape change and the control of myosin localization. Development 132, 4165-4178 (2005).
- Martin, A. C., Kaschube, M. & Wieschaus, E. F. Pulsed contractions of an actin-myosin network drive apical constriction. Nature 457, 495-499, doi:nature07522 [pii] 10.1038/nature07522 (2009).
- Pouille, P. A., Ahmadi, P., Brunet, A. C. & Farge, E. Mechanical Signals Trigger Myosin II Redistribution and Mesoderm Invagination in Drosophila Embryos. Science signaling 2, ra16, doi:scisignal.2000098 [pii] 10.1126/scisignal.2000098 (2009).
- Mitrossilis, D. et al. Mechanotransductive cascade of Myo-II-dependent mesoderm and endoderm invaginations in embryo gastrulation. Nature communications 8, 13883, doi:10.1038/ncomms13883 (2017).
- Brunet, T. et al. Evolutionary conservation of early mesoderm specification by mechanotransduction in Bilateria. Nature communications 4, doi:10.1038/ncomms3821 (2013).
- Desprat, N., Supatto, W., Pouille, P.-A., Beaurepaire, E. & Farge, E. Tissue deformation modulates twist expression to determine anterior midgut differentiation in Drosophila embryos. Developmental Cell 15, 470-477, doi:10.1016/j.devcel.2008.07.009 (2008).
- Farge, E. Mechanical induction of twist in the Drosophila foregut/stomodeal primordium. Curr Biol 13, 1365-1377 (2003).
- Chalfie, M. Neurosensory mechanotransduction. Nature Reviews Molecular Cell Biology 10, 44-52, doi:10.1038/nrm2595 (2009).
- Sawada, Y. et al. Force sensing by mechanical extension of the Src family kinase substrate p130Cas. Cell 127, 1015-1026 (2006).
- Kahn, J. et al. Muscle contraction is necessary to maintain joint progenitor cell fate. Dev Cell 16, 734-743, doi:S1534-5807(09)00175-0 [pii] 10.1016/j.devcel.2009.04.013 (2009).
- Sen, B. et al. Mechanical strain inhibits adipogenesis in mesenchymal stem cells by stimulating a durable beta-catenin signal. Endocrinology 149, 6065-6075 (2008).
- Ekelund, U. et al. Physical activity and gain in abdominal adiposity and body weight: prospective cohort study in 288,498 men and women. The American journal of clinical nutrition 93, 826-835, doi:10.3945/ajcn.110.006593 (2011).
- Benham-Pyle, B. W., Pruitt, B. L. & Nelson, W. J. Cell adhesion. Mechanical strain induces E-cadherin-dependent Yap1 and beta-catenin activation to drive cell cycle entry. Science 348, 1024-1027, doi:10.1126/science.aaa4559 (2015).
- Fernandez-Sanchez, M. E. et al. Mechanical induction of the tumorigenic beta-catenin pathway by tumour growth pressure. Nature 523, 92-95, doi:10.1038/nature14329 (2015).