Les polycétide synthases sont de grands complexes formés de plusieurs enzymes qui synthétisent diverses petites molécules de manière séquentielle.
Les polycétide synthases (en anglais polyketide synthases, PKS) sont présentes dans une grande diversité d’organismes, que ce soit des bactéries, des champignons ou des plantes, et sont responsables de la production de divers composés naturels bioactifs. Plusieurs polycétides1 sont d’importance médicale, comme des antibiotiques (érythromycine, tétracycline), des immunosuppresseurs (rapamycine), des traitements anticancéreux (épothilone, doxorubicine) et des antifongiques (amphotéricine B, avermectine).
Des méga-enzymes modulaires
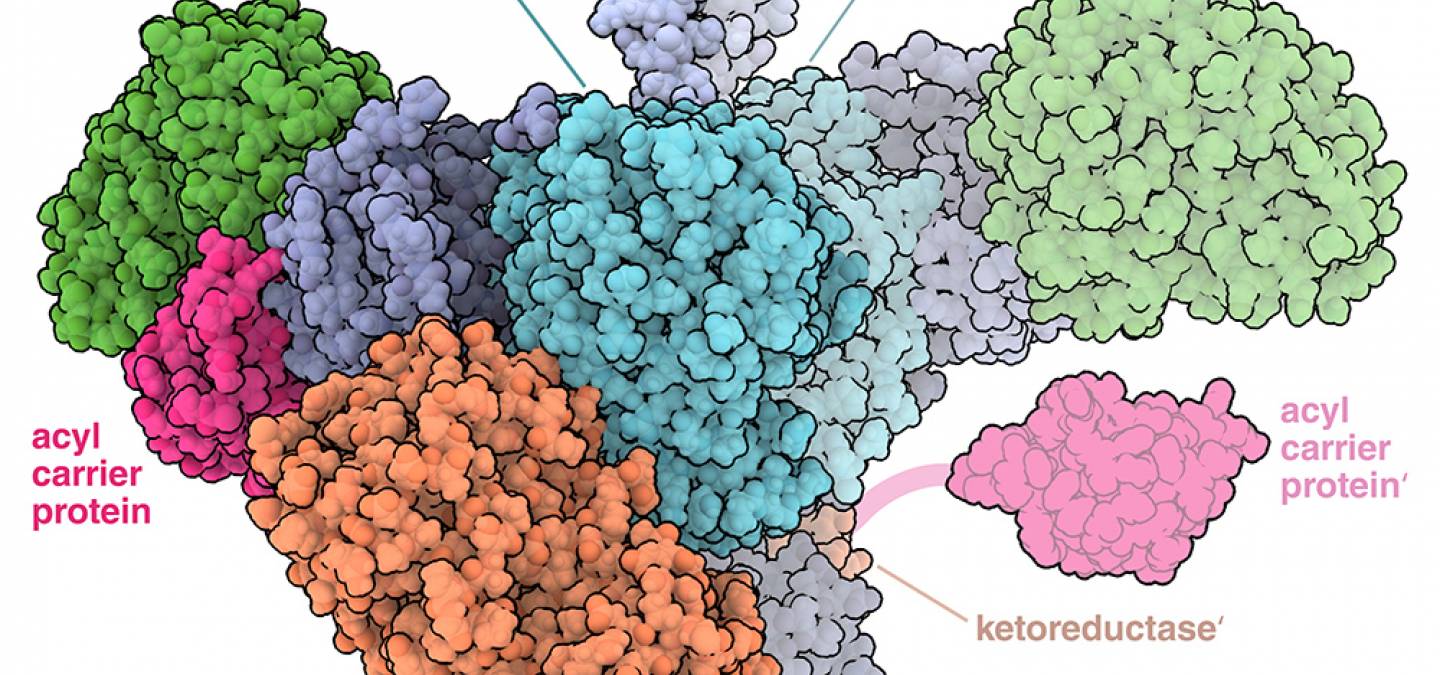
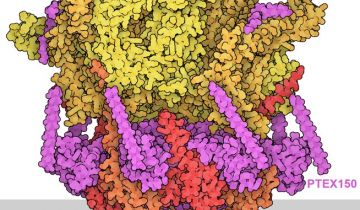
Certaines polycétide synthases sont des complexes particulièrement importants composés de plusieurs modules. Chacun d’entre eux est constitué de plusieurs domaines enzymatiques distincts qui participent chacun à la synthèse du polycétide. Les domaines trouvés généralement dans les modules des polycétide synthases comprennent une protéine porteuse d’acyle (ACP), qui est chargée de transporter le polycétide en formation d’un domaine vers le suivant, un domaine acyltransférase (AT) qui transfère une molécule d’acyl-CoA sur la protéine porteuse d’acyle, et un domaine cétosynthase (KS), qui catalyse la croissance de la chaîne de polycétide par une réaction de condensation avec l’acyl-CoA. D’autres domaines, comme la cétoréductase (KR), peuvent modifier davantage le polycétide en croissance. Ces différents domaines peuvent être observés dans le module Lsd14 représenté sur la figure 1 (entrée 7S6B de la banque de données sur les protéines, PDB). Ce module fait partie d’une polycétide synthase impliquée dans la synthèse de l’antibiotique lasalocide A par la bactérie Streptomyces lasalocidi.
La protéine porteuse d’acyle (ACP) représentée à droite était absente de la structure déterminée expérimentalement et est représentée attachée au domaine de la cétoréductase par l’intermédiaire d’un lien flexible. D'après l'entrée PDB 7S6B de la banque de données sur les protéines (PDB).
Des travailleurs à la chaîne
Lsd14 fait partie d’une classe de polycétide synthases appelées polycétide synthases à chaîne d’assemblage. Dans ces grands complexes, la chaîne de polycétide en croissance est modifiée exactement une fois par chaque domaine enzymatique de chaque module, de manière séquentielle. La protéine porteuse d’acyle, qui tient une extrémité du polycétide et qui se déplace en l’acheminant vers le domaine ou le module suivant, joue un rôle central dans cette chorégraphie millimétrée.
Maintenir l’ordre d’assemblage
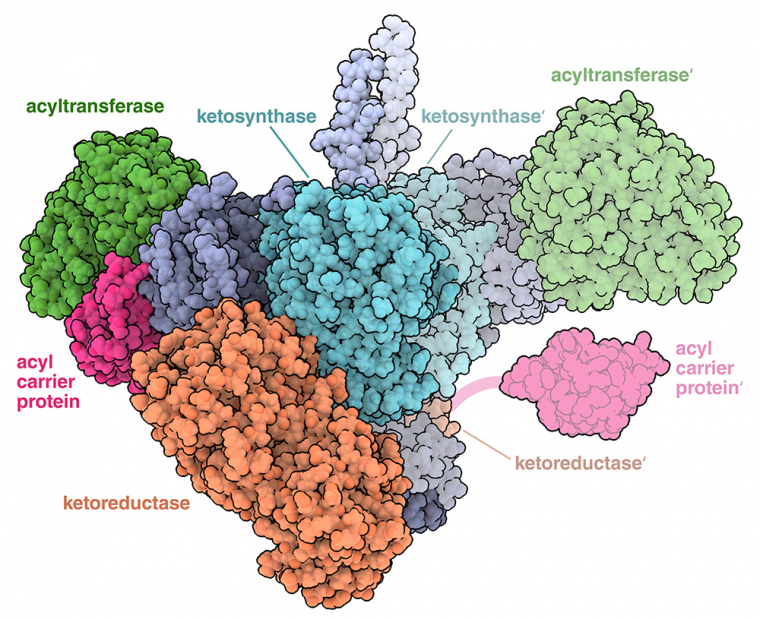
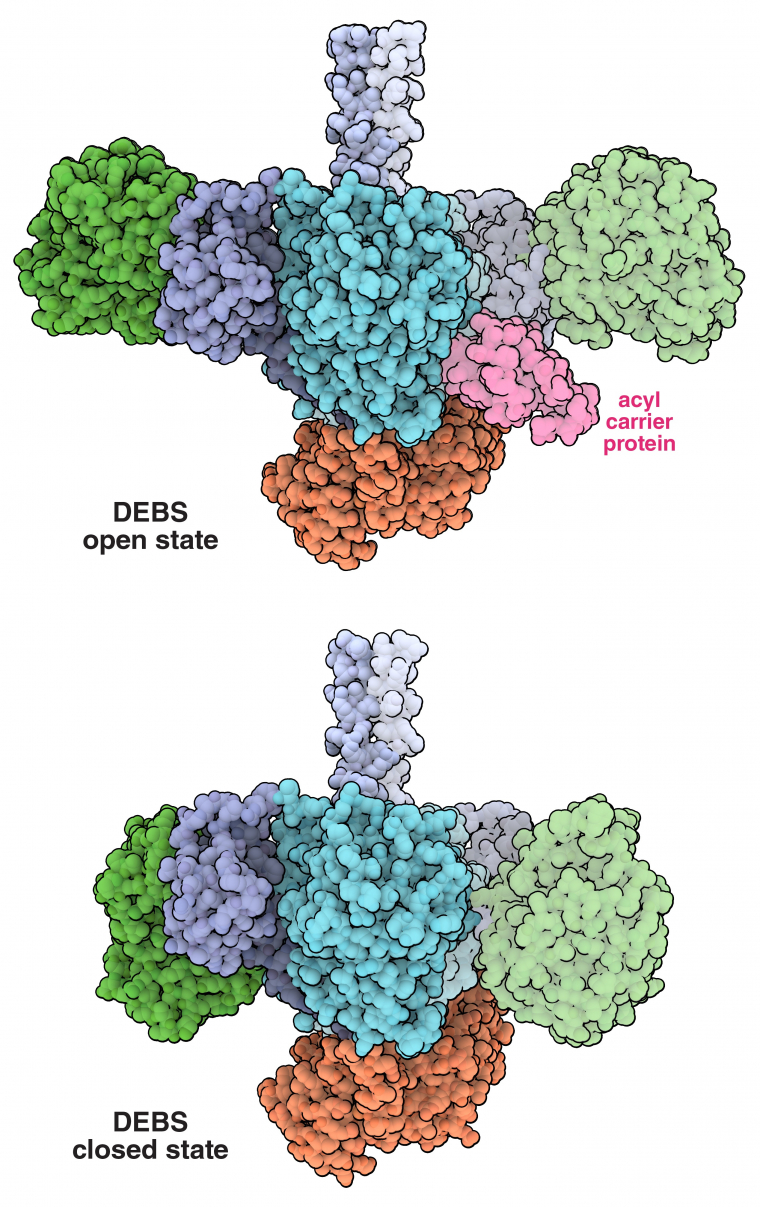
Des analyses structurales récentes de différents modules de polycétide synthases à chaîne d’assemblage, dont Lsd14 et un module de la 6-désoxyérythronolide synthase (DEBS M1, représenté sur la figure 2), ont décrit la manière dont les domaines d’un module sont agencés dans l’espace. Ces analyses ont révélé une structure dimérique asymétrique inattendue, avec deux « chambres réactionnelles » séparées. L’asymétrie (observée dans l’état ouvert de l’enzyme DEBS M1, à l’entrée PDB 7M7F, et dans la structure Lsd14 de la figure 1) suggère qu’un seul côté ou qu’une seule chambre de réaction de la polycétide synthase peut être utilisé à la fois, ce qui empêcherait un deuxième cycle de croissance des polycétides dans le même module 1. Les changements de conformation au sein d’un module d’une polycétide synthase peuvent également garantir que la synthèse se déroule dans un seul ordre. Dans l’enzyme DEBS M1, un changement de conformation dans le domaine acyltransférase, qui serait déclenché par la réaction de condensation dans le domaine cétosynthase, entraîne le module dans un état fermé (entrée PDB 7M7 J), ce qui empêche la protéine porteuse d’acyle de se lier à nouveau au domaine cétosynthase 2. De même, dans le module Lsd14, différents états conformationnels bloquant des sites catalytiques spécifiques ont été mis en évidence, et ils empêcheraient également la protéine porteuse d’acyle d’interagir avec des domaines enzymatiques dans un ordre différent 3.
La synthèse des polycétides en action
La figure 3 représente le module 5 de la polycétide synthase PikAIII, qui synthétise la pikromycine chez Streptomyces venezuelae. Ce module est disponible sur la base de données de microscopie électronique en trois dimensions (EMDB) à l’entrée EMDB 5647-5653 1. L’animation a été créée en collaboration avec Georgios Skiniotis. Contrairement au module Lsd14 ou DEBS, décrits ci-dessus, PikAIII est symétrique et serait capable de catalyser des réactions dans les deux chambres de réaction en même temps 2. La première partie de l’animation montre comment les protéines porteuses d’acyle (ACP) transportent et délivrent la chaîne de polycétide (représentée par un point lumineux) à travers une série de modules. La deuxième partie de l’animation représente un seul module et montre la croissance progressive du polycétide grâce à l’action des domaines acyltransférase (AT) et cétosynthase (KS) 3.
L’arrimage différentiel
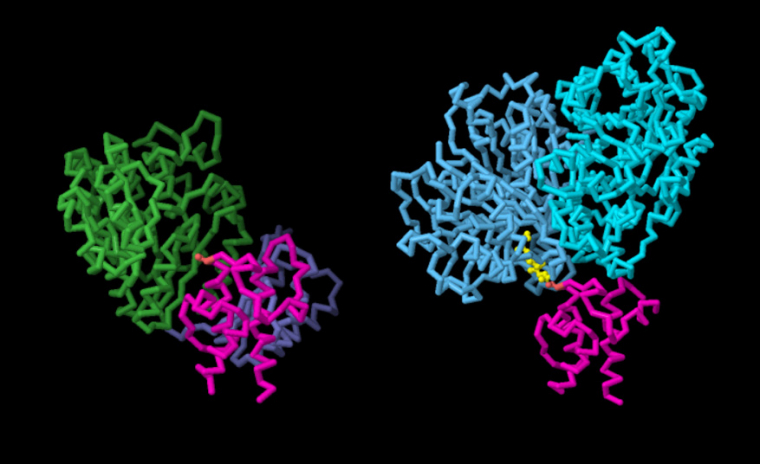
Lors de sa progression dans les cycles d’élongation, le polycétide est maintenu par une protéine porteuse d’acyle qui reconnaît et qui s’arrime à différents sites enzymatiques à divers moments. Comme représenté sur la figure 4, des études sur le module Lsd14 et d’autres polycétide synthases ont montré comment la protéine porteuse d’acyle (ACP, en rose) s’arrime d’abord à l’acyltransférase (en vert, entrée PDB 7S6B), puis à la cétosynthase (en turquoise, entrée PDB 7S6C) à l’aide d’une interface différente 1.
Pour aller plus loin
Les polycétide synthases font partie d’une superfamille de protéines qui comprend les synthases d’acides gras. Comme les polycétide synthases, les synthases d’acides gras fonctionnent de manière modulaire et utilisent des protéines porteuses d’acyle dans le transport d’une chaîne de molécules en croissance d’une enzyme à l’autre. Vous pouvez retrouver un article de la molécule du mois à ce sujet, écrit par David S. Goodsell : Molecule of the Month : Fatty Acid Synthase.
Ce texte correspond à la traduction par Cédric Bordi de l’article Molecule of the Month : Assembly Line Polyketide Synthases 1 écrit par Janet Iwasa et paru en janvier 2025 sur le site PDB-101, le portail éducatif de la base de données sur les protéines (PDB). La note de bas de page est un ajout du traducteur.