Des chercheurs visualisent le mécanisme de la résistance aux antibiotiques.
Environ 75 % des antibiotiques utilisés aujourd’hui font partie de la famille des β-lactamines, un groupe qui comprend les pénicillines, les céphalosporines et les carbapénèmes, et qui est caractérisé par un noyau β-lactame particulier à quatre atomes. Ces antibiotiques sont efficaces parce qu’ils ressemblent aux substrats naturels des protéines responsables du remodelage des parois cellulaires bactériennes. Lorsque les enzymes de la paroi cellulaire se lient aux médicaments de la famille des β-lactamines, ces derniers les empêchent de se fixer à leurs substrats normaux, ce qui interrompt la synthèse de la paroi bactérienne et conduit finalement à la mort de la cellule. Cependant, des bactéries ont développé une résistance à ces antibiotiques grâce à une famille de protéines appelées β-lactamases, qui se lient aux molécules de la famille des β-lactamines et hydrolysent le noyau β-lactame, rendant ainsi les antibiotiques inefficaces.
De nouvelles technologies permettent de visualiser, à l’échelle atomique, les détails des réactions au fur et à mesure qu’elles se produisent
Pour concevoir de meilleurs médicaments, il est essentiel de comprendre le fonctionnement des β-lactamases. Cela représente toutefois un défi, car la réaction d’hydrolyse se produit très rapidement et elle est difficile à repérer à l’aide des techniques structurales classiques. Dans la cristallographie aux rayons X, les protéines cristallisées sont exposées à des faisceaux de rayons X permettant d’obtenir un schéma de diffraction qui peut être utilisé pour déterminer les structures moléculaires. Ces rayons X ont tendance à être continus et d’intensité relativement faible, ce qui permet d’exposer un cristal à un faisceau de rayons X pendant une période prolongée tout en recueillant des données. Une technique plus récente, la cristallographie femtoseconde en série (serial femtosecond crystallography, SFX), utilise des lasers à électrons libres à rayons X (X-ray free-electron lasers, XFEL) pour délivrer des impulsions courtes et intenses de rayons X à des échantillons, capturant les figures de diffraction juste avant que les échantillons ne soient détruits 1.
De petits cristaux peuvent être utilisés pour la cristallographie femtoseconde en série, ce qui permet aux chercheurs d’introduire rapidement de petites molécules (comme des antibiotiques) dans les cristaux de protéines à l’aide de mélangeurs diffusifs spécialement conçus à cet effet. Ces petites molécules peuvent alors diffuser dans les cristaux de protéines et déclencher une réaction. Grâce à cette nouvelle méthode, appelée mix-and-inject-serial-crystallography (MISC, ce qui pourrait être traduit par cristallographie en série après mélange et injection), il est possible d’observer une réaction à haute résolution en injectant les cristaux mélangés à l’antibiotique dans le faisceau des lasers à électrons libres à rayons X (XFEL) à différents moments après le mélange.
La résistance aux antibiotiques en action
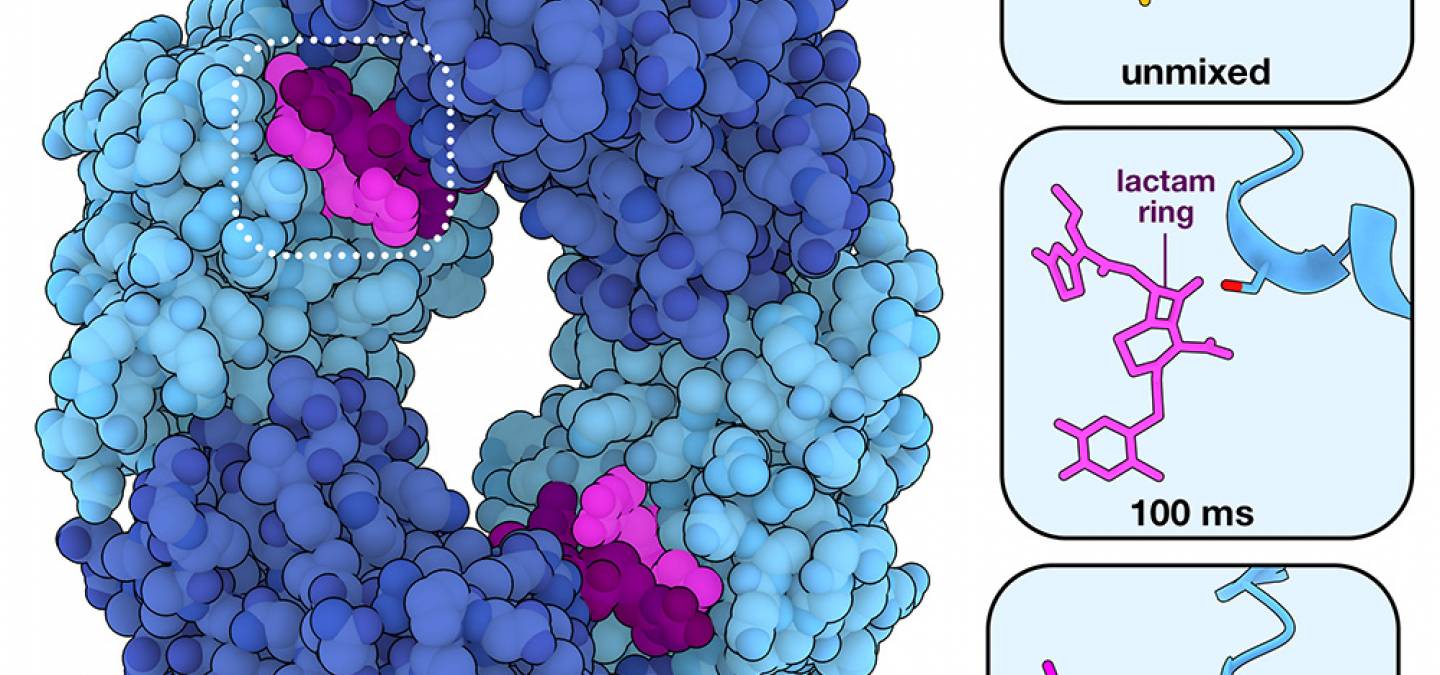
En 2018, des chercheurs ont conçu une expérience MISC pour voir s’ils pouvaient capturer l’action d’une β-lactamase à l’aide d’un faisceau de lasers à électrons libres à rayons X (XFEL) 2. Dans cette expérience, de minuscules cristaux de protéines de la β-lactamase BlaC de Mycobacterium tuberculosis ont été mélangés à un antibiotique, la ceftriaxone, juste avant d’être exposés à des impulsions de rayons X. Les données recueillies à 30 millisecondes, 100 millisecondes, 500 millisecondes et 2 secondes après le mélange ont révélé que la coupure se produit principalement entre 100 et 500 millisecondes. La réaction implique une attaque nucléophile par une sérine de la β-lactamase, qui ouvre le noyau β-lactame et forme un intermédiaire à liaison covalente avant que le noyau β-lactame ne soit hydrolysé et libéré. En deux secondes, l’enzyme s’est déjà liée à un nouvel antibiotique 3. Comme cela est représenté sur la figure 1, la β-lactamase BlaC, cristallisée sous la forme d’un tétramère (entrée de la banque de données des protéines (PDB) 6B68), est composée de quatre copies de l’enzyme. Il est intéressant de noter que seules deux des quatre enzymes ont été observées en train de catalyser la réaction d’hydrolyse au cours de l’expérience.
Seules deux des sous-unités (représentées en bleu clair) ont été observées en train de catalyser l’hydrolyse des β-lactamines. Deux molécules de ceftriaxone, un antibiotique de la famille des β-lactamines, sont liées dans le site actif, mais seule l’une d’entre elles (représentée en rose plus clair) est hydrolysée. Les vignettes sur le côté droit montrent des instantanés avant l’ajout de l’antibiotique (entrée PDB 6B5X), 100 ms après le mélange de l’antibiotique (entrée PDV 6B68) et 500 ms après le mélange (entrée PDB 6B69). Entre 100 et 500 ms, le noyau β-lactame est hydrolysé.
Saisir l’action des inhibiteurs
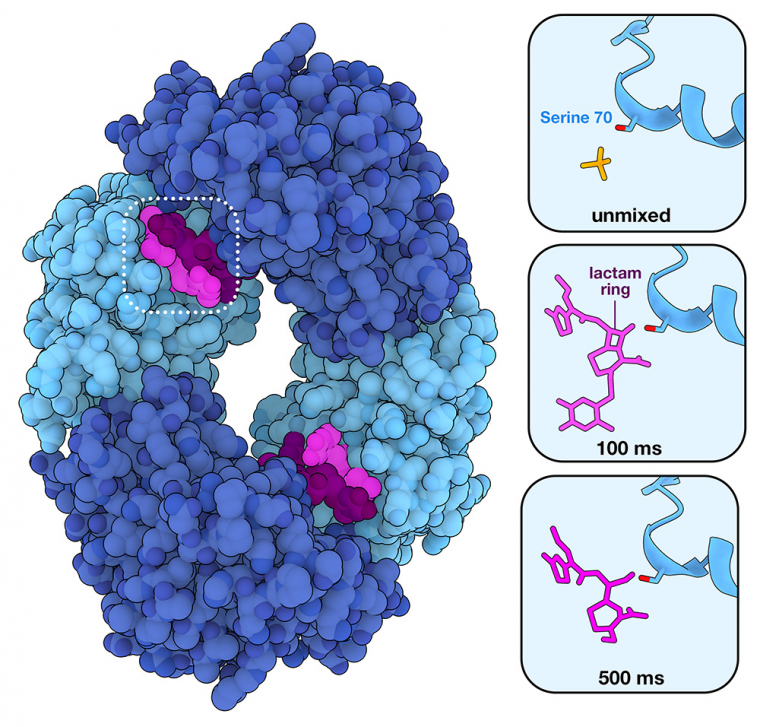
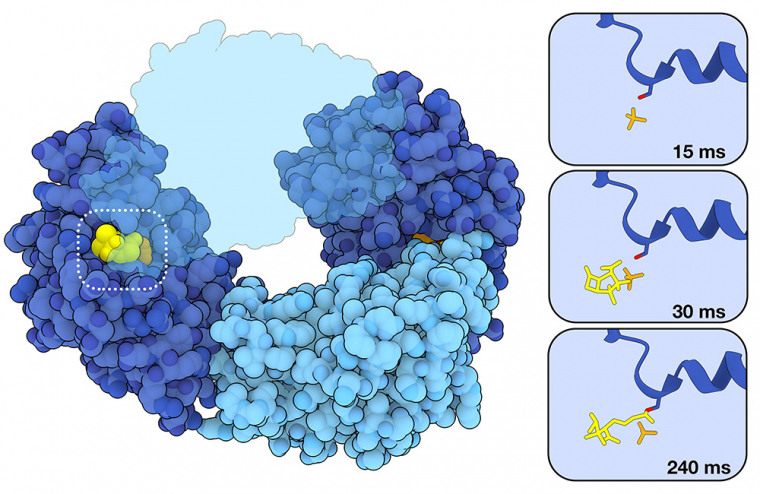
La cristallographie en série après mélange et injection (MISC) a également été utilisée pour étudier l’inhibition des β-lactamases par des inhibiteurs appelés substrats suicides, qui se lient de manière irréversible aux β-lactamases et bloquent leur activité. L’inhibition de BlaC par l’un de ces médicaments, le sulbactam, a été récemment étudiée 1. Comme cela est représenté sur la figure 2, le processus d’inhibition commence par la formation d’un complexe non covalent enzyme-inhibiteur dans le site actif (représentation au bout de 30 ms, entrée PDB 8EBR). Comme dans le cas de la réaction avec la ceftriaxone, cette formation est suivie d’une attaque nucléophile de la sérine active du site catalytique. Dans ce cas, cependant, il en résulte un intermédiaire acyl-enzyme lié de manière covalente qui rend l’enzyme inactive (représentation au bout de 240 ms, entrée PDB 8EC4). Le sulbactam, dont la taille est inférieure à celle d’antibiotiques comme la ceftriaxone, a été observé dans le site actif des quatre sous-unités de l’enzyme BlaC. Dans les deux sous-unités représentées en bleu clair, cependant, la réaction se produit si rapidement que le sulbactam n’a pas pu être observé avant la catalyse. Dans les sous-unités représentées en bleu foncé, la réaction se déroule suffisamment lentement pour que les chercheurs puissent observer la liaison du sulbactam à l’enzyme avant la catalyse. Le sulbactam et des inhibiteurs similaires ont été approuvés par l’Agence américaine des produits alimentaires et médicamenteux (Food and Drug Administration, FDA) pour être utilisés dans des combinaisons à dose fixe avec des β-lactamines déjà approuvées (par exemple l’unasyn2 correspond au mélange de sulbactam et d’ampicilline).
Le sulbactam est capable de se fixer dans le site actif et de se lier de manière covalente à la sérine du site catalytique, empêchant ainsi la β-lactamase BlaC de se lier et d’hydrolyser de nouveaux substrats antibiotiques. La sous-unité supérieure est représentée en semi-transparence pour mieux visualiser la liaison au sulbactam.
Voir la β-lactamase en action
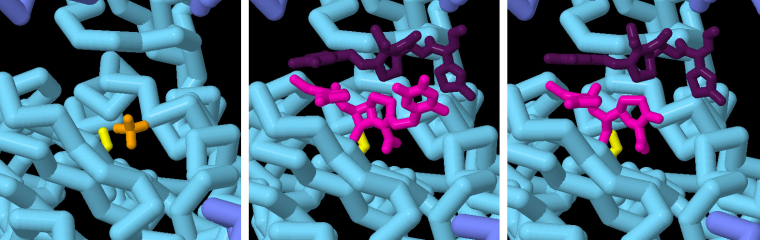
La figure 3 montre différents instantanés du processus d’inactivation de la ceftriaxone par la bêta-lactamase. La fixation de l’antibiotique et l’hydrolyse ultérieure de son noyau β-lactame sont révélés à une résolution atomique. La sérine du site catalytique de l’enzyme est représentée en jaune. L’antibiotique inactivé est représenté en rose, tandis qu’une deuxième molécule d’antibiotique, pouvant se lier au site actif de l’enzyme une fois qu’il est vide, est représentée en violet. Vous pouvez visualiser une animation de ces structures, en vous rendant sur la page de l’article d'origine (en anglais), et en cliquant sur l’onglet JSmol de la section Exploring the structure.
La sérine du site catalytique est représentée en jaune, la ceftriaxone inactivée est représentée en rose. Une seconde molécule de ceftriaxone est représentée en violet.
Pour aller plus loin
-
Vous pouvez découvrir une autre β-lactamase, la métallo-bêta-lactamase de New Delhi en lisant un ancien article de la molécule du mois : Molecule of the Month : New Delhi Metallo-Beta-Lactamase.
-
Vous pouvez lire un article pour en savoir plus sur les superbactéries et la résistance aux antibiotiques sur le site PDB-101. Vous pouvez également retrouver un article sur le site Planet-Vie : La résistance aux antibiotiques.
-
Les antibiotiques n’agissent pas tous de la même manière sur les microorganismes. De nombreux antibiotiques bactériens s’attaquent aux parois cellulaires, comme la pénicilline et la vancomycine. Certains antifongiques, en revanche, comme l’actinomycine, ciblent l’ADN.
-
Les techniques de cristallographie à résolution temporelle ont également été utilisées pour capturer des protéines activables par la lumière. Vous pouvez lire un article de la molécule du mois à ce sujet : Molecule of the month ; Photoactive yellow protein.
Ce texte correspond à la traduction par Cédric Bordi de l’article Molecule of the Month : Capturing Beta-Lactamase in Action 1 écrit par Janet Iwasa et paru en juillet 2025 sur le site PDB-101, le portail éducatif de la base de données sur les protéines (PDB).