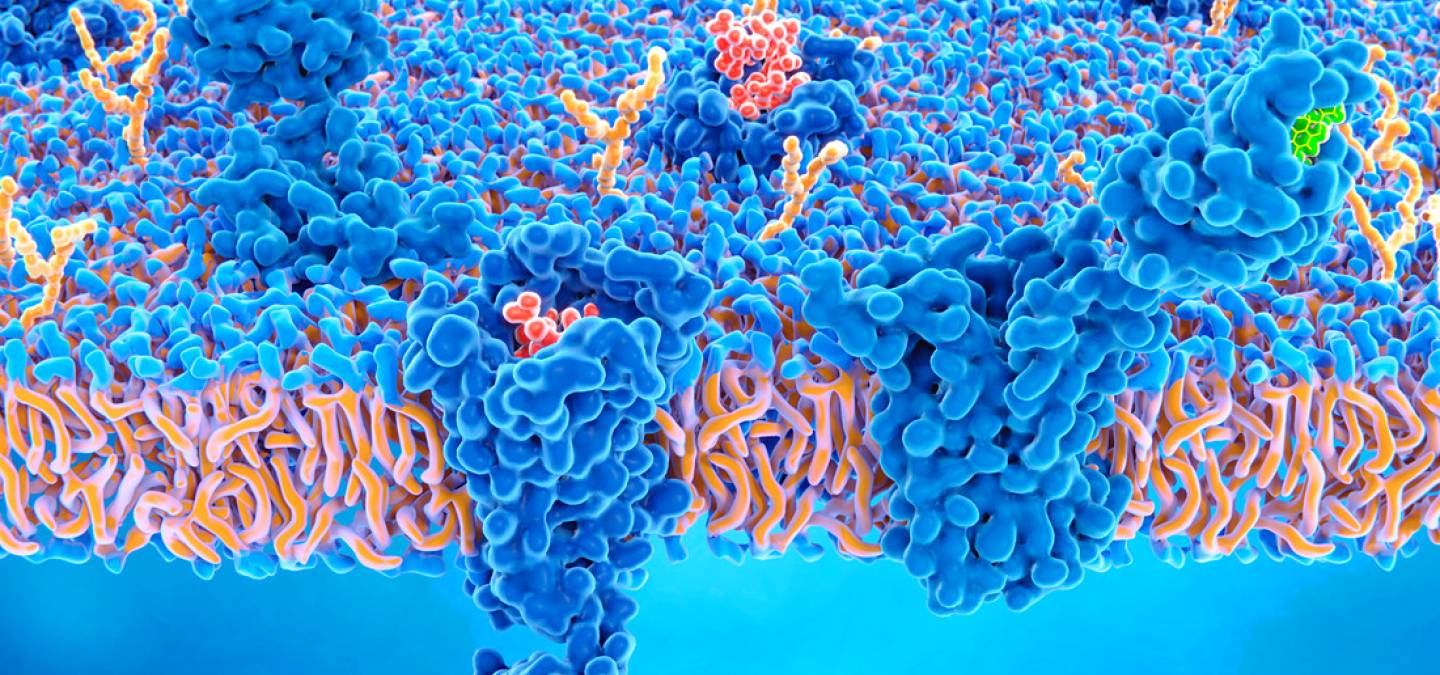
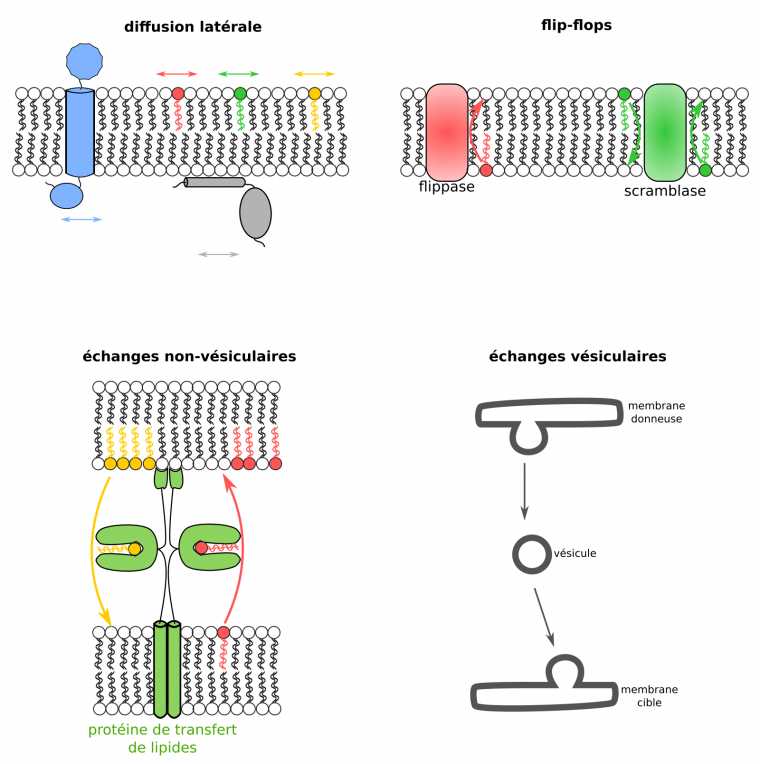
Les membranes biologiques constituent des édifices dynamiques. En effet, les composés membranaires (protéines et lipides) diffusent latéralement, bien qu'un certain nombre de mécanismes limitent cette diffusion. De plus, la composition des deux feuillets diffère, grâce à des transferts actifs de lipides d'une hémimembrane à l'autre. Enfin, les éléments constituant les membranes peuvent varier dans le temps, du fait d'échanges vésiculaires ou non vésiculaires.
Tous les organismes sont composés d’une ou plusieurs cellules : la cellule constitue l’unité structurale et fonctionnelle du vivant. Chaque cellule est définie par la barrière sélective qui constitue sa frontière vis-à-vis de son environnement : la membrane plasmique. Par ailleurs, la plupart des cellules eucaryotes et certaines cellules procaryotes possèdent également des membranes délimitant des compartiments intracellulaires, permettant une compartimentation supplémentaire. Les membranes biologiques permettent la réalisation d’un grand nombre de fonctions (informatives, métaboliques, structurales), adaptées aux besoins de la cellule et aux conditions de son environnement. La plupart de ces fonctions et leur adaptabilité sont permises par leur dynamisme, c’est-à-dire le fait qu’elles soient le siège de mouvements, de changements.
Comment la composition des membranes biologiques les rend-elle dynamiques ? Quels sont les différents aspects de la dynamique des membranes biologiques ? Comment est modulée cette dynamique ?
Dans cet article, après un rapide rappel de la structure des membranes des Eucaryotes, nous verrons que les membranes biologiques présentent une dynamique latérale qui est contrôlée par de nombreux paramètres dans les cellules, puis que des protéines permettent une dynamique verticale, et enfin que des échanges entre membranes contribuent au dynamisme de ces édifices.
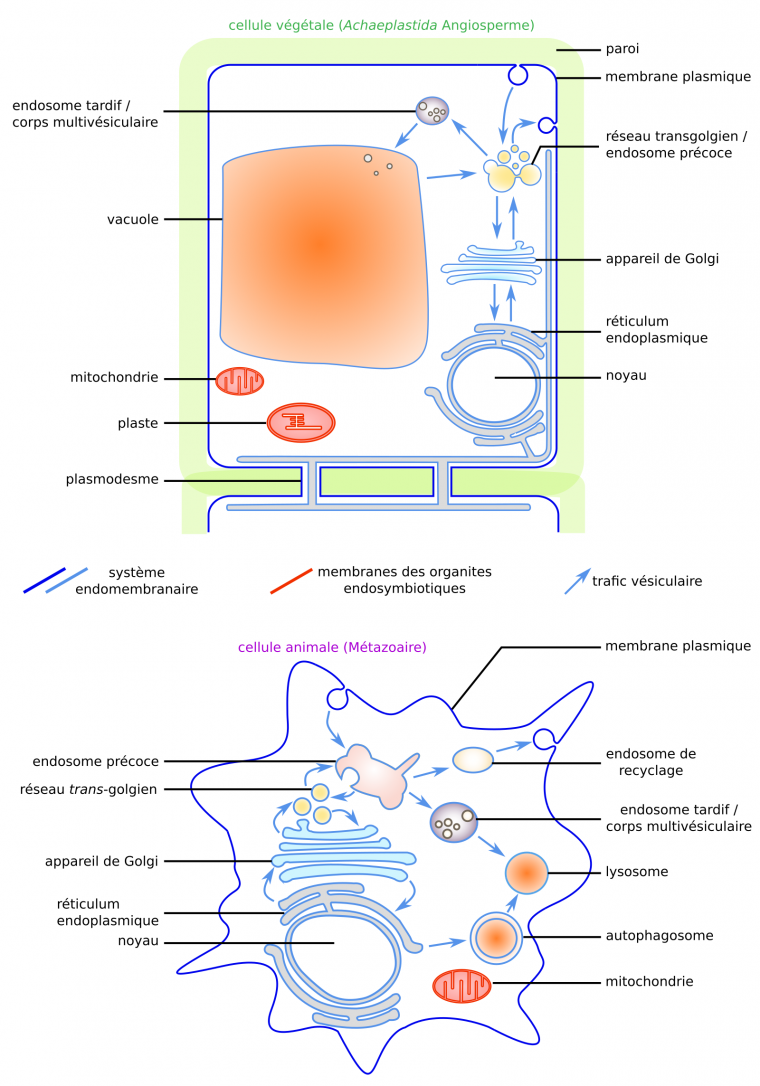
On se limitera ici au système endomembranaire des Eucaryotes, constitué par les membranes participant au trafic vésiculaire : la membrane plasmique et les membranes des organites non endosymbiotiques tels que les endosomes, l’appareil de Golgi, le réticulum endoplasmique, les vacuoles, les lysosomes (Figure 1). Dans un souci de concision, l’accent sera mis sur les propriétés des membranes biologiques, les fonctions permises par le dynamisme des membranes seront plus rapidement évoquées.
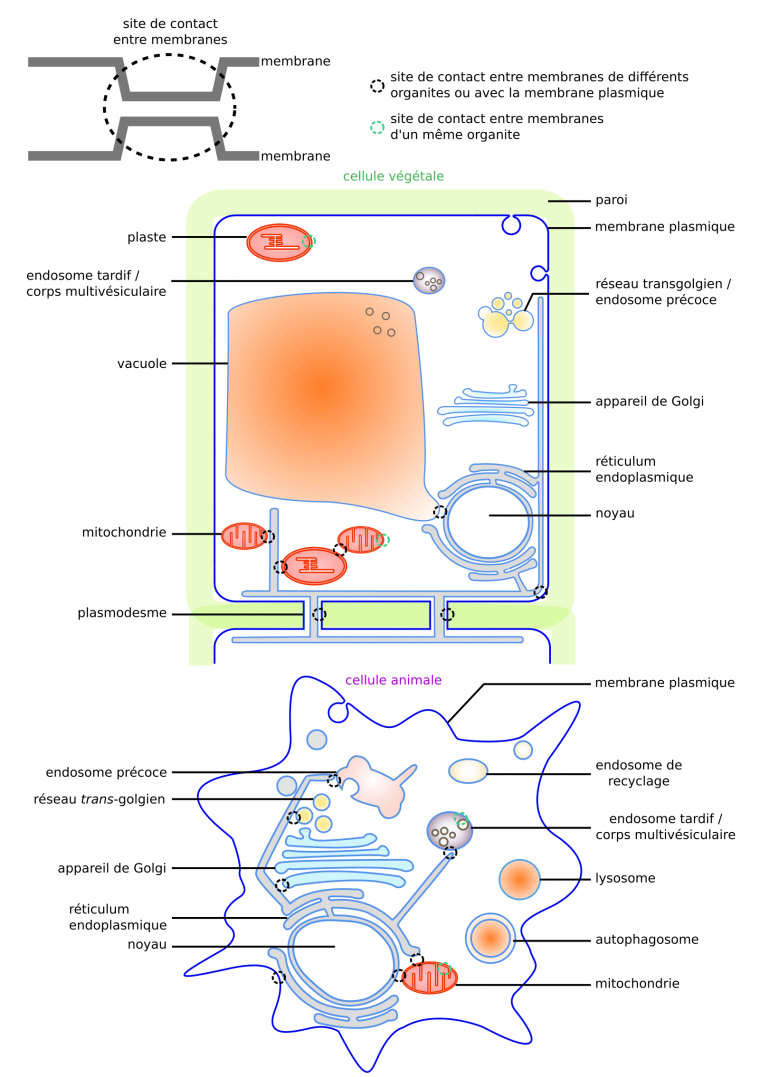
Cellule végétale (haut) et cellule animale (bas). Adapté de [14].
Les membranes des Eucaryotes, des bicouches protéolipidiques
La membrane plasmique des érythrocytes (globules rouges) des Mammifères, cellules qui n’ont pas d’autres membranes, a été extensivement étudiée, et a servi de modèle pour établir la structure plus générale des membranes biologiques. Elle comporte des protéines, des lipides et des glucides liés à des protéines ou des lipides. En masse, les lipides représentent environ 40 % des composants membranaires (environ 60 % pour les protéines). Dans l’espace, les lipides occupent 70 à 90 % de la surface membranaire. En nombre, les lipides représentent environ 98 % des composants membranaires [1,2]. Les membranes des Eucaryotes partagent une organisation en bicouche, formée par deux feuillets tête-bêche de lipides membranaires1.
Les lipides membranaires s’assemblent en bicouche
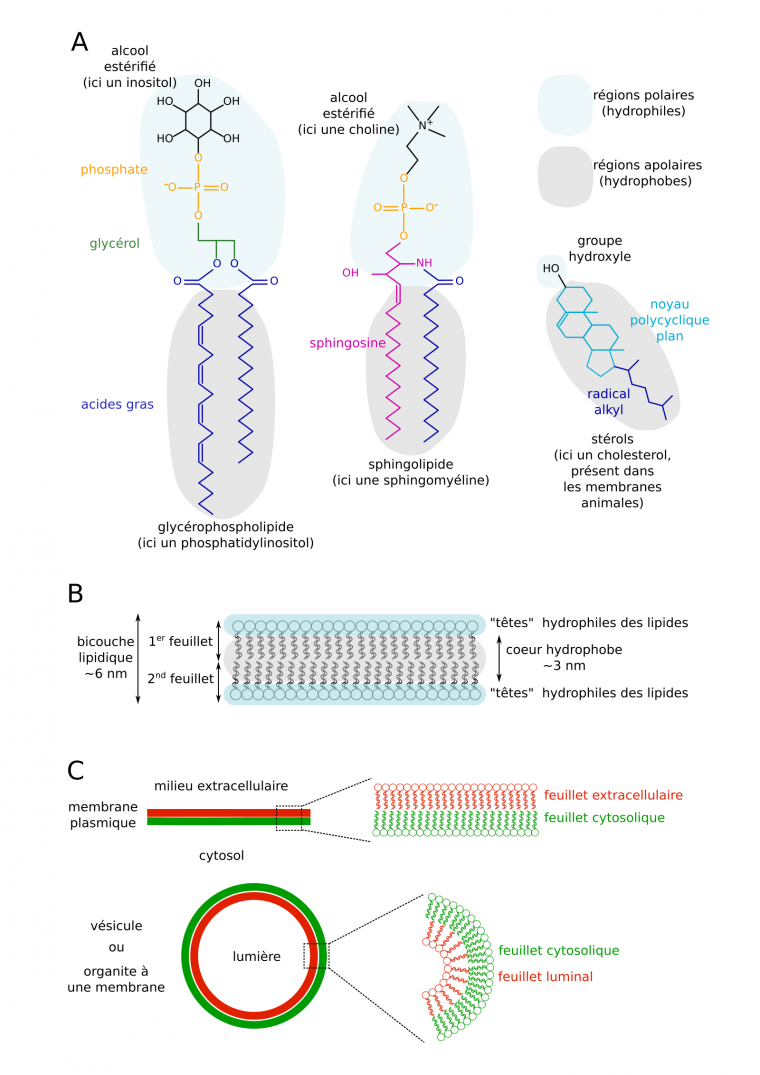
Différents lipides membranaires existent. Plus de la moitié sont des phospholipides : soit des esters de glycérol, d’acides gras et d’acide phosphorique (glycérophospholipides), soit des amides de sphingosine et d’un acide gras, estérifiés par un acide phosphorique (sphingolipides). Il existe aussi environ 30 % de stérols membranaires, dont le cholestérol des membranes animales, le sistostérol des végétaux, et l’ergostérol des Eumycètes [3]. Ils sont composés d’un noyau polycyclique lié d’un côté à une courte chaîne carbonée et de l’autre à un groupe hydroxyle −OH (fonction alcool). Les lipides membranaires partagent un caractère amphiphile, avec (i) une région polaire hydrophile interagissant avec le solvant aqueux ou d’autres groupes polaires, via des liaisons hydrogènes et d’autres interactions électrostatiques, et (ii) une région apolaire hydrophobe pouvant former des liaisons de Van der Waals avec d’autres groupes apolaires (Figure 2A).
(A) Trois exemples de lipides membranaires. (B) Auto-organisation de lipides membranaires en bicouche. (C) Dénomination des feuillets (hémimembranes) de la membrane plasmique et de membranes d’organites ou vésicules.
Ces propriétés expliquent que des lipides membranaires s’assemblent (principalement) en bicouche dans un solvant polaire comme l’eau : ils forment deux feuillets, qui délimitent deux bordures hydrophiles et une couche centrale hydrophobe (Figure 2B). In vivo, pour la membrane plasmique, on parle de feuillet cytosolique (ou interne) et de feuillet extracellulaire (ou externe ; Figure 2C). Pour les vésicules et organites, on parle de feuillet cytosolique et de feuillet luminal (côté lumière ; Figure 2C). Les deux feuillets d’une même membrane peuvent être de composition très différente : par exemple, le feuillet extracellulaire de la membrane plasmique est riche en stérols, glycolipides1, sphingolipides, et est lié à des protéines ou domaines protéiques différents de ceux du feuillet cytosolique, qui lui est enrichi en phosphatidylsérine (PS) et en phospho-inositides (PIP2, PI4P, etc. ; voir 2.3.1.).
Les protéines membranaires sont associées plus ou moins fermement aux membranes
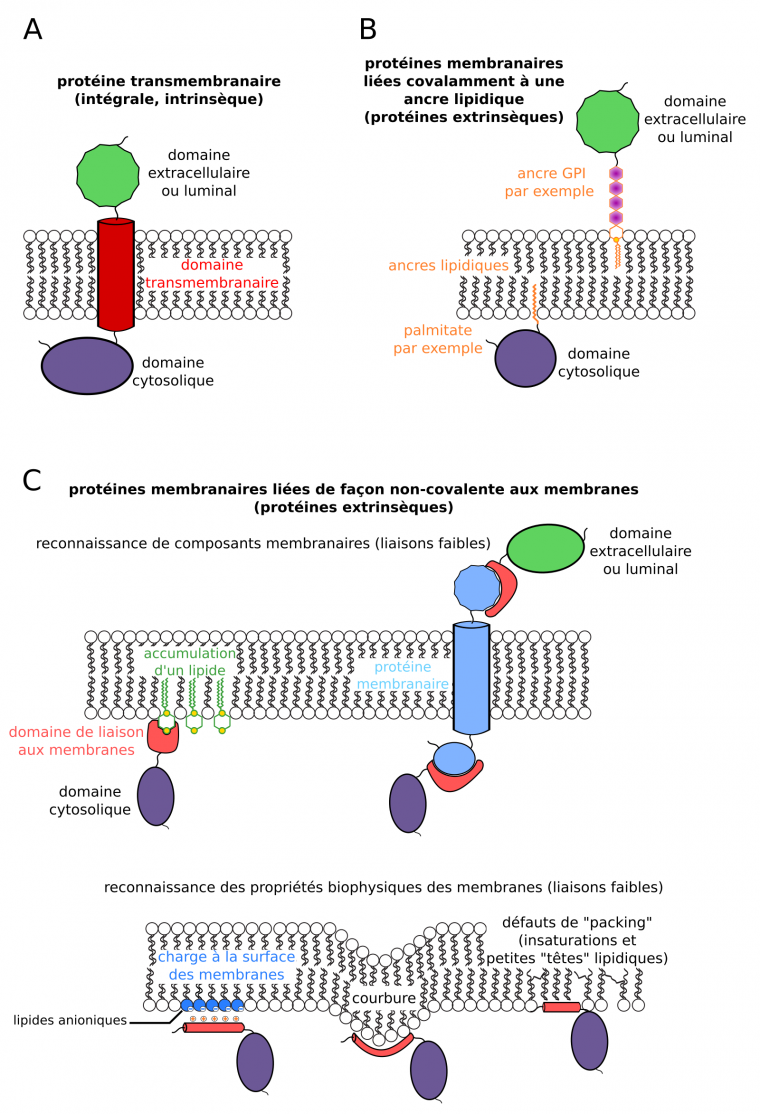
Il existe trois mécanismes d’association entre protéines membranaires et membranes, définissant trois types de protéines membranaires : les protéines membranaires transmembranaires (ou intrinsèques), les protéines membranaires extrinsèques (ou périphériques) ancrées de façon covalente à une membrane, et les protéines extrinsèques (ou périphériques) ancrées de façon non covalente à une membrane2.
Les protéines transmembranaires (intégrales, intrinsèques) possèdent une ou plusieurs structures secondaires organisées en domaines s’insérant au travers d’une membrane biologique. Les plus courants sont les hélices α transmembranaires, dont des radicaux d’acides aminés apolaires interagissent avec les lipides membranaires (Figure 3A). C’est par exemple le cas des cadhérines (cellules animales) ou des transporteurs d’auxine PIN (cellules végétales) [4].
D’autres protéines membranaires ont subi des modifications post-traductionnelles les liant de façon covalente à un lipide qui s’insère dans les membranes : liaison à un acide gras par acylation3 (par exemple un acide myristique ou un acide palmitique), prénylation4, liaison à un glycolipide (par exemple une ancre GPI, pour glycosylphosphatidylinositol ; Figure 3B) [5]. C’est par exemple le cas de petites protéines G comme ROP6 (Rho of Plants 6) [6,7].
Enfin, des protéines membranaires extrinsèques sont associées à la surface de la membrane via des liaisons faibles avec d’autres composants membranaires. Il peut s’agir d’une reconnaissance spécifique de lipides ou de protéines membranaires (reconnaissance biochimique ; Figure 3C), comme la protéine SidM injectée par les bactéries Legionella dans le cytoplasme des cellules infectées, qui reconnaît le PI4P (phosphatidylinositol-4-phosphate) [8,9]. Souvent, les protéines interagissent avec des zones de la membrane présentant des propriétés biophysiques particulières : champ électrostatique (charge) sous-membranaire, courbure, défauts d’agencement lipidique (packing defects) causés par la présence locale d’insaturations et de petites têtes polaires (Figure 3C). C’est par exemple le cas de kinases chez Saccharomyces cerevisiae et dans les cellules animales, qui reconnaissant le fort champ électronégatif à la surface du feuillet cytosolique de la membrane plasmique [10].
(A) Association aux membranes des protéines transmembranaires (intrinsèques, intégrales). (B) Association de protéines aux membranes par liaison covalente à une ancre lipidique (protéines périphériques, extrinsèques). (C) Association de protéines aux membranes par des liaisons non covalentes (protéines périphériques, extrinsèques).
Bilan
Les membranes biologiques sont composées d’une bicouche de lipides à laquelle des protéines sont associées. Il s’agit d’édifices supramoléculaires stables grâce aux nombreuses interactions au sein des membranes, ainsi qu’entre composants membranaires et solvant aqueux. Si les membranes sont des structures stables, elles ne sont pas pour autant statiques.
Les membranes : des structures présentant une dynamique horizontale
Observation de la dynamique horizontale des membranes
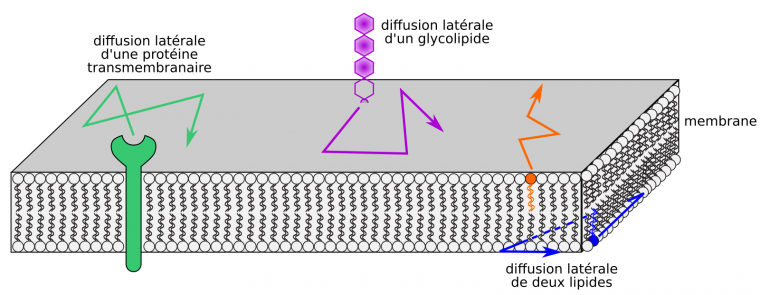
Certains composants membranaires peuvent être rendus fluorescents : protéines membranaires fusionnées à des protéines fluorescentes et exprimées au moyen d’un transgène, analogues de lipides fluorescents [11,12]. L’observation des composants membranaires peut également être indirecte, grâce à des protéines de fusion fluorescentes se liant à des lipides [13-15]. Soumis à une excitation par un laser trop intense, les composés fluorescents perdent leur capacité à émettre de la lumière (phénomène de photoblanchiment). Après avoir provoqué le photoblanchiment d’une petite zone de la membrane plasmique, on observe que cette zone redevient petit à petit fluorescente. De telles expériences, dites de redistribution de fluorescence après photoblanchiment (FRAP, pour fluorescence recovery after photobleaching), montrent qu’il existe une fluidité latérale (ou horizontale) des protéines et des lipides dans le plan des membranes [11,12,16], conformément au modèle de mosaïque fluide proposé par Singer et Nicholson [17].
La labilité des interactions au sein des membranes autorise une fluidité latérale
La structure des membranes biologiques dépend de liaisons non covalentes entre composés membranaires (liaisons de Van der Waals, liaisons hydrogènes entre stérols et phospholipides, etc.) et avec le solvant (interactions électrostatiques, dont les liaisons hydrogènes). Les énergies de liaison de ce type d’interactions sont du même ordre de grandeur (environ 5 à 50 kJ.mol-1 selon les liaisons) que l’énergie cinétique due à l’agitation thermique des molécules membranaires [18], ce qui aboutit à une grande labilité : les liaisons faibles se forment et se brisent constamment au sein de la membrane, et entre la membrane et le solvant aqueux. Par conséquent, la structure globale des membranes reste stable (une bicouche lipidique associée à des protéines), mais les composants membranaires sont mobiles les uns par rapports aux autres dans le plan des membranes (Figure 4). Cette mobilité est d’autant plus grande que la température est élevée (pour une membrane d’une composition donnée).
L’aptitude des constituants membranaires à diffuser latéralement, proposée par Singer et Nicholson dans leur modèle de mosaïque fluide [17], supposait une distribution homogène des lipides. Or, (i) les vitesses de diffusion latérale de composants membranaires mesurées dans des membranes biologiques sont jusqu’à 100 fois inférieures à celles mesurées dans des membranes artificielles (liposomes) [20], (ii) différents composés membranaires n’ont pas les mêmes vitesses de diffusion latérale dans une membrane [16], (iii) de nombreux lipides et protéines membranaires sont concentrés dans des microdomaines (d’un diamètre supérieur à 1 µm) et nanodomaines (ou radeaux lipidiques, dont le diamètre est inférieur à 1 µm et fait plutôt entre 20 et 300 nm) [20], et (iv) de nombreux composés membranaires occupent de grandes régions membranaires distinctes dans les membranes biologiques. Quels sont les facteurs qui restreignent la dynamique horizontale des membranes ?
Il existe des restrictions à la fluidité latérale des membranes
Des lipides peuvent restreindre la diffusion latérale à des nanodomaines
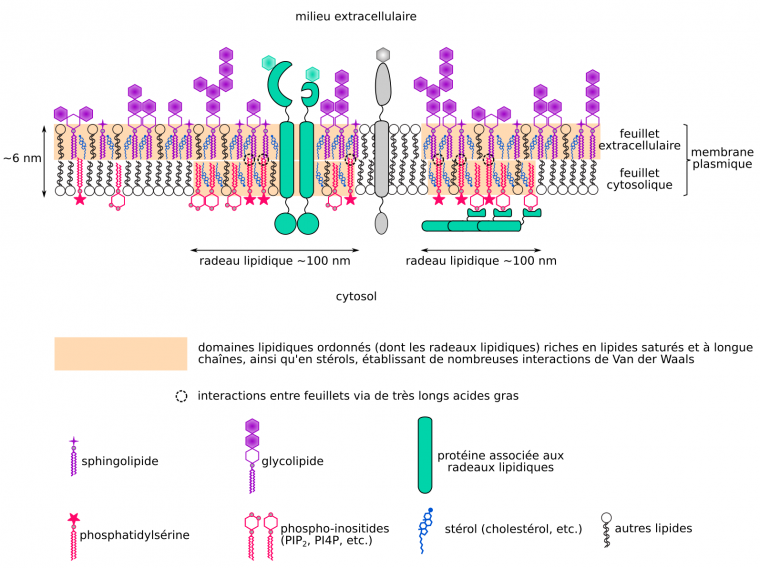
L’existence d’une compartimentation latérale de protéines et lipides membranaires est désormais vérifiée pour les membranes plasmiques animales et végétales [21-25]. En effet, la diffusion latérale de certaines protéines membranaires, comme les flottilines liées à des lipides dans les cellules animales ou les rémorines dans les cellules végétales, est restreinte à des nanodomaines de la membrane plasmique [26,27]. De nombreuses protéines membranaires sont ainsi regroupées dans des radeaux lipidiques, définis comme étant des « domaines membranaires de "petite" taille (d’un diamètre inférieur à 1 µm, mais le plus souvent compris entre 20 et 300 nm ; [20]), hétérogènes, hautement dynamiques et enrichis en stérols et sphingolipides, et qui compartimentent des processus cellulaires » [28]. Cette théorie postule la répartition des lipides membranaires en deux phases distinctes : une phase liquide ordonnée (les radeaux, enrichis en stérols et sphingolipides) et une phase désordonnée constituée par le reste de la membrane [24].
Traditionnellement, les radeaux lipidiques sont vus comme une structure englobant les deux feuillets d’une membrane. Néanmoins, les membranes sont asymétriques (feuillets de composition différentes) et les feuillets en partie découplés (peu d’interactions entre feuillets). Ainsi, un feuillet peut comporter des lipides dans une phase liquide ordonnée, tout en étant à l’aplomb d’un feuillet en phase liquide désordonnée (Figure 5). La composition du feuillet externe de la membrane plasmique correspond à une phase prédite comme ordonnée, et la diffusion latérale y est réduite, par l’abondance des interactions entre stérols et glycosphingolipides [29-31]. En effet, la structure plane des stérols, et les longs acides gras saturés (et donc rectilignes) des sphingolipides, permettent l’établissement de nombreuses liaisons de Van der Waals qui s’opposent aux mouvements horizontaux de lipides. La composition du feuillet cytosolique suggère que les lipides y sont majoritairement en phase liquide désordonnée (pas sous forme de radeaux) et que leur diffusion latérale est plus rapide [16]. Néanmoins, certains lipides du feuillet cytosolique, comme la phosphatidylsérine et les phospho-inositides (dérivés du phosphatidylinositol) sont concentrés dans des nanodomaines constituant des radeaux, modulant la diffusion latérale de composants membranaires [24,31-33]. Ces lipides comportent des acides gras à longue chaîne et les radeaux du feuillet cytosolique dont ils font partie pourraient, au moins pour les cellules animales, être couplés au feuillet extracellulaire via les acides gras à très longue chaîne de nombreux glycosphingolipides [34].
Certaines portions des feuillets membranaires sont en phase liquide ordonnée (radeaux lipidiques formant des nanodomaines notamment), tandis que d’autres sont en phase désordonnée.
Le cytosquelette peut restreindre la diffusion latérale dans les membranes
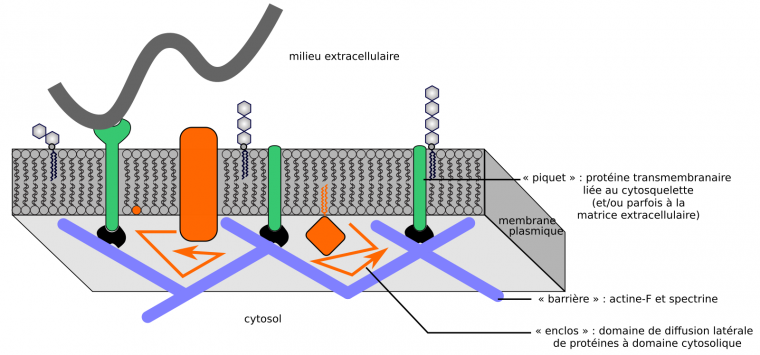
De nombreuses protéines transmembranaires sont liées, via des protéines de liaison, au cytosquelette cortical des cellules : principalement les microfilaments d’actine et la spectrine dans les cellules animales, et les microtubules corticaux et microfilaments d’actine dans les cellules végétales. Dans les cellules animales au cytosquelette périphérique absent ou perturbé, la fluidité de la membrane plasmique augmente globalement (à l’échelle micrométrique) [11,24]. Pourtant à l’échelle nanométrique, la vitesse de diffusion latérale des lipides suivis individuellement n’est pas affectée [19]. En fait, le cytosquelette sous-membranaire forme des « enclos » (corrals) constituant des domaines de diffusion latérale où les composants membranaires diffusent, mais dont ils sortent rarement. Dans les cellules végétales, l’effet semble moins prononcé, notamment sur les protéines extrinsèques, mais existe [16,35-37]. La dynamique horizontale des membranes, et en particulier de la membrane plasmique des cellules animales, peut s’expliquer par le modèle des « barrières et piquets » (anchored picket fence concept) : les protéines membranaires interagissant avec le cytosquelette sont immobilisées (piquets), et le cytosquelette sous-membranaire forme des barrières restreignant la diffusion latérale de composants membranaires dont la région cytosolique est suffisamment volumineuse (Figure 6) [24].
Des protéines membranaires ancrées au cytosquelette (et éventuellement à la matrice extracellulaire) se comportent comme des piquets. Le cytosquelette sous-membranaire définit des « enclos » au sein desquels les composants membranaires diffusent. Ce modèle explique bien le cas de la membrane plasmique des cellules animales.
La matrice extracellulaire peut restreindre la diffusion latérale
Du fait du fort potentiel hydrostatique (pression de turgescence) des cellules végétales, leur membrane plasmique est plaquée contre la paroi (matrice extracellulaire). Or, pour des protéines membranaires de la membrane plasmique possédant un domaine extracellulaire, la fluidité latérale à l’échelle microscopique augmente dans des protoplastes frais (cellules végétales sans paroi) ou dans des cellules plasmolysées (membrane plasmique « décollée » de la paroi) [16]. Le placage de protéines ayant un domaine extracellulaire contre la paroi inhibe donc leur diffusion latérale. Cependant à l’échelle nanométrique, l’observation de protéines uniques montre que la paroi contrôle la taille des domaines où les protéines transmembranaires diffusent, mais pas ou peu leur vitesse : la paroi agit donc comme « enclos », à la manière du cytosquelette, restreignant le domaine de diffusion des protéines membranaires [16,36]. Cet effet vaut y compris pour des protéines à domaine extracellulaire très peu volumineux, et est vraisemblablement valable aussi pour des protéines qui ne sont pas directement au contact de la paroi. Par ailleurs, les glycosphingolipides du feuillet externe de la membrane plasmique comportent pour beaucoup des oligosides volumineux qui sont au contact de la paroi. Cette dernière restreint donc probablement la diffusion de ces lipides [31,38].
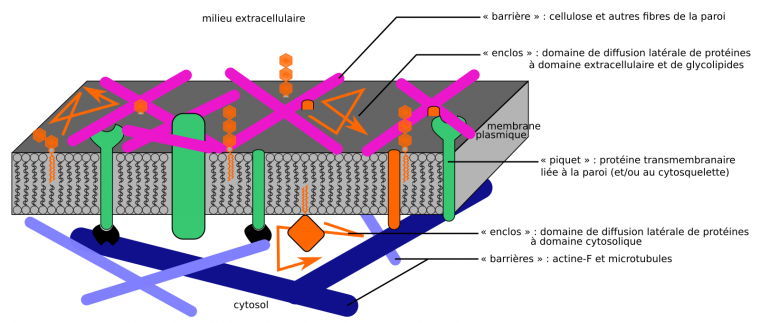
Dans les cellules animales également, la matrice extracellulaire peut contribuer à restreindre les possibilités de déplacement de protéines transmembranaires (interactions entre intégrines membranaires et fibronectines matricielles, par exemple, formant des « piquets »). Cet effet est néanmoins plus modeste que dans les cellules végétales, où la dynamique horizontale de la membrane plasmique peut se modéliser par un modèle plus complet de « barrières et piquets », où la paroi joue un rôle prédominant par rapport au cytosquelette. Tout lipide, protéine ou glycolipide extracellulaire y est ainsi susceptible d’interagir avec elle, et donc de se comporter comme piquet, et/ou de voir sa diffusion contrainte par la paroi qui agit comme barrière et forme des « enclos » (Figure 7) [21].
Ici, les « piquets » sont principalement ancrés par leur interaction avec la matrice extracellulaire (paroi chez les végétaux), et peuvent virtuellement être n’importe quel composant membranaire ayant un domaine extracellulaire. Ce modèle explique bien le cas de la membrane plasmique des cellules végétales, qui est plaquée contre la paroi.
Des domaines membranaires micrométriques : les microdomaines
Les membranes biologiques présentent des domaines de taille micrométrique. C’est en particulier le cas de domaines de croissance apicale, comme à l’apex des poils absorbants et tubes polliniques en cours de croissance chez les Angiospermes [39,40], ainsi que des sites de contacts entre membranes (membrane contact sites). Ces derniers constituent des zones où des membranes distinctes sont très proches (environ 10 nm), et existent chez les Eucaryotes entre de nombreuses membranes : entre membrane plasmique et réticulum endoplasmique (dont les plasmodesmes, ainsi que les célèbres triades et diades permettant la contraction des cellules musculaires striées squelettiques et cardiaques respectivement), entre réticulum et appareil de Golgi, etc. [41,42]. Au niveau de ces microdomaines, les membranes ont une composition atypique, notamment en protéines stabilisant ces contacts et/ou y réalisant des échanges (voir 4.3 ; Figures 16 et 17).
Des barrières à la diffusion latérale définissent de grands domaines membranaires
Dans certains types cellulaires animaux et végétaux, on constate que des protéines transmembranaires ne se localisent que dans une région de la membrane plasmique, isolée du reste de cette membrane.
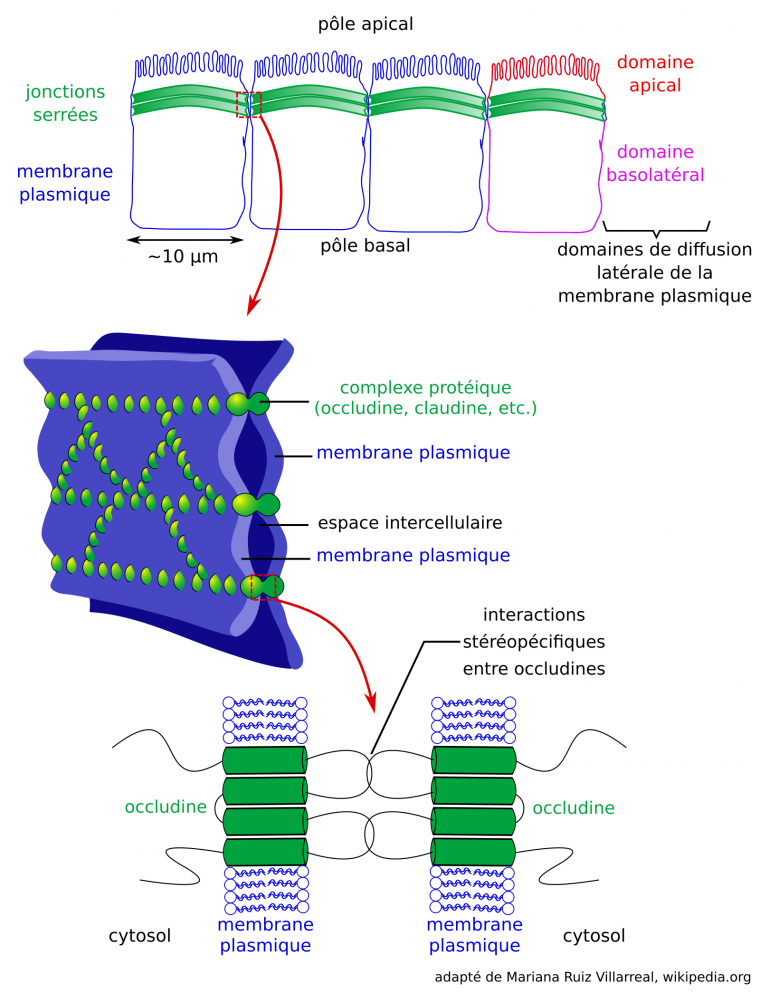
Dans les cellules animales : cas des jonctions serrées
Les jonctions serrées des épithéliums animaux délimitent des domaines de diffusion latérale dans la membrane plasmique : un domaine apical et un domaine basolatéral (Figure 8). Ces jonctions forment un anneau dans la membrane plasmique des cellules épithéliales, et sont constituées notamment par les protéines transmembranaires claudines et occludines qui se lient entre elles et accolent ainsi les membranes plasmiques des cellules voisines, empêchant entre autres la diffusion latérale des protéines membranaires [43]. Les complexes protéiques des jonctions serrées interagissent par ailleurs avec le cytosquelette des cellules [43]. Ces jonctions permettent ainsi la présence de transporteurs transmembranaires distincts aux domaines apicaux et basolatéraux des épithéliums, et en conséquence un transport polarisé de solutés au travers du tissu épithélial.
Adapté de Mariana Ruiz Villarreal, Wikimedia.
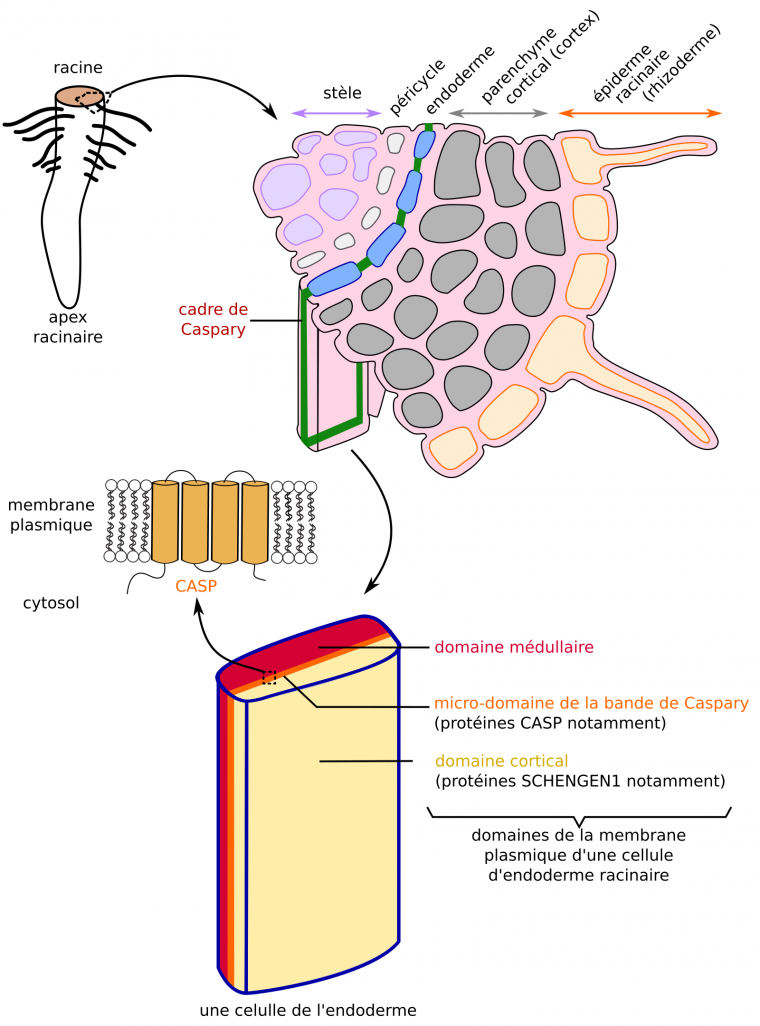
Dans les cellules végétales : cas de l’endoderme racinaire
Dans les racines des Angiospermes, l’endoderme forme une couche de cellules séparant la stèle (dont font partie les tissus conducteurs) et le parenchyme cortical (cortex). Chez les Eudicotylédones, il se forme dans la paroi des cellules de l’endoderme une bande riche en lignine et subérine, et donc imperméable, qui entoure les cellules : le cadre de Caspary. Ce cadre de Caspary contraint les composés transportés depuis l’épiderme racinaire vers les tissus conducteurs de sève brute à emprunter la voie symplasmique. Des travaux récents menés sur Arabidopsis thaliana ont montré qu’il existait deux domaines distincts dans la membrane plasmique des cellules de l’endoderme, l’un cortical et l’autre médullaire, de part et d’autre du cadre de Caspary ou de sa future position (Figure 9). À la frontière entre ces domaines, il existe une grande concentration de la protéine CASP qui, avec ses 4 hélices α-transmembranaires, possède une structure rappelant celles des protéines de jonctions serrées animales. L’accumulation de protéines CASP forme un microdomaine dans la membrane plasmique qui spécifie la localisation de la synthèse de lignine et donc celle du cadre de Caspary, et constituerait une barrière à la diffusion de protéines membranaires adressées spécifiquement côté médullaire ou cortical des cellules (Figure 9) [44-47].
Au niveau du cadre de Caspary, l’accumulation de protéines CASP constitue un microdomaine qui agirait comme barrière à la diffusion latérale dans la membrane plasmique : il se forme un domaine cortical et un domaine médullaire.
Bilan
Ces deux exemples montrent, dans certains types cellulaires, l’existence de barrières strictes à la diffusion latérale au sein de la membrane plasmique. Ceci permet une spécialisation de chaque domaine, dont la composition unique permet par exemple le transport contrôlé de composés.
Les membranes biologiques constituent des assemblages supramoléculaires dont les composants présentent une dynamique horizontale grâce à la labilité des interactions intermoléculaires. De nombreux mécanismes modulent la fluidité latérale des membranes biologiques au sein de grands domaines membranaires, de microdomaines, et de nanodomaines (radeaux lipidiques). Quelles autres modalités de déplacement des constituants membranaires sont impliquées dans la dynamique des membranes, et concourent à leur structure ?
Les membranes : des structures présentant une dynamique verticale
La dynamique verticale d’une membrane correspond à des mouvements de composants membranaires entre son feuillet cytosolique et son feuillet luminal ou extracellulaire. Cette dynamique est thermodynamiquement défavorisée pour la plupart des lipides membranaires, puisqu’elle nécessite que des groupements chimiques polaires (et donc hydrophiles) traversent la couche apolaire (et hydrophobe) au cœur des membranes.
Observation d’une dynamique verticale
De nombreux lipides membranaires sont répartis asymétriquement entre les deux feuillets membranaires (Figure 5). Cette asymétrie est héritée en grande partie de l’asymétrie des processus de synthèse des constituants : la majorité des phospholipides du feuillet cytosolique est directement synthétisée dans le feuillet cytosolique du réticulum endoplasmique où ils persistent [48, 49]. Toutefois, la phosphatidylsérine a elle aussi une répartition asymétrique très enrichie dans le feuillet cytosolique de la membrane plasmique et de certains organites dans les cellules animales, végétales et fongiques [1,50,51], et pourtant les enzymes PSS1 et PSS2 synthétisent principalement ce lipide dans le feuillet luminal du réticulum endoplasmique [52]. Par conséquent, la phosphatidylsérine est nécessairement échangée du feuillet luminal vers le feuillet cytosolique : on parle de « flip-flop ». Par ailleurs, l’engagement des cellules animales en apoptose ou l’activation des plaquettes et ostéoblastes s’accompagnent d’une délocalisation rapide de la phosphatidylsérine depuis le feuillet cytosolique vers le feuillet extracellulaire de la membrane plasmique [1,53]. Comment expliquer cette dynamique verticale pourtant thermodynamiquement défavorisée ?
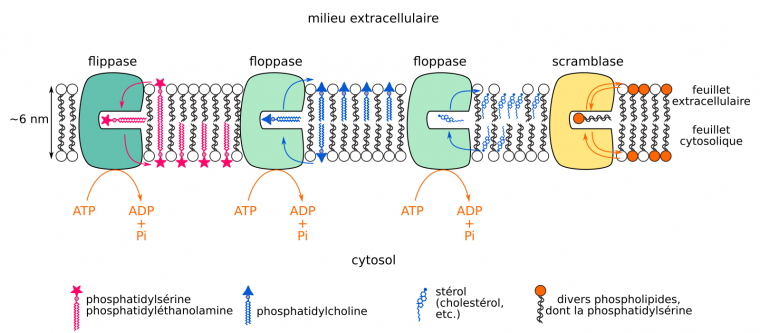
Des protéines permettent les échanges de lipides entre feuillets membranaires
Trois types de protéines permettent les flip-flops de certains lipides membranaires : les scramblases, les flippases (stricto sensu), et les floppases1 (Figure 10). Les quelques scramblases connues sont des protéines transmembranaires capables de transférer des phospholipides d’un feuillet à l’autre sans couplage à une source d’énergie. Ces transferts ne sont pas directionnels et sont peu spécifiques : les scramblases, une fois activées, homogénéisent la composition des deux feuillets membranaires en phosphatidylsérine et phosphatidyléthanolamine [54,55]. Les flippases et les floppases sont capables d’échanges directionnels de lipides entre feuillets, par couplage à l’énergie dégagée par l’hydrolyse de l’ATP. Mais alors que les flippases déplacent principalement la phosphatidylsérine et la phosphatidyléthanolamine depuis le feuillet extracellulaire vers le feuillet cytosolique de la membrane plasmique [56,57], les floppases déplacent le cholestérol2 et la phosphatidylcholine du feuillet cytosolique vers le feuillet extracellulaire/luminal3 [58,59].
Ces flips-flops sont directionnels et couplé à l’hydrolyse d’ATP, ou non directionnels.
Flip-flops de la phosphatidylsérine
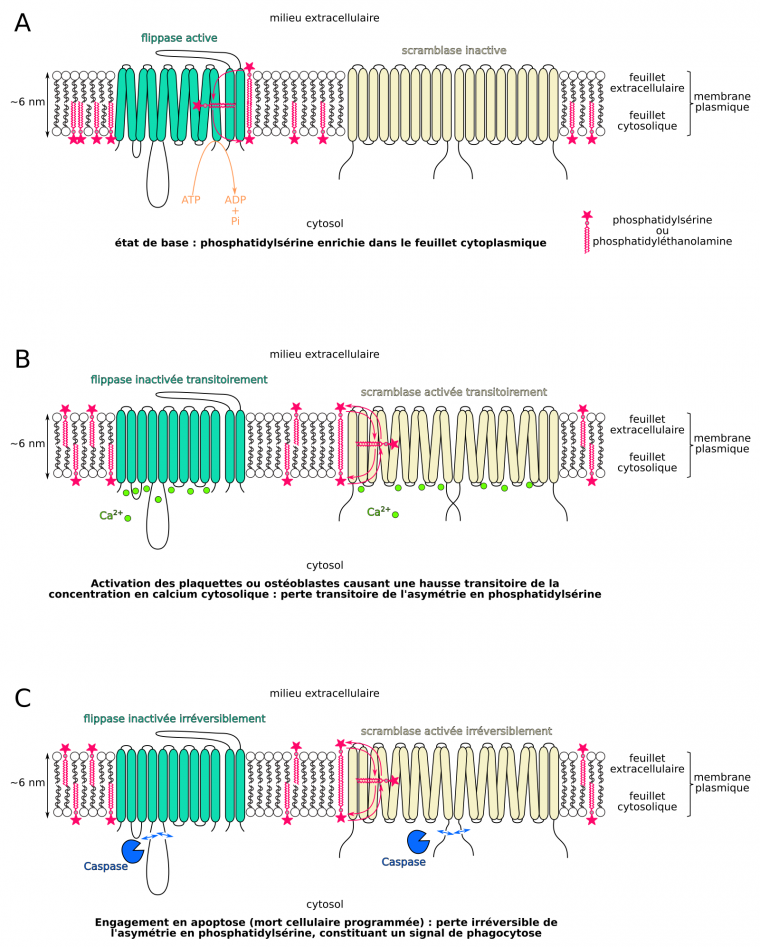
Concernant la phosphatidylsérine, les flippases sont constitutivement actives. Elles transloquent la phosphatidylsérine néosynthétisée dans le feuillet cytosolique des membranes et rapatrient les quelques molécules s’étant spontanément déplacées sur le feuillet extracellulaire/luminal (Figure 11A) [53]. Dans les processus d’activation des ostéoblastes, le calcium inactive de manière réversible les flippases de phosphatidylsérine et active une scramblase (Figure 11B) [53,55], ce qui cause le flip-flop de ce lipide vers le feuillet extracellulaire de la membrane plasmique, et permet par exemple d’enclencher transitoirement la sécrétion d’hydroxyapatite par les ostéoblastes. À l’inverse, dans les cellules animales engagées en apoptose, des caspases clivent les flippases de phosphatidylsérine, ce qui les inactive irréversiblement, et clivent une scramblase ce qui l’active irréversiblement, causant le flip-flop de ce lipide sur le feuillet extracellulaire de la membrane plasmique (Figure 11C) [60].
(A) État de base : les molécules de phosphatidylsérine sont accumulées dans le feuillet cytosolique de la membrane plasmique. (B) Perte réversible de l’asymétrie en phosphatidylsérine entre les feuillets de la membrane plasmique en réponse au Ca2+. (C) Perte irréversible de l’asymétrie d’une cellule engagée en apoptose.
Les membranes : des structures dynamiques par les échanges qu’elles réalisent
La dynamique des membranes ne tient pas qu’à la mobilité horizontale et verticale de leurs constituants. Ceux-ci sont par ailleurs variables au cours du temps, et leur acheminement, leur recyclage ainsi que leurs transformations participent à la dynamique des différentes membranes.
Observation d’échanges entre membranes
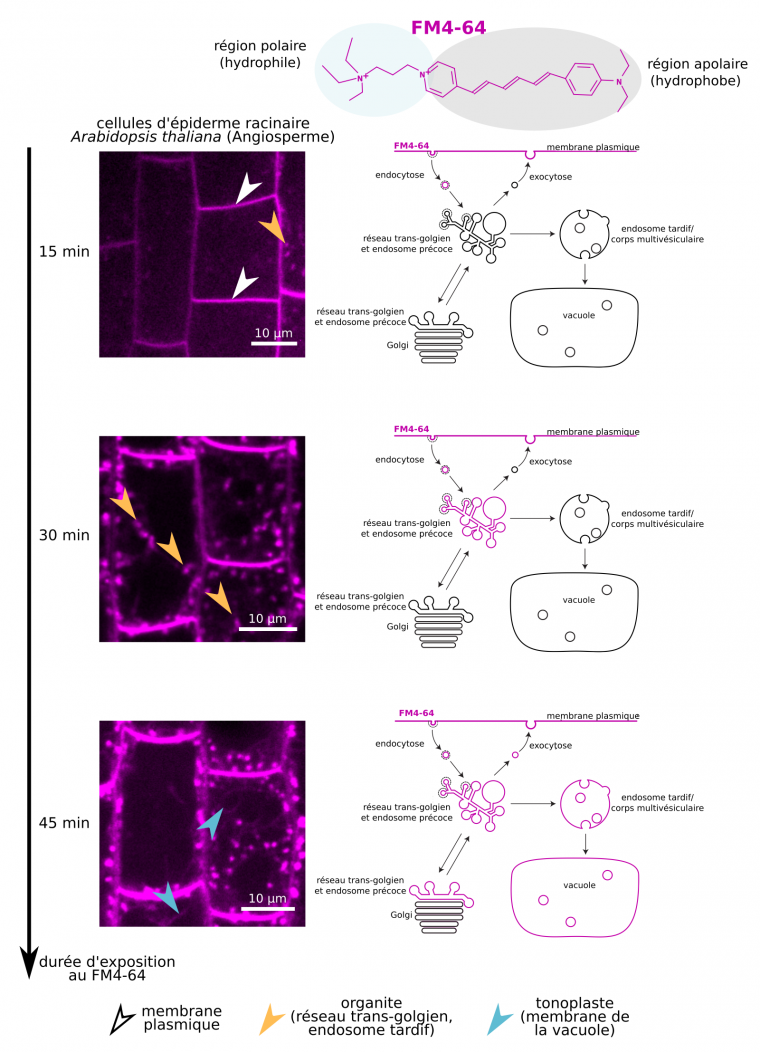
On utilise en recherche des composés fluorescents amphiphiles, comme le FM4-64, qui fluorescent une fois insérés dans une membrane. Ajoutés dans le milieu extracellulaire de cellules animales, végétales ou fongiques, ces composés s’incorporent à la membrane plasmique qui devient rapidement marquée (Figure 12). Au cours des minutes qui suivent, différentes autres membranes deviennent fluorescentes, montrant qu’il existe des échanges avec la membrane plasmique. Quelles sont les modalités de ces échanges ? Quelle importance ont-ils pour la biologie des membranes et des cellules ?
Le FM4-64 est un composé amphiphile fluorescent s’insérant dans la membrane plasmique. Au cours du temps, on constate qu’il est transporté vers d’autres membranes du système endomembranaire (réseau trans-golgien, endosomes, tonoplaste).
Les échanges vésiculaires participent à la dynamique des membranes
Des échanges permis par des flux de vésicules
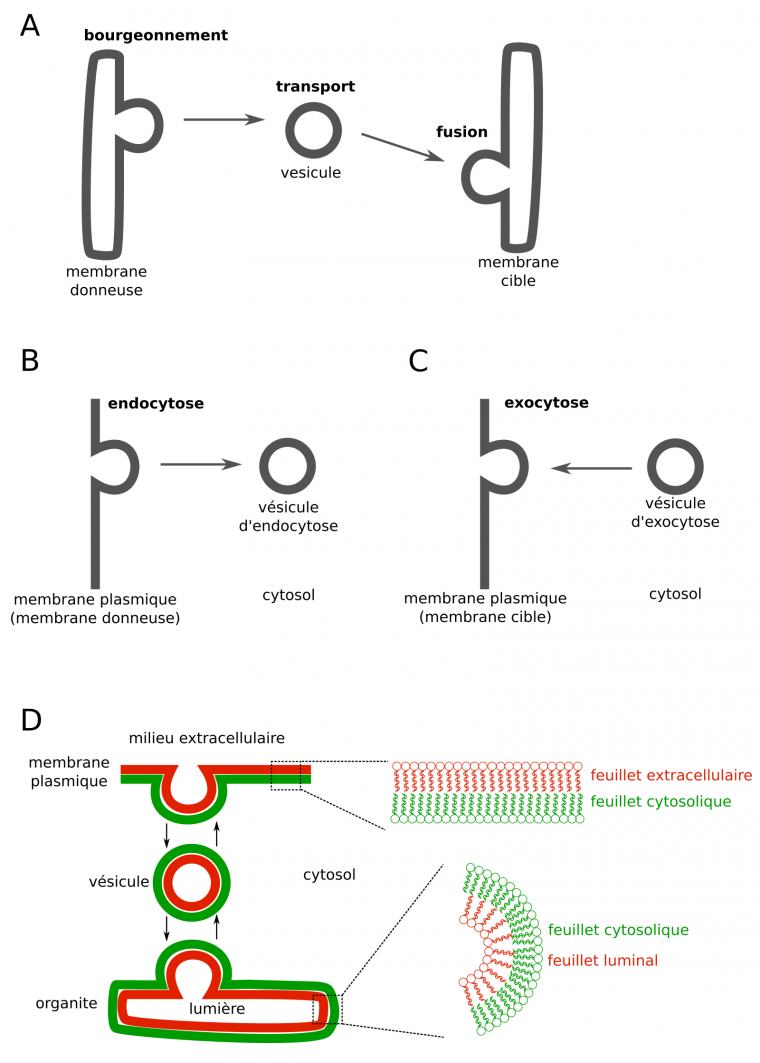
Les différentes membranes du système endomembranaire des cellules Eucaryotes (Figure 1) échangent des vésicules, et par conséquent du matériel membranaire : une vésicule bourgeonne depuis la membrane donneuse, puis est transportée grâce à des moteurs moléculaires liés au cytosquelette, et enfin fusionne avec la membrane cible (Figure 13A). On parle d’endocytose lorsque la membrane donneuse est la membrane plasmique (Figure 13B), et d’exocytose lorsque la membrane plasmique est la membrane cible (Figure 13C). Ces échanges, de fait, participent à la dynamique des membranes via l’apport et le départ de lipides et protéines membranaires. Il est important de noter que les lipides (et protéines associées) de chaque feuillet restent dans ces feuillets malgré les échanges vésiculaires : le feuillet cytosolique des compartiments donneurs et receveurs est le même que celui de la vésicule, de même que le feuillet luminal/extracellulaire (Figure 13D).
(A) Cas général. (B) Endocytose : bourgeonnement de la membrane plasmique. (C) Exocytose : fusion avec la membrane plasmique. (D) Le feuillet cytosolique et le feuillet luminal/extracellulaire restent les mêmes lors du trafic vésiculaire.
Bourgeonnement de vésicules depuis une membrane donneuse
Le bourgeonnement depuis une membrane donneuse est permis par l’assemblage d’un manteau protéique, par exemple de clathrine, à la membrane plasmique ou sur le réseau trans-golgien [61]. Ce manteau de protéines est lié à des protéines transmembranaires, via des protéines adaptatrices, et déforme la membrane en un « puits » [61]. Enfin, le cou du puits est clivé par des dynamines, libérant la vésicule, qui perd ensuite son manteau protéique plus ou moins rapidement selon le type d’organismes [61,62].
Fusion avec un compartiment cible
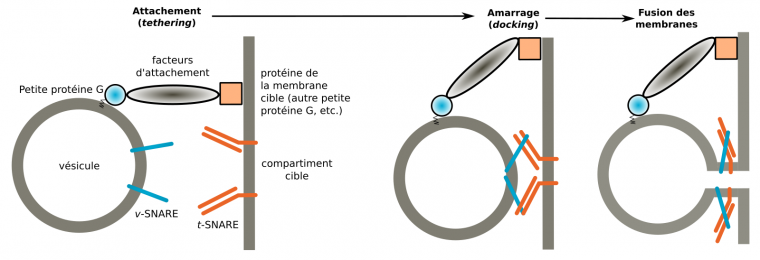
Les vésicules, les membranes d’organites et la membrane plasmique portent des protéines spécifiques, souvent de petites protéines G, qui s’associent spécifiquement à de longues protéines (~300 nm) appelée facteurs d’attachement. Ces derniers permettent l’attachement (tethering) de la vésicule à la membrane cible et son rapprochement vis-à-vis de celle-ci [63-66]. La spécificité de l’interaction entre protéines G de la membrane vésiculaire, facteur d’attachement, et déterminant de la membrane cible (une autre petite protéine G par exemple) participent à l’adressage des vésicules à une membrane cible donnée. Ensuite, des protéines appelées SNARE (v-SNARE sur la vésicule, t-SNARE sur la membrane cible) vont, si elles sont complémentaires, s’associer et amarrer la vésicule à la membrane cible (docking). Enfin, un changement de conformation des SNARE permet la fusion entre les deux membranes, et ainsi l’incorporation de la membrane vésiculaire dans la membrane cible (Figure 14).
Pour l’exemple de la fusion d’une vésicule de l’appareil de Golgi, les facteurs d’attachement sont des golgines et le compartiment cible un saccule golgien.
Malgré ces échanges vésiculaires, qui devraient tendre à homogénéiser la composition des différentes membranes du système endomembranaire, chaque membrane conserve son identité (une composition propre). Ceci est permis par (i) l’adressage, la rétention et le rapatriement de protéines dans leur compartiment intracellulaire, et par (ii) le transport, la synthèse et la dégradation localisée de lipides membranaires au niveau des différentes membranes. Par exemple, le PI(4,5)P2 (ou PIP2, phosphatidyl-inositol-4,5-bisphosphate) est synthétisé à la membrane plasmique, et est dégradé pendant l’endocytose, ce qui fait qu’on ne le retrouve pas sur d’autres membranes.
Les échanges non vésiculaires de lipides participent à la dynamique des membranes
Des échanges massifs de lipides membranaires ont lieu entre de nombreuses membranes, par des transports non vésiculaires. Ces échanges sont démontrés dans les cellules animales et chez S. cerevisiae [42,67], et existent vraisemblablement chez tous les Eucaryotes.
Des échanges de lipides ayant souvent lieu au niveau de sites de contacts entre membranes
Les sites de contacts entre membranes correspondent à des rapprochements de deux membranes, alors séparées par un espace de seulement 10 à 30 nm [42]. Ces contacts existent entre de nombreuses membranes. D’une part entre organites : entre réticulum endoplasmique et de multiples autres membranes (membrane plasmique, membrane externe mitochondriale, appareil de Golgi, réseau trans-golgien, gouttelettes lipidiques, peroxysome), entre vacuole et enveloppe nucléaire, etc. [42,68,69]. D’autre part, entre membranes d’un même organite : entre saccules golgiens, entre membrane interne et externe des mitochondries ou chloroplastes, entre vésicules des corps multivésiculaires (endosomes très tardifs ; Figure 15 ; [68,70,71]), etc.
Cellule végétale (haut) et cellule animale (bas). Adapté de [14].
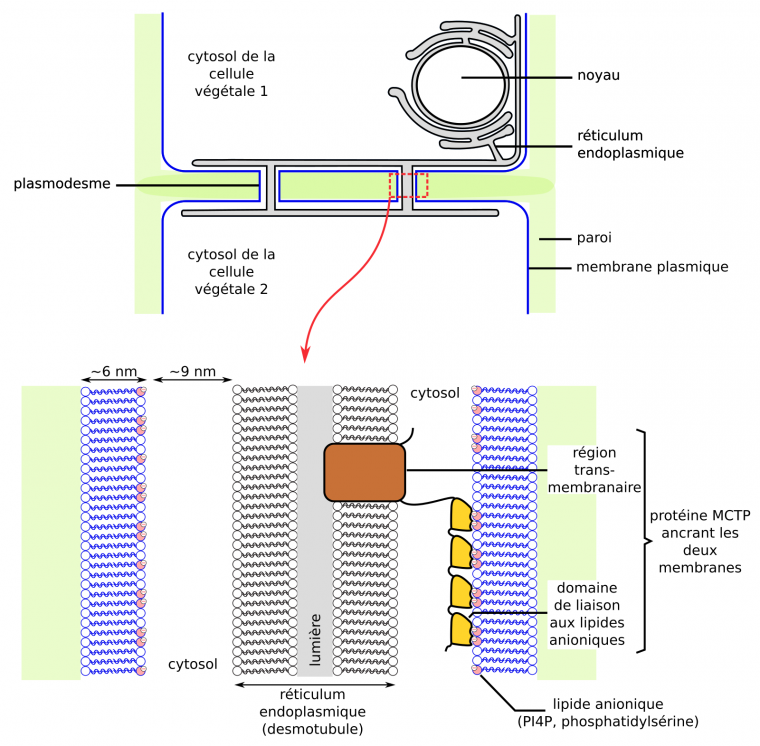
Les sites de contacts entre membranes sont stabilisés par des protéines interagissant avec les deux membranes. Ainsi, les sites de contacts entre membrane plasmique et réticulum endoplasmique (desmotubule) dans les plasmodesmes végétaux sont stabilisés par des protéines dont le domaine transmembranaire est ancré dans la membrane du réticulum, et dont le domaine cytosolique interagit avec des lipides anioniques (phosphatidylsérine, PI4P) de la membrane plasmique (Figure 16) [72]. Ces sites de contacts sont propices à la réalisation d’échanges de lipides entre membranes.
Les membranes sont attachées entre elles par des protéines comme la protéine MCTP. D’après [72].
Des échanges de lipides réalisé par des protéines liant des lipides
Les stérols membranaires sont principalement localisés dans la membrane plasmique, et dans une moindre mesure dans les membranes des endosomes et de l’appareil de Golgi [1,3,67]. Ils sont synthétisés dans le réticulum endoplasmique, puis rapidement transportés (en 10 minutes environ dans des cellules animales et fongiques) jusqu’à la membrane plasmique [73,74], ainsi que dans les membranes du Golgi, du réseau trans-golgien, et d’endosomes. Ce transport n’est pas affecté par l’inhibition de la quasi-totalité des transports vésiculaires, ce qui montre que les stérols membranaires sont transportés principalement par d’autres mécanismes [73]. De même, la phosphatidylsérine est rapidement transportée du réticulum à la membrane plasmique, essentiellement par un transport non vésiculaire [75]. Ces transports sont réalisés par des protéines cytosoliques capables de lier ces lipides et de leur faire traverser la phase aqueuse du cytosol, en les isolant dans un site hydrophobe [67,76]. Dans les cellules animales, la majorité de ces protéines sont concentrées dans des sites de contact entre membranes (membrane plasmique et membrane du réticulum en particulier ; Figure 15).
Des échanges dont le sens dépend de gradients de lipides
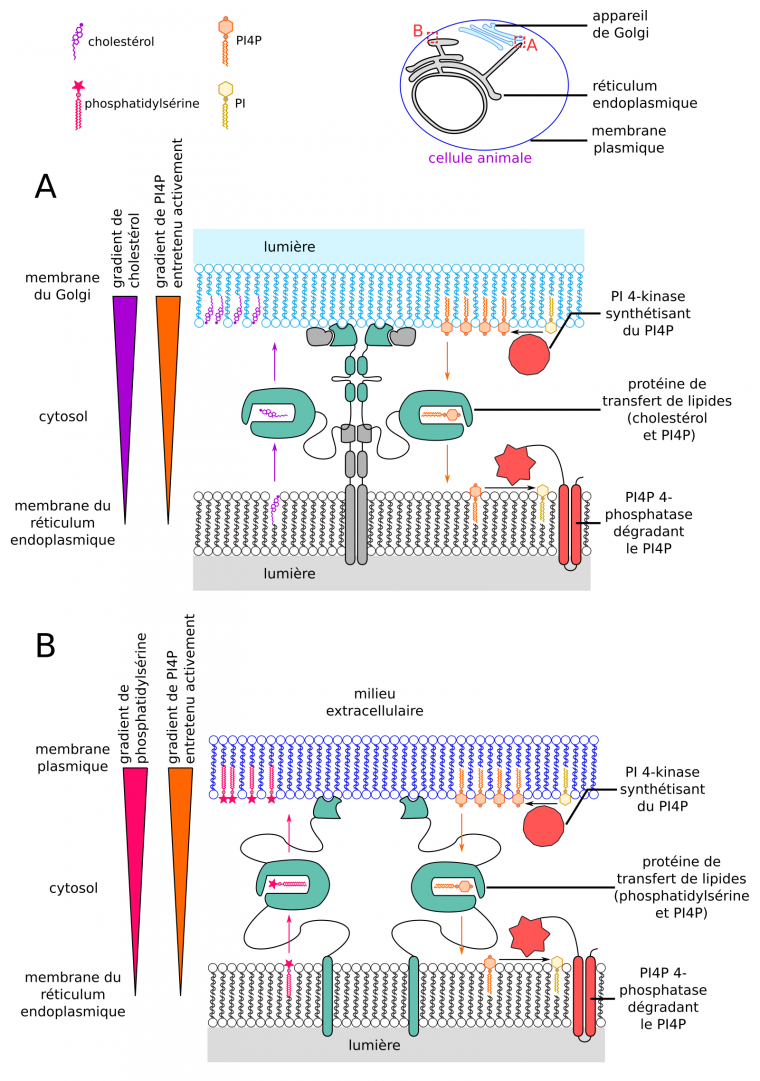
Le transport de stérols et celui de phosphatidylsérine sont réalisés contre les gradients de ces lipides : ce sont des transports actifs. Ils ont lieu grâce au couplage à un transport d’un autre lipide, le PI4P (phosphatidylinositol-4-phosphate), par les mêmes protéines de transfert. Le PI4P est en effet lui aussi largement moins concentré dans la membrane du réticulum que dans la membrane plasmique, celles du Golgi, ou du réseau trans-golgien. Ainsi, par effet statistique, les protéines de transfert de lipides tendent à transporter du PI4P selon son gradient vers le réticulum, puis à rétrotransporter des stérols ou de la phosphatidylsérine vers la membrane plasmique ou le Golgi. Le fort gradient de PI4P permet donc le transport de la phosphatidylsérine et des stérols contre leur gradient de concentration, et est maintenu par sa synthèse à la membrane plasmique et par son hydrolyse à la membrane du réticulum (Figure 17) [77-81]. D’autres lipides seraient ainsi transportés, comme le phosphatidylinositol exporté du réticulum vers la membrane plasmique grâce au contre-transport d’acide phosphatidique (diacylglycérol) [82-85].
(A) Le cholestérol est transporté de la membrane du réticulum endoplasmique où il est synthétisé, à la membrane de saccules golgiens contre son gradient. Ce transport actif est possible grâce au gradient identique de PI4P qui est transporté passivement en sens inverse par les mêmes protéines de transfert de lipides. (B) De même, la phosphatidylsérine est transportée contre son gradient de la membrane du réticulum où elle est synthétisée à la membrane plasmique. D’après [92].
Les échanges de lipides, qui ont largement lieu par des transferts non vésiculaires, contribuent à la dynamique des membranes et constituent des mécanismes majeurs d’acheminement de lipides membranaires jusqu’à leur localisation fonctionnelle.
L’arrivée et le départ de protéines membranaires contribuent à la dynamique des membranes
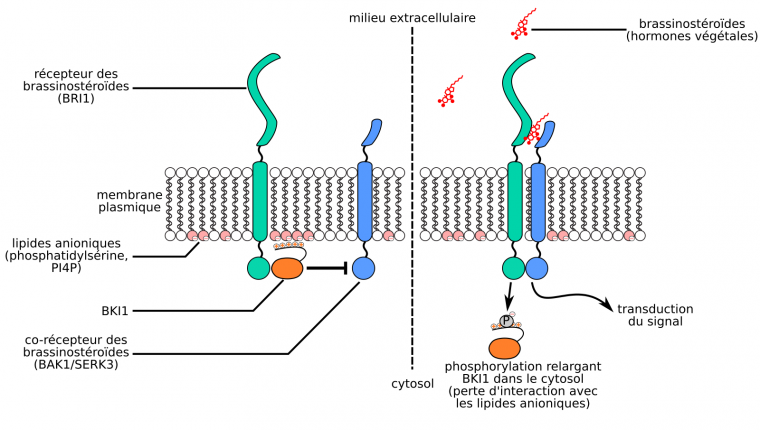
S’il n’existe, à notre connaissance, pas de mécanisme alternatif au transport vésiculaire permettant le transfert des protéines transmembranaires d’une membrane à une autre, des protéines extrinsèques peuvent quant à elles s’associer ou se défaire des membranes avec lesquelles elles interagissent. C’est notamment le cas de BKI (BRI1 kinase inhibitor 1), une protéine végétale extrinsèque de la membrane plasmique interagissant avec les lipides anioniques de la membrane plasmique (phosphatidylsérine, PI4P) grâce à une courte séquence riche en acides aminés à radicaux basiques et donc chargés positivement [86]. En absence de brassinostéroïdes (une famille d’hormones végétales), BKI inhibe le récepteur membranaire aux brassinostéroïdes BRI1 (Brassinosteroid insensitive 1). Lorsque BRI1 lie des brassinostéroïdes, il phosphoryle BKI au niveau de la séquence d’acides aminés chargés positivement, ce qui lui confère deux charges négatives, entraînant la dissociation de BKI1 de la membrane plasmique, ce qui permet in fine la transduction du signal (Figure 18).
Lorsque que le récepteur-kinase BRI1 lie des brassinostéroïdes (hormones végétales), il phosphoryle la protéine extrinsèque BKI1 qui est alors relarguée de la membrane plasmique. Adapté d’Yvon Jaillais.
Par ailleurs, des fragments de protéines transmembranaires peuvent être libérés par clivage protéique, et ainsi quitter les membranes : c’est le cas d’EIN2 (Ethylene insensitive protein 2), second messager dans la perception de l’éthylène localisé dans la membrane du réticulum des cellules végétales [87,88], ou de la protéine APP humaine (Amyloid-beta Precursor Protein) qui peut subir un clivage libérant son domaine extracellulaire, ou deux clivages libérant notamment des peptides Aβ impliqués dans la maladie d’Alzheimer [89]. Certains lipides membranaires peuvent également être clivés, comme le PI(4,5)P2 hydrolysé en diacylglycérol (restant dans la membrane) et IP3 (inositol-1,4,5-triphosphate, libéré dans le cytosol).
Bilan
Les membranes biologiques réalisent de nombreux échanges, qui participent à leur dynamique par l’apport et le départ de composants membranaires. Ces échanges ont lieu par divers mécanismes, dont les transports vésiculaires de lipides et protéines, et les transports non vésiculaires dont l’importance critique émerge depuis une dizaine d’années. Des composés membranaires peuvent également s’associer transitoirement à une membrane, et d’autres peuvent subir un clivage relarguant deux fragments. Cette dynamique permet l’acheminement de biomolécules, notamment membranaires, de leur site de synthèse à leur localisation fonctionnelle, leur recyclage, des mécanismes de signalisation, etc.
Conclusion
Les membranes biologiques sont des édifices supramoléculaires stables du fait des multiples liaisons faibles qui existent entre les protéines membranaires, les lipides membranaires, et le solvant aqueux. Ils n’en sont pas moins dynamiques, avec une fluidité latérale, une dynamique verticale et des échanges entre membranes (Figure 19). La labilité des interactions entre composants des membranes permet ces différentes dynamiques, en autorisant le mouvement relatif des protéines et lipides membranaires, leur extraction d’une membrane ou d’un feuillet, le bourgeonnement et la fusion membranaire. Au-delà de ces aspects développés ci-avant, les membranes présentent également une dynamique de par les transformations qu’elles subissent : synthèses, dégradations, transformations covalentes et non covalentes de composés membranaires. Cette dynamique permet l’adaptation des cellules (modification de la composition lipidique en réponse à une variation de température permettant de conserver la même fluidité membranaire par exemple) et le maintien de l’identité des différentes membranes (dégradation et synthèse de lipides au niveau de membranes précises empêchant leur propagation à d’autres compartiments malgré le trafic vésiculaire par exemple).
La dynamique des membranes biologique constitue une propriété clé pour comprendre la réalisation des différentes fonctions biologiques qu’elles supportent : interface mécanique et barrière sélective, interface et supports d’échanges d’informations, interface et support d’activité métaboliques.
On entend parfois que la présence d’organites est l’apanage des Eucaryotes, à l’exception de quelques lignées de procaryotes, comme les Cyanobactéries qui possèdent des thylakoïdes. Pourtant, un nombre croissant d’études montre que la présence d’organites, au moins chez les Bactéries, tendrait à « être la règle plutôt que l’exception » [90]. Certains de ces organites sont séparés du cytosol par une bicouche protéo-lipidique, comme les magnétosomes de Magnetospirillum magneticum, qui se formeraient par invagination de la membrane plasmique (membrane interne de cette bactérie à coloration de Gram négative) selon un processus analogue au bourgeonnement d’une membrane Eucaryote [90,91]. Ainsi, des concepts exposés dans ce texte à propos des membranes eucaryotes pourraient aussi s’appliquer à des cellules procaryotes.
Références
[1] P. A. Leventis and S. Grinstein, “The Distribution and Function of Phosphatidylserine in Cellular Membranes,” Annu. Rev. Biophys., vol. 39, no. 1, pp. 407–427, 2010, doi: 10.1146/annurev.biophys.093008.131234.
[2] J. Finean, T. Bramley, and R. Coleman, “Lipid Layer in Cell Membranes,” Nature, vol. 229, p. 1971, 1971.
[3] J. T. Hannich, K. Umebayashi, and H. Riezman, “Distribution and functions of sterols and sphingolipids,” Cold Spring Harb. Perspect. Biol., vol. 3, no. 5, pp. 1–14, 2011, doi: 10.1101/cshperspect.a004762.
[4] L. Armengot, M. M. Marquès-Bueno, and Y. Jaillais, “Regulation of polar auxin transport by protein and lipid kinases,” J. Exp. Bot., vol. 67, no. 14, pp. 4015–4037, 2016, doi: 10.1093/jxb/erw216.
[5] M. Fujita and T. Kinoshita, “GPI-anchor remodeling: Potential functions of GPI-anchors in intracellular trafficking and membrane dynamics,” Biochim. Biophys. Acta - Mol. Cell Biol. Lipids, vol. 1821, no. 8, pp. 1050–1058, 2012, doi: 10.1016/j.bbalip.2012.01.004.
[6] D. Turnbull and P. A. Hemsley, “Fats and function: protein lipid modifications in plant cell signalling,” Curr. Opin. Plant Biol., vol. 40, pp. 63–70, 2017, doi: 10.1016/j.pbi.2017.07.007.
[7] N. Sorek et al., “An S-Acylation Switch of Conserved G Domain Cysteines Is Required for Polarity Signaling by ROP GTPases,” Curr. Biol., vol. 20, no. 10, pp. 914–920, 2010, doi: 10.1016/j.cub.2010.03.057.
[8] M. Laetitia et al., “A PtdIns(4)P-driven electrostatic field controls cell membrane identity and signalling in plants Membrane Identity and Signalling in Plants,” Nat. Plants, vol. 2, no. June, pp. 1–10, 2016, doi: 10.1038/nplants.2016.89.
[9] E. Brombacher et al., “Rab1 guanine nucleotide exchange factor SidM is a major phosphatidylinositol 4-phosphate-binding effector protein of Legionella pneumophila,” J. Biol. Chem., vol. 284, no. 8, pp. 4846–4856, 2009, doi: 10.1074/jbc.M807505200.
[10] K. Moravcevic et al., “Kinase associated-1 domains drive MARK/PAR1 kinases to membrane targets by binding acidic phospholipids,” Cell, vol. 143, no. 6, pp. 966–977, 2010, doi: 10.1016/j.cell.2010.11.028.
[11] M. P. Sheetz, M. Schindler, and D. E. Koppel, “Lateral mobility of integral membrane proteins is increased in spherocytic erythrocytes,” Nature, vol. 285, no. 5765. pp. 510–512, 1980, doi: 10.1038/285510a0.
[12] M. Schindler, M. J. Osborn, and D. E. Koppel, “Lateral diffusion of lipopolysaccharide in the outer membrane of Salmonella typhimurium,” Nature, vol. 285, no. 5762. pp. 261–263, 1980, doi: 10.1038/285261a0.
[13] R. C. Wills, B. D. Goulden, and G. R. V. Hammond, “Genetically encoded lipid biosensors,” Mol. Biol. Cell, vol. 29, no. 13, pp. 1526–1532, 2018, doi: 10.1091/mbc.E17-12-0738.
[14] M. P. Platre and Y. Jaillais, “Guidelines for the Use of Protein Domains in Acidic Phospholipid Imaging.,” Methods Mol. Biol., vol. 1376, pp. 175–94, Jan. 2016, doi: 10.1007/978-1-4939-3170-5_15.
[15] O. Idevall-Hagren and P. De Camilli, “Detection and manipulation of phosphoinositides,” Biochim. Biophys. Acta - Mol. Cell Biol. Lipids, vol. 1851, no. 6, pp. 736–745, 2015, doi: 10.1016/j.bbalip.2014.12.008.
[16] A. Martinière et al., “Cell wall constrains lateral diffusion of plant plasma-membrane proteins.,” Proc. Natl. Acad. Sci. U. S. A., vol. 109, no. 31, pp. 12805–10, Jul. 2012, doi: 10.1073/pnas.1202040109.
[17] S. Singer and G. Nicolson, “Model of fluid mosaic membrane,” Science (80-. )., 1972.
[18] E. Frieden, “Non-covalent interactions. Keyto biological flexibility and specificity.,” J. Chem. Educ., vol. 52, no. 12, pp. 754–756, 1975, doi: 10.1021/ed052p754.
[19] T. Fujiwara, K. Ritchie, H. Murakoshi, K. Jacobson, and A. Kusumi, “Phospholipids undergo hop diffusion in compartmentalized cell membrane,” J. Cell Biol., vol. 157, no. 6, pp. 1071–1081, 2002, doi: 10.1083/jcb.200202050.
[20] T. Ott, “Membrane nanodomains and microdomains in plant–microbe interactions,” Curr. Opin. Plant Biol., vol. 40, pp. 82–88, 2017, doi: 10.1016/j.pbi.2017.08.008.
[21] Y. Jaillais and T. Ott, “The nanoscale organization of the plasma membrane and its importance in signaling - a proteolipid perspective,” Plant Physiol., vol. 182, no. April, p. pp.01349.2019, 2019, doi: 10.1104/pp.19.01349.
[22] C. A. Bücherl et al., “Plant immune and growth receptors share common signalling components but localise to distinct plasma membrane nanodomains,” Elife, vol. 6, pp. 1–28, 2017, doi: 10.7554/eLife.25114.
[23] F. Demir, “Supporting Information,” Proc. Natl. Acad. Sci., pp. 1–7, 2013, doi: 10.6019/PXD000211.
[24] A. Kusumi et al., “Dynamic Organizing Principles of the Plasma Membrane that Regulate Signal Transduction: Commemorating the Fortieth Anniversary of Singer and Nicolson’s Fluid-Mosaic Model,” Annu. Rev. Cell Dev. Biol., vol. 28, no. 1, pp. 215–250, 2012, doi: 10.1146/annurev-cellbio-100809-151736.
[25] J. Kleine-Vehn et al., “Recycling, clustering, and endocytosis jointly maintain PIN auxin carrier polarity at the plasma membrane,” Mol. Syst. Biol., vol. 7, no. 540, pp. 1–13, 2011, doi: 10.1038/msb.2011.72.
[26] S. Raffaele et al., “Remorin, a solanaceae protein resident in membrane rafts and plasmodesmata, impairs potato virus X movement,” Plant Cell, vol. 21, no. 5, pp. 1541–1555, 2009, doi: 10.1105/tpc.108.064279.
[27] M. F. Langhorst, A. Reuter, and C. A. O. Stuermer, “Scaffolding microdomains and beyond: The function of reggie/flotillin proteins,” Cell. Mol. Life Sci., vol. 62, no. 19–20, pp. 2228–2240, 2005, doi: 10.1007/s00018-005-5166-4.
[28] L. J. Pike, “Rafts defined: A report on the Keystone symposium on lipid rafts and cell function,” J. Lipid Res., vol. 47, no. 7, pp. 1597–1598, 2006, doi: 10.1194/jlr.E600002-JLR200.
[29] X. Pan et al., “Auxin-induced nanoclustering of membrane signaling complexes underlies cell polarity establishment in Arabidopsis,” bioRxiv, vol. 32, no. 0, pp. 1–32, 2019, doi: 10.1101/734665.
[30] D. Huang et al., “Salicylic acid-mediated plasmodesmal closure via Remorin-dependent lipid organization,” Proc. Natl. Acad. Sci. U. S. A., vol. 116, no. 42, pp. 21274–21284, 2019, doi: 10.1073/pnas.1911892116.
[31] J. L. Cacas et al., “Revisiting plant plasma membrane lipids in tobacco: A focus on sphingolipids,” Plant Physiol., vol. 170, no. 1, pp. 367–384, 2016, doi: 10.1104/pp.15.00564.
[32] M. P. Platre et al., “Developmental control of plant Rho GTPase nano-organization by the lipid phosphatidylserine,” Science (80-. )., vol. 62, no. April, pp. 57–62, 2019.
[33] F. Furt et al., “Polyphosphoinositides are enriched in plant membrane rafts and form microdomains in the plasma membrane,” Plant Physiol., vol. 152, no. 4, pp. 2173–2187, 2010, doi: 10.1104/pp.109.149823.
[34] R. Raghupathy et al., “Transbilayer lipid interactions mediate nanoclustering of lipid-anchored proteins,” Cell, vol. 161, no. 3, pp. 581–594, 2015, doi: 10.1016/j.cell.2015.03.048.
[35] M. Daněk et al., “Cell wall contributes to the stability of plasma membrane nanodomain organization of Arabidopsis thaliana FLOTILLIN2 and HYPERSENSITIVE INDUCED REACTION1 proteins,” Plant J., vol. 101, no. 3, pp. 619–636, 2020, doi: 10.1111/tpj.14566.
[36] J. F. McKenna et al., “The cell wall regulates dynamics and size of plasma-membrane nanodomains in Arabidopsis,” Proc. Natl. Acad. Sci. U. S. A., vol. 116, no. 26, pp. 12857–12862, 2019, doi: 10.1073/pnas.1819077116.
[37] X. Lv et al., “Membrane microdomains and the cytoskeleton constrain AtHIR1 dynamics and facilitate the formation of an AtHIR1-associated immune complex,” Plant J., vol. 90, no. 1, pp. 3–16, 2017, doi: 10.1111/tpj.13480.
[38] J. Gronnier et al., “Structural basis for plant plasma membrane protein dynamics and organization into functional nanodomains,” Elife, vol. 6, pp. 1–24, 2017, doi: 10.7554/eLife.26404.
[39] I. Stenzel et al., “The type B phosphatidylinositol-4-phosphate 5-kinase 3 is essential for root hair formation in Arabidopsis thaliana,” Plant Cell, vol. 20, no. 1, pp. 124–141, 2008, doi: 10.1105/tpc.107.052852.
[40] P. Campanoni and M. R. Blatt, “Membrane trafficking and polar growth in root hairs and pollen tubes,” J. Exp. Bot., vol. 58, no. 1, pp. 65–74, 2007, doi: 10.1093/jxb/erl059.
[41] J. Tilsner, W. Nicolas, A. Rosado, and E. M. Bayer, “Staying Tight: Plasmodesmal Membrane Contact Sites and the Control of Cell-to-Cell Connectivity in Plants,” Annu. Rev. Plant Biol., vol. 67, no. 1, pp. 337–364, 2016, doi: 10.1146/annurev-arplant-043015-111840.
[42] S. C. J. Helle, G. Kanfer, K. Kolar, A. Lang, A. H. Michel, and B. Kornmann, “Organization and function of membrane contact sites,” Biochim. Biophys. Acta - Mol. Cell Res., vol. 1833, no. 11, pp. 2526–2541, 2013, doi: 10.1016/j.bbamcr.2013.01.028.
[43] P. M. Cummins, “Occludin: One Protein, Many Forms,” Mol. Cell. Biol., vol. 32, no. 2, pp. 242–250, 2012, doi: 10.1128/mcb.06029-11.
[44] T. Nakayama, H. Shinohara, M. Tanaka, K. Baba, M. Ogawa-Ohnishi, and Y. Matsubayashi, “A peptide hormone required for Casparian strip diffusion barrier formation in Arabidopsis roots,” Science (80-. )., vol. 355, no. 6322, pp. 284–286, 2017, doi: 10.1126/science.aai9057.
[45] V. G. Doblas et al., “Root diffusion barrier control by a vasculature-derived peptide binding to the SGN3 receptor,” Science (80-. )., vol. 355, no. 6322, pp. 280–284, 2017, doi: 10.1126/science.aaj1562.
[46] J. Alassimone et al., “Polarly localized kinase SGN1 is required for Casparian strip integrity and positioning,” Nat. Plants, vol. 2, no. 8, pp. 1–10, 2016, doi: 10.1038/nplants.2016.113.
[47] A. Pfister et al., “A receptor-like kinase mutant with absent endodermal diffusion barrier displays selective nutrient homeostasis defects,” Elife, vol. 3, p. e03115, 2014, doi: 10.7554/eLife.03115.
[48] M. Bell and A. Coleman, “Lipid topogenesis,” vol. 22, pp. 391–403, 1981.
[49] L. M. Ballas and R. M. Bell, “Topography of Glycerolipid Synthetic Enzymes,” Biochim. Biophys. Acta, vol. 5, no. 198 1, pp. 586–595, 1981.
[50] M. P. Platre et al., “A Combinatorial Lipid Code Shapes the Electrostatic Landscape of Plant Endomembranes,” Dev. Cell, vol. 0, no. 0, pp. 1–16, 2018, doi: 10.1016/j.devcel.2018.04.011.
[51] H. M. Hankins, R. D. Baldridge, P. Xu, and T. R. Graham, “Role of Flippases, Scramblases and Transfer Proteins in Phosphatidylserine Subcellular Distribution,” Traffic, vol. 16, no. 1, pp. 35–47, 2015, doi: 10.1111/tra.12233.
[52] G. D. Fairn et al., “High-resolution mapping reveals topologically distinct cellular pools of phosphatidylserine,” J. Cell Biol., vol. 194, no. 2, pp. 257–275, 2011, doi: 10.1083/jcb.201012028.
[53] S. Nagata, T. Sakuragi, and K. Segawa, “Flippase and scramblase for phosphatidylserine exposure,” Curr. Opin. Immunol., vol. 62, pp. 31–38, 2020, doi: 10.1016/j.coi.2019.11.009.
[54] J. D. Brunner, N. K. Lim, S. Schenck, A. Duerst, and R. Dutzler, “X-ray structure of a calcium-activated TMEM16 lipid scramblase,” Nature, vol. 516, no. 7530, pp. 207–212, 2014, doi: 10.1038/nature13984.
[55] J. Suzuki, M. Umeda, P. J. Sims, and S. Nagata, “Calcium-dependent phospholipid scrambling by TMEM16F,” Nature, vol. 468, no. 7325, pp. 834–840, 2010, doi: 10.1038/nature09583.
[56] O. M. Siggs et al., “The P4-type ATPase ATP11C is essential for B lymphopoiesis in adult bone marrow,” Nat. Immunol., vol. 12, no. 5, pp. 434–440, 2011, doi: 10.1038/ni.2012.
[57] B. Mirnikjoo, K. Balasubramanian, and A. J. Schroit, “Suicidal membrane repair regulates phosphatidylserine externalization during apoptosis,” J. Biol. Chem., 2009, doi: 10.1074/jbc.C109.022913.
[58] Y. Okamoto et al., “C-terminal of ABCA1 separately regulates cholesterol floppase activity and cholesterol efflux activity,” Biosci. Biotechnol. Biochem., vol. 00, no. 00, pp. 1–10, 2019, doi: 10.1080/09168451.2019.1700775.
[59] J. Neumann, D. Rose-sperling, and U. A. Hellmich, “Biochimica et Biophysica Acta Diverse relations between ABC transporters and lipids : An overview,” BBA - Biomembr., 2016, doi: 10.1016/j.bbamem.2016.09.023.
[60] J. Suzuki, E. Imanishi, and S. Nagata, “Xkr8 phospholipid scrambling complex in apoptotic phosphatidylserine exposure,” Proc. Natl. Acad. Sci. U. S. A., vol. 113, no. 34, pp. 9509–9514, 2016, doi: 10.1073/pnas.1610403113.
[61] M. S. Robinson, “Forty Years of Clathrin-coated Vesicles,” Traffic, vol. 16, no. 12, pp. 1210–1238, 2015, doi: 10.1111/tra.12335.
[62] M. Narasimhan, A. Johnson, R. Prizak, W. A. Kaufmann, B. Casillas-Pérez, and J. Friml, “Evolutionary unique mechanistic framework of clathrin-mediated endocytosis in plants,” bioRxiv, p. 762906, 2019, doi: 10.1101/762906.
[63] M. Lowe, “The physiological functions of the Golgin vesicle tethering proteins,” Front. Cell Dev. Biol., vol. 7, no. JUN, pp. 1–13, 2019, doi: 10.3389/fcell.2019.00094.
[64] A. Diao, L. Frost, Y. Morohashi, and M. Lowe, “Coordination of Golgin tethering and SNARE assembly: GM130 binds syntaxin 5 in a p115-regulated manner,” J. Biol. Chem., vol. 283, no. 11, pp. 6957–6967, 2008, doi: 10.1074/jbc.M708401200.
[65] M. G. Waters and S. R. Pfeffer, “Membrane tethering in intracellular transport,” Curr. Opin. Cell Biol., vol. 11, no. 4, pp. 453–459, 1999, doi: 10.1016/S0955-0674(99)80065-9.
[66] S. R. Pfeffer, “Transport-vesicle targeting: Tethers before SNAREs,” Nat. Cell Biol., vol. 1, no. 1, pp. E17–E22, 1999, doi: 10.1038/8967.
[67] J. Luo, L. Y. Jiang, H. Yang, and B. L. Song, “Intracellular Cholesterol Transport by Sterol Transfer Proteins at Membrane Contact Sites,” Trends Biochem. Sci., vol. 44, no. 3, pp. 273–292, 2019, doi: 10.1016/j.tibs.2018.10.001.
[68] J. Pérez-Sancho, J. Tilsner, A. L. Samuels, M. A. Botella, E. M. Bayer, and A. Rosado, “Stitching Organelles: Organization and Function of Specialized Membrane Contact Sites in Plants,” Trends Cell Biol., vol. 26, no. 9, pp. 705–717, 2016, doi: 10.1016/j.tcb.2016.05.007.
[69] M. Eisenberg-Bord, N. Shai, M. Schuldiner, and M. Bohnert, “A Tether Is a Tether Is a Tether: Tethering at Membrane Contact Sites,” Dev. Cell, vol. 39, no. 4, pp. 395–409, 2016, doi: 10.1016/j.devcel.2016.10.022.
[70] Y. Ito, T. Uemura, and A. Nakano, Formation and maintenance of the golgi apparatus in plant cells, 1st ed., vol. 310. Elsevier Inc., 2014.
[71] R. M. Zerbes, I. J. V. Der Klei, M. Veenhuis, N. Pfanner, M. Van Der Laan, and M. Bohnert, “Mitofilin complexes: Conserved organizers of mitochondrial membrane architecture,” Biological Chemistry. 2012, doi: 10.1515/hsz-2012-0239.
[72] M. L. Brault et al., “Multiple C2 domains and transmembrane region proteins ( MCTP s) tether membranes at plasmodesmata,” EMBO Rep., vol. 20, no. 8, pp. 1–26, 2019, doi: 10.15252/embr.201847182.
[73] N. A. Baumann et al., “Transport of newly synthesized sterol to the sterol-enriched plasma membrane occurs via nonvesicular equilibration,” Biochemistry, vol. 44, no. 15, pp. 5816–5826, 2005, doi: 10.1021/bi048296z.
[74] M. R. Kaplan and R. D. Simoni, “Transport of cholesterol from the endoplasmic reticulum to the plasma membrane,” J. Cell Biol., vol. 101, no. 2, pp. 446–453, 1985, doi: 10.1083/jcb.101.2.446.
[75] K. Maeda et al., “Interactome map uncovers phosphatidylserine transport by oxysterol-binding proteins,” Nature, vol. 501, no. 7466, pp. 257–261, 2013, doi: 10.1038/nature12430.
[76] J. M. Von Filseck, S. Vanni, B. Mesmin, B. Antonny, and G. Drin, “A phosphatidylinositol-4-phosphate powered exchange mechanism to create a lipid gradient between membranes,” Nat. Commun., vol. 6, 2015, doi: 10.1038/ncomms7671.
[77] J. P. Zewe, R. C. Wills, S. Sangappa, B. D. Goulden, and G. R. V. Hammond, “SAC1 degrades its lipid substrate Ptdins4P in the endoplasmic reticulum to maintain a steep chemical gradient with donor membranes,” Elife, vol. 7, pp. 1–25, 2018, doi: 10.7554/eLife.35588.
[78] E. Quon et al., Endoplasmic reticulum-plasma membrane contact sites integrate sterol and phospholipid regulation, vol. 16, no. 5. 2018.
[79] B. Mesmin, J. Bigay, J. Polidori, D. Jamecna, S. Lacas‐Gervais, and B. Antonny, “Sterol transfer, PI 4P consumption, and control of membrane lipid order by endogenous OSBP,” EMBO J., vol. 36, no. 21, pp. 3156–3174, 2017, doi: 10.15252/embj.201796687.
[80] J. M. Von Filseck et al., “Phosphatidylserine transport by ORP/Osh proteins is driven by phosphatidylinositol 4-phosphate,” Science (80-. )., vol. 349, no. 6246, pp. 432–436, 2015, doi: 10.1126/science.aab1346.
[81] J. Chung et al., “PI4P/phosphatidylserine countertransport at ORP5- and ORP8-mediated ER - Plasma membrane contacts,” Science (80-. )., vol. 349, no. 6246, pp. 428–432, 2015, doi: 10.1126/science.aab1370.
[82] J. P. Zewe, A. M. Miller, S. Sangappa, R. C. Wills, B. D. Goulden, and G. R. V. Hammond, “Probing the subcellular distribution of phosphatidylinositol reveals a surprising lack at the plasma membrane,” J. Cell Biol., vol. 219, no. 3, 2020, doi: 10.1083/jcb.201906127.
[83] Y. J. Kim, M. L. Guzman-Hernandez, E. Wisniewski, and T. Balla, “Phosphatidylinositol-Phosphatidic Acid Exchange by Nir2 at ER-PM Contact Sites Maintains Phosphoinositide Signaling Competence,” Dev. Cell, vol. 33, no. 5, pp. 549–561, 2015, doi: 10.1016/j.devcel.2015.04.028.
[84] A. Bankaitis and A. Grabon, “Phosphatidylinositol Synthase and Diacylglycerol Platforms Bust a Move,” Dev. Cell, vol. 46, no. 4, pp. 564–574, 2011, doi: 10.1016/j.devcel.2011.10.016.
[85] V. Bankaitis, J. Mousley, and G. Schaaf, “The Sec14-superfamily and mechanisms for crosstalk between lipid metabolism and lipid signaling,” Trends Biochem Sci., vol. 46, no. 4, pp. 564–574, 2010, doi: 10.1016/j.tibs.2009.10.008.
[86] Y. Jaillais et al., “Tyrosine phosphorylation controls brassinosteroid receptor activation by triggering membrane release of its kinase inhibitor,” Genes Dev., vol. 25, no. 3, pp. 232–237, 2011, doi: 10.1101/gad.2001911.
[87] X. Wen et al., “Activation of ethylene signaling is mediated by nuclear translocation of the cleaved EIN2 carboxyl terminus,” Cell Res., vol. 22, no. 11, pp. 1613–1616, 2012, doi: 10.1038/cr.2012.145.
[88] H. Qiao et al., “Processing and subcellular trafficking of ER-tethered EIN2 control response to ethylene gas,” Science (80-. )., vol. 338, no. 6105, pp. 390–393, 2012, doi: 10.1126/science.1225974.
[89] J. C. Dodart, C. Mathis, and A. Ungerer, “Des formes sécrétées du précurseur de la protéine β-amylo’ide impliqué dans la maladie d’Alzheimer améliorent la mémoire des souris,” Medecine/Sciences, 1999, doi: 10.4267/10608/1319.
[90] C. Greening and T. Lithgow, “Formation and function of bacterial organelles,” Nat. Rev. Microbiol., no. 2, pp. 1–13, doi: 10.1038/s41579-020-0413-0.
[91] R. Uebe and D. Schüler, “Magnetosome biogenesis in magnetotactic bacteria,” Nat. Rev. Microbiol., vol. 14, no. 10, pp. 621–637, 2016, doi: 10.1038/nrmicro.2016.99.
[92] J. Moser von Filseck and G. Drin, “Running up that hill: How to create cellular lipid gradients by lipid counter-flows,” Biochimie, vol. 130, pp. 115–121, 2016, doi: 10.1016/j.biochi.2016.08.001.