Selon l’Organisation mondiale de la santé, 466 millions d'individus dont 34 millions d’enfants présentent une déficience auditive handicapante, et un milliard de personnes seront touchées en 2050. Ces atteintes ont des causes multiples, peuvent survenir à tout âge et avoir des degrés de sévérité et de progression variables. Notre environnement devenant de plus en plus bruyant, les sources de nuisances sonores allant croissantes, l’exposition au bruit occupe malheureusement une place de plus en plus importante comme cause de perte d'audition. Bien qu’évitables, ces atteintes ont un impact économique et sociétal très important. En effet, l’exposition prolongée au bruit ou à des sons de forte intensité peut entraîner des dommages irréversibles aux cellules sensorielles et aux neurones auditifs, ce qui détériore la perception auditive et perturbe l’intelligibilité de la parole.
La communication est essentielle à l’interaction sociale. Un déclin non traité des capacités auditives entraîne souvent un isolement social, une dépression et une réduction des fonctions cognitives. Par sa prévalence élevée, la surdité représente un problème de santé publique majeur. Selon les estimations de l’Organisation mondiale de la santé, la prévalence mondiale des déficiences auditives est passée de 42 millions en 1985 à 466 millions dont 34 millions d’enfants en 2021, et d’ici 2050, environ un milliard de personnes seront soumises à un risque de pertes auditives, soit un individu sur dix ! Les causes sont multiples : génétiques, complications à la naissance, maladies infectieuses, infections chroniques de l’oreille, exposition aux bruits ou à des sons forts, agents chimiques, médicaments ototoxiques, ou vieillissement (voir [1,2] pour des revues de ces causes). On parle de déficience auditive lorsqu’une personne entend moins bien qu’une personne avec une audition normale (seuil auditif en dessous de 20 décibels (dB)). La surdité peut se présenter sous un grand nombre de formes complètement distinctes, allant de la simple gêne au véritable handicap avec perte totale d’audition. On parle de surdité légère lorsque la perte auditive se situe entre 21 et 39 décibels, de surdité moyenne pour une perte de 40 à 69 dB, de surdité sévère pour une perte comprise entre 70 et 89 dB (qui devient une gêne importante au quotidien), et de surdité profonde ou totale lorsque la perte est supérieure à 90 dB (la personne est sourde et ne peut généralement communiquer qu’en utilisant la langue des signes). En France, près de 7 millions de personnes souffrent de déficience auditive : un millier de nouveau-nés naissent sourds chaque année, et le pourcentage de malentendants dans la population ne cesse de progresser avec l’âge : 6 % entre 15 et 24 ans, 9 % entre 25 et 34 ans, 18 % entre 35 et 44 ans et plus de 65 % après 65 ans. Avant de traiter des surdités liées au bruit, et des traitements possibles en cas de traumatismes sonores, nous commencerons par présenter le fonctionnement de l'oreille interne.
L’oreille interne, des cellules ciliées hautement spécialisées au service de la mécanoréception
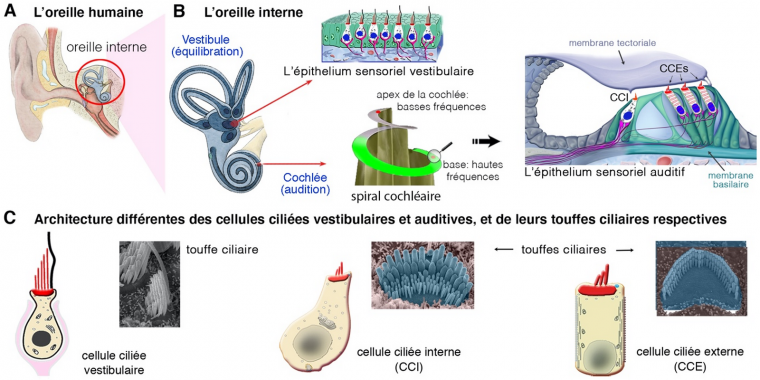
Chez les Mammifères, l’oreille interne abrite l’organe sensoriel de l’audition, la cochlée, et l’organe de l’équilibration, le vestibule. L’organisation de l’épithélium sensoriel (lieu où se fait la transduction du signal : mouvement pour le vestibule, ou son pour la cochlée) est différente dans les deux organes. L’architecture de l’organe auditif cochléaire chez les Mammifères est très différenciée et hautement spécialisée (voir [1, 2] ; et Figure 1A,B). Cette organisation anatomique de la cochlée est essentielle pour assurer les performances auditives exceptionnelles qui sont celles des Mammifères, tant en ce qui concerne la sensibilité de l’audition que la gamme d’intensités sonores et des fréquences des sons perçus. Chez les Mammifères, l’organe sensoriel auditif (organe de Corti) contient deux types de cellules ciliées, ainsi nommées car elles présentent à leur surface une touffe ciliaire, site de la transduction mécano-électrique (Figure 1B,C). Les cellules ciliées externes (CCE, au nombre de 9 000 à 12 000 cellules organisées en trois rangées) sont uniques aux Mammifères et jouent un rôle d’amplificateur de la stimulation sonore. Les cellules ciliées internes (CCI, organisées en une rangée unique de 3 000 à 3 500 cellules), sont les véritables cellules sensorielles ; elles seules transmettent l’information sensorielle au système nerveux central (Figure 1B,C). À l’extrémité apicale de chaque cellule ciliée, vestibulaire ou auditive, plusieurs dizaines de microvillosités rigides, appelées stéréocils, forment la touffe ciliaire. Cette dernière est le siège de la transduction mécano-électrique (Figure 1C). Dans la cochlée, l’arrivée de l’onde sonore entraine une série d’évènements qui aboutissent à la déflection de la touffe ciliaire des cellules ciliées internes. Il s’ensuit une dépolarisation de la cellule qui conduit à la libération du neurotransmetteur (glutamate). L’activation des neurones auditifs primaires qui en résulte est ensuite transmise à travers les voies auditives jusqu’au cortex auditif [1].
A. L’oreille humaine est constituée du vestibule (organe de l’équilibre) et de la cochlée (organe de l’audition).
B. L’épithélium sensoriel auditif se situe entre la membrane basilaire et la membrane tectoriale. La bonne transduction des signaux sonores requiert un bon fonctionnement des cellules sensorielles auditives qui sont de deux types : les cellules ciliées internes (CCI) et les cellules ciliées externes (CCE).
C. Représentation schématique illustrant les différences de morphologie des cellules sensorielles qui composent le vestibule et la cochlée de l’oreille interne. Grâce à leur touffe ciliaire, structure mécanosensible à la surface apicale, elles convertissent les mouvements (pour les cellules ciliées vestibulaires) et les sons (pour les cellules ciliées auditives) en signaux électriques. La touffe ciliaire, vue en microscopie électronique à balayage, est composée de 50 à 100 microvillosités rigides, remplies de filaments d’actine, appelés stéréocils. Ces stéréocils sont étroitement liés entre eux, organisés en rangées de tailles croissantes assemblées sous des formes différentes, mais spécifiques aux types de cellules ciliées.
Figure adaptée de Delmaghani et El-Amraoui 2020, Journal of Clinical Medicine.
Pour comprendre le fonctionnement des cellules ciliées auditives, il est important de comprendre aussi l’évolution de l’organe auditif chez les Vertébrés [2, 3]. En effet, tout indique que l’organe de l’audition aurait émergé à partir d’un organe sensoriel de type vestibulaire, servant à l’origine à l’équilibre. Chez les Vertébrés, les premiers signes de l’existence d’une audition remontent aux Gnathostomes, poissons pourvus d’une mandibule, apparus il y a environ 440 millions d’années. Un organe du vestibule, qui présente déjà une structure très semblable à celui des Mammifères, devient capable de détecter des ondes de fréquence faible, 800 Hertz (Hz) au maximum. Au moment du passage de la mer à la terre (chez les Tétrapodes), apparaît ensuite un organe indépendant, exclusivement dédié à l’audition. Cet organe de l’audition a continué d’évoluer pour accompagner les changements du spectre de fréquences audibles spécifique à chaque espèce, qui s’élargissait au fur et à mesure vers les hautes fréquences (voir [2-4]). Au plan anatomique, plusieurs innovations et spécialisations de structures existantes ont eu lieu pour adapter l’oreille aux besoins spécifiques de chaque espèce. Ces changements incluent entre autres, l’apparition de l’oreille moyenne et externe, l’allongement de l’organe sensoriel auditif – dont la taille est approximativement proportionnelle à la gamme de fréquences audibles – ainsi que l’apparition et l’allongement de la membrane basilaire [2, 3]. Un des changements majeurs récents est la spécialisation des cellules ciliées, et l’apparition des cellules ciliées externes qui n’existent que chez les Mammifères [2, 3]. Ces cellules ciliées auditives sont nécessaires pour l’amplification de l’onde sonore, et jouent un rôle clé dans notre capacité à discriminer les sons et à comprendre la parole malgré le bruit environnant [3, 5].
Outre ces différences anatomiques interspécifiques, il est important de noter également l’existence d’une différence anatomique au sein de la cochlée elle-même. Ces différences intracochlée sont plus marquantes chez les Mammifères. Dans l’espèce humaine, le spectre des fréquences sonores perceptibles pour une oreille en bon état de fonctionnement s’étend de 20 Hz à 20 kHz. Les propriétés physiques, morphologiques et moléculaires des cellules ciliées varient de façon graduelle le long de la cochlée, ce qui confère à chacune d’elles une résonance à une fréquence particulière (fréquence caractéristique) [1]. Ceci établit une carte fréquentielle apico-basale, ou tonotopie, où chaque fréquence est analysée à un emplacement spécifique le long de la cochlée [1]. La base de la cochlée, où les structures de l’organe auditif (par exemple la membrane basilaire et la membrane tectoriale) et les cellules sensorielles (en particulier les cellules ciliées externes, et les touffes ciliaires) sont plus rigides, est dévolue à l’analyse des hautes fréquences (sons aigus). En revanche, plus on avance vers l’apex de la cochlée, dévolu aux basses fréquences (sons graves), plus les structures de l’organe auditif sont fines, longues et souples [1].
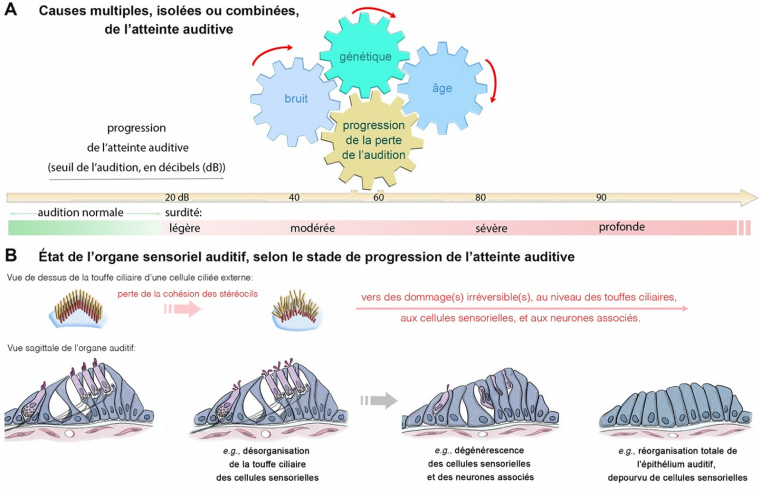
Les différentes spécialisations et évolutions anatomiques des structures et cellules de la cochlée permettent de percevoir les fréquences de notre spectre audible (20 – 20 000 Hz) et de discriminer, avec une grande sensibilité, les fréquences qui composent la voix parlée. En revanche, alors que chez les Téléostéens les cellules ciliées sont renouvelées spontanément, chaque jour, et en continu, chez les Mammifères aucune régénération n’est possible en cas de dommage ou mort des cellules ciliées auditives [1, 2]. Ainsi, chez les Mammifères, y compris dans l'espèce humaine, le nombre de cellules ciliées ou de neurones auditifs associés est prédéterminé avant la naissance ; toute perte ou atteinte de ces cellules entraîne un déficit sensoriel irréversible [6, 7]. Ceci explique la fréquence élevée des atteintes auditives, car quelle que soit la cause – génétique, environnementale (exposition à des sons intenses) ou vieillissement normal – l’atteinte auditive est bien souvent liée à un dysfonctionnement ou une perte des cellules ciliées et à la dégénérescence de leur innervation (voir Figure 2A, B).
Les sons intenses : ennemis n°1 des cellules sensorielles auditives
Plusieurs études ont confirmé la notion intuitive selon laquelle l’exposition à des sons forts, même sous forme de musique, peut endommager le système auditif périphérique et entraîner une diminution de la sensibilité auditive [8-13]. Outre l’atteinte physiologique du système auditif, la surdité liée au bruit peut affecter l’efficacité de la communication, en particulier en rendant la parole inintelligible. La protection de son propre système auditif, dès le plus jeune âge, et tout au long de la vie, est donc impérative.
Figure adaptée de Delmaghani et El-Amraoui 2020, Journal of Clinical Medicine.
Les cellules sensorielles sont fragiles, leur nombre est déterminé avant la naissance et, une fois endommagées, elles ne se régénèrent pas. La surdité liée au bruit est une perte auditive neurosensorielle due à une surexposition à des sons forts. Dans la plupart des cas, la déficience auditive se développe progressivement à la suite d’une exposition prolongée aux bruits qui, s’ils sont trop forts, peuvent à terme entraîner la mort des cellules ciliées et le dysfonctionnement total du système auditif (voir Figure 2A, B). Dans notre oreille, les cellules ciliées externes, produits de l’évolution spécifiques aux Mammifères, sont les plus fragiles. Leur fragilité réside notamment au niveau de la touffe ciliaire, la structure mécanosensible dont l’intégrité est essentielle pour l’amplification de l’onde sonore. En cas d’exposition au bruit, les premiers signes de dysfonctionnement peuvent se manifester au niveau de la touffe ciliaire, par la perte de la cohésion des stéréocils (Figure 2B). Cette perte de cohésion, et la diminution des seuils audiométriques qui en découle, peuvent être temporaires si le bruit s'arrête. Malheureusement, si l’intensité du son est trop forte (tel un coup de feu), ou la durée d’exposition trop importante (voir Figure 3 et Tableau 1), les dommages peuvent devenir permanents (Figure 2B). La perte de cohésion des stéréocils se poursuit alors jusqu’à la perte totale de la touffe ciliaire. En l’absence de touffe ciliaire fonctionnelle, des dommages surviennent également au sein de la cellule, conduisant à terme à la disparition des cellules ciliées (Figure 2B).
Chez l’être humain, un trauma sonore peut conduire à l’apparition de symptômes tels que des acouphènes, qui sont perçus comme des bruits entendus par le patient et qui n’ont pas de source externe dans l’environnement, ou de l’hyperacousie, qui est une extrême sensibilité aux sons [14, 15]. Les acouphènes peuvent se manifester par un bruit gênant, parfois intermittent, un bourdonnement, un sifflement, un grondement ou, le plus souvent, une sonnerie aiguë. L’apparition des acouphènes est donc un signal d’alerte de l’existence d’un dysfonctionnement qui peut se situer au niveau périphérique (oreille externe, moyenne ou interne), voire au niveau du cerveau, parmi les voies qui traitent les informations sonores.
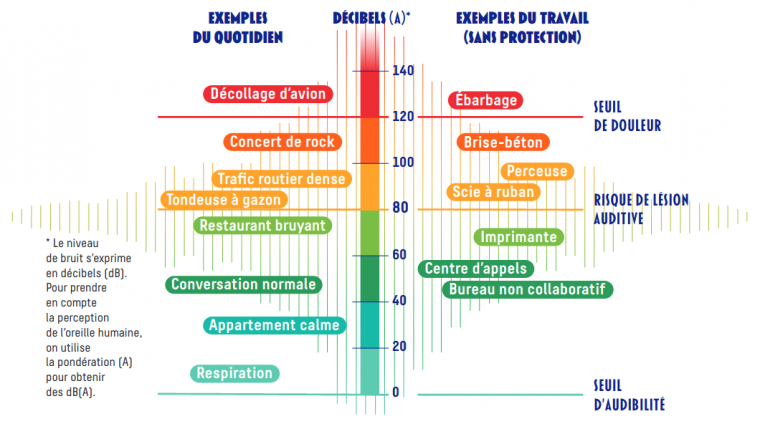
Au travail, au milieu de la circulation, lorsque nous écoutons de la musique, au concert ou dans une boîte de nuit très bruyante, nos oreilles sont exposées au bruit (Figure 3). L’exposition au bruit peut être dangereuse en fonction de l’intensité du son et de la durée de l’exposition. Les dommages peuvent varier de simple dysfonctionnement de la touffe ciliaire jusqu’à la perte totale des cellules sensorielles et des fibres neuronales associées, ce qui conduit à une élévation croissante et irréversible du seuil d’audition. Les études ont montré que les cellules auditives continuent de fonctionner normalement, tant que le modèle animal étudié n’est pas exposé à des intensités sonores au-delà de 80 décibels (la voix parlée, criée, salle de classe) pendant 8 heures par jour. C’est donc ce seuil qui est aujourd’hui retenu comme seuil de risque dans le cadre du travail par la législation européenne. Au-delà de 80 dB, la durée d’exposition suffisante pour provoquer des lésions varie en fonction de l’intensité du son (Tableau 1). Par exemple, la durée limite d’exposition pouvant provoquer des dommages passe de 8 heures par jour pour un son de l’intensité de 80 dB à seulement 1 minute par jour pour un son de l’intensité de 107 dB. Au-delà de 110 dB, quelques secondes suffissent à provoquer des dommages irréversibles. Ainsi, l’écoute de la musique à un niveau sonore élevé et pendant une période prolongée met nos oreilles en danger et peut entraîner une perte auditive irréversible. Ce ne sont donc pas seulement les bruits continus et stables, tels que ceux produits par les machines dans les usines, ou les sons transitoires et impulsionnels, caractéristiques des armes à feu, qui peuvent endommager le système auditif périphérique.
Figure issue du dépliant Moins fort le bruit et reproduite avec l'aimable autorisation de l’Institut national de recherche et de sécurité pour la prévention des accidents du travail et des maladies professionnelles (INRS).
| Niveau d'intensité sonore (décibels, dB) | Durée d'exposition |
|---|---|
| 80 | 8 heures |
| 83 | 4 heures |
| 86 | 2 heures |
| 89 | 1 heure |
| 92 | 30 minutes |
| 95 | 15 minutes |
| 98 | 7 minutes 30 |
| 101 | 3 minutes 45 |
| 104 | 1 minute 52 |
| 107 | 1 minute |
Les stratégies préventives et thérapeutiques des atteintes auditives
Comment prévenir les risques auditifs d’un traumatisme sonore ? Quelques conseils peuvent être appliqués : porter des protections auditives dans les milieux bruyants, contrôler le volume des appareils audio (casques, enceintes…), ne pas s’endormir avec un casque ou des écouteurs en fonctionnement, limiter les durées d’exposition au bruit.
Cependant, l’apparition d’acouphènes, d’hyperacousie, ou encore la sensation d’entendre ou de comprendre moins bien les conversations nécessitent une consultation médicale. Il est important de faire contrôler régulièrement son audition. L’audiométrie clinique à sons purs est utilisée pour évaluer les seuils d’audition de 250 à 8000 Hz, et la surdité liée au bruit est conventionnellement mesurée de cette manière. Les seuils d’audition sont dans ce cas mesurés avec une réponse subjective du patient. Cependant, des modifications subcliniques du système auditif peuvent ne pas être détectées par les méthodes conventionnelles de test audiométrique. La mesure des émissions otoacoustiques constitue une autre méthode d'évaluation de l’acuité auditive [16]. Ces émissions correspondent à des petits sons émis depuis l’intérieur de l’oreille interne, par l’activité des cellules ciliées externes. Ces sons peuvent être enregistrées par des capteurs externes. Ainsi, pour mesurer les émissions otoacoustiques, l’oreille est stimulée à l’aide d’un haut-parleur miniature et, en parallèle, un petit microphone placé dans le conduit auditif va permettre de capter les sons que la cochlée émet en réponse à la stimulation. Le niveau sonore de ces émissions otoacoustiques reflète l’état de santé des structures cochléaires, celles qui interviennent depuis l’oreille moyenne jusqu’à la mise en action des cellules ciliées externes. Les émissions otoacoustiques peuvent donc être utilisées pour détecter les lésions cochléaires précoces, telles que celles provenant d’une exposition au bruit [10, 17-20]. La mesure des émissions otoacoustiques auprès de plusieurs individus, qui de par de leur activité sont exposés à des sons forts (policiers exposés au bruit des armes à feu, musiciens professionnels), révèle une diminution des émissions otoacoustiques, signe d’un déclin auditif [10, 19-22].
Bien que l’exposition prolongée au bruit ou à des sons de forte intensité entraîne un dysfonctionnement du système auditif, la nature multifactorielle de la perte auditive doit être considérée : histoire familiale et prédisposition génétique, sexe, état physiologique et présence de comorbidités (par exemple, hypertension, diabète), âge, appartenance ethnique des individus, facteurs environnementaux et en particulier utilisation de médicaments ototoxiques (par exemple, les agents anticancéreux ou les antibiotiques de la famille des aminoglycosides) [23] et mode de vie (par exemple, tabagisme, consommation d’alcool, alimentation).
Traiter les symptômes des déficiences auditives : prothèses auditives externes et implants cochléaires
Comment corriger ou traiter les déficiences auditives liées aux traumas sonores ? Aujourd’hui, il n’y pas de traitement pour les pertes de l’audition. Seules des « aides auditives conventionnelles », prothèses auditives externes et implants cochléaires, existent. Elles sont utilisées pour pallier les symptômes sans traiter la cause à l’origine de la déficience auditive. Les aides auditives (appareils externes) sont conseillées lorsque l’oreille conserve une activité résiduelle dont la personne malentendante pourra encore bénéficier (exemple de personnes souffrant d’une surdité légère à modérée). Le but des prothèses est donc de tenter de suppléer l’activité manquante, en apportant une amplification des signaux acoustiques dans le but d’améliorer leur traitement. Discrètes et légères, ces prothèses sont performantes, mais elles ne fonctionnent pas très bien en milieu bruyant ou avec des sons parasites.
Dans le cas de surdités sévères à profonde, l’implant cochléaire est fortement conseillé. L’implant est composé d’un processeur externe qui transforme les sons en signaux électriques et les transmet par ondes à la partie interne implantée chirurgicalement derrière l’oreille. Le dispositif implanté permet de contourner les cellules ciliées endommagées de la cochlée et émet des impulsions électriques au niveau d’électrodes stimulant directement les fibres du nerf auditif. Il faut noter deux points majeurs : (1) si notre cochlée est capable de capter des ondes sonores comprises entre 20 Hz et 20 000 Hz, ce sont surtout les fréquences comprises entre 150 et 8000 Hz, les fréquences de la parole, qui sont prises en charge par l’implant cochléaire ; (2) l’implant cochléaire, au travers d’une vingtaine d’électrodes implantée dans la cochlée, est censé reproduire le résultat de l’activité de nos 15 000 cellules ciliées par oreille et leur capacité à discriminer finement les sons. Il va de soi que le message ainsi transmis au cerveau via l’implant est très appauvri par rapport à celui qui arrive avec une audition normale. La personne implantée devra donc suivre un parcours spécialisé pour réapprendre à interpréter et intégrer ces nouveaux types d’informations reçues. L’implant cochléaire permet à la personne implantée de suivre une conversation, dans un environnement sans interférence sonore, ou de répondre au téléphone. Comme les prothèses externes, l’implant cochléaire est moins performant en milieu bruyant ou avec des sons parasites. Aujourd’hui, quelle que soit sa forme, la réhabilitation prothétique ne peut assurer la récupération complète de la sensibilité auditive ni la restauration des épithéliums sensoriels natifs de l’oreille interne.
La thérapie de l’oreille interne, de nombreux défis en perspectives
Alors que les recherches se poursuivent pour améliorer les performances des prothèses auditives, notamment pour restituer une meilleure écoute de la parole dans le bruit et une écoute satisfaisante de la musique, des approches thérapeutiques nouvelles sont en cours de développement chez des modèles animaux, reproduisant des surdités humaines, avec l’objectif d’évaluer leur efficacité à prévenir, ralentir ou corriger la perte de l’audition. La grande diversité des caractéristiques phénotypiques des surdités, leurs causes multiples ainsi que la diversité des cibles cellulaire en jeu sont des éléments clés à prendre en compte pour concevoir une thérapie adaptée, que ce soit pour prévenir la perte des sens ou restaurer biologiquement la perception. Plusieurs pistes thérapeutiques sont en effet possibles (pour plus de détails, voir [1]).
Quelles pistes pour la régénération des cellules ciliées ?
Pour protéger ou prévenir une détérioration de l’audition, de nombreux travaux se sont intéressés à la régénération ou au remplacement de cellules ciliées défectueuses. Des résultats encourageants ont été obtenus in vitro et chez l’animal, en particulier par la surexpression d’un facteur de transcription, Math1 (ou Atoh1), à la fois nécessaire et suffisant pour induire la différenciation des cellules ciliées de la cochlée des Mammifères [6, 7]. Il a été montré que la seule addition de ce gène est capable de convertir une cellule de soutien en cellule ciliée [6, 7]. Néanmoins, de nombreuses questions restent encore posées : l’état de différenciation de la cellule ciliée nouvellement produite reste à un stade immature, différent de celui attendu pour une cellule ciliée auditive mature. Sera-t-on alors capable de produire, de manière reproductible, des cellules ciliées au bon stade de développement ? La voie Math1 sera-t-elle opérante sur le long terme ? Pourra-t-elle passer le stade du modèle animal et s’appliquer à l’espèce humaine ?
Il y a sûrement d’autres pistes à explorer : les signaux impliqués dans la régénération existent tout au long de la vie dans l’oreille des Vertébrés non-Mammifères, capable de renouveler spontanément ou de régénérer les cellules ciliées perdues et leur innervation. Néanmoins, quand les conditions de cette régénération auront été identifiées, se posera la question essentielle de leur réactivation dans l’oreille de Mammifères, et de leur maintien à travers le temps dans un environnement, adulte, pourtant devenu non permissif. À noter également que cette stratégie ne pourrait pas s’appliquer aux surdités d’origine génétique, à moins d’intégrer dans la démarche la correction de la mutation à l’origine de l’atteinte héréditaire.
Comment reproduire, ou maintenir, la tonotopie cochléaire ?
Il est important de garder à l’esprit que le fonctionnement de la cochlée mature repose sur une organisation tonotopique, préalablement mise en place au cours de la morphogenèse et de la différenciation de l’organe auditif. Les signaux contrôlant la variabilité base-apex de l’organe auditif agissent essentiellement au cours de la vie embryonnaire et sont pour la plupart inexistants chez l'adulte. Ainsi, lorsqu’on imagine le développement d’une thérapie pour retrouver une audition normale après une perte auditive, les cellules réparées ou nouvellement différenciées doivent avoir des propriétés corrélées à leur position le long de la cochlée, et établir un couplage mécanique adéquat avec leurs cellules de support environnantes et les neurones qui les innervent. La restauration de la tonotopie cochléaire doit être efficace pour permettre une meilleure discrimination des fréquences, en particulier celles de la parole.
La médecine personnalisée : mieux connaître la pathologie pour mieux la traiter
Ces dernières années, les avancées de la recherche sur les mécanismes moléculaires de l’audition et les facteurs responsables des troubles auditifs laissent espérer un développement futur de thérapies préventives et curatives des déficiences auditives. Récemment, des résultats très prometteurs ont pu être obtenus chez divers modèles animaux de surdités humaines, notamment via l’utilisation de la thérapie génique (voir [1, 24-27]). La thérapie génique, notamment l’addition de gène, consiste à transférer dans les cellules cibles un gène fonctionnel ou thérapeutique appelé « transgène » qui remplace, ou supplée, le gène défectueux à l’origine de la maladie. La découverte des ciseaux à ADN offre aussi de nouvelles voies à explorer pour tenter de corriger le gène défectueux directement dans les cellules cibles (voir [1, 27]). Il est prématuré de prédire quand de nouvelles approches thérapeutiques pour restaurer l’audition chez les patients sourds arriveront en clinique. En raison de la complexité de leur mise en œuvre et des risques en cas d’application mal maîtrisée, l’ensemble de ces nouvelles approches thérapeutiques nécessitera des études poussées et bien contrôlées chez l’animal, avant d’envisager une possible application chez l’être humain.
Conclusion
Notre faculté à donner un sens aux sons et à discriminer les mots repose sur un décodage extrêmement sélectif et rapide des propriétés spectro-temporelles du signal sonore, les hautes fréquences (sons aigus) étant traitées à la base de la cochlée, et les basses fréquences (sons graves) à l’apex. Chaque région de notre oreille est donc essentielle, irremplaçable. Tout au long de la cochlée, la discrimination fréquentielle fine des informations auditives s’opère au sein des cellules ciliées auditives qui fonctionnent en continu, et pour lesquelles tout dommage est irréversible. En l’absence de traitement, aujourd’hui, le meilleur moyen de protéger son audition est la prévention. La surdité altère considérablement les interactions sociales : mal entendre ou ne plus entendre autrui conduit à l’isolement social, source d’une souffrance psychologique qui plonge certains malentendants dans un état dépressif, associé à un déclin cognitif (altération de la mémoire, des capacités d’attention…). Les atteintes auditives chez l’adulte semblent d’ailleurs être un facteur de risque de maladies neurodégénératives. Les cellules ciliées et les neurones auditifs sont extrêmement sensibles à l’exposition à des sons de fortes intensités et ne se régénèrent pas. L’écoute de la musique à un niveau sonore élevé et pendant une période prolongée met nos oreilles en danger et peut entraîner une perte auditive irréversible. Malgré les avancées de la recherche sur le développement de thérapies préventives et curatives des déficiences auditives, seules des aides auditives conventionnelles existent aujourd’hui. En attendant, pour que la musique reste un plaisir tout au long de votre vie, protégez votre audition.
Références
[1] S. Delmaghani and A. El-Amraoui, « Inner Ear Gene Therapies Take Off : Current Promises and Future Challenges," (in English), Journal of Clinical Medicine, vol. 9, no. 7, Jul 2020, doi : ARTN 230910.3390/jcm9072309.
[2] A. Maudoux, S. Vitry, and A. El-Amraoui, « Vestibular deficits in deafness : clinical presentation, animal modeling and treatment solutions " Front. Neurol., vol. in press, 2022.
[3] C. Koppl and G. A. Manley, « A Functional Perspective on the Evolution of the Cochlea," Cold Spring Harb Perspect Med, vol. 9, no. 6, Jun 3 2019, doi : 10.1101/cshperspect.a033241.
[4] S. Picaud and A. El-Amraoui, « Les organes des sens " in Le cerveau en lumières, H. E. P. B Ed.: Edition Odile Jacob, 2020.
[5] K. Legendre, C. Petit, and A. El-Amraoui, « The outer hair cell of the mammalian cochlea : an outstanding amplifier," (in French), M S-Med Sci, vol. 25, no. 2, pp. 117-120, Feb 2009, doi : DOI 10.1051/medsci/2009252117.
[6] I. Jahan, N. Pan, K. L. Elliott, and B. Fritzsch, « The quest for restoring hearing : Understanding ear development more completely," Bioessays, vol. 37, no. 9, pp. 1016-27, Sep 2015, doi : 10.1002/bies.201500044.
[7] F. Zheng and J. Zuo, « Cochlear hair cell regeneration after noise-induced hearing loss : Does regeneration follow development?," Hear Res, vol. 349, pp. 182-196, Jun 2017, doi : 10.1016/j.heares.2016.12.011.
[8] M. G. Kim, S. M. Hong, H. J. Shim, Y. D. Kim, C. I. Cha, and S. G. Yeo, « Hearing threshold of Korean adolescents associated with the use of personal music players," Yonsei Med J, vol. 50, no. 6, pp. 771-6, Dec 31 2009, doi : 10.3349/ymj.2009.50.6.771.
[9] F. X. Lesage, N. Jovenin, F. Deschamps, and S. Vincent, « Noise-induced hearing loss in French police officers," Occup Med (Lond), vol. 59, no. 7, pp. 483-6, Oct 2009, doi : 10.1093/occmed/kqp091.
[10] F. Zhao, V. K. Manchaiah, D. French, and S. M. Price, « Music exposure and hearing disorders : an overview," Int J Audiol, vol. 49, no. 1, pp. 54-64, Jan 2010, doi : 10.3109/14992020903202520.
[11] G. Broyles, C. A. Kardous, P. B. Shaw, and E. F. Krieg, « Noise exposures and perceptions of hearing conservation programs among wildland firefighters," J Occup Environ Hyg, vol. 16, no. 12, pp. 775-784, Dec 2019, doi : 10.1080/15459624.2019.1668001.
[12] S. Unsal and F. Bal, « Hearing and Tinnitus Evaluation in Music Teachers," Int Tinnitus J, vol. 25, no. 1, pp. 94-99, Mar 1 2021, doi : 10.5935/0946-5448.20210017.
[13] Z. Shi et al., « Occupational Hearing Loss Associated With Non-Gaussian Noise : A Systematic Review and Meta-analysis," Ear Hear, vol. 42, no. 6, pp. 1472-1484, Nov-Dec 01 2021, doi : 10.1097/AUD.0000000000001060.
[14] H. J. Kang, D. W. Kang, S. S. Kim, T. I. Oh, S. H. Kim, and S. G. Yeo, « Analysis of Chronic Tinnitus in Noise-Induced Hearing Loss and Presbycusis," J Clin Med, vol. 10, no. 8, Apr 19 2021, doi : 10.3390/jcm10081779.
[15] M. Pienkowski, « Loud Music and Leisure Noise Is a Common Cause of Chronic Hearing Loss, Tinnitus and Hyperacusis," Int J Environ Res Public Health, vol. 18, no. 8, Apr 16 2021, doi : 10.3390/ijerph18084236.
[16] D. T. Kemp, « Otoacoustic emissions, their origin in cochlear function, and use," Br Med Bull, vol. 63, pp. 223-41, 2002, doi : 10.1093/bmb/63.1.223.
[17] L. Marshall, J. A. Lapsley Miller, and L. M. Heller, « Distortion-Product Otoacoustic Emissions as a Screening Tool for Noise-Induced Hearing Loss," Noise Health, vol. 3, no. 12, pp. 43-60, 2001. [Online]. Available : https://www.ncbi.nlm.nih.gov/pubmed/12678940.
[18] A. Shupak, D. Tal, Z. Sharoni, M. Oren, A. Ravid, and H. Pratt, « Otoacoustic emissions in early noise-induced hearing loss," Otol Neurotol, vol. 28, no. 6, pp. 745-52, Sep 2007, doi : 10.1097/MAO.0b013e3180a726c9.
[19] W. Jiang, F. Zhao, N. Guderley, and V. Manchaiah, « Daily music exposure dose and hearing problems using personal listening devices in adolescents and young adults : A systematic review," Int J Audiol, vol. 55, no. 4, pp. 197-205, 2016, doi : 10.3109/14992027.2015.1122237.
[20] P. G. Narahari, J. Bhat, A. Nambi, and A. Arora, « Impact of usage of personal music systems on oto-acoustic emissions among medical students," Noise Health, vol. 19, no. 90, pp. 222-226, Sep-Oct 2017, doi : 10.4103/nah. NAH_75_16.
[21] S. P. Bhagat and A. M. Davis, « Modification of otoacoustic emissions following ear-level exposure to MP3 player music," Int J Audiol, vol. 47, no. 12, pp. 751-60, Dec 2008, doi : 10.1080/14992020802310879.
[22] K. V. Gopal, K. Chesky, E. A. Beschoner, P. D. Nelson, and B. J. Stewart, « Auditory risk assessment of college music students in jazz band-based instructional activity," Noise Health, vol. 15, no. 65, pp. 246-52, Jul-Aug 2013, doi : 10.4103/1463-1741.113520.
[23] J. Wang and J. L. Puel, « Toward Cochlear Therapies," Physiol Rev, vol. 98, no. 4, pp. 2477-2522, Oct 1 2018, doi : 10.1152/physrev.00053.2017.
[24] A. El-Amraoui and C. Petit, « Thérapie cellulaire dans l’oreille interne – Nouveaux développements et perspectives – [Stem cell therapy in the inner ear : recent achievements and prospects.]," Med Sci (Paris), vol. 26, no. 11, pp. 981-985, Nov 2010. [Online]. Available : http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=21106181 Therapie cellulaire dans l’oreille interne : nouveaux developpements et perspectives.
[25] A. Meyer, C. Petit, and S. Safieddine, "[Gene therapy for human hearing loss : challenges and promises]," Med Sci (Paris), vol. 29, no. 10, pp. 883-9, Oct 2013, doi : 10.1051/medsci/20132910016. Therapie genique des surdites humaines : defis et promesses.
[26] M. C. Liberman, « Noise-induced and age-related hearing loss : new perspectives and potential therapies," F1000Res, vol. 6, p. 927, 2017, doi : 10.12688/f1000research.11310.1.
[27] C. Botto, D. Dalkara, and A. El-Amraoui, « Progress in Gene Editing Tools and Their Potential for Correcting Mutations Underlying Hearing and Vision Loss," Front Genome Ed, vol. 3, p. 737632, 2021, doi : 10.3389/fgeed.2021.737632.