Scanner, échographie, IRM ou encore imagerie nucléaire : l’imagerie médicale occupe une place centrale dans le parcours de soin des patients. Elle est donc logiquement présente dans les laboratoires de recherche, comme outil pour évaluer de nouveaux traitements, ou bien comme objet de recherche en soi ! C’est un domaine au carrefour de plusieurs disciplines scientifiques : physique, biologie, médecine, mais aussi chimie, traitement de l’image et du signal.
Nous présentons ici quatre méthodes d’imagerie du cerveau actuellement en développement dans les laboratoires de recherche. Ces techniques émergentes, utilisées chez l’animal de laboratoire, trouveront peut-être une application chez l’homme dans quelques années. À ce stade de leur développement, l’expérimentation animale est nécessaire pour prouver l’utilité (bénéfice) et vérifier l’absence d’effet secondaire (risque) de ces techniques d’imagerie.
Seront donc abordés :
- l’utilisation de nanoparticules pour l’IRM, avec Marlène Wiart ;
- l’imagerie ultrasonore fonctionnelle du cerveau, avec Benjamin Vidal ;
- la tomographie X en contraste de phase, avec Emmanuel Brun ;
- l’utilisation de radiotraceurs pour l’imagerie nucléaire en neurologie, avec Guillaume Becker.
Ces quatre modalités d’imagerie reposent chacune sur des bases physiques différentes : champ magnétique intense et ondes radiofréquences ; ondes ultrasonores ; rayons X ; radioactivité et rayons gamma.
Dans ce panorama, coordonné par Fabien Chauveau, nous nous concentrons sur les applications médicales sans détailler les principes physiques de chaque modalité, qui sont néanmoins présentées dans les ressources proposées en hyperliens, avec notamment cette page du site du Commissariat à l’énergie atomique et aux énergies alternatives (CEA) qui présente l’essentiel sur l’imagerie médicale.
L’utilisation de nanoparticules pour l’IRM
L’imagerie par résonance magnétique
L’imagerie par résonance magnétique (IRM) est une modalité d’imagerie médicale très utilisée pour le diagnostic des maladies touchant les tissus dits « mous » (cerveau, moelle épinière, muscles, tendons…).
Son principe repose sur les effets d’un champ magnétique sur les molécules d’eau qui composent notre corps. En effet, les molécules d’eau comprennent deux atomes d’hydrogène dont le noyau est constitué d’un proton. Les protons sont des particules chargées qui possèdent un moment magnétique (spin) et se comportent donc comme des aimants en présence d’un champ magnétique. Dans un appareil d’IRM, les protons sont soumis à un champ magnétique intense. Le moment magnétique résultant (macroscopique) s’aligne avec le champ magnétique.
L’appareil IRM émet une onde radiofréquence qui vient perturber cet alignement et mesure ensuite le retour à l’équilibre des moments magnétiques à l’aide d’une antenne. La vitesse de retour à l’équilibre et la force du signal dépendent de la composition des tissus, ce qui permet de générer un contraste sur les images. L’IRM permet ainsi d’obtenir des images très précises en trois dimensions, de manière très sécurisée, les ondes radiofréquences n’ayant pas d’effet négatif sur l’organisme. Le principe de fonctionnement de l’IRM est expliqué dans une vidéo détaillée traitant également de l’IRM de diffusion, ainsi que dans deux animations plus courtes disponibles sur le site du CEA (lien 1, lien 2).
Nanoparticules couplées à l’IRM
Les agents de contraste sont souvent utilisés pour améliorer la valeur diagnostique de l’examen (par exemple en faisant ressortir une tumeur par rapport au tissu environnant). En IRM, les agents de contraste les plus utilisés sont les chélates de gadolinium, qui sont approuvés par les autorités pour une utilisation chez les patients. Cet ion paramagnétique (Gd3+) n’est pas aimanté en l’absence d’un champ magnétique mais acquiert, sous l’effet du champ, une aimantation orientée dans le même sens que le champ (paramagnétisme). Les nanoparticules d’oxyde de fer (SPIO pour « superparamagnetic particles of iron oxide », de taille comprise entre 50 nm et 100 nm, ou USPIO dans leur version « ultrasmall », de taille inférieure à 50 nm) constituent une autre classe d’agents de contraste. Ces matériaux métalliques de très petite taille sont dits superparamagnétiques, car ils s’aimantent très fortement (par coopération entre les particules) en présence d’un champ magnétique extérieur. À ce jour, les nanoparticules d’oxyde de fer ne sont pas approuvées par les autorités pour un usage en radiologie. Leur utilisation est donc limitée à des protocoles de recherche très encadrés.
En clinique, ces nanoparticules ont des applications pour l’imagerie des vaisseaux (angiographie), du foie (détection de tumeurs) ou encore du système lymphatique (détection de métastases). Dans le domaine de la recherche, elles permettent d’étudier les zones inflammatoires. En effet, certaines cellules du système immunitaire, principalement les macrophages, phagocytent ces nanoparticules et, de ce fait, acquièrent des propriétés magnétiques. Il devient alors possible de les détecter et de les suivre en IRM (figures 1 à 4), ce qui est une manière d’appréhender la réponse inflammatoire. Cela représente un grand progrès, car il existe actuellement peu de techniques d’imagerie médicale donnant une information aussi précise sur l’inflammation.
Les (U)SPIO sont constituées de particules de petite taille (inférieure à 100 nm voire à 50 nm pour les ultrasmall) qui ont l’avantage d’être biocompatibles et faiblement toxiques. Certaines d’entre elles sont utilisées aux États-Unis pour le traitement de l’anémie (carence en fer). Elles ont donc déjà été administrées à un très grand nombre de patients sans problème. Cependant, leur utilisation en tant qu’agent de contraste est plus difficile, car elles n’ont pas encore démontré de supériorité diagnostique pour leur indication principale, le diagnostic de certains cancers.
Ainsi, aujourd’hui, l’imagerie de l’inflammation en IRM couplée à l’administration d'(U)SPIO n’est réalisée que dans le cadre de protocoles cliniques très encadrés. Cependant, la recherche pré-clinique (chez le petit animal de laboratoire) et clinique (chez les patients) est très dynamique et devrait permettre à terme de voir émerger des applications chez l’Homme. Ainsi, cette nouvelle approche d’imagerie pourrait ouvrir la voie à une meilleure compréhension des maladies, à un meilleur diagnostic de leur composante inflammatoire, et au développement de nouvelles thérapies adaptées à chaque patient (médecine personnalisée). Parmi les applications phares, on peut citer la sclérose en plaque, une maladie neurologique auto-immune caractérisée par des pics de réaction inflammatoire, ou encore l’accident vasculaire cérébral. Cela suppose de mener une recherche pluridisciplinaire, à l’interface entre la médecine, la biologie, la physique et le traitement du signal et de l’image.
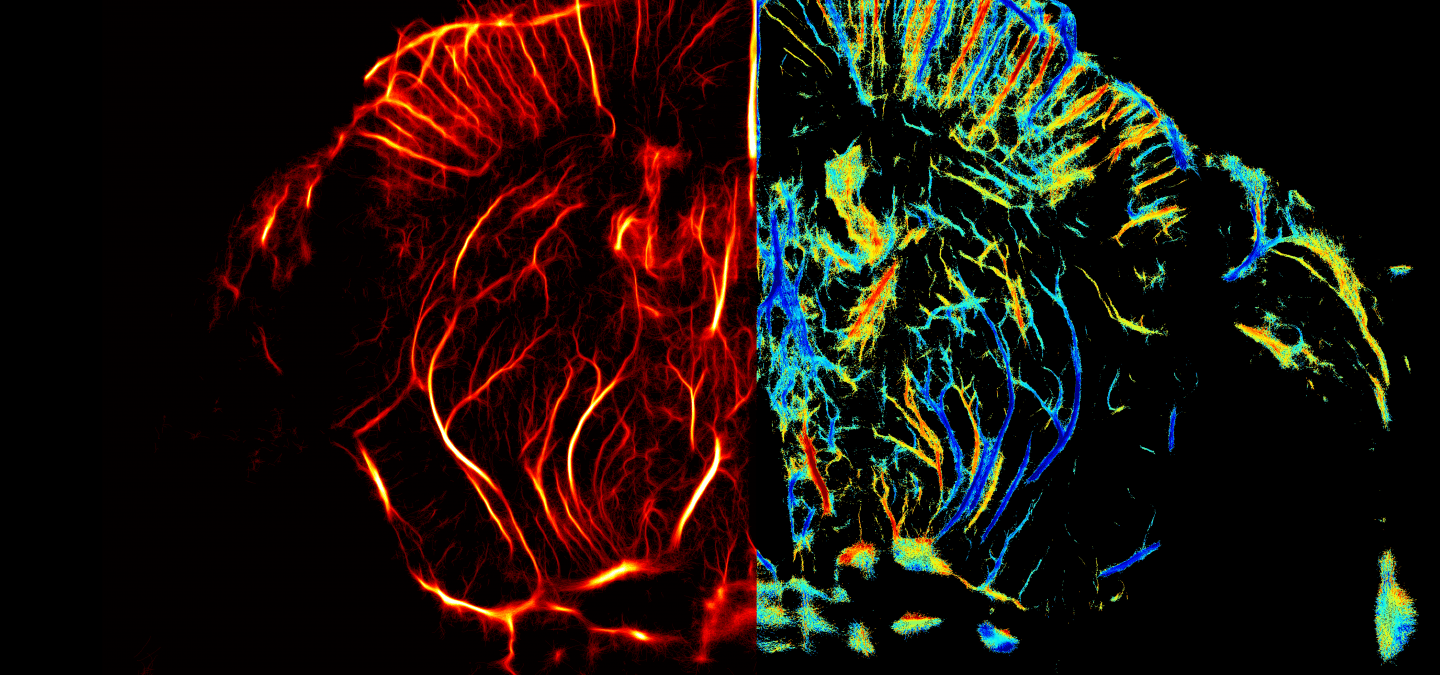
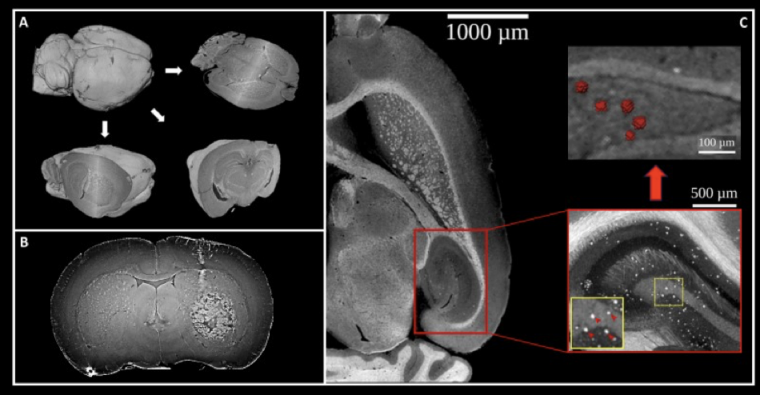
Les figures 1 à 4 présentent des résultats d’IRM réhaussées avec des nanoparticules d’oxyde de fer (USPIO). Dans le cerveau d’une souris présentant une neuroinflammation (Figures 3 et 4), les signaux hypointenses (noirs) proviennent de l’internalisation des USPIO par les cellules immunitaires (macrophages) et mettent donc en évidence la présence d’une réaction inflammatoire.
A. Les USPIO sont des nanoparticules d’oxyde de fer (diamètre < 50 nm) qui se présentent sous forme de solution colloïdale. Le tube de droite montre la couleur « rouille » de la solution en comparaison avec un tube sans USPIO.
B. Un tube témoin sans USPIO (0) et des tubes avec une concentration croissante de USPIO sont placés dans l’IRM. L’augmentation de la concentration en fer, notée [c], entraîne une chute du signal qui devient « hypointense » (noir).
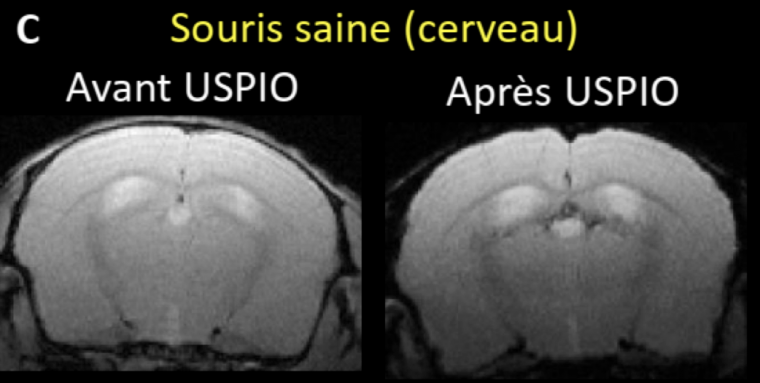
Cerveau d’une souris saine imagée in vivo par imagerie par résonance magnétique (IRM), avant et après administration des nanoparticules d’oxyde de fer (USPIO). En l’absence d’inflammation, les USPIO ne produisent pas de signal sur l’image.
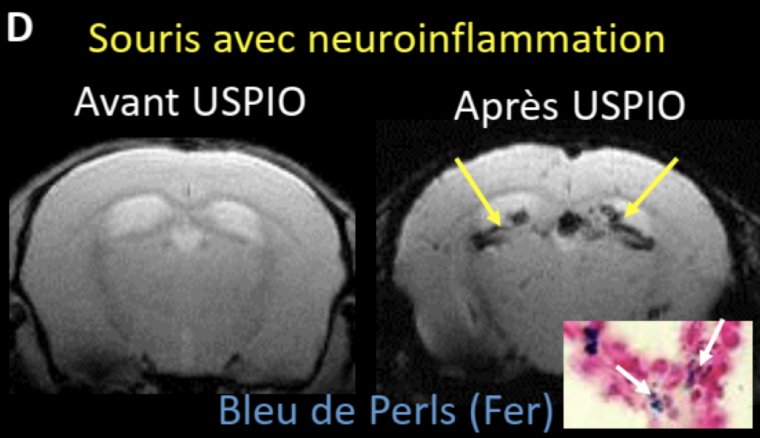
Cerveau d’une souris avec un modèle de neuro-inflammation imagée in vivo par imagerie par résonance magnétique (IRM) avant et après administration de nanoparticules d’oxyde de fer (USPIO). En présence d’inflammation et avant l’administration d’USPIO, le cerveau apparaît identique à celui de la souris saine. Après l’administration d’USPIO, des signaux hypointenses sont visibles au niveau des plexus choroïdes, indiqués par les flèches. Ces signaux proviennent de l’internalisation des USPIO par les cellules immunitaires (macrophages) et mettent donc en évidence la présence d’un phénomène inflammatoire. L’histologie (insert) confirme que ces signaux proviennent du fer des USPIO (coloration au bleu de Perls, flèches).
L’imagerie ultrasonore fonctionnelle du cerveau
Principe général
L’imagerie ultrasonore fonctionnelle est une technique récente d’imagerie qui permet de mesurer les changements de volume sanguin dans les vaisseaux. Cette méthode d’échographie est basée sur l’effet Doppler : un faisceau d’ultrasons, émis par une sonde à une certaine fréquence, est envoyé vers le tissu ; une partie des ultrasons renvoyée par différents éléments du tissu, à des fréquences variables, est détectée par la sonde. La différence entre la fréquence émise et la fréquence réfléchie dépend de la vitesse de déplacement de la cible rencontrée dans le tissu, il est donc possible de détecter les hématies (globules rouges) en mouvement dans les vaisseaux sanguins.
Vers l’imagerie ultrasonore ultrarapide pour l’étude du cerveau
À l’origine, l’échographie conventionnelle n’était pas suffisamment sensible pour permettre d’étudier les vaisseaux du cerveau, car le crâne est une barrière difficile à franchir pour les ultrasons. Mais les développements technologiques récents ont permis de surmonter cette difficulté. L’échographie conventionnelle génère une image ligne par ligne, jusqu’à reconstituer un plan en deux dimensions, ce qui permet d’acquérir une cinquantaine d’images par seconde.
L’imagerie ultrasonore ultrarapide, qui permet de scanner l’ensemble du plan en une seule image, est quant à elle capable d’acquérir plus de 10 000 images par seconde ! Cette haute résolution temporelle permet de détecter des variations de débit sanguin 50 fois plus faibles que sur les échographes conventionnels. Il devient ainsi possible de détecter le flux sanguin dans les petits vaisseaux du cerveau.
L’intérêt de cette technique réside dans le phénomène de couplage neurovasculaire : lorsqu’une région du cerveau est très active, l’apport local de sang est augmenté afin de répondre aux besoins énergétiques importants des neurones. Ainsi, mesurer les variations de quantité de sang dans le cerveau au cours du temps permet d’étudier indirectement l’activité du cerveau.
L’imagerie fonctionnelle ultrasonore est donc une technique de choix pour explorer le fonctionnement du cerveau, en conditions physiologiques ou pathologiques, et notamment pour mieux comprendre l’effet des médicaments du cerveau (Figures 5 et 6).
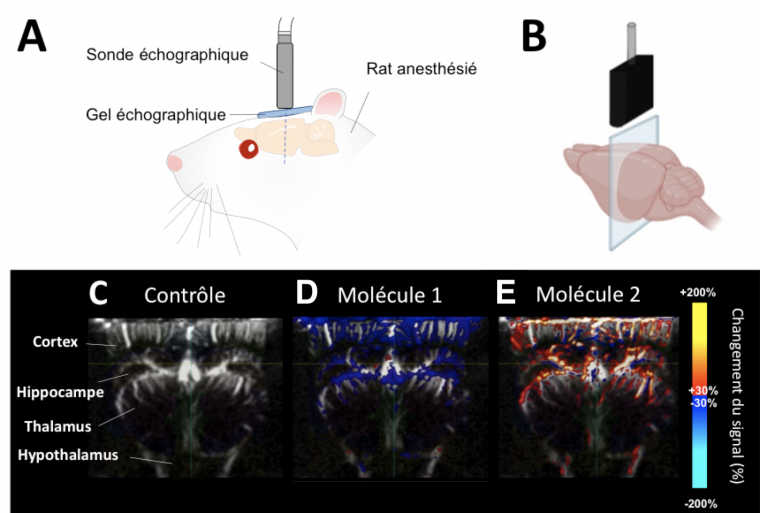
A. Mise en place de l’imagerie fonctionnelle ultrasonore chez un rat anesthésié.
B. L’imagerie fonctionnelle ultrasonore permet de mesurer sur un plan 2D (ici coronal) les changements de volume sanguin dans les vaisseaux du cerveau de petits animaux. Ces changements se produisent suite à des changements d’activité cérébrale et permettent de subvenir aux besoins énergétiques des régions très actives.
C. Imagerie fonctionnelle ultrasonore du cerveau d’un rat au cours d’une période de repos (condition contrôle). Les différents vaisseaux du cerveau apparaissent en blanc.
D. Imagerie fonctionnelle ultrasonore chez le même rat après injection intraveineuse d’une molécule (n°1) qui modifie l’activité cérébrale par stimulation de certains récepteurs de la sérotonine. On constate ici une diminution du volume sanguin (en bleu) dans les vaisseaux irriguant des régions riches en récepteurs, notamment l’hippocampe et le cortex. La stimulation de ces récepteurs provoque localement une diminution de l’activité des neurones.
E. Imagerie fonctionnelle ultrasonore chez le même rat après injection intraveineuse d’une molécule (n°2) capable de bloquer ces mêmes récepteurs à la sérotonine. On constate principalement une augmentation du volume sanguin (en rouge/jaune) dans les mêmes vaisseaux présents dans les zones riches en récepteurs, signe d’une augmentation de l’activité des neurones dans ces régions après blocage des récepteurs.
L’imagerie fonctionnelle ultrasonore est pour l’instant utilisée principalement comme outil de recherche préclinique chez le rat et la souris, car l’épaisseur du crâne chez l’humain continue d’être un élément limitant la qualité du signal.
Toutefois, de premières études prometteuses ont été réalisées dans le champ de la pédiatrie et de la neurochirurgie, et les développements technologiques devraient permettre d’élargir le champ d’application de la technique dans les prochaines années.
La tomographie X en contraste de phase
Description de l’imagerie X en contraste de phase
Comme la radiographie et le scanner, l’imagerie en contraste de phase repose sur la mesure de l’absorption de rayons X par les tissus traversés. Elle permet donc, elle aussi, de bien voir les os. Mais, et c’est une grande innovation, elle mesure également la réfraction des rayons, c’est-à-dire la déviation des rayons X par les tissus.
En effet, chaque tissu possède un indice d’absorption et un indice de réfraction propres, qui dépendent de l’énergie d’irradiation. Pour les rayons X utilisés en radiologie (10-100 keV), la réfraction générée par les éléments de faible poids atomique est 100 à 2 000 fois supérieure à l’absorption. L’imagerie en contraste de phase est donc plus sensible que l’imagerie X conventionnelle (radiographie, scanner) pour détecter les faibles variations de densité.
Son principe de détection repose sur l’utilisation des synchrotrons et des franges d’interférences. Le synchrotron, sorte de laser à rayon X, est un accélérateur de particules de plusieurs centaines de mètres de circonférence permettant de générer de la lumière sur toutes les longueurs d’ondes (voir la vidéo Un Synchrotron, c’est quoi ?). Les franges d’interférences collectées grâce à cette source de lumière dite cohérente, sont les mêmes que celles que l’on peut observer sur le fond d’une piscine grâce à la lumière du soleil qui lui aussi est une source cohérente. Par l’analyse de ces franges il est ainsi possible de remonter de manière indirecte à la réfraction de la lumière causée par l’échantillon.
Utilisation de l’imagerie X en contraste de phase sur le cerveau d’un rat
Au cours des trois dernières décennies, l’imagerie en contraste de phase a été proposée pour surmonter les limites de l’imagerie conventionnelle basée sur la seule absorption : la technique du contraste de phase permet en effet d’améliorer le contraste et la qualité des images pour des objets absorbants très peu les rayons X, comme le cerveau.
L’imagerie en contraste de phase fournit des images tridimensionnelles du cerveau qui offrent une résolution et un contraste proches de l’histologie. Ces acquisitions sont réalisées sur l’organe isolé et fixé chimiquement, comme lors d’une biopsie ou d’une autopsie. Mais l’échantillon n’a pas besoin d’être sectionné comme pour une analyse histologique : il est « numérisé en trois dimensions », et peut-être examiné sous tous les angles : l’histologie est « virtuelle » (Figures 7A et 8).
La figure 7 montre des exemples d’images, sur des modèles animaux de tumeur cérébrale (image B) et de maladie d’Alzheimer (image C). L’intérêt principal est l’étude de la morphométrie (géométrie 3D) des objets pathologiques (la tumeur, les plaques amyloïdes), qui est rendue possible, car l’organe a été scanné sans être altéré.
A. Découpe virtuelle de l’échantillon biologique « numérisé ».
B. Exemple de tumeur cérébrale implantée.
C. Étude des plaques amyloïdes dans un modèle génétique de maladie d’Alzheimer : la zone pathologique, riche en plaques amyloïdes est repérée par le rectangle rouge, les plaques apparaissent comme des points brillants qui peuvent être précisément délimités pour étudier leur géométrie en 3D.
Crédits des images : (A) Matthieu Chourrout, (B) Ludovic Broche, (C) modifiée d’après Chourrout et coll., 2021, bioRxiv.
Si le synchrotron est un outil de recherche formidable, un enjeu important est désormais de pouvoir réaliser cette imagerie sur des pièces anatomiques à l’hôpital ou au laboratoire. Il faut pour cela réussir à réaliser une imagerie en contraste de phase avec une source de rayons X « classique », ce qui représente aujourd’hui un défi technologique considérable.
Plusieurs possibilités sont à l’étude pour cela : l’utilisation de sources X spécifiques (très onéreuses à ce jour), ou l’emploi de dispositifs particuliers comme des grilles avec des micro-fentes ou des membranes avec une surface rugueuse. Ces dispositifs permettent de détecter la réfraction des rayons X, mais nécessitent pour l’instant des temps d’acquisition longs. Il est cependant probable que des dispositifs efficaces voient le jour durant les prochaines années et rendent ainsi l’imagerie X en contraste de phase accessible à une plus grande communauté de chercheurs.
Les radiotraceurs pour l’imagerie nucléaire en neurologie
La tomographie par émission de positons
La tomographie par émission de positons (TEP) repose sur la détection de la radioactivité émise des isotopes radioactifs. Ceux-ci possèdent le même nombre de protons que les isotopes stables correspondants, mais un nombre de neutrons différent. Les plus utilisés aujourd’hui en imagerie nucléaire sont le carbone 11 et le fluor 18. Le premier est un isotope radioactif du carbone 12, stable, qui compose l’essentiel de la matière vivante. Le carbone 11 et le fluor 18 n’existent pas naturellement, ils sont produits en modifiant les noyaux d’autres atomes à l’intérieur d’accélérateurs de particules appelés cyclotrons. Ainsi, le fluor 18 est produit à partir d’oxygène 18 stable qui existe à l’état naturel. Après leur production, les isotopes radioactifs sont accrochés sur des molécules, comme du glucose ou des médicaments grâce à des réactions chimiques (« radiochimie »). L’ensemble isotope-radiotraceur constitue un radiotraceur qui est alors injecté dans le sang. Ces aspects sont détaillés dans la conférence de notre collègue Didier Le Bars, disponible sur le site CultureSciences-Physique.
Les isotopes radioactifs se désintègrent en émettant une particule appelée positon (une particule de même masse qu’un électron, mais de charge positive). Lorsque ce positon rencontre dans la matière un électron, les deux s’annihilent et disparaissent en créant de l’énergie selon la formule connue E = mc2. L’énergie créée E est égale à la masse m des deux particules, multipliée par la vitesse de la lumière c au carré.
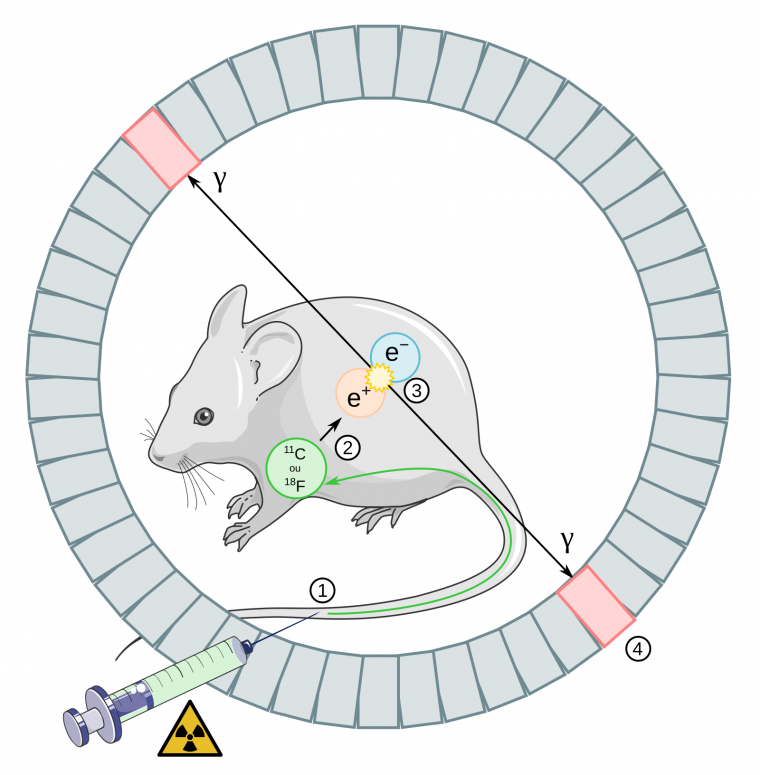
Cette énergie E prend la forme de deux rayons gamma émis à 180° l’un de l’autre. Ce sont ces rayons gamma qui sont captés par la caméra TEP, elle-même constituée d’une couronne de détecteurs sensibles à la radioactivité (Figure 9). C’est la détection simultanée des deux rayons gamma qui permet à la caméra de reconstituer l’origine de la réaction d’annihilation et ainsi créer une image.
1. Injection du traceur radiomarqué (carbone 11 ou au fluor 18) par voie intraveineuse (veine caudale).
2. Émission d’un positon (électron chargé positivement) par le radioisotope.
3. Le positon rencontre un électron présent dans la matière environnante (tissu). Cette rencontre provoque une réaction d’annihilation dans laquelle les deux particules (positon et électron) disparaissent pour créer deux photons gamma d’énergie discrète de 511 kiloélectronvolts émis à 180° l’un de l’autre.
4. Les photons gamma sont détectés en même temps par les détecteurs situés en couronne autour de l’animal. La détection de l’ensemble des photons sur toute la durée de l’examen constitue les données brutes de l’imagerie TEP qui sont ensuite reconstruites pour fournir les images.
Source des schémas utilisés : Souris : Servier, CC-BY, Bioicons ; Seringue : Servier, CC-BY, Bioicons ; Icône radioactivité : Cary Bass, CC0, Wikimedia.
L’imagerie TEP permet de détecter les endroits où le radiotraceur est présent. Elle ne donne par contre aucune information anatomique et de ce fait elle est souvent accompagnée d’une imagerie anatomique telle que le scanner à rayons X ou l’IRM. Ces caméras hybrides TEP/scanner, ou plus rarement TEP/IRM, sont disponibles dans les services hospitaliers de médecine nucléaires, et les mêmes radiotraceurs peuvent être utilisés chez l’être humain et chez l’animal de laboratoire. En cela, l’imagerie TEP permet une recherche véritablement « translationnelle », du laboratoire au lit du patient.
Les radiotraceurs pour l’imagerie nucléaire en neurologie
L’imagerie TEP occupe une place majeure en médecine pour le diagnostic des patients atteints de cancer, et en neurosciences pour l’étude du cerveau, organe difficilement accessible autrement que par l’imagerie.
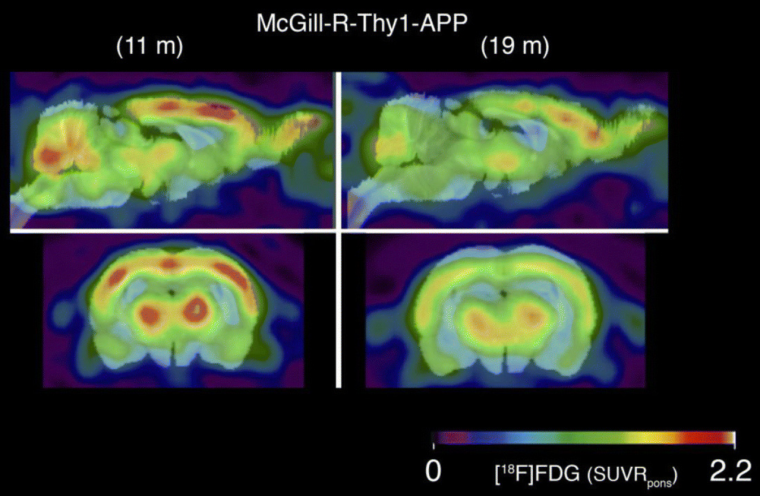
Le cerveau est un organe qui utilise énormément de glucose pour fonctionner. Ainsi, le glucose radiomarqué au fluor 18 ([18F]FDG) constitue un radiotraceur du métabolisme cérébral. Une fois injecté dans des rats placés dans une caméra TEP dédiée aux petits animaux, il devient possible d'étudier les variations du métabolisme cérébral provoquées par des maladies comme la maladie d’Alzheimer (Figure 10).
Des rats modèles pour la maladie d'Alzheimer (rats transgéniques McGill-R-Thy1-APP) ont été imagé deux fois, à 11 mois (à gauche) et 19 mois (à droite), en vues sagittale (en haut) et coronale (en bas). Le suivi temporel met en évidence une nette diminution de la fixation du radiotraceur utilisé, le [18F]FDG, dans le cerveau des rats, révélant une baisse du métabolisme cérébral provoqué par la progression de la maladie.
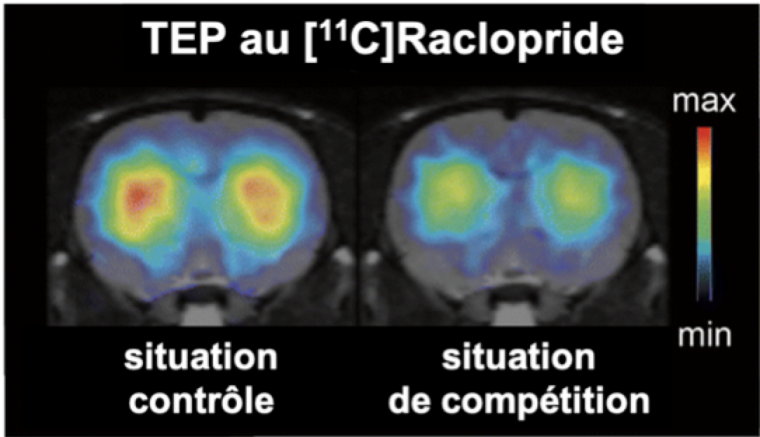
L’imagerie TEP permet également d’étudier la chimie du cerveau (Figure 11). Ainsi, le développement continu de nouveaux radiotraceurs ciblant divers types de récepteurs neuronaux (sérotoninergiques, noradrénergiques…) permet d’explorer la diversité de la biochimie cérébrale.
Le radiotraceur [11C]Raclopride est utilisé pour visualiser les récepteurs de la dopamine. Ceux-ci sont également les cibles de drogues psychostimulantes telles que la cocaïne ou les amphétamines. Lorsque les amphétamines sont injectées juste avant le radiotraceur, les deux molécules sont en compétition au niveau des récepteurs de la dopamine, provoquant ainsi la baisse de signal observée (image de droite).