Le point sur une catégorie particulière de lymphocytes T CD8, les lymphocytes TRM. Cette catégorie de lymphocytes T mémoires réside dans les tissus périphériques (peau, poumons, système nerveux…). Les lymphocytes TRM favorisent, en cas de réinfection, le recrutement et l’activation d’autres cellules immunitaires et la mise en place de réponses effectrices efficaces capables d’éliminer l’agent infectieux. Une meilleure connaissance de ces cellules pourrait permettre de créer de nouveaux vaccins.
Le système immunitaire est formé de l’ensemble des cellules et des molécules qui protègent notre organisme contre les éléments qui lui sont étrangers, en particulier les agents infectieux comme les bactéries et virus. Parmi tous les types cellulaires impliqués dans le maintien de l’immunité, une population particulière joue un rôle crucial contre les infections intracellulaires (dont font partie les infections virales) : les lymphocytes T CD8 (Figure 1).
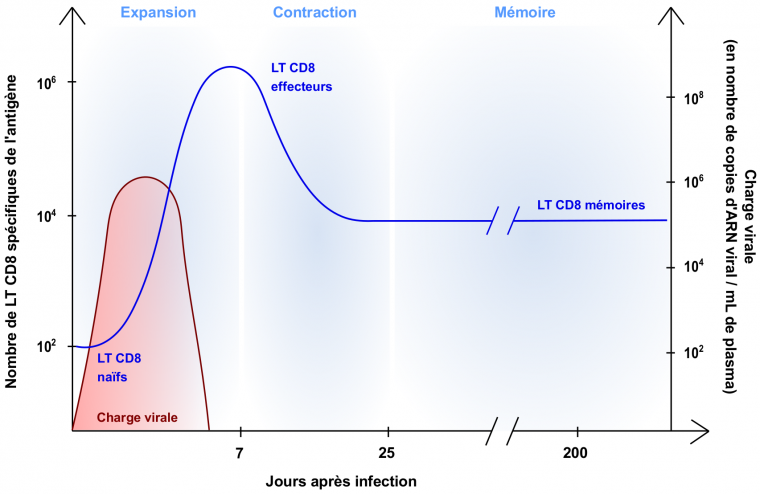
Lors d’une infection virale, les lymphocytes T CD8 naïfs spécifiques des antigènes viraux (environ 10 à 100 cellules) sont activés, prolifèrent et se différencient en lymphocytes T CD8 effecteurs. Cette phase d’activation et d’expansion aboutit à la génération de millions de cellules effectrices au 7e jour post-infection, qui vont tuer les cellules infectées. Une fois le pathogène éliminé, 90 % des lymphocytes T CD8 effecteurs meurent, tandis que les cellules restantes se différencient en cellules mémoires (environ 104 lymphocytes T CD8 mémoires spécifiques d’un antigène)
Lors d’une infection de l’organisme par un virus, les lymphocytes T CD8 naïfs (i. e. n’ayant jamais rencontré d’antigène) spécifiques des antigènes viraux sont activés dans les organes lymphoïdes secondaires (ganglions lymphatiques, rate, tissus lymphoïdes associés aux muqueuses), prolifèrent et se différencient en lymphocytes T CD8 effecteurs, également appelés lymphocytes T cytotoxiques. Ces cellules ont pour principale fonction de tuer les cellules infectées en sécrétant des protéines effectrices (e. g. granzymes et perforine) qui induisent la lyse des cellules cibles. Suite à leur différenciation dans les organes lymphoïdes secondaires, les lymphocytes T cytotoxiques migrent jusqu’au site de l’infection et tuent les cellules infectées, conduisant à l’élimination du virus. Une fois leur action terminée, 90 % des lymphocytes T CD8 effecteurs meurent tandis que les cellules restantes se différencient en lymphocytes T CD8 mémoires.
Mécanismes de différenciation des lymphocytes T CD8 mémoires
Malgré l’avancée des connaissances sur le déroulement des réponses T CD8 lors d’une infection par un pathogène intracellulaire, les mécanismes de génération des cellules mémoires restent encore très controversés : en effet, on ne sait toujours pas ni quand ni comment ces cellules se forment après infection.
Contrairement à ce qui était pensé initialement, l’acquisition du potentiel « mémoire » par un lymphocyte T CD8 ne se ferait pas de façon aléatoire mais dépendrait de nombreux signaux tels que l’intensité du signal TCR ( i. e. le récepteur spécifique de l’antigène), la présence de cytokines, ou encore de facteurs intrinsèques à la cellule (accessibilité de la chromatine, expression de régulateurs métaboliques…) (Chang, Wherry, & Goldrath, 2014). Différents modèles ont notamment été élaborés pour expliquer l’acquisition du destin « mémoire » par un lymphocyte T CD8 en réponse à ces différents signaux, et proposent une acquisition du potentiel « mémoire » soit très tôt après la reconnaissance de l’antigène (dès l’activation de la cellule naïve et/ou lors de sa première division), soit au cours de la phase effectrice (Kaech & Cui, 2012 ; Kaech & Wherry, 2007). Cependant, l’identification des processus de différenciation reste très difficile et controversé, d’autant plus que ces différents modèles ne sont pas mutuellement exclusifs et pourraient être combinés lors des réponses T CD8.
Néanmoins, des chercheurs ont récemment réussi à suivre l’évolution des différentes populations de lymphocytes T CD8 suite à une infection virale, en utilisant des analyses moléculaires in vivo couplées à des modèles mathématiques (Crauste et al., 2017). Ils ont ainsi pu montrer que la majorité des cellules suivrait une voie de différenciation linéaire « naïf → effecteur précoce → effecteur tardif → mémoire ». Ces résultats sont ainsi une avancée supplémentaire vers une meilleure compréhension des mécanismes de différenciation des lymphocytes T CD8, dont de nombreux facteurs restent encore à élucider.
Différentes populations de lymphocytes T CD8 mémoires
Les lymphocytes T mémoires ont plusieurs spécificités qui les distinguent des cellules naïves :
- Ils sont capables de s’auto-renouveler et de se maintenir sur le long terme en l’absence d’antigène.
- Ils ont des propriétés migratrices accrues et sont notamment capables de circuler dans les tissus périphériques non-lymphoïdes (peau, poumon, intestin…).
- Ils ont des fonctions effectrices améliorées en termes de cytotoxicité et de sécrétion de cytokines (des petites protéines agissant sur leurs cellules cibles pour en réguler l’activité, jouant un rôle majeur au sein du système immunitaire).
Ces propriétés permettent aux cellules mémoires de protéger l’organisme sur le long terme, à travers des réponses plus rapides et plus efficaces en cas de ré-infection par un pathogène.
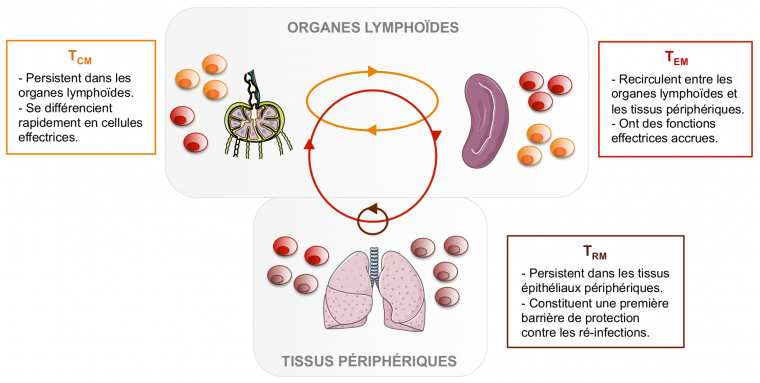
Néanmoins, malgré l’existence de caractéristiques communes à tous les lymphocytes T CD8 mémoires, ces cellules ne forment pas une population homogène. En effet, différentes sous-populations de lymphocytes T CD8 mémoires ont été caractérisées, et se distinguent notamment par leur mode de circulation et leurs principales fonctions. Les deux premières populations à avoir été décrites en 1999 sont les lymphocytes T CD8 mémoires centraux (TCM) et effecteurs (TEM) (Sallusto, 1999) (Figure 2). Les TCM sont dits centraux car ils sont localisés au niveau des organes lymphoïdes secondaires (qui sont les organes « centraux » où se mettent en place les réponses immunitaires), où ils se maintiennent sur le long-terme en s’auto-renouvelant. Ces cellules n’ont pas d’activité effectrice directe, mais sont en revanche capables de se différencier rapidement en lymphocytes T effecteurs en cas de ré-infection. Quant à la deuxième sous-population, les TEM, ils circulent entre le sang et les tissus périphériques. Comme leur nom l’indique, ils ont des fonctions effectrices accrues, à savoir plus rapides et plus efficaces que celles des lymphocytes T effecteurs générés lors de la primo-infection.
TCM : Lymphocytes T CD8 mémoires centraux ; TEM : Lymphocytes T CD8 mémoires effecteurs ; TRM : Lymphocytes T CD8 mémoires résidents des tissus.
Les flèches indiquent les zones de recirculation ou de résidence de ces trois types cellulaires.
Quelques années plus tard, au début des années 2000, un troisième type de lymphocytes T CD8 mémoires a été identifié. Jusqu’alors, la communauté scientifique savait que des cellules mémoires pouvaient se trouver au sein des tissus périphériques et les considérait comme étant des TEM. Cependant, des expériences de parabiose chez la souris ont permis de remettre en cause ce postulat (Klonowski et al., 2004 ; Schenkel & Masopust, 2014). Ces expériences consistent à relier les circulations sanguines et lymphatiques de deux animaux, ici des souris, puis à analyser la localisation des cellules des deux organismes après un certain temps. Dans ces conditions, certaines populations de cellules s’équilibrent entre les deux animaux : ce sont les cellules circulantes. En revanche, d’autres cellules restent dans leur tissu d’origine et ne migrent pas entre les deux organismes : ce sont les cellules résidentes des tissus. Ces lymphocytes particuliers, caractérisés par la suite comme ayant un phénotype mémoire, ont alors été baptisés TRM, pour lymphocytes T mémoires résidents des tissus (Figure 2).
Propriétés des TRM
Localisation
Les TRM ont été initialement identifiés dans l’intestin, avant d’être mis en évidence dans de nombreux tissus comme la peau, le poumon, le système nerveux ou le tractus génital (Cauley & Lefrançois, 2013). Ce type cellulaire est prépondérant au sein des tissus non-lymphoïdes, où il peut constituer jusqu’à 90 % des lymphocytes résidents (Steinert et al., 2015). À titre d’exemple chez l’Homme, on estime à 10 milliards le nombre de lymphocytes T dans le poumon en l’absence d’inflammation, ce qui équivaut au nombre de lymphocytes circulant dans le sang (Chiu & Openshaw, 2015).
Mise en place et maintien au sein du tissu
Les TRM dérivent de précurseurs lymphocytaires entrés dans les tissus au cours de la primo-infection, qui y sont restés et se sont différenciés sur place. Selon le tissu considéré, différents facteurs peuvent contribuer à la mise en place de cette population. Dans la peau par exemple, ce sont des cytokines qui jouent un rôle majeur dans l’établissement des TRM (Mackay et al., 2013), alors que dans le poumon et le système nerveux, ce sont les antigènes viraux qui réalisent cette fonction (Khan et al., 2016 ; Wakim et al., 2015 ; Wakim et al., 2010).
Une fois différenciés au sein du tissu, les TRM expriment divers marqueurs à leur surface qui les distinguent des autres sous-populations de lymphocytes T non-résidentes des tissus. Ces molécules sont CD69 (une lectine, marqueur d’activation lymphocytaire) et CD103 (une molécule d’adhérence, l’intégrine αE). Ces deux protéines de surface jouent un rôle majeur dans la biologie des TRM, en favorisant leur rétention et leur survie au sein du tissu. Ainsi, plus que de « simples » marqueurs de surface des TRM permettant aux immunologistes de repérer ces cellules, CD69 et CD103 sont les deux molécules clés à l’origine du pouvoir résidentiel de ces lymphocytes mémoires. Outre ces deux protéines, on peut également noter que la survie des TRM est dépendante de facteurs externes présents au sein du tissu de résidence, comme la cytokine IL-7 (Cui et al., 2015). Cependant, et de façon remarquable, la survie des TRM varie grandement selon le tissu où ils sont localisés. En effet, les TRM de la peau peuvent s’y maintenir pendant plusieurs mois (Jiang et al., 2012 ; Mackay et al., 2012), contrairement aux populations pulmonaires qui décroissent au cours du temps jusqu’à devenir indétectables sept mois après infection (Slütteret al., 2017 ; Wu et al., 2014). Cette perte des TRM du poumon semble d’ailleurs intrinsèque à ce tissu, et pourrait être liée à une nécessité d’empêcher des réponses inflammatoires trop fortes qui pourraient endommager le tissu pulmonaire et altérer la fonction respiratoire de cet organe (Van Braeckel-Budimir & Harty, 2017).
Fonctions
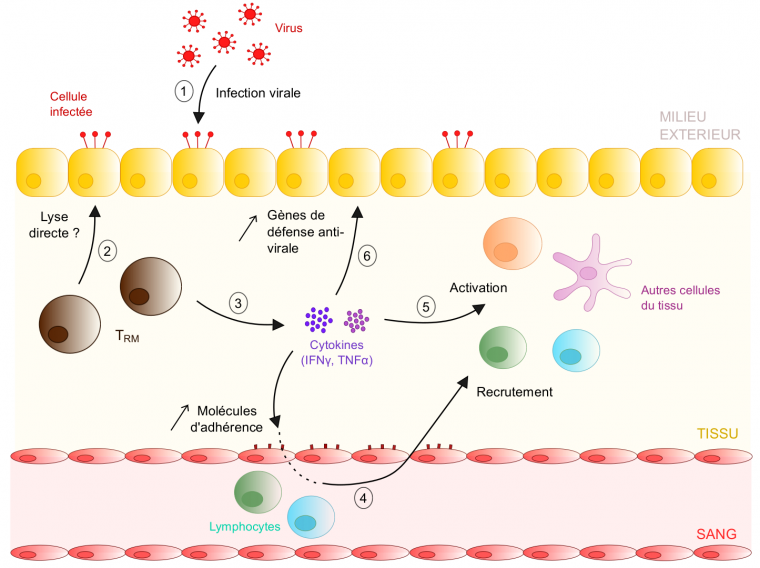
Les tissus périphériques comme la peau ou le poumon sont en contact direct avec le milieu extérieur : ce sont de véritables portes d’entrée pour les pathogènes. De par leur position stratégique au sein des tissus, les T RM pourraient donc constituer une première barrière protectrice contre les infections, en initiant des réponses rapides en présence d’un pathogène. Cette hypothèse fut confortée par plusieurs études, et premièrement par l’observation que les TRM se déplacent au sein des tissus et interagissent avec d’autres cellules, favorisant la détection de potentiels agents infectieux (Ariotti et al., 2012). Cependant, l’activité effectrice des TRM et les réponses de ces cellules en cas de ré-infection sont restées inconnues pendant encore plusieurs années. C’est seulement en 2014 que la publication d’un article dans Science a permis d’élucider le mode d’action de cette population cellulaire (Schenkel et al., 2014). Dans cet article, les auteurs réalisent leurs expériences sur la souris. Ils infectent tout d’abord les animaux avec un virus pour générer des TRM sur le site infecté, ici le tractus génital femelle. Puis, en phase mémoire, ils ré-immunisent les animaux au niveau du tractus génital pour activer les TRM et étudier leurs réponses. Les chercheurs démontrent ainsi qu’après ré-immunisation, les TRM activés sécrètent une cytokine appelée interféron-γ, qui induit l’expression de molécules d’adhérence par l’endothélium vaginal et le recrutement d’autres cellules immunitaires tels que les lymphocytes B. Outre ce recrutement, les auteurs mettent en évidence que la sécrétion de cytokines par les TRM promeut l’activation d’autres populations de cellules immunes (e. g. cellules dendritiques, cellules natural killer). Finalement, cette double action des TRM entraîne l’élimination du pathogène, montré indétectable chez les souris quelques jours après infection, uniquement lorsque les TRM sont spécifiquement activés et sécrètent des cytokines. Ainsi, les TRM jouent un rôle de sentinelle au sein des tissus : via leur sécrétion de différentes cytokines, ils favorisent le recrutement et l’activation d’autres cellules immunitaires et la mise en place de réponses effectrices efficaces capables d’éliminer l’agent infectieux (Figure 3).
En cas de ré-infection du tissu (1), les TRM sont probablement capables de tuer directement les cellules infectées via leur forte expression d’enzymes lytiques comme le granzyme B - cela reste néanmoins à démontrer in vivo (2). En parallèle, suite à leur activation, les TRM sécrètent des cytokines comme l'IFNγ ou le TNFα (3). Ces molécules induisent différents mécanismes favorisant la mise en place de réponses immunitaires anti-virales efficaces. Premièrement, elles augmentent l’expression de molécules d’adhésion par l’endothélium vasculaire (e. g. VCAM-1), ce qui favorise le recrutement de lymphocytes circulants au sein du tissu infecté (4). Ensuite, elles induisent l’activation d’autres cellules immunes résidentes du tissu ( e. g. cellules dendritiques) ou des lymphocytes nouvellement recrutés (5). Enfin, la sécrétion cytokinique par les TRM favorise également l’expression de gènes anti-viraux par les cellules épithéliales (e. g. gènes codant pour des chimiokines et cytokines impliquées dans les réponses immunitaires innées), ce qui augmente leur résistance à l’infection virale (6).
Ainsi, les TRM déclenchent des cascades de réactions immuno-stimulatrices et anti-virales lors d’une ré-infection du tissu, favorisant une protection rapide et efficace contre le pathogène.
Ces résultats clés sur les fonctions des TRM ont ensuite été complétés par d’autres études. En particulier, plusieurs publications ont montré que ces lymphocytes entraînent des modifications généralisées au niveau du site infecté, mais aussi à l’échelle de tout l’organisme, en induisant l’expression de gènes antiviraux et antibactériens (Ariotti et al., 2014 ; Kadoki et al., 2017). En parallèle, Kadoki et ses collègues montrent qu’une infection au niveau de la peau induit la génération de TRM non seulement sur le site infecté, mais également au sein d’organes plus distants tels que le poumon ou le foie. Ainsi, en plus d’activer et de recruter d’autres cellules du système immunitaire, les TRM favorisent la mise en place d’un état anti-infectieux au niveau de l’organisme entier, entraînant une protection efficace contre les pathogènes intracellulaires, notamment les virus (Figure 3).
Implication des TRM en vaccination
Cette découverte des TRM et de leur rôle protecteur contre les pathogènes intracellulaires ont des implications prometteuses dans la recherche vaccinale.
Tout d’abord, la découverte de facteurs responsables de la mise en place et du maintien des TRM au sein des tissus ouvre la voie au développement de nouveaux vaccins. À titre d’exemple, une équipe australienne a montré que la présentation des antigènes aux lymphocytes T CD8 par les cellules dendritiques résidentes du poumon induit la génération de TRM au sein de cet organe, capables de protéger efficacement contre le virus de la grippe (Wakim et al., 2015). Cependant, nous avons vu précédemment que dans le cas des TRM pulmonaires, ces cellules ne persistent pas sur le long terme. Des connaissances supplémentaires sur les facteurs impliqués dans leur longévité pourraient permettre de concevoir des vaccins protecteurs pendant plusieurs années. Des recherches à ce sujet sont en cours et montrent des résultats encourageants : par exemple, la ré-infection de souris par le virus de la grippe augmenterait de dix fois le nombre de TRM pulmonaires (Slütter et al., 2017). Ces différentes études visant à développer de nouvelles stratégies vaccinales semblent donc prometteuses dans la lutte contre les infections grippales.
En parallèle, il pourrait être intéressant de déterminer si les T RM seraient capables de conférer une protection efficace contre d’autres maladies infectieuses humaines posant d’importants problèmes de santé publique (e. g. SIDA, herpès, malaria…), et si des vaccins efficaces contre ces pathologies pourraient alors être élaborés. Cependant, la mise en place de telles études chez l’Homme soulève des questions éthiques et pratiques : en particulier, les TRM n’étant pas des cellules circulantes, des biopsies sont nécessaires pour identifier et isoler ces lymphocytes. Néanmoins, ces barrières pratiques ne sont pas insurmontables. En effet, une étude clinique chez l’Homme a pu être réalisée dans laquelle les auteurs montrent que les TRM pourraient jouer un rôle protecteur contre la malaria, propriété qu’ils utilisent pour développer une stratégie vaccinale prometteuse contre cette maladie (Ishizuka et al., 2016).
Cependant, la conception de nouveaux vaccins basés sur les TRM nécessite de prendre en considération les potentiels effets indésirables que pourraient causer ces cellules. En effet, plusieurs études récentes ont montré que des maladies inflammatoires chroniques comme le psoriasis pourraient être associées à la présence de TRM dans les tissus enflammés (Mueller & Mackay, 2016). Une bonne connaissance du mode d’action de ces cellules reste donc indispensable pour éviter tout effet secondaire pouvant être provoqué par un type de vaccination générant des T RM.
Ainsi, depuis ces dernières années, des travaux de recherche considérables ont permis de montrer que les TRM constituent une sous-population majeure de lymphocytes T CD8 mémoires. En effet, en plus de former une proportion majoritaire des cellules mémoires au sein des tissus, ces lymphocytes jouent un rôle crucial contre les agents pathogènes en constituant une première barrière protectrice en cas de ré-infection. Néanmoins, notre connaissance des TRM est loin d’être complète : de nouvelles études restent nécessaires pour mieux comprendre le fonctionnement de ces cellules et permettre d’améliorer notre protection contre les maladies infectieuses, notamment via la conception de nouveaux vaccins.
Bibliographie
- Ariotti, S., Beltman, J. B., Chodaczek, G., Hoekstra, M. E., van Beek, A. E., Gomez-Eerland, R.,… Schumacher, T. N. (2012). Tissue-resident memory CD8+ T cells continuously patrol skin epithelia to quickly recognize local antigen. Proceedings of the National Academy of Sciences of the United States of America , 109(48).
- Ariotti, S., Hogenbirk, M. A., Dijkgraaf, F., Visser, L., & Hoekstra, M. (2014). Skin-resident memory CD8+ T cells trigger a state of tissue-wide pathogen alert. Science, 346(6205), 101–105.
- Cauley, L., & Lefrançois, L. (2013). Guarding the perimeter : protection of the mucosa by tissue-resident memory T cells. Mucosal Immunology, 6(1), 14–23.
- Chang, J. T., Wherry, E. J., & Goldrath, A. W. (2014). Molecular regulation of effector and memory T cell differentiation. Nature Immunology, 15(12), 1104–1115.
- Chiu, C., & Openshaw, P. J. (2015). Antiviral B cell and T cell immunity in the lungs. Nature Immunology, 16(1), 18–26.
- Crauste, F., Mafille, J., Boucinha, L., Djebali, S., Gandrillon, O., Marvel, J., & Arpin, C. (2017). Identification of Nascent Memory CD8 T Cells and Modeling of Their Ontogeny. Cell Systems, 4(3), 306–317.
- Cui, G., Staron, M., Gray, S., Ho, P.-C., Amezquita, R., Wu, J., & Kaech, S. (2015). IL-7-Induced Glycerol Transport and TAG Synthesis Promotes Memory CD8+ T Cell Longevity. Cell, 161(4), 1–23.
- Ishizuka A., Lyke K., DeZure A., Berry A.,… Seder R. (2016). Protection against malaria at 1 year and immune correlates following PfSPZ vaccination. Nature medicine, 22(6), 614-623.
- Jiang, X., Clark, R. A., Liu, L., Wagers, A. J., Fuhlbrigge, R. C., & Kupper, T. S. (2012). Skin infection generates non-migratory memory CD8+ Trm Cells providing global skin immunity. Nature, 483 (7388), 227–231.
- Kadoki, M., Patil, A., Thaiss, C. C., Brooks, D. J., Pandey, S., Deep, D.,… Chevrier, N. (2017). Organism-Level Analysis of Vaccination Reveals Networks of Protection across Tissues. Cell, 171(2), 1–16.
- Kaech, S. M., & Cui, W. (2012). Transcriptional control of effector and memory CD8 T cell differenciation. Nature Reviews Immunology, 12(11), 749–761.
- Kaech, S. M., & Wherry, E. J. (2007). Heterogeneity and cell-fate decisions in effector and memory CD8+ T cell differentiation during viral infection. Immunity, 27(3), 393–405.
- Khan, T. N., Mooster, J. L., Kilgore, A. M., Osborn, J. F., & Nolz, J. C. (2016). Local antigen in nonlymphoid tissue promotes resident memory CD8 + T cell formation during viral infection. Journal of Experimental Medicine, 1–16.
- Klonowski, K. D., Williams, K. J., Marzo, A. L., Blair, D. A., Lingenheld, E. G., & Lefranc, L. (2004). Dynamics of Blood-Borne CD8 Memory T Cell Migration In Vivo. Immunity, 20, 551–562.
- Lipp, M., Sallusto, F., Lenig, D., Fo, R., & Lanzavecchia, A. (1999). Two subsets of memory T lymphocytes with distinct homing potentials. Nature, 401(October), 708–712.
- Mackay, L. K., Rahimpour, A., Ma, J. Z., Collins, N., Stock, A. T., Hafon, M.-L.,… Gebhardt, T. (2013). The developmental pathway for CD103(+)CD8+ tissue-resident memory T cells of skin. Nature Immunology, 14(12), 1294–301.
- Mackay, L. K., Stock, A. T., Ma, J. Z., Jones, C. M., Kent, S. J., Mueller, S. N.,… Gebhardt, T. (2012). Long-lived epithelial immunity by tissue-resident memory T (TRM) cells in the absence of persisting local antigen presentation. Proceedings of the National Academy of Sciences of the United States of America , 109(18), 7037–42.
- Mueller, S. N., & Mackay, L. K. (2016). Tissue-resident memory T cells : local specialists in immune defence. Nature Reviews. Immunology, 16(2), 79–89.
- Schenkel, J. M., Fraser, K. A., Beura, L. K., Pauken, K. E., & Masopust, D. (2014). Resident memory CD8 T cells trigger protective innate and adaptive immune responses. Science, 346(6205), 98–101.
- Schenkel, J. M., & Masopust, D. (2014). Tissue-resident memory T cells. Immunity, 41(6), 886–897.
- Slütter, B., Van Braeckel-Budimir, N., Abboud, G., Varga, S. M., Salek-Ardakani, S., & Harty, J. T. (2017). Dynamics of influenza-induced lung-resident memory T cells underlie waning heterosubtypic immunity. Science Immunology, 2(7).
- Steinert, E. M., Schenkel, J. M., Fraser, K. a, Beura, L. K., Manlove, L. S., Igyártó, B. Z.,… Masopust, D. (2015). Quantifying Memory CD8 T Cells Reveals Regionalization of Immunosurveillance. Cell, 161 (4), 737–49.
- Van Braeckel-Budimir, N., & Harty, J. T. (2017). Influenza-induced lung Trm : not all memories last forever. Immunology and Cell Biology, 95(8), 651–655.
- Wakim, L. M., Smith, J., Caminschi, I., Lahoud, M. H., & Villadangos, J. a. (2015). Antibody-targeted vaccination to lung dendritic cells generates tissue-resident memory CD8 T cells that are highly protective against influenza virus infection. Mucosal Immunology, 8 (5), 1060–71.
- Wakim, L. M., Woodward-davis, A., & Bevan, M. J. (2010). Memory T cells persisting within the brain after local infection show functional adaptations to their tissue of residence. PNAS, 107(42), 17872–17879.
- Wu, T., Hu, Y., Lee, Y.-T., Bouchard, K. R., Benechet, A., Khanna, K., & Cauley, L. S. (2014). Lung-resident memory CD8 T cells (TRM) are indispensable for optimal cross-protection against pulmonary virus infection. Journal of Leukocyte Biology, 95(2), 215–24.